2. 400016 重庆,重庆医科大学附属第一医院:肝胆外科;
3. 400016 重庆,重庆医科大学附属第一医院:急诊&重症医学科
2. Department of Hepatobiliary Surgery, , Chongqing, 400016, China;
3. Department of Emergency & Critical Care Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
肝脏移植是治疗终末期肝病和肝脏恶性肿瘤的有效方法, 但肝脏缺血再灌注损伤(ischemia reperfusion injury, IRI)仍然是目前无法避免且尚未解决的重要问题。缺血再灌注所造成的肝损伤不仅可导致高达10%的早期移植物功能衰竭,还增加了器官排斥和肝功能障碍发生的风险[1]。虽然其病理机制尚不完全清楚,但炎症级联效应被认为是肝脏IRI发生、发展的关键因素[2],而Kupffer细胞(KCs)在移植早期被激活,产生、释放TNF-α、IL-6、IL-1β、ROS等促炎介质,招募并活化中性粒细胞等免疫细胞,是引发下游炎症瀑布级联反应的重要原因[3]。我们前期研究发现:抑制KCs中Toll样受体4(Toll like receptor 4, TLR4)-核因子-κB (nuclear factor-κB, NF-κB)通路可在一定程度上减轻炎症反应并改善移植肝脏IRI[4-5],但未能较满意地解决KCs活化这一问题。如何调控肝移植过程中KCs活性仍待进一步研究。
作为定居于肝脏的巨噬细胞,KCs在不同的微环境中可以表现出明显不同的表型和功能[6]。研究发现:在内毒素(lipopolysaccharide, LPS)刺激下,巨噬细胞中血管内皮生长因子受体-3(vascular endothelial growth factor receptor-3, VEGFR-3)及其配体血管内皮生长因子-C(vascular endothelial growth factor-c, VEGF-C)表达上调。VEGF-C和VEGFR-3结合后不仅抑制了TLR4-NF-κB通路,还增加了抗炎细胞因子的产生[7]。由于肝移植过程中阻断门静脉可引起肠壁充血和菌群移位,导致LPS入血[8],我们推测VEGFR-3/VEGF-C信号通路可能参与调节肝移植过程中KCs功能。本研究将通过大鼠原位肝移植模型,观察经门静脉灌注外源性VEGF-C能否改善肝移植IRI,并探讨其可能的机制。
1 材料与方法 1.1 实验动物及主要试剂雄性Lewis大鼠,体质量200~230 g,购于重庆医科大学动物实验中心。重组人VEGF-C购于R&D Systems公司; 大鼠TNF-α、IL-6、IL-10 ELISA检测试剂盒购于北京四正柏生物公司; EMSA试剂盒购于美国Thermo Fisher Scientific公司; NF-κB寡核苷酸生物素标记探针购于碧云天生物公司; 磷酸化糖原合成酶激酶3β[phosphorylated glycogen synthase kinase 3β, p-GSK3β(Ser9)]和细胞因子信号传导抑制因子1(suppressor of cytokine signaling 1, SOCS1)一抗购于美国Cell Signaling Technology公司。
1.2 实验设计采用随机数字表法分为3组:①VEGF-C组:共6对大鼠,在冷保存期开始时经门静脉插管用微量泵持续灌注VEGF-C[5 ng/(kg·min)]1 h; ②对照组:共6对大鼠,以相同的方式灌注等体积的UW液(University of Wisconsin solution)作为对照; ③假手术组:共6只动物,麻醉后仅行开、关腹。实验动物均存活至术后24 h。术后24 h处死全部动物,经门静脉采集血液样本,获取肝组织用于组织病理学分析及分离KCs。
1.3 建立动物模型根据KAMADA二袖套法建立肝移植模型[9]。采用乙醚吸入麻醉,获取供肝后,在0~4 ℃ UW液中将袖套套入肝下下腔静脉、门静脉,并置入胆管内支架。供肝在0~4 ℃ UW液中冷保存18 h [10]。切除受体肝脏,原位植入供肝,连续缝合肝上下腔静脉,袖套套入法吻合门静脉,结束无肝期,控制无肝期在17~25 min。袖套法吻合肝下下腔静脉,结扎肝动脉但不吻合,插入胆管内支架重建胆道。受体术后4 h开始进饮。
1.4 肝功能检测采用Beckman CX7全自动生化分析仪检测移植术后血清中丙氨酸氨基转移酶(alanine transaminase,ALT)和总胆红素(total bilirubin, TBIL)水平。
1.5 HE染色将获取肝组织于10%甲醛溶液中固定后包埋切片,用苏木精-伊红(hematoxylin-eosin, HE)染色观察病理形态学改变。根据Suzuki评分标准, 肝损伤程度被量化为0~4级[11]。
1.6 血清炎症因子水平用ELISA试剂盒(北京四正柏生物公司)检测移植术后血清中TNF-α、IL-6、IL-10水平。
1.7 分离KCs参照ZENG等[12]的报道分离KCs。简言之,用10 mL无钙的Hank平衡盐溶液经门静脉灌注去除肝脏内的血液。将肝组织切碎后在含50 U Ⅳ型胶原酶(美国Sigma-Aldrich公司)的容器中于37 ℃孵育30 min。然后将肝匀浆滤液进行不连续梯度离心从而分离出非实质细胞。将获得的细胞在37 ℃、5%CO2条件下继续孵育2 h,除去非贴壁细胞后获得KCs。采集的KCs最终密度为1×10 6/孔。
1.8 Real time-PCR检测根据试剂盒说明书(碧云天生物公司)提取KCs的总RNA并逆转录成cDNA。采用Real time-PCR检测KCs中VEGFR-3以及巨噬细胞极化特异性标记基因水平。具体引物如下,VEGFR-3上游: 5′-TGAA-AGACGGCACACGAATG-3′, 下游: 5′-CCTCGCTTTAG-GGTCTCCAG-3′, 267 bp; TNF-α上游: 5′-CATACCAGGAGAAAGTCAGC-3′, 下游: 5′-CTAAGTACTTGGGCA-GGTTG-3′, 204 bp; IL-6上游: 5′-GTTCTCTGGGAA-ATCGTGGA-3′, 下游: 5′-TGTACTCCAGGTAGCTA-3′, 218 bp; IL-10上游: 5′-TGGGTAGACAGCAGTGCCAC-3′, 下游: 5′-GCCCACAAGATGGACAGGG-3′, 176 bp; Arg1上游: 5′-CCAGTATTCACCCCGGCTAC-3′, 下游: 5′-ACAAGACAAGGTCAACGCCA-3′,231 bp; 以GAPDH为内参,上游: 5′-TCAACGGGGGACATAAAAGT-3′, 下游: 5′-TGCATTGTTTTACCAGTGTCAA-3′,132 bp。结果用2-ΔΔCt表示。
1.9 EMSA检测采用EMSA试剂盒(美国Thermo Fisher Scientific公司)检测KCs中NF-κB转录活性。为了进行super-shift检测,将提取的KCs核蛋白先与NF-κB P65抗体(美国Santa Cruz Biotechnology公司)在室温下孵育20 min,再用NF-κB生物素标记探针(碧云天生物公司)(上游5′-AGTTGAGGGGACTTTCCCAGGC-3′, 下游3′-TCAACTCCCCTGAAAGGGTCCG-5′)进行标记。最后将样品在4%聚丙烯酰胺凝胶上进行电泳,具体步骤参照说明书进行。
1.10 Western blot检测据报道,VEGFR-3-VEGF-C信号通过增强SOCS1表达进而抑制TLR4-NF-κB通路[7]。而糖原合成酶激酶3β (glycogen synthase kinase 3β,GSK3β)在丝氨酸9位点发生磷酸化可抑制GSK3β活性从而增加IL-10的产生[13]。故对SOCS1及p-GSK3β(Ser9)进行检测。
采用RIPA裂解缓冲液(碧云天生物公司)从KCs(1×106)中提取蛋白质,并用BCA蛋白质定量试剂盒(碧云天生物公司)定量。将提取的蛋白质在8%十二烷基硫酸钠聚丙烯酰胺凝胶上进行电泳并转膜。经脱脂奶粉在室温下封闭1 h后,再与p-GSK3β(Ser9)/SOCS1抗体(rabbit, 1 :100, Cell Signaling Technology)在4 ℃下孵育过夜。最后将膜与辣根过氧化物酶偶联的二抗在37 ℃反应1 h,并用DAB显色。采用Image-Pro Plus 6.0分析目的条带和内参光密度值比值。
1.11 统计学分析采用SPSS 17.0统计软件。计量结果以x±s表示。各组数据均符合正态分布,多组间差异采用单因素方差分析,两组间比较采用Student’s-t检验,P < 0.05被认为差异有统计学意义。
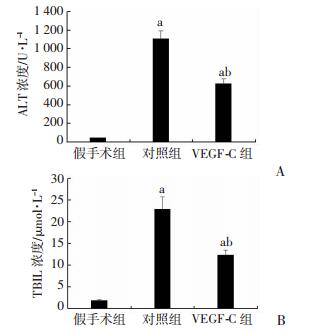
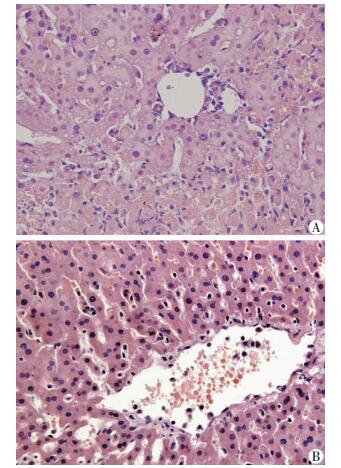
2 结果 2.1 外源性VEGF-C减轻了移植术后肝脏IRI观察经门静脉灌注外源性VEGF-C对移植肝脏IRI的影响发现:对照组和VEGF-C组术后24 h的血清ALT和TBIL水平较假手术组明显上升; 与对照组比较,VEGF-C显著降低了术后ALT和TBIL水平(图 1)。通过HE染色观察到:对照组可见较多的肝细胞空泡样变性,细胞边界形态轮廓模糊,部分细胞核固缩或溶解,而VEGF-C组则表现为肝血窦轻度扩张,少部分肝细胞空泡样变性,局灶性肝细胞核固缩,个别肝细胞坏死以及少量炎症细胞浸润(图 2)。VEGF-C组的Suzuki评分(1.16±0.75)较对照组(3±0.63)明显降低(P < 0.05)。
|
| a:P < 0.05, 与假手术组比较; b: P < 0.05, 与对照组比较 图 1 各组大鼠术后24 h血清ALT(A)、TBIL(B)水平(n=6) |
|
| A:对照组; B:VEGF-C组 图 2 大鼠移植术后24 h肝脏HE染色观察(×400) |
2.2 VEGF-C调节移植术后KCs由M1向M2极化
分离出移植肝脏中KCs,采用Real time-PCR检测VEGFR-3和极化特异性标记基因水平。对VEGFR-3的检测发现:对照组(5.50±0.79)和VEGF-C组(5.70±0.36)的水平较假手术组(1.03±0.08)明显升高(n=6, P < 0.05),而对照组和VEGF-C组之间差异没有统计学意义。与对照组比较,M2特异性标记基因(IL-10和Arg1)的表达在VEGF-C组中显著增加,而M1特异性标记基因(IL-6和TNF-α)明显减少(P < 0.05,图 3)。

|
| a: P < 0.05,与对照组比较 图 3 移植术后24 h KCs中极化相关基因mRNA水平(n=6) |
2.3 VEGF-C抑制NF-κB活性并上调SOCS1和p-GSK3β表达
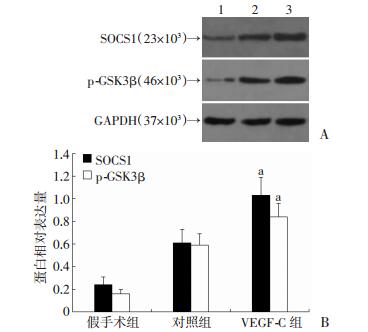
与对照组比较,VEGF-C明显增强了KCs中SOCS1的表达(P < 0.05,图 4)并抑制了NF-κB转录活性(图 5)。VEGF-C组中KCs的p-GSK3β(Ser9)表达明显高于对照组(P < 0.05,图 4)。
|
| A:Western blot检测1:假手术组; 2:对照组; 3:VEGF-C组; B:半定量分析(n=3) a:P < 0.05,与对照组比较 图 4 Western blot检测移植术后24 h KCs中SOCS1及p-GSK3β表达 |

|
| 1:假手术组,2:对照组,3:VEGF-C组 图 5 EMSA检测移植术后24 h KCs中NF-κB活性 |
2.4 VEGF-C对血清中炎症因子的影响
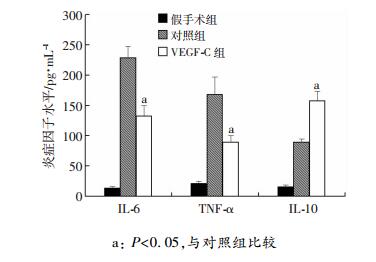
Western blot检测血清中炎性细胞因子的水平,结果显示:与对照组比较,VEGF-C减少了促炎细胞因子(IL-6和TNF-α)的产生,增加了IL-10水平(P < 0.05,图 6)。
|
| a: P < 0.05,与对照组比较 图 6 ELISA检测移植术后24 h血清中炎症因子水平(n=6) |
3 讨论
研究发现VEGFR-3/VEGF-C信号在淋巴管生成和血管生成中具有关键作用[14-15]。新近发现VEGFR-3/ VEGF-C信号能负性调节TLR4引发的巨噬细胞炎症反应[7]。本研究发现经门静脉灌注外源性VEGF-C可调节移植术后KCs活性,提示VEGF-C对肝移植术后IRI具有重要的保护作用; 证实VEGF-C显著降低了移植术后24 h的ALT和TBIL水平,并从病理形态学上减轻了肝损伤。
作为体内数量最多的巨噬细胞,KCs是肝内释放促炎因子的主要来源[16-17]。其激活在肝脏IRI的发生、发展中具有重要的触发作用[3]。当KCs被TLR4-NF-κB通路激活后,促炎细胞因子(如TNF-α和IL-6)的产生增加,移植肝脏IRI加重[4-5];相反,当KCs释放IL-10增加时,肝脏IRI减轻[18-19]。这种差异与KCs不同的表型有关。M1型即经典激活(classicallyactivated macrophage)的KCs和M2型即替代性活化(alternatively activatedmacrophage)的KCs是这种差异的两个极端表型。M1型在识别微生物组分LPS和损伤相关分子模式(damage-associated molecular patterns, DAMPs)后,合成、分泌大量促炎因子(如TNF-α、IL-6、IL-1β等),对感染和组织损伤产生快速炎症应答; 而M2型通过释放IL-10等抗炎介质,参与了消除炎症、促进组织损伤修复、肿瘤逃逸等病理生理过程[6]。本研究观察到移植术后KCs的VEGFR-3 mRNA水平明显上升,这与ZHANG等[7]在LPS刺激下细胞实验中的发现一致。外源性VEGF-C使KCs中M2特异性标记基因(IL-10和Arg1)的表达增加,并降低了M1特异性标记基因(IL-6和TNF-α)水平。以上结果表明VEGFR-3/VEGF-C信号可诱导肝移植过程中KCs由M1向M2表型转化。血清中促炎因子(IL-6和TNF-α)水平的降低及IL-10含量的增加也进一步支持上述发现。
SOCS1被定义为TLR4-NF-κB通路的负性调节器[20],而p-GSK3β (serine 9)可抑制GSK3β活性,增加IL-10的产生,并改善肝脏IRI[21]。本研究发现外源性VEGF-C上调了SOCS1和p-GSK3β的表达,并抑制NF-κB活性。有研究认为VEGF-C对SOCS1和p-GSK3β的调控作用与磷脂酰肌醇3激酶(1-phosphatidylinositol 3-kinase, PI3K)-Akt1信号通路的激活有关[7, 21],但确切的机制有待进一步研究。
综上所述,本研究证实外源性VEGF-C通过减轻移植术后炎症反应及诱导KCs由M1向M2极化从而改善了移植肝脏IRI。其机制和上调SOCS1和p-GSK3β的表达,以及抑制NF-κB活性有关。本研究结果表明VEGFR-3/VEGF-C信号可能是预防和治疗肝脏IRI的新靶点。
| [1] | ZHANG X J, CHENG X, YAN Z Z, et al. An ALOX12-12-HETE-GPR31 signaling axis is a key mediator of hepatic ischemia-reperfusion injury[J]. Nat Med, 2017, 24(1): 73–83. DOI:10.1038/nm.4451 |
| [2] | LU L, ZHOU H M, NI M, et al. Innate immune regulations and liver ischemia-reperfusion injury[J]. Transplantation, 2016, 100(12): 2601–2610. DOI:10.1097/TP.0000000000001411 |
| [3] | TOMIYAMA K, IKEDA A, UEKI S, et al. Inhibition of Kupffer cell-mediated early proinflammatory response with carbon monoxide in transplant-induced hepatic ischemia/reperfusion injury in rats[J]. Hepatology, 2008, 48(5): 1608–1620. DOI:10.1002/hep.22482 |
| [4] | LI X F, WU Y K, ZHANG W F, et al. Pre-conditioning with tanshinone ⅡA attenuates the ischemia/reperfusion injury caused by liver grafts via regulation of HMGB1 in rat Kupffer cells[J]. Biomed Pharmacother, 2017, 89: 1392–1400. DOI:10.1016/j.biopha.2017.03.022 |
| [5] |
彭勇, 龚建平, 刘长安, 等. 甘氨酸对大鼠肝移植缺血再灌注损伤库普弗细胞CD14和核因子-κB的影响[J].
中华肝脏病杂志, 2005, 13(3): 179–182.
PENG Y, GONG J P, LIU C A, et al. The effect of glycine on CD14 and NF-kappa B in Kupffer cells from rat liver grafts after ischemia-reperfusion injury[J]. Chin J Hepatol, 2005, 13(3): 179–182. DOI:10.3760/j.issn:1007-3418.2005.03.006 |
| [6] | MURRAY P J. Macrophage polarization[J]. Annu Rev Physiol, 2017, 79(1): 541–566. DOI:10.1146/annurev-physiol-022516-034339 |
| [7] | ZHANG Y B, LU Y, MA L, et al. Activation of vascular endothelial growth factor receptor-3 in macrophages restrains TLR4-NF-κb signaling and protects against endotoxin shock[J]. Immunity, 2014, 40(4): 501–514. DOI:10.1016/j.immuni.2014.01.013 |
| [8] | ZHAI Y, QIAO B, SHEN X D, et al. Evidence for the pivotal role of endogenous Toll-like receptor 4 ligands in liver ischemia and reperfusion injury[J]. Transplantation, 2008, 85(7): 1016–1022. DOI:10.1097/TP.0b013e3181684248 |
| [9] | KAMADA N, CALNE R Y. A surgical experience with five hundred thirty liver transplants in the rat[J]. Surgery, 1983, 93(1 Pt 1): 64–69. |
| [10] | XIAO Z Y, BANAN B, JIA J L, et al. CD47 blockade reduces ischemia/reperfusion injury and improves survival in a rat liver transplantation model[J]. Liver Transpl, 2015, 21(4): 468–477. DOI:10.1002/lt.24059 |
| [11] | SUZUKI S, TOLEDO-PEREYRA L H, RODRIGUEZ F J, et al. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine[J]. Transplantation, 1993, 55(6): 1265–1272. DOI:10.1097/00007890-199306000-00011 |
| [12] | ZENG W Q, ZHANG J Q, LI Y, et al. A new method to isolate and culture rat kupffer cells[J]. PLoS ONE, 2013, 8(8): e70832. DOI:10.1371/journal.pone.0070832 |
| [13] | MARTIN M, REHANI K, JOPE R S, et al. Toll-like receptor-mediated cytokine production is differentially regulated by glycogen synthase kinase 3[J]. Nat Immunol, 2005, 6(8): 777–784. DOI:10.1038/ni1221 |
| [14] | YU J L, ZHANG X F, KUZONTKOSKI P M, et al. Slit2N and Robo4 regulate lymphangiogenesis through the VEGF-C/VEGFR-3 pathway[J]. Cell Commun Signal, 2014, 12: 25. DOI:10.1186/1478-811X-12-25 |
| [15] | ENGELMANN D, MAYOLI-NüSSLE D, MAYRHOFER C, et al. E2F1 promotes angiogenesis through the VEGF-C/VEGFR-3 axis in a feedback loop for cooperative induction of PDGF-B[J]. J Mol Cell Biol, 2013, 5(6): 391–403. DOI:10.1093/jmcb/mjt035 |
| [16] | BALA S S, MARCOS M, KODYS K, et al. Up-regulation of microRNA-155 in macrophages contributes to increased tumor necrosis factor {alpha} (TNF{alpha}) production via increased mRNA half-life in alcoholic liver disease[J]. J Biol Chem, 2011, 286(2): 1436–1444. DOI:10.1074/jbc.M110.145870 |
| [17] | DONG Z J, WEI H M, SUN R, et al. The roles of innate immune cells in liver injury and regeneration[J]. Cell Mol Immunol, 2007, 4(4): 241–252. |
| [18] | LI Y K, MA D X, WANG Z M, et al. MicroRNA-155 deficiency in kupffer cells ameliorates liver ischemia-reperfusion injury in mice[J]. Transplantation, 2017, 101(7): 1600–1608. DOI:10.1097/TP.0000000000001765 |
| [19] | RAPTIS D A, LIMANI P, JANG J H, et al. GPR120 on Kupffer cells mediates hepatoprotective effects of ω3-fatty acids[J]. J Hepatol, 2014, 60(3): 625–632. DOI:10.1016/j.jhep.2013.11.006 |
| [20] | MANSELL A, SMITH R, DOYLE S L, et al. Suppressor of cytokine signaling 1 negatively regulates Toll-like receptor signaling by mediating Mal degradation[J]. Nat Immunol, 2006, 7(2): 148–155. DOI:10.1038/ni1299 |
| [21] | REN F, DUAN Z P, CHENG Q, et al. Inhibition of glycogen synthase kinase 3 beta ameliorates liver ischemia reperfusion injury by way of an interleukin-10-mediated immune regulatory mechanism[J]. Hepatology, 2011, 54(2): 687–696. DOI:10.1002/hep.24419 |



