椎间盘的退变是脊柱退行性疾病发生、发展的重要原因。研究显示,由椎间盘髓核细胞所产生的炎性细胞因子及其炎症反应在椎间盘退变过程中起关键作用,控制炎症也是改善椎间盘退变患者临床症状的重要途径[1-2],但炎性细胞因子信号通路关键抑制靶点的研究及其对椎间盘退变的保护作用机制目前尚未阐明。
目前,锌指蛋白A20在许多炎症疾病领域一直受到密切关注,其是在内源性保护机制研究中发现的一类新的胞质蛋白。A20是核转录因子κB活化的下游产物,同时也是核因子-kappB(NF-κB)信号系统的负反馈调节因子,能直接负反馈调节NF-κB通路的激活[3]。体内A20在细胞中的过表达可抑制NF-κB的活性,显著减少TNF-α和IL-1等炎症因子的产生,从而控制炎症反应。A20是一种重要的调节蛋白,可防止体内炎症反应失控[4]。然而在人椎间盘退变情况下,将外源性A20基因转染入退变髓核细胞后过表达,对髓核细胞炎症因子、NF-κB以及细胞退变指标表达变化的影响尚未见相关报道。因此,本研究通过观察A20在内毒素刺激情况下,对人椎间盘髓核细胞炎症因子、NF-κB以及细胞退变指标表达变化的影响,以期为深入探讨椎间盘髓核细胞炎性信号通路关键抑制靶点及其对椎间盘退变的保护作用机制研究提供实验依据。
1 材料与方法 1.1 临床获取人退变椎间盘髓核组织经重庆医科大学附属第一医院伦理委员会批准(2016-059),所收集的人退变椎间盘髓核组织来自本院骨科2017年6月至2018年7月住院患者术中常规切除的退变椎间盘组织,术前与患者签署知情同意书。标本来自15例患者,年龄45~67岁,男性9例,女性6例,平均年龄52岁。患者术前均经术前症状、体征和影像学检查确诊为腰椎间盘突出症,保守治疗无效,Pfirrmann分级为Grade Ⅲ~Ⅴ。
1.2 腺病毒包装及主要实验试剂人A20基因载体pHBAd-EF1-MCS-GFP/TNFAIP3由汉恒生物科技(上海)有限公司构建、测序并进行重组腺病毒的包装。DMEM/F12细胞培养液购自HyClone公司,优质胎牛血清(新西兰血源)购自美国Corning公司。脂多糖(LPS)与Ⅱ型胶原酶购自美国Sigma公司。TNF-α以及IL-β的ELISA试剂盒购自上海依科赛公司。兔抗人TNF-α单克隆抗体、兔抗人p65单克隆抗体、兔抗人p-p65单克隆抗体、兔抗人TNFAIP3单克隆抗体、兔抗人Collagen Ⅱ单克隆抗体、羊抗兔二抗购自Boster公司;兔抗人IL-β单克隆抗体、兔抗人aggrecan单克隆抗体购自美国SAB公司;兔抗人β-actin抗体、兔抗人GAPDH抗体购自万类生物科技公司。RNA逆转录试剂盒、荧光发光剂SYBR购自TaKaRa公司,PCR引物由TaKaRa公司设计并合成。
1.3 髓核细胞的体外分离培养术中获取的人退变椎间盘髓核组织装入标本袋中,放入冰盒中保存,带入超净台,洗涤并清除杂质,剪碎同时分离髓核组织,并将髓核组织块转移到无菌的15 mL离心管中。向上述离心管中加入0.25%胰酶,1 :2体积密封后摇匀,放入37 ℃孵箱中孵育30 min,并且每15 min摇匀1次。然后离心(1 200 r/min,5 min),弃上清液,加入2倍于组织体积、浓度为2 g/L的二型胶原酶,于37 ℃孵箱内消化4 h,每1.5~2 h摇匀1次。离心管中的混合物用200目细胞筛过滤,并转移到15 mL离心管收集细胞。将细胞悬浮于含有20%胎牛血清的DMEM/F12培养基中,并在37 ℃和5%CO2培养箱中培养。细胞贴壁后,倒置显微镜观察并拍照。细胞培养至80%~90%融合后胰酶消化,1 :2传代。取P1、P2代髓核细胞进行实验。
1.4 外源性A20目的基因转染效率检测A20目的基因检测分组:A组(空白对照组),B组(空载体腺病毒pHBAd-EF1-MCS-GFP感染组),C组(A20过表达腺病毒pHBAd-EF1-MCS-GFP/TNFAIP3感染组),分别进行A20目的基因与蛋白表达检测,以观察目的基因的转染效率。空白对照组为成功培养的髓核细胞;空载体腺病毒感染组为髓核细胞成功培养后以携带空载体腺病毒液1 μL/mL的完全培养基,继续培养48 h后的髓核细胞;A20过表达腺病毒感染组为髓核细胞成功培养后以携带过表达腺病毒液1 μL/mL的完全培养基,继续培养48 h后的髓核细胞。
1.5 实验设计与分组处理证实外源性A20目的基因可高效转染髓核细胞后,进行正式腺病毒感染人退变椎间盘髓核细胞实验。实验分组:对照组、单纯过表达A20基因腺病毒感染组、单纯LPS(10 μg/mL)刺激组及LPS(10 μg/mL)刺激+过表达A20基因腺病毒感染组。髓核细胞成功培养后,对照组为以含有空载体腺病毒液1 μL/mL的完全培养基,继续培养48 h后的髓核细胞;单纯过表达A20基因腺病毒感染组为以含有过表达腺病毒液1 μL/mL的完全培养基,继续培养48 h后的髓核细胞;单纯LPS刺激组为以含有空载体腺病毒液1 μL/mL的完全培养基培养48 h后,再以10 μg/mL LPS的完全培养基继续培养12 h的髓核细胞;LPS刺激+过表达A20基因腺病毒感染组为含有过表达腺病毒液1 μL/mL的完全培养基培养48 h后,再以10 μg/mL LPS的完全培养基继续培养12 h的髓核细胞。
1.6 Real-time PCR检测髓核细胞A20基因mRNA表达使用TRIzol试剂盒提取细胞总RNA并测定总RNA的浓度与光密度值,如果浓度大于500 μg/μL,则稀释至500 μg/μL。取2 μL总RNA按照逆转录试剂盒说明书合成cDNA,用于检测A20 mRNA的表达。TNFAIP3引物序列:上游5′-AGAGCAACTGAGATC- GAGCCA-3′,下游5′-CTGGTTGGGATGCTGACACTC-3′。Real-time PCR反应体系共10 μL:SYBR 5 μL,DEPC水3.2 μL,前后引物各0.4 μL,模板cDNA 1 μL。反应条件: Step1:95 ℃ 30 s;Step2:PCR反应,95 ℃ 5 s预处理,60 ℃ 30 s,40个循环;Step3:95 ℃ 10 s,65 ℃ 5 s,溶解分析。以GAPDH为内参照标化各组cDNA模板。
1.7 Western blot检测髓核细胞A20、IL-1β、TNF-α、p65及p-p65、aggrecan、collagen Ⅱ蛋白的表达裂解各组细胞后,冰浴,4 ℃ 12 000 r/min离心15 min,收集上清并定容,BCA法测定上清中蛋白浓度,加入RIPA稀释蛋白以平衡各组间蛋白浓度,以1/4蛋白体积上样缓冲液混合煮沸15 min后上样,恒压120 V进行电泳分离,恒流250 mA进行电转,将蛋白电转至0.22 mm PVDF膜。用快速封闭液对转好的膜封闭30 min,TBST洗涤3次,每次5 min。一抗(1 :500)4 ℃孵育12 h,TBST洗涤3次,每次15 min,二抗(1 :3 000)室温孵育1 h,TBST洗涤2次,每次15 min。显影,发光。用Image J软件处理。系统分析目标条带的光密度值。
1.8 ELISA法检测细胞培养上清液中TNF-α、IL-1β的水平分别按照TNF-α、ELISA试剂盒操作说明,使用多功能酶标仪检测光密度,绘制标准曲线,计算各组TNF-α、IL-1β的浓度。
1.9 统计学方法采用SPSS 19.0统计学软件进行统计,计量资料以x±s表示。采用双因素方差分析,各组间均值的两-两多重比较采用LSD法,检验水准α=0.05。
2 结果 2.1 原代人退变椎间盘髓核细胞形态观察原代退变椎间盘髓核细胞可在提取培养1周内开始逐渐贴壁,贴壁后的细胞呈类圆形或多角形,随着贴壁时间增加,逐渐变为梭形。细胞生长逐渐加快,4周左右可达80%~90%融合状态,呈不规则梭形细胞团聚集,且可开始传代(图 1)。
|
| 图 1 光学显微镜下观察培养4周的髓核细胞 (×40) |
2.2 外源性A20目的基因转染效率检测
A20过表达腺病毒转染组A20的mRNA和蛋白表达量明显高于空白对照组与转染空载体腺病毒组(P < 0.05);转染空载体腺病毒后与空白对照组相比,A20的mRNA和蛋白表达量差异无统计学意义。见图 2,3。
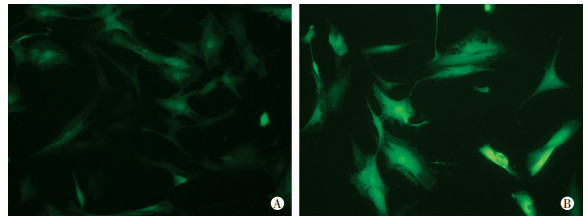
|
| A:感染24 h;B:感染48 h 图 2 荧光显微镜观察A20过表达腺病毒感染不同时间感染效率 (×200) |

|
| A:荧光定量PCR结果分析;B:Western blot检测结果;C:Western blot半定量结果分析;1:空白对照组;2:空载体腺病毒转染组;3:A20过表达腺病毒转染组;a:P < 0.05,与空载体腺病毒转染组比较 图 3 Real-time PCR与Western blot检测各组髓核细胞锌指蛋白A20的表达 |
2.3 Western blot检测髓核细胞炎症相关蛋白以及p65、p-p65的表达
单纯LPS刺激组TNF-α、IL-1β以及p-p65的蛋白表达量明显高于对照组(P < 0.05);A20过表达腺病毒感染组TNF-α、IL-1β、p-p65蛋白表达与对照组相比,差异无统计学意义;LPS+A20过表达腺病毒感染组与单纯LPS刺激组相比,TNF-α、IL-1β以及p-p65的表达明显下降(P < 0.05)。各组之间p65的表达差异均无统计学意义。见图 4。
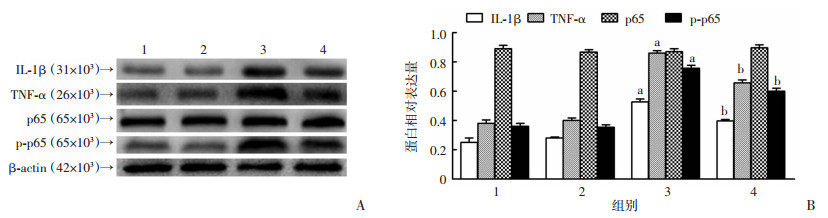
|
| 1:对照组;2:A20过表达腺病毒转染组;3:LPS刺激组;4:LPS+A20过表达腺病毒转染组 A:Western blot检测结果;B:Western blot半定量结果分析 a:P < 0.05,与对照组比较;b:P < 0.05,与单纯LPS刺激组比较 图 4 Western blot检测各组髓核细胞相关炎症因子的表达 |
2.4 ELISA检测髓核细胞培养液中TNF-α及IL-1β的含量
对照组和A20过表达腺病毒感染组细胞培养液中TNF-α、IL-1β的含量很低,而单纯LPS刺激组细胞培养液中TNF-α、IL-1β相较于对照组明显升高(P < 0.05);LPS+A20过表达腺病毒感染组TNF-α、IL-1β表达量与单纯LPS刺激组相比其表达量明显降低(P < 0.05),见图 5。
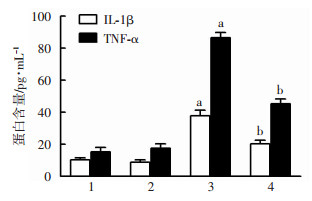
|
| 1:对照组;2:A20过表达腺病毒转染组;3:LPS刺激组;4:LPS+A20过表达腺病毒转染组; a:P < 0.05,与对照组比较;b:P < 0.05,与LPS刺激组比较 图 5 各组髓核细胞培养液中TNF-α及IL-1β的含量 |
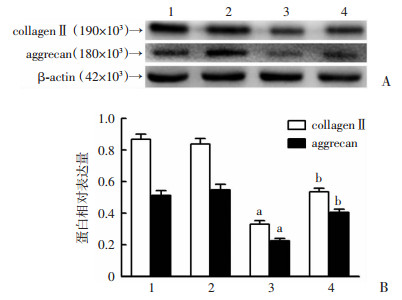
2.5 各组髓核细胞中退变相关指标
单纯LPS刺激组aggrecan、collagen Ⅱ蛋白表达量明显低于对照组,差异有统计学意义(P < 0.05);A20过表达腺病毒感染组aggrecan、collagen Ⅱ蛋白表达量与对照组比较无明显差异;LPS+A20过表达腺病毒感染组aggrecan、collagen Ⅱ蛋白表达量高于单纯LPS刺激组(P < 0.05)。见图 6。
|
| 1:对照组;2:A20过表达腺病毒转染组;3:LPS刺激组;4:LPS+A20过表达腺病毒转染组;A:Western blot检测结果;B:Western blot半定量结果分析;a:P < 0.05,与对照组比较;b:P < 0.05,与LPS刺激组比较 图 6 Western blot检测各组髓核细胞相关退变指标的表达 |
3 讨论
腰椎间盘退行性变是一种以腰椎间盘退行性变为主要症状的疾病,如腰背痛和神经根痛。它受吸烟、衰老、感染、年龄、遗传、机械压迫、自身免疫、糖尿病、创伤等多种因素的影响[5-7],被认为是临床上腰椎间盘突出症、慢性下腰痛、腰椎管狭窄等疾病的病理基础,是引起患者慢性腰腿痛的重要原因之一。国内外许多研究者认为,腰椎间盘退变主要表现在细胞外基质成分的变化,包括炎症因子、氧化应激、细胞凋亡、细胞衰老、酶活性、营养的变化、遗传因素等[8-10],而其中炎症因子的增多是引起椎间盘退变非常重要的因素之一[11-12]。研究证实:TNF-α和IL-1β与椎间盘退变密切相关[2]。炎症因子TNF-α和IL-1β通过上调组织金属蛋白酶(MMP)的活性来减少Ⅱ型胶原和蛋白多糖的合成和降解。另一方面,它们可以通过死亡受体通路介导椎间盘细胞的凋亡,从而引起椎间盘退变。由此可见,炎症在椎间盘退变的发生、发展过程中起重要作用。因此,寻找炎症信号转导途径的关键靶点,抑制炎症反应可能是控制椎间盘退变的有效方法。
锌指蛋白A20是一种胞质蛋白,各种活化NF-κB的刺激因素均可诱导多种细胞表达A20,A20可负反馈调节NF-κB诱导的炎症反应[13],在各种炎症性疾病及其进展过程中发挥负性调节作用。炎性关键因子TNF-α和IL-1β是通过调控NF-κB信号通路来实现对炎症级联反应的激发,而NF-κB被激活并参与了椎间盘退变的慢性炎症过程[14]。锌指蛋白A20对关键靶点NF-κB的活化具有重要的负反馈调控作用,是防止体内炎症反应失控的调节蛋白,所以我们选取了锌指蛋白A20作为椎间盘退变过程中的关键靶点来进行研究。
为观察A20目的基因的转染效率,本实验使用腺病毒将过表达A20基因载体转入髓核细胞,实验结果显示,A20过表达腺病毒转染组髓核细胞内A20 mRNA和蛋白表达量与对照组相比有所增高(P < 0.05);而空载体腺病毒转染组与对照组相比A20的mRNA与蛋白表达量无明显差异。提示髓核内A20在基因高效转染了髓核细胞,并在基因水平与蛋白水平获得了高表达。
为进一步观察A20对人椎间盘髓核细胞炎症因子、NF-κB以及细胞退变指标表达变化的影响,本实验通过LPS刺激人椎间髓核细胞,Western blot结果显示髓核细胞中炎症因子TNF-α、IL-1β以及p-p65的蛋白表达量明显高于对照组,表明LPS诱导了髓核细胞内炎症级联反应的发生,同时使p65主要进入细胞核内表达,p-p65蛋白表达明显增高,提示NF-κB通路活化增加;髓核细胞内aggrecan、collagenⅡ表达量相对于对照组减少,提示髓核细胞在LPS与炎症刺激下退变过程加重;同时ELISA结果也提示LPS刺激细胞后培养上清中TNF-α和IL-1β的表达增加。然后,通过锌指蛋白A20在髓核细胞内过表达来干预LPS引起的炎症反应,Western blot结果显示:A20转染组在受到LPS刺激后与单纯LPS刺激组相比较,髓核细胞内炎性因子TNF-α和IL-1β、p-p65表达水平明显下降,ELISA检测结果也表明A20转染组细胞培养液中TNF-α及IL-1β表达水平低于单纯LPS刺激组,同时转染组中髓核细胞退变相关指标aggrecan、collagenⅡ表达量与单纯LPS刺激组相比明显升高,上述结果提示在髓核细胞中锌指蛋白A20过表达能够减少NF-κB通路的活化,同时抑制髓核细胞中LPS引起的级联炎症反应,减少了炎症因子的释放,从而使髓核细胞炎性退变的过程得到控制。而A20转染组髓核细胞在未受到LPS刺激时,TNF-α、IL-1β、p-p65以及aggrecan、collagenⅡ表达水平与对照组无明显差异,表明过表达A20在髓核细胞内发挥作用具有一定的炎症依赖性。
综上所述,LPS刺激可增加椎间盘髓核细胞中炎症因子的表达并加重退变过程,而使A20在髓核细胞中过表达后,可加强炎症的负性调节系统的作用,抑制NF-κB通路活性,使髓核细胞中炎症因子TNF-α、IL-1β的过度表达得到有效控制,同时也使椎间盘炎症退变的过程得到一定的控制,提示锌指蛋白A20可能通过NF-κB信号通路抑制髓核细胞在受到内毒素刺激时的炎症反应,同时在控制椎间盘炎症退变过程中可能起到关键作用。然而,其在控制椎间盘炎症退变中的具体作用机制尚未十分清楚,有待于今后进一步深入研究。
| [1] | TEIXEIRA G Q, PEREIRA C L, FERREIRA J R, et al. Immunomodulation of human mesenchymal stem/stromal cells in intervertebral disc degeneration: insights from a proinflammatory/degenerative Ex vivo model[J]. Spine, 2018, 43(12): E673–E682. DOI:10.1097/BRS.0000000000002494 |
| [2] | MOLINOS M, ALMEIDA C R, CALDEIRA J, et al. Inflammation in intervertebral disc degeneration and regeneration[J]. J R Soc Interface, 2015, 12(104): 20141191. DOI:10.1098/rsif.2014.1191 |
| [3] | DE WINTHER M P, KANTERS E, KRAAL G, et al. Nuclear factor κB singnaling in atherogenesis[J]. Arterioscler Thromb Vasc Biol, 2005, 25(5): 904–914. DOI:10.1161/01.ATV.0000160340.72641.87 |
| [4] |
刘浠, 易威威, 温亚枫, 等. 锌指蛋白A20及其相关炎症因子在椎间盘髓核细胞退变前后的表达变化[J].
第三军医大学学报, 2016, 38(18): 2077–2081.
LIU X, YI W W, WEN Y F, et al. Expression of zinc finger protein A20 and related inflammatory factors in nucleus pulposus cells in degenerative intervertebral disc[J]. J Third Mil Med Univ, 2016, 38(18): 2077–2081. DOI:10.16016/j.1000-5404.201602105 |
| [5] | VO N V, HARTMAN R A, PATIL P R, et al. Molecular mechanismsof biological aging in intervertebral discs[J]. J Orthop Res, 2016, 34(8): 1289–1306. DOI:10.1002/jor.23195 |
| [6] | PARK J B, BYUN C H, PARK E Y. Rat notochordal cells undergo premature stress-induced senescence by high glucose[J]. Asian Spine J, 2015, 9(4): 495–502. DOI:10.4184/asj.2015.9.4.495 |
| [7] | PARK J S, PARK J B, PARK I J, et al. Accelerated premature stress-induced senescence of young annulus fibrosus cells of rats by high glucose-induced oxidative stress[J]. Int Orthop, 2014, 38(6): 1311–1320. DOI:10.1007/s00264-014-2296-z |
| [8] | SUZUKI S, FUJITA N, HOSOGANE N, et al. Excessive reactive oxygen species are therapeutic targets for intervertebral disc degeneration[J]. Arthritis Res Ther, 2015, 17: 316. DOI:10.1186/s13075-015-0834-8 |
| [9] | LIPSON S J, MUIR H. Experimental intervertebral disc degeneration: morphologic and proteoglycan changes over time[J]. Arthritis Rheum, 1981, 24(1): 12–21. DOI:10.1002/art.1780240103 |
| [10] | JONES P, GARDNER L, MENAGE J, et al. Intervertebral disc cells as competent phagocytes in vitro: implications for cell death in disc degeneration[J]. Arthritis Res Ther, 2008, 10(4): R86. DOI:10.1186/ar2466 |
| [11] | WANG S, LI J, TIAN J, et al. High amplitude and low frequency cyclic mechanical strain promotes degeneration of human nucleus pulposus cells via the NF-κB p65 pathway[J]. J Cell Physiol, 2018, 233(9): 7206–7216. DOI:10.1002/jcp.26551 |
| [12] | ANDERSSON G B. Epidemiological features of chronic low-backpain[J]. Lancet, 1999, 354(9178): 581–585. DOI:10.1016/S0140-6736(99)01312-4 |
| [13] | SHEMBADE N, MA A, HARHAJ E W. Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes[J]. Science, 2010, 327(5969): 1135–1139. DOI:10.1126/science.1182364 |
| [14] |
易威威, 温亚枫, 刘浠, 等. NF-κB抑制剂对脂多糖刺激的退变人椎间盘髓核细胞炎症因子表达的影响[J].
第三军医大学学报, 2017, 39(8): 755–758.
YI W W, WEN Y F, LIU X, et al. Effect of nuclear factor-κB inhibitor on expression of inflammatory factors in lipopolysaccharide-stimulated degenerative human nucleus pulposus cells[J]. J Third Mil Med Univ, 2017, 39(8): 755–758. DOI:10.16016/j.1000-5404.201610083 |



