2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:全军眼科中心
2. Department of Ophthalmology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSC)来源于胎儿附属物脐带,易于获取,对捐献者无明显损伤;细胞易于分离、培养,增殖能力强、扩增迅速并且凋亡率较低[1]。这些特点使它在组织工程应用中具有巨大潜能,成了近年来研究的热点。但移植到损伤部位的hUC-MSC在较短时间内迅速减少,限制了干细胞治疗效力,这可能是由于损伤后出血及继发炎症、缺血缺氧形成的病理环境导致了hUC-MSC凋亡[2-4]。如何提升hUC-MSC移植治疗的生物学作用?或许可以通过提高hUC-MSC存活比例和时间来实现。
姜黄素(curcumin,cur)是从姜科植物根茎中提取的二酮类化合物,前期我们发现姜黄素抑制促炎细胞因子的表达,通过抗炎作用减少胶质纤维酸性蛋白的表达,抑制反应性神经胶质增生,促进脊髓损伤后大鼠后肢运动功能的改善[5]。同时研究表明姜黄素可以通过抑制大鼠肾脏炎症和细胞凋亡,改善顺铂诱导的肾脏损伤[6];YU等[7]研究报道姜黄素可以保护高糖诱导的心肌细胞凋亡,表明姜黄素还具有较可靠的抗凋亡作用。姜黄素是否同样可以抑制hUC-MSC凋亡,增加其存活的时间和比例,使其发挥更持久的生物学作用,进而提升hUC-MSC移植治疗效果目前尚不明确。本实验通过TNF-α诱导hUC-MSC凋亡并施以姜黄素干预,进一步探讨姜黄素对hUC-MSC凋亡的作用及可能的机制,为姜黄素结合hUC-MSC移植治疗脊髓损伤等疾病提供初步的实验室依据。
1 材料与方法 1.1 材料hUC-MSC由陆军军医大学(第三军医大学)第一附属医院干细胞技术研发及转化中心提供,为冻存的P2代细胞,规格为:1×107个/支。主要试剂及药品:CCK-8试剂盒购自美国Dojindo公司, LDH释放检测试剂盒购自上海碧云天生物技术有限公司,凋亡检测试剂盒购自美国BioLegend公司,重组TNF-α细胞因子购自美国PEPROTECH公司,姜黄素购自德国Sigma公司,Anti-Human CD34 FITC、Anti-Human CD45 FITC、Anti-Human HLA-DR FITC、Anti-Human CD73 PE、Anti- Human CD90(Thy-1) PE、Anti-Human CD105(Endoglin) PE均购自美国eBioscience公司,兔抗p38、JNK、ERK、p-p38、p-JNK、p-ERK、Bcl-2、Bax均购自美国CST公司,小鼠抗GAPDH、β-actin购自武汉三鹰生物技术有限公司,辣根过氧化物酶标记的山羊抗小鼠二抗、辣根过氧化物酶标记的山羊抗兔二抗均购自北京中杉金桥生物技术有限公司。一抗:使用Western blot一抗稀释液按照1 :1 000稀释;二抗:使用TBST按照15 000稀释。
1.2 方法 1.2.1 hUC-MSC培养及鉴定将P2代冻存hUC- MSC在37 ℃水浴锅内迅速复温,1 000 r/min离心5 min,弃上清,使用含5% AD(UltraGROTM-Advanced)的达科为间充质干细胞基础培养基(mesenchymal stem cell basal medium,MSCBM)重悬细胞,计数后以5 000个/cm2密度接种于细胞培养瓶,移入5% CO2、37℃孵箱培养,次日换液,当细胞达到80%融合时传代。使用流式细胞技术鉴定表面分子CD34、CD45、CD73、CD90、CD105、HLA-DR检验hUC-MSC纯度[8]。
1.2.2 CCK-8检测姜黄素对hUC-MSC增殖的影响将hUC-MSC使用0.125%胰酶消化,按照2 000个/孔接种在96孔板中。将细胞分成对照组,0.062 5、0.125、0.25、0.5、1、2、4、8、16、32 μmol/L的姜黄素干预组(n=5),对照组加入等浓度的DMSO。干预24 h后向各个孔加入10 μL CCK-8溶液,37 ℃孵育2 h后,使用多功能酶标仪在450 nm波长测量光密度值D(450)。
1.2.3 LDH释放实验检测hUC-MSC凋亡将hUC-MSC按照2 000 /孔接种在96孔板中,设正常细胞组, 正常细胞裂解组, 浓度分别为0.625、1.25、2.5、5、10、20 ng/mL的TNF-α干预组(n=5),干预时每个孔加入180μL培养基,24 h后使用LDH释放检测试剂盒进行检测,具体操作过程遵从试剂盒的操作说明书,计算TNF-α诱导细胞的死亡率。根据计算结果选取5 ng/mL为TNF-α诱导浓度。将接种在96孔板的细胞分为正常细胞组、正常细胞裂解组、TNF-α(5 ng/mL)干预组、TNF-α(5 ng/mL)+姜黄素(0.5、2.0、4.0、8.0 μmol/L)干预组(n=5),非姜黄素干预组中加入等浓度的DMSO,同法测量并计算各组细胞死亡率。
1.2.4 流式细胞技术检测hUC-MSC凋亡根据LDH释放实验结果,选择TNF-α为5 ng/mL,姜黄素4 μmol/L为干预浓度进一步行流式细胞凋亡检测。将hUC-MSC接种在直径10 cm的培养皿中,分成control组、TNF-α组、姜黄素组、TNF-α+姜黄素组,非姜黄素干预组中加入等浓度的DMSO。处理24 h后使用不含EDTA的胰酶消化细胞,使用FTTC Annexin V Apoptosis Detection Kit with PI (BioLegend)检测姜黄素对hUC-MSC凋亡的影响,具体操作过程遵从试剂盒的操作说明书。在流式细胞仪上机检测。
1.2.5 Western blot检测MAPK家族信号通路激活情况以及Bcl-2、Bax表达将hUC-MSC接种在直径10 cm的培养皿中,分组及药物干预同上。信号通路检测样本干预时间为30 min,Bcl-2及Bax检测样本干预时间为24 h。干预完成后提取总蛋白,使用BCA法测定蛋白浓度。用12% SDS-PAGE电泳分离,110 V电泳70 min,200 mA转膜120 min,5%脱脂奶粉封闭2 h,4 ℃孵育一抗过夜。TBST清洗3次,室温孵育二抗2 h,TBST清洗3次后显影。
1.3 统计学分析采用SPSS 22.0软件进行数据分析,数据均以x±s表示,多组间比较采用单因素方差分析,LSD比较组间差异。检验水准:α=0.05。
2 结果 2.1 hUC-MSC培养及鉴定hUC-MSC贴壁生长,生长速度较快,3 d可达到80%左右融合,当细胞达到100%融合时呈典型的鱼群样(图 1B)。流式鉴定结果显示间充质干细胞表型CD73、CD90和CD105呈阳性,造血干细胞表型CD34、CD45和HLA-DR呈阴性(图 1A)。鉴定结果显示细胞纯度>95%,满足实验需求。
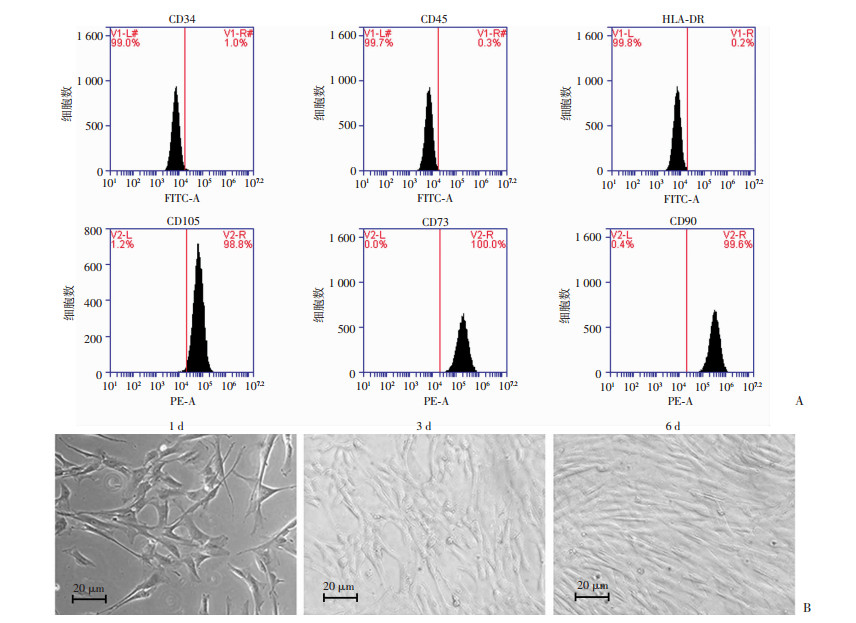
|
| A:流式细胞仪鉴定结果;B:hUC-MSC传代后1、3、6 d时形态变化 图 1 hUC-MSC的培养和鉴定 |
2.2 姜黄素减轻TNF-α诱导的hUC-MSC凋亡
CCK-8检测结果提示当浓度低于8 μmol/L时,姜黄素对hUC-MSC无明显毒性(P > 0.05),当浓度高于16 μmol/L,可明显抑制细胞生长(P < 0.05, 图 2A)。LDH释放实验提示TNF-α浓度低于5 ng/mL时,随着TNF-α浓度升高,细胞死亡率增加,当TNF-α浓度高于5 ng/mL时细胞死亡率无明显增加(图 2B),因此选择5 ng/mL作为TNF-α诱导hUC-MSC凋亡浓度。使用5 ng/mL TNF-α诱导hUC-MSC凋亡,采用不同浓度姜黄素(0.5、2、4、8 μmol/L)进行干预,见浓度低于4 μmol/L时姜黄素可以减轻hUC-MSC凋亡,其抗凋亡效果随剂量增加而增强,姜黄素浓度为4 μmol/L时可显著减轻hUC-MSC凋亡(P < 0.05);当姜黄素浓度为8 μmol/L对TNF-α诱导hUC-MSC凋亡无明显抑制作用(图 2C),这可能是较高浓度姜黄素和TNF-α对hUC-MSC产生毒性累积作用。
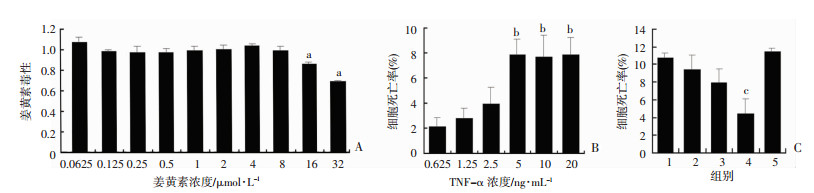
|
| A: CCK-8检测cur对hUC-MSC的增殖影响;B:LDH释放实验检测不同浓度TNF-α对hUC-MSC凋亡的影响;C:检测不同浓cur对TNF-α诱导hUC-MSC凋亡的影响1:TNF-α+DMSO组;2~5:依次为TNF-α+姜黄素(0.5、2、4、8 μmol/L)组;a:P < 0.05,与0.625 ng/mL TNF-α组比较;b:P < 0.05,与5 ng/mL的TNF-α+DMSO组比较 图 2 CCK-8和LDH分别检测不同浓度的cur和TNF-α对hUC-MSC活性的影响及不同浓度的cur对TNF-α诱导hUC-MSC凋亡的作用 |
2.3 姜黄素可以减轻TNF-α诱导的hUC-MSC凋亡
进一步使用5 ng/mL TNF-α诱导hUC-MSC凋亡,并且使用姜黄素4 μmol/L进行干预,流式细胞仪检测细胞凋亡情况。5 ng/mL浓度的TNF-α可以促进hUC-MSC凋亡(P < 0.05),浓度为4 μmol/L的姜黄素对hUC-MSC无明显毒性作用,并且该浓度的姜黄素可以减轻TNF-α诱导的hUC-MSC凋亡(P < 0.05,图 3)。
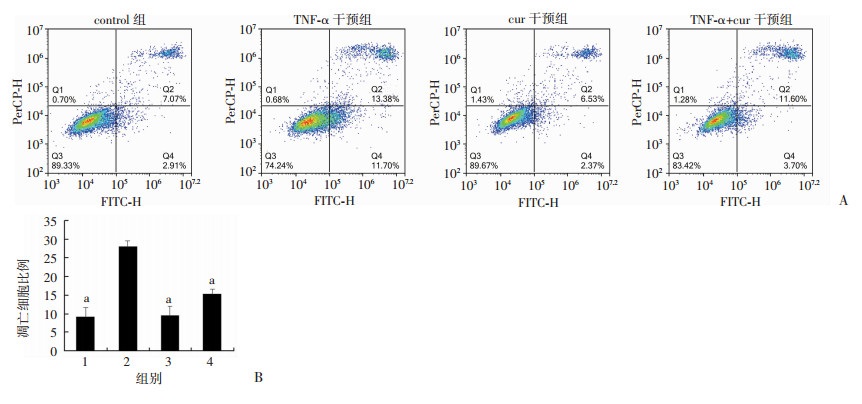
|
| A:流式细胞仪检测细胞凋亡;B细胞凋亡统计分析 1: control组; 2,TNF-α干预组;3: cur干预组; 4: TNF-α+cur干预组; a:P < 0.05, 与TNF-α干预组比较 图 3 流式细胞仪检测姜黄素对TNF-α诱导hUC-MSC凋亡的影响 |
2.4 姜黄素激活ERK,上调Bcl-2/Bax比值,抑制TNF-α诱导的hUC-MSC凋亡
Western blot检测结果提示:TNF-α干预hUC-MSC后JNK、p38、ERK均被激活(P < 0.05)。姜黄素干预后可以显著激活p42/44(P < 0.05),对JNK、p38的活性无明显影响(P > 0.05)。当TNF-α与姜黄素同时存在时,ERK激活明显增强(P < 0.05), JNK、p38与TNF-α单独干预差异无统计学意义(P > 0.05)。同时可以检测到姜黄素干预后Bcl-2表达增加(P < 0.05),Bax表达无明显改变,Bcl-2/Bax的表达升高(P < 0.05,图 4)。
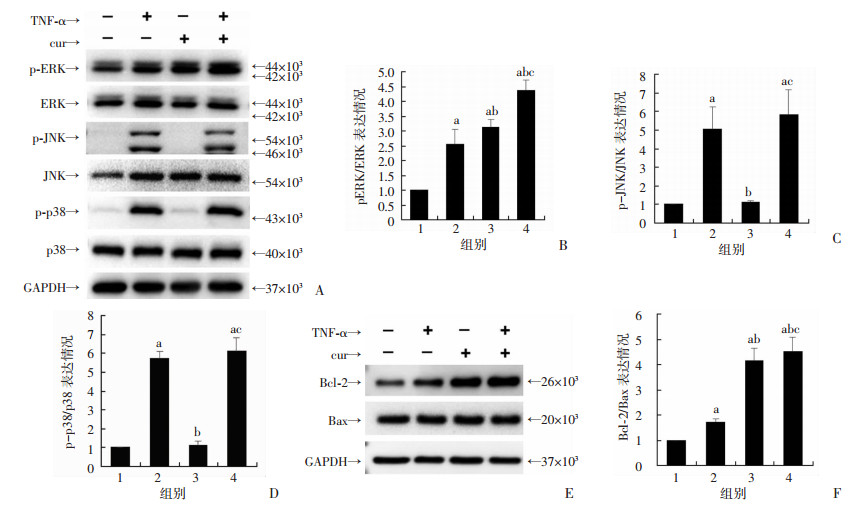
|
| A:Western blot检测MAPK家族(ERK、JNK、p38)激活情况;B、C、D:分别为p-ERK/ERK、p-JNK/JNK、p-p38/p38的半定量分析;E:Western blot检测Bcl-2和Bax的表达;F:Bcl-2/Bax蛋白表达半定量分析;1: control组;2:TNF-α干预组;3:cur干预组;4:TNF-α+cur干预组;a:P < 0.05,与control组比较;b; P < 0.05, 与TNF-α干预组比较;c:P < 0.05, 与cur干预组比较 图 4 Western blot检测MAPK家族激活情况以及Bcl-2和Bax表达 |
3 讨论
近年来干细胞治疗成为脊髓损伤、脑卒中、骨关节疾病、视网膜病变、烧伤、糖尿病等领域研究的热点[9-14],hUC-MSC本身具备的优点使其具有更广阔的应用前景[1]。前期研究表明hUC-MSC在脊髓损伤、脑卒中、肿瘤、神经退行性疾病、移植物抗宿主病、肝脏疾病、烧伤的研究中都显示了一定的效果,但同时也发现干细胞在体内较难长时间存活[2-3, 15]。特别是Hu使用超顺磁性氧化铁(SPIO)纳米粒子标记hUC-MSC移植到脊髓损伤部位,行MRI检查显示hUC-MSC信号强度在术后1~3周大幅降低[4]。这可能是脊髓损伤后出血及继发炎症、缺血缺氧形成的病理环境导致了hUC-MSC凋亡,严重削弱移植部位hUC-MSC的生物学作用。抑制hUC-MSC凋亡可以增加其存活的时间和比例,进而发挥更持久的生物学作用,提升hUC-MSC移植治疗效果。
姜黄素是姜科植物姜黄的活性成分,其抗炎、抗氧化作用已经得到了广泛验证。前期我们发现姜黄素抑制脊髓损伤后促炎细胞因子如TNF-α,IL-1β和NF-κβ的表达,通过抗炎减少胶质纤维酸性蛋白的表达和反应性神经胶质增生;同时姜黄素抑制TGF-β1,TGF-β2和SOX-9的产生,通过抑制转化生长因子和转录因子,减少硫酸软骨素蛋白多糖的沉积,显著减少胶质瘢痕体积,改善轴突生长,促进脊髓损伤后大鼠后肢功能的改善[5, 16]。此外姜黄素还具有肝保护、调节免疫作用[17-18]。本研究证实姜黄素可以有效抑制TNF-α诱导的hUC-MSC凋亡,近期关于姜黄素对肾脏细胞和心肌细胞凋亡影响的研究结果也支持姜黄素具有可靠的抗凋亡作用[6, 19-20]。
本研究发现TNF-α处理后hUC-MSC凋亡增加,而同时ERK、JNK、p38磷酸化水平也增加,此时说明p-ERK、p-JNK、p-p38参与了细胞凋亡,这些通路的作用可能是促进凋亡,也有可能是凋亡后的负反馈调节抑制凋亡。单独给予姜黄素干预hUC-MSC,发现姜黄素能激活ERK,并且使Bcl-2/Bax增加。在TNF-α和姜黄素联合组中,姜黄素降低了TNF-α诱导的凋亡,同时在TNF-α促进ERK磷酸化的基础上进一步增加ERK的磷酸化水平,也使Bcl-2/Bax进一步增加;姜黄素对TNF-α干预后hUC-MSC的JNK、p38磷酸化水平无明显影响。本实验证实姜黄素能抑制干细胞凋亡,结合相关文献[21-22],我们推测其抗凋亡的作用机制可能是通过激活ERK、促进Bcl-2表达实现的。这和新型姜黄素类似物通过抑制JNK磷酸化进而抑制心肌细胞凋亡不同[20],可能是新型姜黄素类似物才具有抑制JNK激活的特性,也可能是因为不同种类细胞对药物的不同反应敏感性所导致。此外,还有研究表明ERK活化后可促进Bad磷酸化形成二聚体,使Bad与Bcl-x(L)解离,发挥抑制凋亡的作用[23]。这为结合使用姜黄素促进hUC-MSC在移植部位的存活、提高干细胞治疗效果提供了初步的理论依据。但姜黄素抑制hUC-MSC凋亡是否还通过其他信号通路发挥作用,以及在hUC-MSC移植的动物实验中能否同样发挥抗凋亡作用仍需要进一步研究。
| [1] | CAN A, KARAHUSEYINOGLU S. Concise review: human umbilical cord stroma with regard to the source of fetus-derived stem cells[J]. Stem Cells, 2007, 25(11): 2886–2895. DOI:10.1634/stemcells.2007-0417 |
| [2] | LI T, XIA M, GAO Y, et al. Human umbilical cord mesenchymal stem cells: an overview of their potential in cell-based therapy[J]. Expert Opin Biol Ther, 2015, 15(9): 1293–1306. DOI:10.1517/14712598.2015.1051528 |
| [3] | TROUNSON A, MCDONALD C. Stem cell therapies in clinical trials: progress and challenges[J]. Cell Stem Cell, 2015, 17(1): 11–22. DOI:10.1016/j.stem.2015.06.007 |
| [4] | HU S L, LUO H S, LI J T, et al. Functional recovery in acute traumatic spinal cord injury after transplantation of human umbilical cord mesenchymal stem cells[J]. Crit Care Med, 2010, 38(11): 2181–2189. DOI:10.1097/CCM.0b013e3181f17c0e |
| [5] | YUAN J, ZOU M, XIANG X, et al. Curcumin improves neural function after spinal cord injury by the joint inhibition of the intracellular and extracellular components of glial scar[J]. J Surg Res, 2015, 195(1): 235–245. DOI:10.1016/j.jss.2014.12.055 |
| [6] | SOETIKNO V, SARI S D P, UL MAKNUN L, et al. Pre-treatment with curcumin ameliorates cisplatin-induced kidney damage by suppressing kidney inflammation and apoptosis in rats[J]. Drug Res (Stuttg), . DOI:10.1055/a-0641-5148 |
| [7] | YU W, ZHA W L, KE Z Q, et al. Curcumin protects neonatal rat cardiomyocytes against high glucose-induced apoptosis via PI3K/Akt signalling pathway[J]. J Diabetes Res, 2016, 2016: 1–11. DOI:10.1155/2016/4158591 |
| [8] | ZHANG H, TAO Y L, LIU H H, et al. Immunomodulatory function of whole human umbilical cord derived mesenchymal stem cells[J]. Mol Immunol, 2017, 87: 293–299. DOI:10.1016/j.molimm.2017.03.003 |
| [9] | ASSINCK P, DUNCAN G J, HILTON B J, et al. Cell transplantation therapy for spinal cord injury[J]. Nat Neurosci, 2017, 20(5): 637–647. DOI:10.1038/nn.4541 |
| [10] |
刘婕, 张国华. 脐血干细胞治疗脑卒中的作用与机制[J].
中国组织工程研究, 2017, 21(9): 1470–1476.
LIU J, ZHANG G H. Effect and mechanism of umbilical cord blood stem cells in the treatment of stroke[J]. Chin J Tissue Eng Res, 2017, 21(9): 1470–1476. DOI:10.3969/j.issn.2095-4344.2017.09.028 |
| [11] | ONG E, CHIMUTENGWENDE-GORDON M, KHAN W. Stem cell therapy for knee ligament, articular cartilage and meniscal injuries[J]. Curr Stem Cell Res Ther, 2013, 8(6): 422–428. DOI:10.2174/1574888x1130800059 |
| [12] |
陈莉, 陈松. 间充质干细胞治疗早期糖尿病视网膜病变研究进展[J].
中华实验眼科杂志, 2016, 34(7): 667–671.
CHEN L, CHEN S. Research progress of mesenchymal stem cells for the treatment of diabetic retinopathy[J]. Chin J Exp Ophthalmol, 2016, 34(7): 667–671. DOI:10.3760/cma.j.issn.2095-0160.2016.07.020 |
| [13] | OZTURK S, KARAGOZ H. Experimental stem cell therapies on burn wound: do source, dose, timing and method matter?[J]. Burns, 2015, 41(6): 1133–1139. DOI:10.1016/j.burns.2015.01.005 |
| [14] |
施静, 姚豫桐, 冯天航. 胰岛细胞与骨髓间充质干细胞联合移植治疗糖尿病的进展[J].
中国普外基础与临床杂志, 2018, 25(05): 635–638.
SHI J, YAO Y T, FENG T H. The progress of islet cells co-transplantation with bone marrow mesenchymal stem cells in the treatment of diabetes[J]. Chin J Basic Clin Gen Surg, 2018, 25(05): 635–638. DOI:10.7507/1007-9424.2O1711040 |
| [15] | LI X, LIU L, YANG J, et al. Exosome derived from human umbilical cord mesenchymal stem cell mediates MiR-181c attenuating burn-induced excessive inflammation[J]. EBioMedicine, 2016, 8: 72–82. DOI:10.1016/j.ebiom.2016.04.030 |
| [16] |
邹明明, 薛兴森, 朱海涛, 等. 姜黄素促进大鼠脊髓损伤恢复的病理及行为学研究[J].
第三军医大学学报, 2011, 30(8): 765–770.
ZOU M M, XUE X X, ZHU H T, et al. Effect of curcumin on recovery promotion after spinal cord injury in rats:a pathological and behavioral study[J]. J Third Mil Med Univ, 2011, 30(8): 765–770. |
| [17] | FARZAEI M, ZOBEIRI M, PARVIZI F, et al. Curcumin in liver diseases: a systematic review of the cellular mechanisms of oxidative stress and clinical perspective[J]. Nutrients, 2018, 10(7): 855. DOI:10.3390/nu10070855 |
| [18] | JEONG Y I, KIM S W, JUNG I D, et al. Curcumin suppresses the induction of indoleamine 2, 3-dioxygenase by blocking the janus-activated kinase-protein kinase Cδ-STAT1 signaling pathway in interferon-γ-stimulated murine dendritic cells[J]. J Biol Chem, 2008, 284(6): 3700–3708. DOI:10.1074/jbc.m807328200 |
| [19] | YU W, ZHA W L, KE Z Q, et al. Curcumin protects neonatal rat cardiomyocytes against high Glucose-Induced apoptosis via PI3K/Akt signalling pathway[J]. J Diabetes Res, 2016, 2016: 1–11. DOI:10.1155/2016/4158591 |
| [20] | PAN Y, WANG Y, ZHAO Y J, et al. Inhibition of JNK phosphorylation by a novel curcumin analog prevents high glucose-induced inflammation and apoptosis in cardiomyocytes and the development of diabetic cardiomyopathy[J]. Diabetes, 2014, 63(10): 3497–3511. DOI:10.2337/db13-1577 |
| [21] |
王倩, 邹健, 张秀芬, 等. GCS通过MEK/ERK通路调控白血病多药耐药细胞凋亡相关基因bcl-2的表达[J].
中国病理生理杂志, 2015, 31(1): 114–118.
WANG Q, ZOU J, ZHANG X F, et al. Glucosylceramide synthase upregulates apoptosis-related gene bcl-2 ex-pression via MEK/ERK signaling pathway in leukemia multidrug-resistant cell line[J]. Chin J Pathophysiol, 2015, 31(1): 114–118. DOI:10.3969/j.issn.1000.4718.2015.01.022 |
| [22] | CAI C, TENG L, VU D, et al. The heme oxygenase 1 inducer (CoPP) protects human cardiac stem cells against apoptosis through activation of the extracellular signal-regulated kinase (ERK)/NRF2 signaling pathway and cytokine release[J]. J Biol Chem, 2012, 287(40): 33720–33732. DOI:10.1074/jbc.M112.385542 |
| [23] | SCHEID M P, SCHUBERT K M, DURONIO V. Regulation of bad phosphorylation and association with Bcl-x(L) by the MAPK/Erk kinase[J]. J Biol Chem, 1999, 274(43): 31108–31113. DOI:10.1074/jbc.274.43.31108 |



