2. 402460 重庆, 重庆市荣昌区人民医院泌尿外科
2. Department of Urology, Rongchang District People's Hospital, Chongqing, 402460, China
前列腺癌(prostate cancer,PCa)是西方国家男性中发病率第二的肿瘤[1],我国的发病率和病死率逐年上升[2]。PCa是一种具有明显突变异质性的肿瘤类型,其中雄激素剥夺治疗(androgen deprivation therapy, ADT)是最主要的治疗手段[3]。虽其初治有效,但大多数患者在2~3年内不可避免的发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[4-5],其中位生存期小于20个月。目前对CRPC缺乏有效的治疗手段,因而选择新的基因靶点和治疗方案显得尤为迫切。
抑癌基因NPRL2(nitrogen permease regulator like-2)位于染色体3p21.3,最早在2000年由LERMAN等[6]研究肺癌和乳腺癌时采用基因测序等方法所发现。NPRL2参与DNA错配修复,并影响细胞周期及凋亡通路[7],但NPRL2在CRPC中的表达和作用尚不明确。
奥拉帕尼(Olaparib)属于聚腺苷二磷酸核糖聚合酶抑制剂(PARP inhibitor,PARPi)。目前认为聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase, PARP)本身参与调控多种DNA修复过程,PARPi抑制了该酶活性,使得DNA修复障碍,引起肿瘤细胞损伤和凋亡[8]。2015年一项Ⅱ期临床试验显示部分Olaparib对去势抵抗型前列腺癌患者有明显的治疗反应,但其有效性与患者瘤内PARP多少似乎无直接联系[9],且并不延长所有CRPC患者生存期。
最近的一项由美国Cedars-Sinai医学中心牵头的多医学中心研究显示,DNA损伤修复通路在CRPC的非雄激素受体相关治疗中占重要地位[9]。而NPRL2与DNA修复相关基因如BRCA、ATM及γ-H2AX密切联系[10-12]。提示CRPC中NPRL2的表达很可能调节DNA修复从而影响CRPC细胞生长、凋亡和侵袭转移。本研究拟在CRPC临床标本中验证NPRL2的表达,进而通过慢病毒转染在体外细胞实验中探讨NPRL2调节CRPC对Olaparib的敏感性,以期为CRPC治疗提供新的策略并发现新的分子靶点。
1 材料与方法 1.1 材料 1.1.1 细胞人前列腺癌LNCaP细胞、人正常前列腺上皮细胞RWPE-1购自中科院上海细胞库。为模拟人去势抵抗型前列腺癌,LNCaP细胞采用恩杂鲁胺(10 μmol/L)培养6个月以上,获得耐恩杂鲁胺的人去势抵抗性前列腺癌的LNPER细胞(LNCaP Enzalutamide-resistant)。
1.1.2 引物引物设计和合成均由TaKaRa公司完成。NPRL2上游引物:5′-AGAACCTCATCAGGCGA-CTACAG-3′,下游引物:5′-CATTTTCAAGCCGCTCAT-CC-3′,产物长度156 bp。GAPDH上游引物:5′-CTTTGGTATCGTGGAAGGACTC-3′,下游引物:5′-GTAGAGGCAGGGATGATGTTCT-3′,产物长度132 bp。
1.1.3 主要试剂Enzalutimade和Olaparib购自selleck公司;嘌呤霉素(puromycin, PM)购自MP公司;过表达/沉默NPRL2慢病毒和聚凝胺(polybrene)购自吉玛公司;兔SP试剂盒购自中杉金桥公司;CCK-8试剂盒购自Donjindo公司;RPMI 1640购自HyClone公司;胎牛血清购自PAN公司;SYBRGreeb qPCR试剂盒、逆转录试剂盒购自TaKaRa公司;蛋白预染Marker购自Thermo公司;兔抗NPRL2和ATM多克隆抗体购自Proteintech公司;RIPA裂解液、4×蛋白上样缓冲液、BCA蛋白定量试剂盒、SDS-PAGE凝胶电泳试剂盒购自碧云天生物技术公司;山羊抗兔二抗和GAPDH抗体购自博士德生物公司。
1.2 方法 1.2.1 临床标本收集2013-2017年在重庆医科大学附属第一医院泌尿外科行前列腺电切或前列腺根治术的患者。其中良性前列腺增生组织(benign prostatic hyperplasia,BPH)55例,前列腺癌(prostate cancer,PCa)42例,去势抵抗性前列腺癌(CRPC)14例。患者手术标本用4%多聚甲醛作石蜡包埋,用于免疫组化染色。手术流程符合2005年AUA手术流程指南,组织标本、病理蜡块收集获重庆医科大学附属第一医院伦理委员会批准。
1.2.2 免疫组化染色分析采用过氧化酶标记的链霉卵白素(steptavidin peroxidase,SP)法,DAB显色,在光镜下观察。切片交由2名病理科医师行NPRL2染色半定量评分,最终取其平均数。评分标准如下:①视野阳性胞数所占该区域百分数记为0、1、2、3、4分,分别对应0%、1%~25%、26%~50%、51%~75%、76%~100%。②染色强度也记为0、1、2、3分,分别对应细胞没有被染色、弱染色、中等染色以及强染色。③免疫组化染评分(H-score)为阳性细胞百分数的评分乘以染色强度的评分。H-score得分范围:0分表示阴性(-),1~3分表示弱阳性(+),4~6分表示中等阳性(++),8~12分表示强阳性(+++)。因前列腺癌的异质性,为尽可能均衡评估,每张切片随机选取10个肿瘤视野,取其平均得分数。若平均数不足,由病理医师协商后再评分。
1.2.3 Western blot检测NPRL2在细胞中的表达收集RWPE-1、LNCaP和LNPER细胞,进行总蛋白提取。BCA法测蛋白浓度、定量,SDS-PAGE电泳,电转,封闭,一抗过夜,二抗孵育1 h,ECL显色。
1.2.4 慢病毒转染及稳定株筛选实验分为空白对照组(LNPER)、过表达组(LV)、阴性病毒对照组(NV)、空载病毒组(EV)和干扰病毒组(sh-1、2、3),通过预实验分别得到最适MOI值和最小嘌呤霉素筛选浓度,当细胞融合度达到70%时,更换为含有相应浓度的慢病毒和5 μg/mL polybrene终浓度的培养基,72 h后加入终浓度为2 μg/mL的嘌呤霉素,继续培养4 d以上,转染成功的细胞在荧光显微镜下呈现绿色荧光,在光学和荧光显微镜下观察,各组转染成功,后继续克隆成为稳定细胞株。荧光显微镜下观察各组转染率,转染成功的细胞继续培养1周后得到稳定株,传代或冻存后作为后续实验细胞。
1.2.5 Western blot及qPCR验证NPRL2干扰效率收集各组细胞进行总蛋白提取,BCA法测蛋白浓度、定量,样品蛋白SDS-PAGE电泳分离,电转至PVDF膜上,专用快速封闭液封闭,一抗过夜,二抗孵育1 h,ECL显色。TRIzol法分别提取各组细胞中总RNA,GAPDH基因为内参。待RNA基本透明时,加入20 μL DEPC水,至完全溶解,紫外分光光度计分析测定所抽提RNA的浓度,逆转录后测试DNA浓度,测量方法同前。qPCR程序为:预变性95 ℃,15 s;之后每一步变性95 ℃,5 s;退火延伸60 ℃,30 s;共进行45个循环。每个样本设3个复孔,取光密度值均数作为结果。采用2-△△Ct法计算NPRL2 mRNA的变化。
1.2.6 CCK-8法检测细胞增殖和药物毒性收集对数生长期的各组LNPER细胞,96孔板中每孔加入含500个细胞的培养基100 μL,每组设置3个复孔,培养24、48、72、96 h后,每孔加入10 μL CCK-8试剂,孵育2 h后检测450 nm波长处的光密度值[D(450)],Y轴为D(450)值,X轴为培养时间,绘制细胞增殖曲线。为检测Olaparib对细胞的毒性,同上方法铺板,每组细胞设置4个Olaparib梯度浓度(0、20、40、80、160 μmol/L),对照组加入相应实验组等体积溶解Olaparib的DMSO,培养48 h后,加入10 μL CCK-8孵育2 h,检测各组酶标仪450 nm波长处的光密度值[D(450)]。按照下列公式计算细胞存活百分数:细胞活力=[加药D(450)-空白D(450)]/[0加药D(450)-空白D(450)]×100%。其中加药为具有细胞、CCK-8溶液、Olaparib或DMSO孔的光密度;空白为具有培养基和CCK-8溶液而没有细胞的孔的光密度;0加药为具有细胞、CCK-8溶液而不含Olaparib等毒性物质的孔的光密度;实验重复3次。绘制细胞毒性曲线,Y轴为细胞活力百分数,X轴为药物梯度浓度。
1.2.7 Western blot检测各组ATM蛋白表达EV组为空载细胞,sh组为沉默NPRL2细胞,NV组为阴性对照病毒细胞,LV组为过表达NPRL2细胞,药物处理组用20 μmol/L的Olaparib处理细胞48 h。实验步骤同1.2.5,检测各组ATM蛋白表达情况。
1.2.8 流式细胞术检测细胞凋亡EV组为空载细胞,sh组为沉默NPRL2细胞,EV+Olaparib组和sh+Olaparib分别为空载细胞和沉默NPRL2细胞用20 μmol/L的Olaparib处理48 h。将各组细胞胰酶消化后离心,小心去除浸泡细胞的培养基,加入适量PBS重悬,轻轻吹散细胞。上机前依照AnnexinV-PE/7-ADD凋亡试剂盒说明书对样本进行处理后,用CytoFIEX流式细胞仪检测。凋亡数据由CytExpert software生成。
1.2.9 Transwell测定侵袭和迁移实验分组同流式细胞术,侵袭实验:将Matrigel(BD Biosciences)置于Transwell上室并在37 ℃下聚合。然后,将无血清培养基中的CRPC细胞接种在上室(2×105/孔)中,并将10%含血清的培养基置于下室中。用Olaparib处理48 h后,从上室中除去培养基。用棉签除去非侵入细胞;入侵细胞用4%多聚甲醛固定,用0.1%结晶紫染色,用显微镜在3个不加选择的视野中拍照和定量。使用Image J软件计数侵入细胞的数量。迁移实验:使用不含Matrigel的Transwell小室,其他步骤同侵袭实验。
1.3 统计学分析采用SPSS 22.0统计软件,两组之间采用Student’s t检验,多组间比较采用单因素方差分析,细胞增殖-毒性曲线采用多次重复测量的方差分析,P < 0.05表示有统计学意义。
2 结果 2.1 NPRL2在良性BPH、PCa和CRPC中的表达免疫组化结果显示BPH、PCa和CRPC中NPRL2表达阳性率存在明显差异(P < 0.001),且CRPC中的阳性率最高(图 1、表 1)。
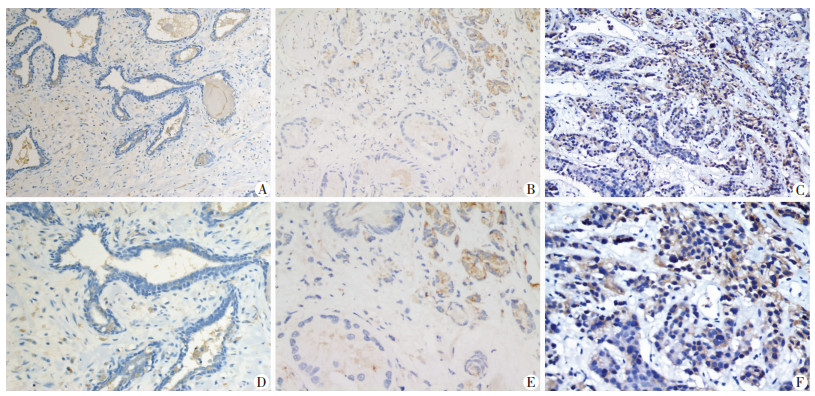
|
| A、D:BPH组织; B、E:PCa组织; C、F:CRPC组织; A~C:放大倍数200倍; D~F:放大倍数400倍 图 1 免疫组化观察NPRL2在BPH、PCa组织和CRPC组织中的表达(S-P) |
| 临床标本 | n | NPRL2表达 | 阳性率(%) | P值 | |||
| - | + | ++ | +++ | ||||
| BPH组织 | 55 | 43 | 7 | 3 | 2 | 21.8 | |
| PCa组织 | 42 | 18 | 8 | 7 | 9 | 57.1 | <0.001 |
| CRPC组织 | 14 | 2 | 1 | 5 | 6 | 85.7 | |
2.2 NPRL2在CRPC细胞中高表达
LNPER细胞系和LNCaP细胞系中的NPRL2表达分别为(0.350±0.150)、(0.270±0.125),均显著高于人正常前列腺上皮细胞系RWPE-1[(0.171±0.110),P < 0.01,]图 2],且LNPER细胞NPRL2蛋白表达水平较LNCaP组高(P < 0.01,图 2)。
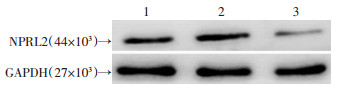
|
| 1:LNCaP; 2:LNPER; 3:RWPE-1 图 2 NPRL2蛋白在LNCaP、LNPER、RWPE-1细胞中的表达 |
2.3 Western blot及qPCR检测沉默和过表达效率
Western blot结果表明3个沉默组中sh-1组的NPRL2蛋白表达量最低(P < 0.01,图 3A、C);过表达组NPRL2蛋白相对表达量较BV组明显增加(P < 0.01,图 3B、D)。qPCR验证各组细胞中NPRL2 mRNA相对表达量结果与Western blot结果一致(P < 0.01, 图 3E、F)。表明sh-1组慢病毒干扰载体的抑制效率最高,故后续实验采取sh-1组作为沉默组,而慢病毒过表达载体的转染能使细胞中的NPRL2表达明显增强。
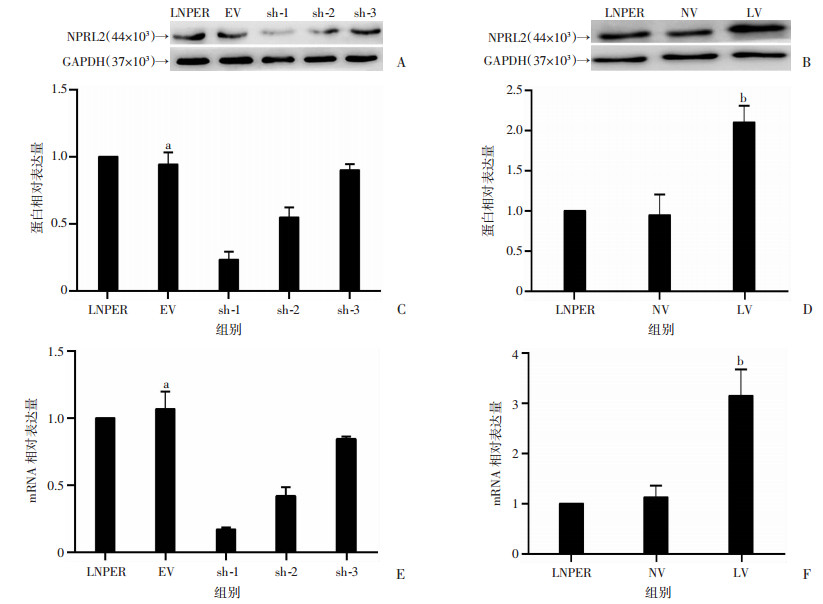
|
| A、C:沉默NPRL2后细胞的蛋白印迹检测;B、D:过表达NPRL2后细胞的蛋白印迹检测;E、F:转录水平验证;a:P < 0.01,与sh-1组比较;b:P < 0.01,与NV组比较 图 3 慢病毒沉默和过表达NPRL2后各组细胞NPRL2蛋白和mRNA的表达 |
2.4 沉默和过表达NPRL2对CRPC细胞增殖的影响
过表达组(LV)较阴性对照组(NV)生长明显增高(P < 0.01), 而沉默组(sh)较空载病毒组(EV)增殖能力明显减弱(P < 0.01,图 4)。结果表明NPRL2可以促进细胞生长且因LNPER细胞中NPRL2表达较为丰富,故着重观察沉默NPRL2后效应。
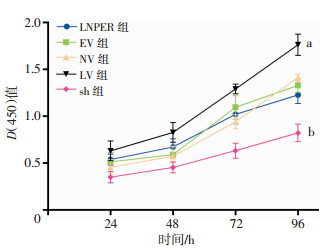
|
| a:P < 0.01,与NV组比较;b:P < 0.01,与EV组比较 图 4 过表达和沉默NPRL2对CRPC细胞生长、增殖的影响 |
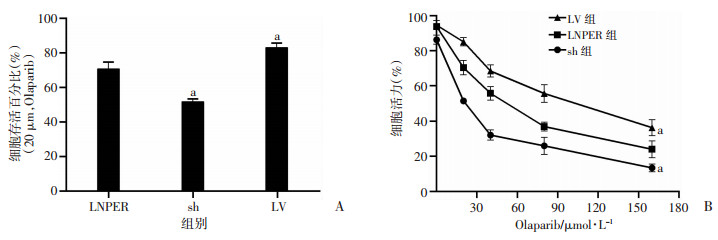
2.5 沉默NPRL2的表达增加CRPC细胞对Olaparib的敏感性
CCK-8法检测结果显示,20 μmol/L的Olaparib处理48 h后,沉默组(sh)细胞存活率较空白对照组显著降低(P < 0.01),而过表达组(LV)细胞存活率反而升高(P < 0.05,图 5A)。不同浓度Olaparib处理各组CRPC细胞后,沉默组细胞存活率降低得最为显著(P < < 0.01,图 5B),反之过表达组加入Olaparib后细胞存活率较空白对照组升高(P < 0.05,图 5B)。
|
| A:20 μmol/L Olaparib处理48 h后各组细胞存活百分比;B:不同浓度Olaparib处理48 h后各组细胞存活情况;a:P < 0.01, 与空白对照组(LNPER)比较 图 5 CRPC细胞中NPRL2的表达与Olaparib敏感性的关系 |
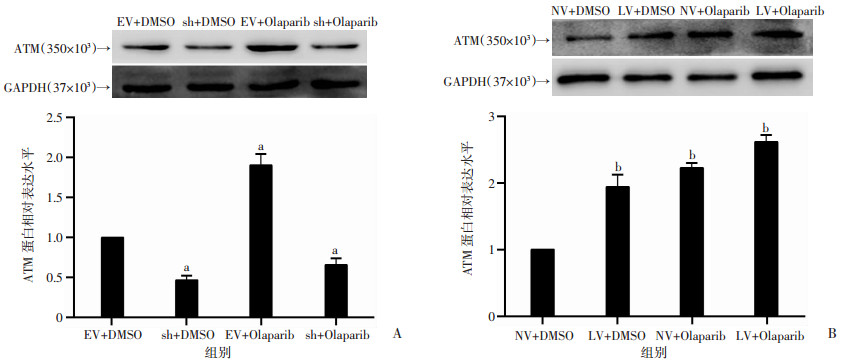
2.6 NPRL2联合Olaparib影响ATM蛋白表达水平
Western blot检测结果显示,sh组ATM蛋白表达较EV组低,LV组ATM蛋白表达较NV组高,Olaparib作用于EV组和NV组细胞均可增加ATM表达,LV+Olaparib组较NV组、LV组和NV+Olaparib组ATM表达最高。提示NPRL2与ATM基因表达呈正相关(P < 0.01, 图 6),单药Olaparib处理CRPC细胞能增加ATM表达,NPRL2过表达联合Olapraib增加ATM蛋白表达(P < 0.01)。
|
| A:Western blot检测沉默NPRL2联合Olaparib后ATM蛋白表达及半定量分析a:P < 0.01,与EV+DMSO组比较;B:Western blot检测过表达NPRL2联合Olaparib后ATM蛋白表达及半定量分析b:P < 0.01,与NV+DMSO组比较 图 6 沉默或过表达NPRL2联合Olaparib处理对细胞ATM蛋白表达的影响 |
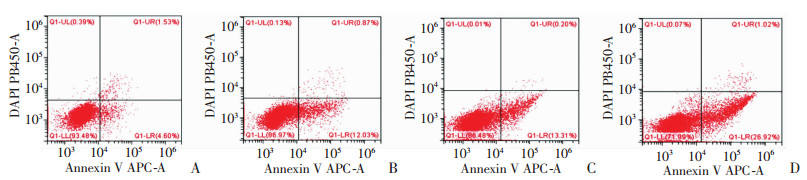
2.7 沉默NPRL2联合Olaparib促进CRPC细胞凋亡
流式细胞仪行细胞凋亡检测,sh+Olaparib组细胞凋亡率为(25.080±2.643)%,较EV组(6.050±0.753)%、sh组(10.620±1.997)%和EV+Olaparib组(15.130±1.454)%显著升高(P < 0.001),沉默NPRL2和Olaparib的联合处理比单独使用任何一种处理都显著增加细胞凋亡率(图 7)。
|
| A:EV+DMSO组; B:sh+DMSO组; C:EV+Olaparib组; D:sh+Olaparib组 图 7 流式细胞仪检测各组细胞凋亡率 |
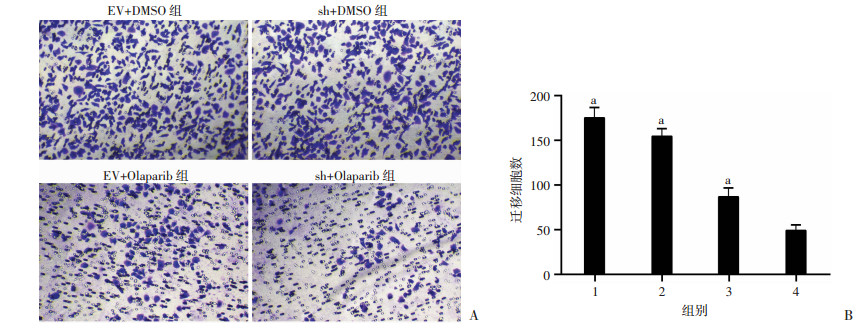
2.8 沉默NPRL2联合Olaparib更显著的抑制CRPC细胞的迁移和侵袭
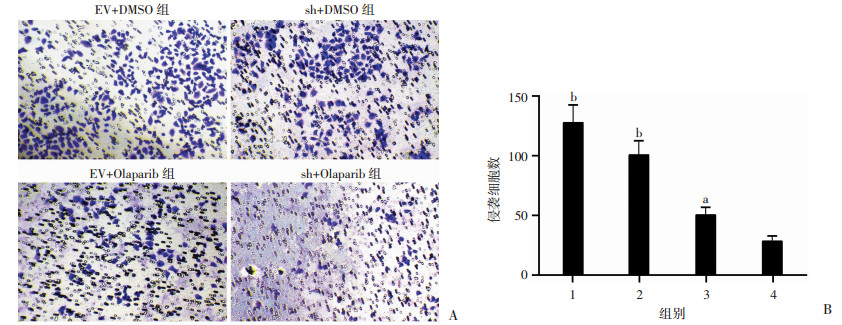
Transwell实验结果显示,Olaparib和沉默NPRL2的联合处理后CRPC细胞的迁移和通过基质胶的数量最少(P < 0.05,图 8、9),Olaparib联合沉默NPRL2显著抑制CRPC细胞侵袭和转移能力。
|
| A:Transwell实验检测各组细胞的迁移(结晶紫×200);B:各组细胞迁移的数量1:EV+DMSO组; 2:sh+DMSO组; 3:EV+Olaparib组; 4:sh+Olaparib组;a:P < 0.01, 与sh+Olaparib组比较 图 8 沉默NPRL2增强Olaparib诱导对细胞迁移的抑制作用 |
|
| A:Transwell实验检测各组细胞的侵袭(结晶紫×200);B:各组细胞通过基质胶的数量1:EV+DMSO组; 2:sh+DMSO组; 3:EV+Olaparib组; 4:sh+Olaparib组;a:P < 0.05, b:P < 0.01, 与sh+Olaparib组比较 图 9 沉默NPRL2增强Olaparib诱导对细胞侵袭的抑制作用 |
3 讨论
近年来NPRL2在肿瘤发生、发展中的作用开始受到关注。目前研究认为NPRL2作为一种抑癌候选基因,其mRNA在骨骼肌、心脏、胰腺、肾脏、大脑、胎盘、肝脏和肺脏等正常组织中呈现一个高表达状态[6],在多种肿瘤中,如结肠癌[13]、神经胶质瘤[14]、肺癌[10]、乳腺癌[12]等,呈低表达状态。本课题组也发现NRPL2在肾癌中呈现低表达[15],在肿瘤细胞中发挥着抑癌作用。一些研究和基因大数据网站(https://www.proteinatlas.org/)显示,NPRL2蛋白在HeLa、HT29和Jurkat等细胞系中呈现高表达[16]。本研究显示,在前列腺癌特别是CRPC中,NPRL2表达明显高于前列腺正常组织,并且本课题组发现NPRL2与CRPC患者分期分级呈正相关,且与患者预后呈负相关[17]。说明NPRL2异常高表达可能在前列腺癌中发挥着重要的生理作用,不同于以往研究中NPRL2作为抑制基因的观念。这引起了我们的高度兴趣,为了探究NPRL2在CRPC中发挥的生物学功能,我们设计过表达/沉默NPRL2慢病毒,经过转染成功构建稳定沉默/过表达NPRL2细胞株。本研究结果显示,沉默NPRL2显著降低了CRPC细胞的增殖能力,反之过表达NPRL2促进了癌细胞的生长。不仅如此,沉默NPRL2也显著增加了CRPC细胞的凋亡,并在CRPC细胞侵袭和转移中NPRL2基因也起到了促进作用。这些研究结果说明NPRL2在CRPC中并不是一个典型的抑癌基因,很可能扮演促癌的角色,具体机制尚待进一步研究。
研究发现NPRL2可能参与DNA损伤修复:在非小细胞肺癌中NPRL2能改变DNA修复基因如毛细血管扩张共济失调突变激酶(ATM激酶)的磷酸化水平增敏顺铂对肺癌细胞的抑制作用[10];同时NPRL2能通过调控DNA损伤相关蛋白如γ-H2AX增强结肠癌细胞对伊立替康的敏感性[11];并且NPRL2增加E3连接酶Herc2泛素化降解的BRCA1蛋白水平,阻止乳腺癌的发生、发展[12]。去势抵抗型前列腺癌基因组分析发现BRCA1/2、ATM等与DNA修复有关基因的突变显著[1, 9]。不难看出NPRL2基因与DNA修复密切相关基因如ATM等存在直接关联。我们大胆猜测NPRL2很可能参与去势抵抗型前列腺癌DNA修复进而影响细胞生长与凋亡。Olaparib是PARP抑制剂,通过阻止DNA修复引起细胞凋亡。在一项临床试验中,Olaparib能够减缓部分CRPC患者的肿瘤进展[18]。然而NPRL2是否能够增强CRPC对Olaparib的敏感性尚不可知。
因此,为进一步探寻NPRL2调控Olaparib对CRPC的细胞毒性,本课题组绘制细胞毒性曲线,观察沉默/过表达NPRL2对Olaparib处理后的CRPC细胞生长的影响。结果发现沉默组加入Olaparib后细胞存活率降低的最为显著(P < 0.01),反之过表达组加入Olaparib后细胞存活率较空白对照组增高(P < 0.05)。抑制肿瘤细胞的生长是抗肿瘤治疗的重要环节,而诱导肿瘤细胞凋亡更为关键。本实验采用流式细胞术检测细胞凋亡,发现沉默NPRL2和Olaparib的联合处理比单独使用任何一种处理都显著增加细胞凋亡率(P < 0.05)。另一方面,Transwell实验发现Olaparib和沉默NPRL2的联合处理后CRPC细胞的侵袭/转移能力显著下降(P < 0.05)。因此,沉默NPRL2可增加Olaparib对CRPC细胞的敏感性,但具体机制尚不清楚。我们猜测可能与DNA修复有关。DNA修复反应在肿瘤细胞中起到关键作用,它的激活帮助癌细胞抵御相关治疗[19]。ATM介导DNA损伤反应(DDR),ATM的激活可以促进肿瘤细胞存活,相反抑制ATM能促进肿瘤细胞的死亡[20]。Olaparib作为一种PARP抑制剂,能够增强ATM缺陷肿瘤细胞中预先存在的DNA修复缺陷,导致未修复的DNA双链断裂(DSB)的积累和细胞凋亡,同时NPRL2能增加癌细胞中ATM的磷酸化水平[10, 21]。因此,本研究采用免疫蛋白印迹实验检测NPRL2沉默或过表达联合Olaparib处理CRPC细胞后的ATM基因的表达情况,结果显示ATM表达与NPRL2呈正相关,NPRL2过表达联合Olaparib处理后CRPC细胞中的ATM表达明显增高,其中ATM可增加肿瘤细胞对药物的抵抗能力。我们推断NPRL2可促进ATM表达使CRPC细胞对Olaparib不敏感,而NPRL2沉默联合Olaparib处理后CRPC中的ATM表达并未增高,可以进一步说明沉默NPRL2增加Olaparib对CRPC细胞的敏感性的机制可能是沉默NPRL2的表达从而降低ATM表达水平,加剧CRPC细胞中的DNA修复缺陷,使Olaparib对CRPC细胞敏感性增加。这与WESTON等[22]在淋巴瘤中的研究是一致的。
综上所述,本研究显示,沉默NPRL2通过抑制癌细胞的增殖、迁移和侵袭以及诱导细胞凋亡来增加CRPC细胞对Olaparib的敏感性。这有助于预测患者对Olaparib的耐药性,同时NPRL2也有望成为治疗CRPC的一个潜在靶点。
| [1] | ABESHOUSE A, AHN J, AKBANI R, et al. The molecular taxonomy of primary prostate cancer[J]. Cell, 2015, 163(4): 1011–1025. DOI:10.1016/j.cell.2015.10.025 |
| [2] | NA R, YE D, QI J, et al. Prostate health index significantly reduced unnecessary prostate biopsies in patients with PSA 2-10 ng/mL and PSA >10 ng/mL:Results from a multicenter study in China[J]. Prostate, 2017, 77(11): 1221–1229. DOI:10.1002/pros.23382 |
| [3] | ROSS R W, XIE W, REGAN M M, et al. Efficacy of androgen deprivation therapy (ADT) in patients with advanced prostate cancer:association between Gleason score, prostate-specific antigen level, and prior ADT exposure with duration of ADT effect[J]. Cancer, 2008, 112(6): 1247–1253. DOI:10.1002/cncr.23304 |
| [4] | ITO Y, SADAR M D. Enzalutamide and blocking androgen receptor in advanced prostate cancer:lessons learnt from the history of drug development of antiandrogens[J]. Res Rep Urol, 2018, 10: 23–32. DOI:10.2147/RRU.S157116 |
| [5] | MOTTET N, BELLMUNT J, BOLLA M, et al. EAU guidelines on prostate cancer.Part Ⅱ:Treatment of advanced, relapsing, and castration-resistant prostate cancer[J]. Eur Urol, 2011, 59(4): 572–583. DOI:10.1016/j.eururo.2011.01.025 |
| [6] | LERMAN M I, MINNA J D. The 630-kb lung cancer homozygous deletion region on human chromosome 3p21.3:identification and evaluation of the resident candidate tumor suppressor genes.The International Lung Cancer Chromosome 3p21.3 Tumor Suppressor Gene Consortium[J]. Cancer Res, 2000, 60(21): 6116–6133. |
| [7] | LI J, WANG F, HARALDSON K, et al. Functional characterization of the candidate tumor suppressor gene NPRL2/G21 located in 3p21.3C[J]. Cancer Res, 2004, 64(18): 6438–6443. DOI:10.1158/0008-5472.can-03-3869 |
| [8] | FARMER H, MCCABE N, LORD C J, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J]. Nature, 2005, 434(7035): 917–921. DOI:10.1038/nature03445 |
| [9] | ROBINSON D, VAN ALLEN E M, WU Y M, et al. Integrative clinical genomics of advanced prostate cancer[J]. Cell, 2015, 161(5): 1215–1228. DOI:10.1016/j.cell.2015.05.001 |
| [10] | JAYACHANDRAN G, UEDA K, WANG B, et al. NPRL2 sensitizes human non-small cell lung cancer (NSCLC) cells to cisplatin treatment by regulating key components in the DNA repair pathway[J]. PLoS ONE, 2010, 5(8): e11994. DOI:10.1371/journal.pone.0011994 |
| [11] | LIU S, LIU B. Overexpression of nitrogen permease regulator like-2(NPRL2) enhances sensitivity to irinotecan (CPT-11) in colon cancer cells by activating the DNA damage checkpoint pathway[J]. Med Sci Monit, 2018, 24: 1424–1433. DOI:10.12659/msm.909186 |
| [12] | PENG Y, DAI H, WANG E, et al. TUSC4 functions as a tumor suppressor by regulating BRCA1 stability[J]. Cancer Res, 2015, 75(2): 378–386. DOI:10.1158/0008-5472.can-14-2315 |
| [13] | LIU M N, LIU A Y, PEI F H, et al. Functional mechanism of the enhancement of 5-fluorouracil sensitivity by TUSC4 in colon cancer cells[J]. Oncol Lett, 2015, 10(6): 3682–3688. DOI:10.3892/ol.2015.3801 |
| [14] | HUANG N, CHENG S, MI X, et al. Downregulation of nitrogen permease regulator like-2 activates PDK1-AKT1 and contributes to the malignant growth of glioma cells[J]. Mol Carcinog, 2016, 55(11): 1613–1626. DOI:10.1002/mc.22413 |
| [15] | TANG Y, JIANG L, TANG W. Decreased expression of NPRL2 in renal cancer cells is associated with unfavourable pathological, proliferation and apoptotic features[J]. Pathol Oncol Res, 2014, 20(4): 829–837. DOI:10.1007/s12253-014-9761-2 |
| [16] | BAR-PELED L, CHANTRANUPONG L, CHERNIACK A D, et al. A Tumor suppressor complex with GAP activity for the Rag GTPases that signal amino acid sufficiency to mTORC1[J]. Science, 2013, 340(6136): 1100–1106. DOI:10.1126/science.1232044 |
| [17] | CHEN Z, LUO S, CHEN Y, et al. High expression of NPRL2 is linked to poor prognosis in patients with prostate cancer[J]. Hum Pathol, 2018, 76: 141–148. DOI:10.1016/j.humpath.2018.02.011 |
| [18] | MATEO J, CARREIRA S, SANDHU S, et al. DNA-Repair defects and olaparib in metastatic prostate cancer[J]. N Engl J Med, 2015, 373(18): 1697–1708. DOI:10.1056/NEJMoa1506859 |
| [19] | ZHANG D, TANG B, XIE X, et al. The interplay between DNA repair and autophagy in cancer therapy[J]. Cancer Biol Ther, 2015, 16(7): 1005–1013. DOI:10.1080/15384047.2015.1046022 |
| [20] | LI Y, YANG D Q. The ATM inhibitor KU-55933 suppresses cell proliferation and induces apoptosis by blocking Akt in cancer cells with overactivated Akt[J]. Mol Cancer Ther, 2010, 9(1): 113–125. DOI:10.1158/1535-7163.mct-08-1189 |
| [21] | REDDY V, WU M, CIAVATTONE N, et al. ATM inhibition potentiates death of androgen receptor-inactivated prostate cancer cells with telomere dysfunction[J]. J Biol Chem, 2015, 290(42): 25522–25533. DOI:10.1074/jbc.M115.671404 |
| [22] | WESTON V J, OLDREIVE C E, SKOWRONSKA A, et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo[J]. Blood, 2010, 116(22): 4578–4587. DOI:10.1182/blood-2010-01-265769 |



