2. 518000 广东 深圳,深圳市南山区人民医院肿瘤科
2. Department of Oncology, the People's Hospital of Nanshan District, Shenzhen, Guangdong Province, 518000, China
胃癌是常见的恶性肿瘤之一,其发病率在恶性肿瘤中居于第4位,病死率仅次于肺癌,占恶性肿瘤死因的第2位。胃癌发病隐匿,确诊时多已处于发病晚期,恶性程度高,预后差[1]。目前我国胃癌的发病率和病死率均呈上升趋势,在农村地区该疾病负担尤为严重[2]。
胃癌的发病机制十分复杂,胃癌标志物的发掘,不仅有助于早期诊断胃癌,评价肿瘤细胞的增殖、分化和迁移能力,也能加深对胃癌发生机制的认识,为胃癌治疗提供新的思路[3]。
长链非编码RNA(long noncoding RNA,lncRNA)是指一类长度大于200 bp的RNA,它可通过转录调控、RNA加工和核内运输等多种方式参与肿瘤的发病过程[1]。近些年研究表明GClnc1在胃癌组织中高表达,与胃部肿瘤的发生和增殖迁移密切相关,但具体的致病机制并不很明确[4]。有研究报道SIRT3/FOXO3/SOD2轴在肿瘤细胞中被激活,以对抗代谢过程中产生的大量活性氧,进而促进肿瘤的转移[5]。本研究通过在人胃癌细胞中转染病毒分别过表达和沉默GClnc1,研究GClnc1对肿瘤细胞增殖和迁移能力的影响,并检测GClnc1对SIRT3/FOXO3/SOD2的调控作用,以进一步探究GClnc1的致病机制。
1 材料与方法 1.1 培养基与试剂胎牛血清、OMEM、DMEM和RPMI1640培养液购自美国Gibco公司; 细胞裂解液RIPA、增强型化学发光试剂盒和CCK-8细胞增殖检测试剂盒购自上海碧云天生物技术有限公司; 青霉素、链霉素、Lipofectamine 2000、TRIzol和SYBR Green PCR Master Mix购自美国Invitrogen公司。
1.2 细胞培养人胃癌细胞SGC7901来源于上海生化细胞所。SGC7901细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640完全培养基进行培养。
1.3 慢病毒的构建与转染慢病毒载体质粒LV3(Pglv3/H1/GFP+PURO)以及包装质粒均购于上海吉玛公司。GClnc1、sh-GClnc1和阴性片段的导入以及病毒包装均由上海吉玛公司完成。慢病毒转染方法参考上海吉玛公司慢病毒产品操作手册。
1.4 RNA干扰将si-RNA与Lipofectamine 2000以合适的比例在OMEM中孵育20 min,将混合液加入细胞培养4 h后,将培养基换为完全培养基,培养48 h后将细胞用于下一步检测。si-SIRT3、si-FOXO3和si-SOD2 (Homo)购自上海吉玛公司。
1.5 qRT-PCR检测使用试剂盒提取总RNA后逆转录为cDNA用于下一步检测。qRT-PCR引物序列:GClnc1,上游5′-TATGTACACAGTGTTGCTCACC-3′,下游5′-AGTTGTGATTTCTCAACAT-3′; SIRT3,上游5′-ACCCAGTGGCATTCCAGAC-3′,下游5′-GGCTTGGGGTTGTGAA-AGAAG-3′; FOXO3,上游5′-CGGACAAACGGCTCAC-TCT-3′,下游5′-GGACCCGCATGAATCGACTAT-3′; SOD2,上游5′-CGTGACTTTGGTTCCTTTGAC-3′,下游5′-ATTTGTAAGTGTCCCCGTTCC-3′; GAPDH,上游5′- GCATTGCCCTCAACGACCAC-3′,下游5′-CCACCACCC-TGTTGCTGTAG-3′。逆转录程序设置:37 ℃ 15 min,85 ℃ 5 s。qRT-PCR程序设置为:第1步95 ℃ 2 min; 第2步95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,进行40个循环; 第3步, 65 ℃ 5 min。
1.6 Western blot检测收集细胞加入RIPA细胞裂解液和SDS上样缓冲液,煮沸10 min,进行SDS-PAGE,并转移到PVDF膜上,用含5%脱脂奶粉的TBST封闭,将PVDF膜分别与对应的一抗和二抗依次进行孵育,最后用ECL试剂盒显影并曝光。抗体SIRT3、FOXO3、SOD2、COX4和GAPDH均购于美国Cell Signal公司,辣根过氧化物酶标记的山羊抗鼠或山羊抗兔IgG购自上海R&D生物科技公司。
1.7 CCK-8测定细胞增殖能力将SGC7901细胞进行转染12 h后,将各组细胞调整至相同的浓度,接种于96孔板,分别在培养12、24 h和36 h后,每孔加入适量CCK-8溶液,在细胞培养箱孵育2 h,并置于全波长酶标仪以450 nm波长测定光密度值D(450)。
1.8 划痕实验将SGC7901细胞进行转染24 h后,将各组细胞调整至相同的浓度接种于12孔板,待细胞贴壁后用移液枪枪头进行划痕,用PBS缓冲液洗去悬浮得细胞,并加入RPMI1640培养基。在显微镜下记录划痕宽度,之后将细胞放入培养箱培养24 h,再次拍照记录划痕宽度,计算迁移速率。
1.9 统计学分析采用Graphpad Prism 6对实验数据进行统计分析。计量数据以x±s表示。数据比较采用t检验。检验水准:α=0.05。
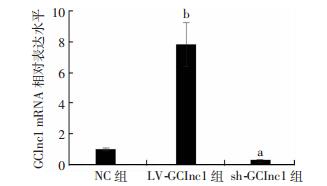
2 结果 2.1 GClnc1过表达慢病毒和GClnc1沉默慢病毒的鉴定在转染GFP-GClnc1慢病毒的细胞中,GClnc1 RNA水平明显上升(P < 0.01),而在转染sh-GClnc1慢病毒的细胞中,GClnc1 RNA水平明显降低(P < 0.05, 图 1)。
|
| a:P < 0.05,b:P < 0.01,与NC组比较 图 1 过表达慢病毒LV-GClnc1和沉默慢病毒LV-sh-GClnc1转染效率的鉴定 |
2.2 GClnc1调控SIRT3、FOXO3和SOD2的蛋白水平和mRNA水平
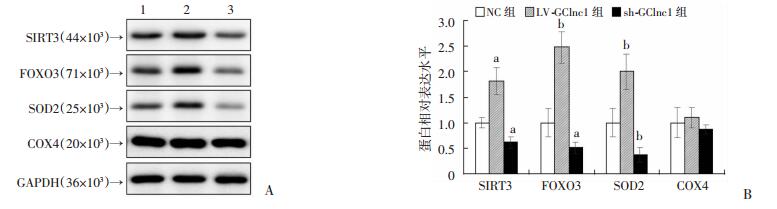
过表达GClnc1上调SIRT3、FOXO3和SOD2的mRNA水平(P < 0.05,P < 0.01),而GClnc1的沉默则使这些分子的mRNA水平降低(P < 0.05,图 2)。同样,过表达GClnc1上调了这些蛋白的水平,而沉默GClnc1则下调其水平(P < 0.05,P < 0.01,图 3)。线粒体的标记蛋白COX4含量差异没有统计学意义(图 3)。

|
| a:P < 0.05,b:P < 0.01,与NC组比较 图 2 qRT-PCR检测SIRT3、FOXO3和SOD2 mRNA水平 |
|
| A:Western blot检测1:NC组; 2:LV-GCInc1组; 3: sh-GCInc1组; B:半定量分析a:P < 0.05,b:P < 0.01,与NC组比较 图 3 Western blot检测SIRT3、FOXO3、SOD2和COX4的蛋白水平 |
2.3 GClnc1依赖于SOD2调控SGC7901细胞的增殖和迁移
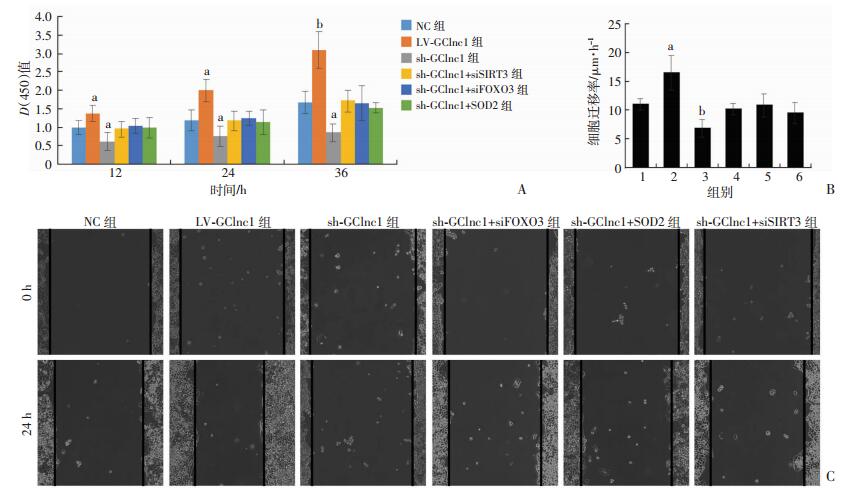
CCK-8和划痕实验结果显示:GClnc1的过表达可以提高细胞活力和细胞迁移速度,而沉默GClnc1则效果相反(P < 0.05,P < 0.01)。在过表达GClnc1的同时沉默SIRT3、FOXO3或者SOD2,肿瘤细胞的增殖和迁移能力不再增加(图 4)。
|
| A:CCK-8检测细胞增殖能力; B:各组细胞迁移速率变化1:NC组; 2:LV-GCInc1组; 3:sh-GCInc1组; 4:sh-GCInc1+siSIRT3组; 5:sh-GCInc1+siFOXO3组; 6:sh-GCInc1+si-SOD2组; a:P < 0.05,b:P < 0.01,与NC组比较; C:划痕实验观察细胞迁移能力(×100) 图 4 GClnc1对细胞增殖能力和迁移能力的影响 |
3 讨论
lncRNA是一类长度大于200 bp的RNA,目前在人类基因组中发现约有上万条lncRNA,它们中大多不编码蛋白质[6]。lncRNA可与DNA、RNA和蛋白质相互作用,并调控染色质重构、转录和转录后修饰。最近的研究表明:lncRNA的异常表达参与了肿瘤细胞的发生、增殖和转移[7]。
通过对胃癌患者组织样本的分析,GClnc1被发现是1条与胃癌相关的lncRNA。GClnc1的上调促进了胃癌细胞的增殖、转移和化疗耐药性,而GClnc1的下调则抑制了胃癌细胞的生长、转移,并增加了胃癌细胞的化疗敏感性[4]。GClnc1在慢性萎缩性胃炎、肠上皮化生、异型增生及胃癌的演变过程中表达量依次升高,高水平表达的GClnc1主要通过结合SOD2的启动子促进胃癌的发生,并成为人类胃癌迁移性增加的决定性因素之一[4]。但GClnc1对SIRT3/FOXO3/SOD2信号通路的影响,以及SIRT3/FOXO3/SOD2信号通路在胃癌演进过程中的作用尚未得到充分研究。
SIRT3是一个重要的线粒体蛋白质,它可以抑制氧化应激,并通过稳定线粒体膜电位来减少活性氧(ROS)的产生,从而维持线粒体的正常功能[8]。SIRT3与肿瘤的发生、发展关系密切,其主要通过调节氧化应激途径促进肿瘤细胞存活。在人宫颈癌细胞HeLa中SIRT3可以去乙酰化Ku70而增强Ku70-Bax结合,并防止Bax转运至线粒体,抑制肿瘤细胞凋亡的发生[9]。SIRT3在一些人口腔癌细胞高表达,在这些细胞下调SIRT3的表达可以抑制细胞生长和增殖,并且增强细胞对放疗和化疗药物的敏感性[10]。FOXO3是一类进化保守的转录因子,在细胞葡萄糖代谢、自噬、衰老和肿瘤中起着重要的作用[11]。有研究报道在人的乳腺肿瘤组织中,FOXO3呈高表达[12]。FOXO3可以诱导基质金属蛋白酶9和基质金属蛋白酶13的表达,而基质金属蛋白酶则是导致肿瘤转移的重要影响因素。SOD2主要定位在线粒体基质中,炎症因子、肿瘤坏死因子和氧化应激均能诱导SOD2的表达。为了对抗过度的氧化应激,抗氧化酶对于肿瘤细胞的生存是必要的。当ROS的积累超过SOD2等抗氧化因子的阈值后,可导致肿瘤细胞的损伤和死亡。SOD2则通过其抗氧化作用,清除肿瘤细胞线粒体所产生的ROS[13]。SOD2在结肠癌、膀胱癌、前列腺癌和肺癌组织中高表达。MYC原癌基因增加SOD2的表达,进而增强舌鳞状细胞癌细胞的迁移和迁移性表型[14]。另有研究报道:在复发性肿瘤中SOD2蛋白表达较高,并且这些复发性肿瘤对SOD2的下调十分敏感,SOD2升高与患者的预后不良相关[15]。FOXO3是SOD2的转录因子,可被SIRT3去乙酰化而激活,进而减少ROS的产生[9]。另外,SIRT3还可以直接通过去乙酰化作用使SOD2活性增强,发挥其抗氧化功能[16]。
本研究将过表达慢病毒LV-GClnc1和沉默慢病毒LV-sh-GClnc1,分别转染到人胃癌细胞SGC7901中。为了检验病毒的表达效率,通过q-PCR检测GClnc1的分子水平,发现在转染GFP-GClnc1慢病毒的细胞中,GClnc1 RNA水平明显上升,而在转染sh-GClnc1慢病毒的细胞中,GClnc1 RNA水平明显降低。这表明GClnc1的过表达病毒和沉默病毒构建成功,转染效果良好。
有研究报道SIRT3/FOXO3/SOD2信号通路在肿瘤的发生、发展中起着重要的作用[5]。为了研究GClnc1是否可以调控该通路,本研究在SGC7901细胞中转染了GFP-GClnc1和sh-GClnc1,随后检测了SIRT3、FOXO3和SOD2的mRNA和蛋白水平。结果表明:过表达GClnc1增加了SIRT3、FOXO3和SOD2的mRNA水平,而GClnc1的沉默则使这些分子的mRNA水平降低。在蛋白水平,观察到了同样的变化。为了排除这些蛋白含量变化受线粒体数量的影响,我们检测了线粒体的标记蛋白COX4,发现COX4蛋白含量没有差异。以上结果说明GClnc1可以从转录水平正向调控SIRT3、FOXO3和SOD2的表达。
既然SIRT3/FOXO3/SOD2信号通路可以影响肿瘤细胞的转移,而本研究发现GClnc1可以调控该通路,那么GClnc1是否通过该信号通路来影响肿瘤细胞的增殖能力和迁移能力呢?本研究在SGC7901细胞中分别过表达和沉默了GClnc1,并且在过表达GClnc1的同时分别沉默了SIRT3、FOXO3和SOD2的表达。通过CCK-8和划痕实验结果发现GClnc1的过表达可以提高肿瘤细胞的增殖能力和迁移能力,而沉默GClnc1则效果相反。在过表达GClnc1的同时沉默SIRT3、FOXO3或者SOD2,肿瘤细胞的增殖和迁移能力不再增加。这些数据表明GClnc1依赖于SIRT3/FOXO3/SOD2轴调控细胞的增殖和迁移能力。
本研究结果显示GClnc1在体外肿瘤细胞中具有促增殖和促迁移作用,并且通过研究其分子机制,发现GClnc1依赖于SIRT3/FOXO3/SOD2信号通路发挥其促增殖和促迁移作用。总之,本研究在一定程度上揭示了SIRT3/FOXO3/SOD2信号通路在GClnc1促进SGC7901细胞增殖和迁移中的作用,为进一步阐明GClnc1对胃癌细胞的作用机制以及胃癌的病理机制提供了实验依据,也为胃癌的治疗研究提供了潜在的靶点。
| [1] | SUN T T, DU W, XIONG H, et al. TMEFF2 deregulation contributes to gastric carcinogenesis and indicates poor survival outcome[J]. Clin Cancer Res, 2014, 20(17): 4689–4704. DOI:10.1158/1078-0432.CCR-14-0315 |
| [2] |
左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J].
中国肿瘤临床, 2017, 44(1): 52–58.
ZUO T T, ZHENG R S, ZENG H M, et al. Epidemiology of stomach cancer in China[J]. Chin Clin Oncol, 2017, 44(1): 52–58. DOI:10.3969/j.issn.1000-8179.2017.01.881 |
| [3] | COHEN J D, LI L, WANG Y X, et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test[J]. Science, 2018, 359(6378): 926–930. DOI:10.1126/science.aar3247 |
| [4] | SUN T T, HE J, LIANG Q, et al. LncRNA GClnc1 promotes gastric carcinogenesis and may act as a modular scaffold of WDR5 and KAT2A complexes to specify the histone modification pattern[J]. Cancer Discov, 2016, 6(7): 784–801. DOI:10.1158/2159-8290.CD-15-0921 |
| [5] | KENNY T C, HART P, RAGAZZI M, et al. Selected mitochondrial DNA landscapes activate the SIRT3 axis of the UPRmt to promote metastasis[J]. Oncogene, 2017, 36(31): 4393–4404. DOI:10.1038/onc.2017.52 |
| [6] | SCHMITT A M, CHANG H Y. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452–463. DOI:10.1016/j.ccell.2016.03.010 |
| [7] | YANG G D, LU X Z, YUAN L J. LncRNA: a link between RNA and cancer[J]. Biochim Biophys Acta, 2014, 1839(11): 1097–1109. DOI:10.1016/j.bbagrm.2014.08.012 |
| [8] | CHEN Y, FU L L, WEN X, et al. Sirtuin-3 (SIRT3), a therapeutic target with oncogenic and tumor-suppressive function in cancer[J]. Cell Death Dis, 2014, 5: e1047. DOI:10.1038/cddis.2014.14 |
| [9] | SUNDARESAN N R, SAMANT S A, PILLAI V B, et al. SIRT3 is a stress-responsive deacetylase in cardiomyocytes that protects cells from stress-mediated cell death by deacetylation of Ku70[J]. Mol Cell Biol, 2008, 28(20): 6384–6401. DOI:10.1128/MCB.00426-08 |
| [10] | ALHAZZAZI T Y, KAMARAJAN P, JOO N, et al. Sirtuin-3 (SIRT3), a novel potential therapeutic target for oral cancer[J]. Cancer, 2011, 117(8): 1670–1678. DOI:10.1002/cncr.25676 |
| [11] | WEBB A E, BRUNET A. FOXO transcription factors: key regulators of cellular quality control[J]. Trends Biochem Sci, 2014, 39(4): 159–169. DOI:10.1016/j.tibs.2014.02.003 |
| [12] | COOMANS DE BRACHNE A, DEMOULIN J B. FOXO transcription factors in cancer development and therapy[J]. Cell Mol Life Sci, 2016, 73(6): 1159–1172. DOI:10.1007/s00018-015-2112-y |
| [13] | KIM Y S, GUPTA VALLUR P, PHA TON R, et al. Insights into the dichotomous regulation of SOD2 in cancer[J]. Antioxidants (Basel), 2017, 6(4): E86. DOI:10.3390/antiox6040086 |
| [14] | LIU Z H, HE Q T, DING X Q, et al. SOD2 is a C-myc target gene that promotes the migration and invasion of tongue squamous cell carcinoma involving cancer stem-like cells[J]. Int J Biochem Cell Biol, 2015, 60: 139–146. DOI:10.1016/j.biocel.2014.12.022 |
| [15] | HU J, HWANG S S, LIESA M, et al. Antitelomerase therapy provokes ALT and mitochondrial adaptive mechanisms in cancer[J]. Cell, 2012, 148(4): 651–663. DOI:10.1016/j.cell.2011.12.028 |
| [16] | LIU X H, ZHANG L, WANG P, et al. Sirt3-dependent deacetylation of SOD2 plays a protective role against oxidative stress in oocytes from diabetic mice[J]. Cell Cycle, 2017, 16(13): 1302–1308. DOI:10.1080/15384101.2017.1320004 |



