创面愈合是烧创伤的基本问题,促进皮肤创面的修复是烧创伤治疗的主要任务[1-2]。创面形成后由于局部血液循环障碍和创周细胞氧耗的增加,导致创面形成低氧的微环境[3]。已有大量研究显示,在创面形成后的24 h内采用密闭性敷料可以显著促进创面愈合,而在该过程中,创面表面的氧分压非常低[4];在急性创面形成早期,短期应用半透性敷料造成的低氧环境可以提高创面愈合速度[5-6];因此低氧环境可能是密闭性敷料促进创面愈合的重要作用因素。
表皮细胞移行是创面再上皮化的起始事件及限速步骤[7-11]。然而,短期低氧环境是否通过调控表皮细胞迁移促进创面愈合目前并不清楚。前期已有大量的研究显示G蛋白偶联受体(GPRCs)相关的G蛋白可感知低氧信号并通过信号通路对细胞行为调控[12-13]。但在表皮细胞中,G蛋白是否有感知能力并对细胞做出行为调控目前也尚不明确。
本研究拟通过活细胞工作站观察表皮细胞在低氧条件下的运动变化,进一步通过基因芯片筛选重要差异基因,同时观察代表性的G蛋白Gαi1在低氧条件下表皮细胞调控中的作用。通过探讨低氧对创面愈合的作用及分子机制,对进一步阐明皮肤创面愈合机制,进行有效地干预、促进创面愈合具有重要的作用,也可为促进创伤创面愈合提供新的思路与策略。
1 材料与方法 1.1 主要细胞、试剂及仪器人永生化表皮细胞株(HaCaT)购置于中国科学院上海生科院细胞资源中心。培养细胞所采用的MEM/EBSS培养基购置于美国HyClone公司,胎牛血清及双抗购置于美国Gibco公司。Gαi低表达及阴性对照慢病毒载体由世翱(上海)生物医药科技有限公司合成。研究中用到的培养瓶、培养板等购置于美国康宁公司。仪器:激光共聚焦显微镜(德国莱卡公司),垂直电泳仪(美国百乐公司),凝胶成像分析仪(美国GE公司),活细胞工作站(德国蔡司公司),细胞培养箱(美国赛默飞公司),高速冷冻离心机(美国赛默飞公司)。
1.2 方法 1.2.1 细胞培养及缺氧处理方式HaCaT细胞正常培养采用MEM/EBSS培养基(含10%胎牛血清及1%双抗),在37 ℃、5% CO2培养箱中培养,每2~3天传1代。低氧处理采用含1%氧浓度的缺氧孵箱培养,细胞在处理之前所有培养基及PBS等均在缺氧孵箱中过夜处理。活细胞工作站观察采用配置1%氧浓度的混合气体充入活细胞工作站观察仓进行。
1.2.2 基因芯片及分析将6孔板内培养好的各组细胞进行常氧和低氧3 h处理后,采用常规步骤提取RNA,后续基因芯片检测及分析由北京中康博生物科技有限公司完成。
1.2.3 活细胞工作站观察并分析细胞运动在24孔板中细胞接种浓度为1×105/mL,待细胞生长融合至50%时,将细胞置于常氧及低氧(1%氧浓度)条件下,活细胞工作站观察并拍照分析。每组设置3个复孔,每个复孔每10分钟拍1张照片,连续记录24 h。对所获取的照片随机选取6个独立细胞采用Image J软件分析其运动轨迹,同时分析各时间点运动速度变化情况。
1.2.4 Gαi敲减稳定细胞株的构建取对数生长期的细胞接种到12孔板中,待细胞生长融合到80%~90%开始进行慢病毒转染。Gαi1基因mRNA的shRNA干扰序列为5′-CCGGGCAGGATCAAACACATATGAACTCGAGTTCATATGTGTTTGATCCTGCTTT-TTG-3′, 对照组为无义shRNA序列,分别插入慢病毒质粒pMAGic7.1获得干扰质粒。常规包装获得shRNA慢病毒,分别感染细胞并经嘌呤霉素筛选获得稳定Gαi1敲减的HaCaT细胞和对照细胞株。
1.2.5 免疫荧光取对数生长期的各组细胞,待细胞爬片后进行常氧及低氧24 h处理。取出细胞爬片,用PBS漂洗2~3次,每次3 min;3.7%甲醛溶液固定细胞10 min;其后0.1% Triton X-100/PBS浸泡细胞20 min;10%山羊血清室温孵育30 min;兔抗人Gαi1(1 :200,美国Santa Cruz Biotechnology),一抗孵育4 ℃过夜;PBS漂洗5 min/次,5~6次;Cy3标记山羊抗兔的二抗孵育2 h,PBS漂洗5 min/次,5~6次;DAPI避光孵育5 min后,PBS避光漂洗5 min/次,2~3次;最后置于激光共聚焦显微镜下观察细胞Gαi蛋白表达变化。
1.2.6 Western blot检测将6孔板内培养好的各组细胞进行常氧和低氧24 h处理后,每孔加入200 μL含0.1% PMSF的RIPA细胞裂解液(碧云天公司,上海)提取细胞总蛋白,BCA法测定蛋白浓度,等量50 μg上样后经8 %聚丙烯酰胺凝胶电泳约90 min,转膜(美国Millipore公司)后经5%脱脂奶粉封闭2 h,一抗于4 ℃条件下过夜:兔抗人Gαi1(1 :200,美国Santa Cruz Biotechnology)、鼠抗人GAPDH(1 :5 000,美国Santa Cruz Biotechnology)。二抗室温孵育2 h,Gαi1抗体用辣根过氧化物酶HRP标记山羊抗兔(1 :1 000,中国碧云天公司),GAPDH使用辣根过氧化物酶HRP标记山羊抗小鼠(1 :1 000,中国碧云天公司);采用ECL显色试剂盒(中国碧云天公司)于凝胶成像仪中观察相关蛋白表达情况。Image J软件进行半定量分析。
1.3 统计学分析划痕实验中定量测量数据采用x±s表示,采用GraphPad软件进行t检验统计分析并绘制柱状图。检验水准:α=0.05。
2 结果 2.1 低氧条件下表皮细胞迁移能力增强采用活细胞工作站观察了低氧条件下HaCaT细胞迁移情况(图 1),在低氧情况下HaCaT细胞迁移能力显著增强,常氧组与低氧组细胞迁移率差异具有统计学意义(P < 0.05)。进一步从细胞运动速度可以看出,在低氧早期,尤其是在前期3 h后,其细胞运动速度持续偏高,而在常氧情况下,运动速度波动较大,这也进一步反映出低氧条件下细胞较强的运动能力。
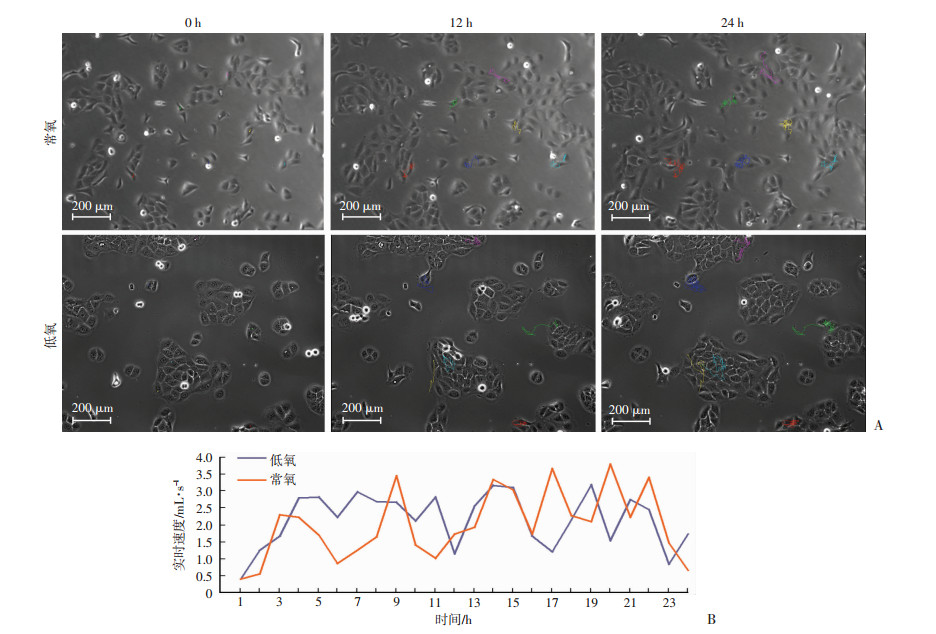
|
| A:活细胞工作站下0、12、24 h视野图;B:细胞运动速率实时曲线 图 1 活细胞工作站观察细胞在常氧及低氧条件下运动情况 |
2.2 基因芯片技术检测低氧及常氧下基因表达差异
为了进一步探究低氧促进表皮细胞迁移的分子调控机制,采用基因芯片技术对低氧处理3 h后基因表达差异进行了检测。检测样本共6组, 其中3组低氧实验组,3组常氧对照组。各样本RNA浓度及吸光度均符合要求,并用琼脂糖凝胶电泳检测了RNA的质量,结果均反映出RNA质量符合要求,可以进行后续基因芯片分析。此外,从相对对数表达箱线图也可以看出,大部分基因的表达量保持一致,平行重复实验之间一致性较强,基因芯片数据可靠。采用基因芯片火山图及基因芯片散点图的方式对所有实验结果进行过滤、筛选,将上调大于1.6倍或者下调也大于1.6倍,且P值≤0.05纳入为差异表达基因。数据分析发现,低氧处理3 h后,表达倍数差异达1.6倍的基因共计1 292个,其中上调基因523个,下调基因769个。对所有基因聚类分析,可见低氧处理组与常氧组各样本均得到较好的聚类。进一步分析差异基因,Gαi1及迁移相关基因均呈现出上调趋势(表 1)。
| 探针集编号 | 低氧组平均信号值 | 常氧组平均信号值 | 倍数关系 | 调控关系 | 基因名称 |
| TC0700008181.hg.1 | 6.907 | 6.253 | 1.574 | 上调 | GNAI |
| TC1700007557.hg.1 | 7.076 | 6.368 | 1.633 | 上调 | CCL2 |
| TC0200010980.hg.1 | 6.005 | 1.874 | 17.521 | 上调 | CCL20 |
| TC1500007614.hg.1 | 7.886 | 6.940 | 1.926 | 上调 | MAP2K1 |
| TC0900011864.hg.1 | 7.832 | 6.989 | 1.794 | 上调 | VAV2 |
2.3 低氧条件下表皮细胞Gαi1蛋白呈现出高表达趋势
基因芯片结果显示Gαi蛋白在低氧及常氧处理下表达差异具有统计学意义,采用Western blot及免疫荧光技术观察并验证了常氧及低氧情况下Gαi1蛋白表达变化。Western blot检测结果显示:低氧处理下Gαi1蛋白的表达呈现出高表达的趋势(图 2A、B)。进一步采用免疫荧光也观察到低氧条件下Gαi1蛋白呈现出相似的变化特征(图 2C)。从免疫荧光结果中可以看出,Gαi1蛋白的表达呈现出边缘多,中间较少的趋势;在低氧处理后边缘蛋白表达量增多。此外, 从细胞极性上看,低氧处理后细胞呈现出较为明显的极性特征,其细胞形态及骨架表现为前端尖锐后缘平展的特征(图 2C)。
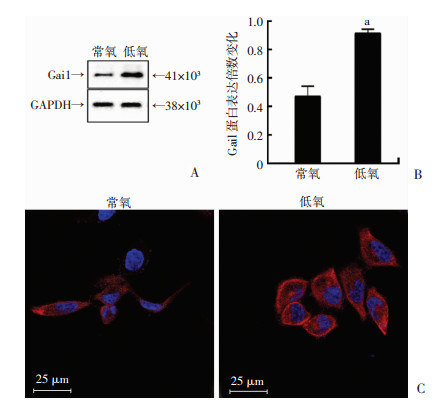
|
| A:Western blot检测;B:半定量分析;C:免疫荧光观察 图 2 免疫印迹及免疫荧光观察Gαi1蛋白表达变化 |
2.4 短期低氧条件下Gαi1蛋白在表皮细胞迁移中起着极其重要的促进作用
为了观察Gαi1蛋白在低氧条件下表皮细胞中的作用情况,采用慢病毒技术敲减Gαi1基因的表达,进一步采用活细胞工作站观察细胞迁移及运动变化情况。敲减Gαi1基因后低氧条件下HaCaT细胞迁移效率明显降低,与常氧相比差异无统计学意义(图 3A)。活细胞工作站实时观察的分析结果也可见,敲减Gαi1基因后HaCaT细胞在常氧及低氧条件下运动能力均大幅下降,同时早期实时运动速度也明显降低且呈现出不稳定波动现象, 在低氧5、9 h后,运动速度明显较常氧条件下小;12 h后运动速度又出现明显提升(图 3B)。
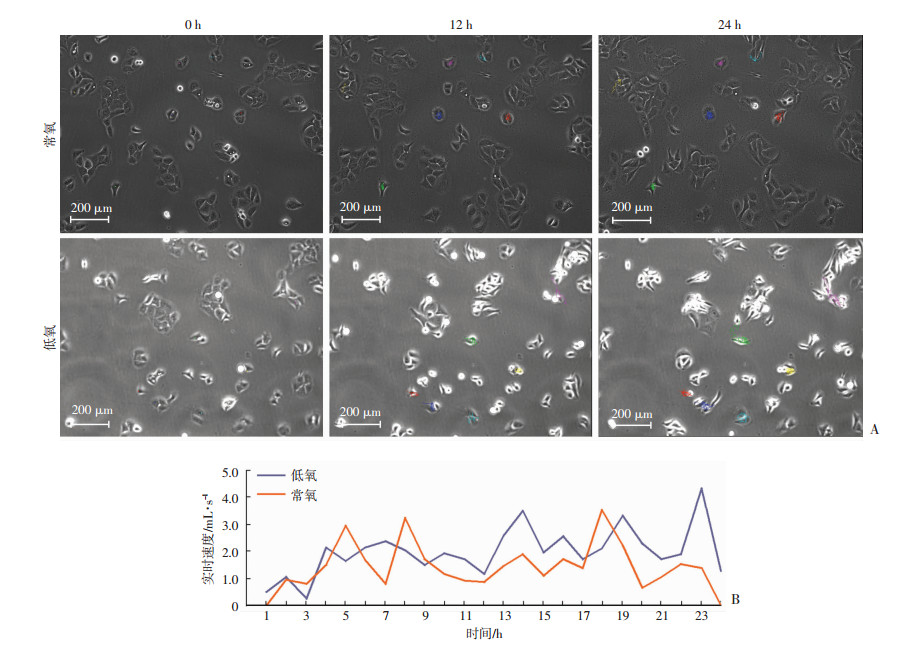
|
| A:活细胞工作站下0、12、24 h视野;B:细胞运动速率实时曲线 图 3 活细胞工作站观察Gαi1基因敲减后细胞在常氧及低氧条件下运动情况 |
3 讨论
皮肤创伤后的自然愈合过程主要包括肉芽组织的形成和创面再上皮化,创面再上皮化是现阶段临床治疗的首要任务,在创面再上皮化过程中,表皮细胞的迁移是决定创面愈合的关键步骤[14]。本研究发现低氧条件下表皮细胞迁移能力明显增强,此外在低氧早期,表皮细胞运动能力加强且较为持续,这也进一步反映出早期低氧环境促进创面愈合。
本研究发现一个比较有意思的现象在于低氧条件下表皮细胞运动能力的变化。从活细胞工作站实时运动数据可以看出,相比常氧条件下,低氧处理早期,细胞运动能力明显较快,且运动能力较为持久,在低氧处理的前12 h内,其运动能力均达到2 μm/s以上的速度。这也是低氧条件下尤其是低氧早期细胞迁移能力明显提升的关键所在。此外,当前的大部分研究已指出,低氧刺激下,细胞内缺氧诱导因子HIF-1发生变化并以此调控细胞的迁移及运动等行为,HIF-1在低氧感受中起着极其重要的作用[15-16]。然而本研究发现,与G蛋白偶联受体(G-protein coupled receptors, GPCRs)相关的G蛋白Gαi在低氧调控的表皮细胞运动中起着促进作用。
作为重要的膜蛋白受体家族,GPCRs可感知氧张力、激素、神经递质、趋化因子等,参与多种细胞内信号传导过程,调控细胞的多种习性[17]。目前研究表明,受到外界刺激后,GPCRs发生构象变化,以三磷酸鸟苷(GTP)交换G蛋白上的二磷酸鸟苷(GDP),激活Gα亚基,参与下一步信号传递过程[18]。Gαi蛋白对腺苷酸环化酶产生抑制作用,然而腺苷酸环化酶活性与细胞代谢、运动等密切相关,这也显示出Gαi蛋白在外界刺激后通过GPRCs调控细胞习性的重要作用[18-20]。新近的研究已显示,Gαi蛋白通过抑制Rap依赖的细胞粘附相关信号通路从而促进肿瘤相关细胞的迁移[21]。前期的研究也表明,Gαi蛋白通过激活PI3K/Akt/mTOR信号通路对表皮细胞迁移起着极大的促进作用[22]。本研究也发现低氧条件下Gαi 1蛋白也呈现出高表达趋势,进一步的功能验证实验结果显示,干扰Gαi 1后细胞迁移及运动能力明显下降,低氧与常氧条件下迁移及运动差异消失,这进一步证实了Gαi 1在调控细胞迁移中的重要作用。因此推测低氧条件下GPRCs通过Gαi1介导PI3K/Akt/mTOR以及Rap信号通路调控表皮细胞的迁移,对促进创面愈合起着积极作用。
综上所述,本研究采用表皮细胞HaCaT细胞株探究低氧及常氧条件下细胞运动能力差异,间接反应创面微环境中表皮细胞在缺氧环境的运动迁移变化。从结果看出,低氧条件下表皮细胞迁移及运动能力明显增强,同时也发现Gαi 1蛋白在低氧促进的迁移中扮演着极其重要的促进作用。该研究对进一步阐明皮肤组织创面愈合的机理以及后期采用相关药物等手段对创面进行有效干预提供理论依据,同时也对促进创面愈合提供新的思路及策略。
| [1] | REINKE J M, SORG H. Wound repair and regeneration[J]. Eur Surg Res, 2012, 49(1): 35–43. DOI:10.1159/000339613 |
| [2] | TAKEO M, LEE W, ITO M. Wound healing and skin regeneration[J]. CSH Perspect Med, 2015, 5(1): a023267. DOI:10.1101/cshperspect.a023267 |
| [3] | SCHREML S, SZEIMIES R M, PRANTL L, et al. Oxygen in acute and chronic wound healing[J]. Br J Dermatol, 2010, 163(2): 257–268. DOI:10.1111/j.1365-2133.2010.09804.x |
| [4] | EAGLSTEIN W H, DAVIS S C, MEHLE A L, et al. Optimal use of an occlusive dressing to enhance healing. Effect of delayed application and early removal on wound healing[J]. Arch Dermatol, 1988, 124(3): 392–395. DOI:10.1001/archderm.124.3.392 |
| [5] | GURTNER G C, WERNER S, BARRANDON Y, et al. Wound repair and regeneration[J]. Nature, 2008, 453(7193): 314–321. DOI:10.1038/nature07039 |
| [6] | EAGLSTEIN W H. Experiences with biosynthetic dressings[J]. J Am Acad Dermatol, 1985, 12(2 Pt 2): 434–440. DOI:10.1016/s0190-9622(85)80006-2 |
| [7] | ZOMER H D, TRENTIN A G. Skin wound healing in humans and mice: Challenges in translational research[J]. J Dermatol Sci, 2018, 90(1): 3–12. DOI:10.1016/j.jdermsci.2017.12.009 |
| [8] | HOFFMAN M. The tissue factor pathway and wound healing[J]. Semin Thromb Hemost, 2018, 44(2): 142–150. DOI:10.1055/s-0037-1606181 |
| [9] | KASUYA A, TOKURA Y. Attempts to accelerate wound healing[J]. J Dermatol Sci, 2014, 76(3): 169–172. DOI:10.1016/j.jdermsci.2014.11.001 |
| [10] | ZHANG H, FU W, XU Z. Re-epithelialization: a key element in tracheal tissue engineering[J]. Regen Med, 2015, 10(8): 1005–1023. DOI:10.2217/rme.15.68 |
| [11] | MARTINS-GREEN M. The yin and yang of integrin function in re-epithelialization during wound healing[J]. Adv Wound Care (New Rochelle), 2013, 2(3): 75–80. DOI:10.1089/wound.2011.0342 |
| [12] | LIN C, EAR J, PAVLOVA Y, et al. Tyrosine phosphorylation of the Gα-interacting protein GIV promotes activation of phosphoinositide 3-kinase during cell migration[J]. Sci Signal, 2011, 4(192): ra64. DOI:10.1126/scisignal.2002049 |
| [13] | ZHONG M, CLARKE S, VO B T, et al. The essential role of Giα2 in prostate cancer cell migration[J]. Mol Cancer Res, 2012, 10(10): 1380–1388. DOI:10.1158/1541-7786.MCR-12-0219 |
| [14] | WANG P H, HUANG B S, HORNG H C, et al. Wound healing[J]. J Chin Med Assoc, 2018, 81(2): 94–101. DOI:10.1016/j.jcma.2017.11.002 |
| [15] | BAUGH J A, GANTIER M, LI L, et al. Dual regulation of macrophage migration inhibitory factor (MIF) expression in hypoxia by CREB and HIF-1[J]. Biochem Biophys Res Commun, 2006, 347(4): 895–903. DOI:10.1016/j.bbrc.2006.06.148 |
| [16] | ANDRIKOPOULOU E, ZHANG X, SEBASTIAN R, et al. Current insights into the role of HIF-1 in cutaneous wound healing[J]. Curr Mol Med, 2011, 11(3): 218–235. DOI:10.2174/156652411795243414 |
| [17] | LIN H H, HSIAO C C, PABST C, et al. Adhesion GPCRs in regulating immune responses and inflammation[J]. Adv Immunol, 2017, 136: 163–201. DOI:10.1016/bs.ai.2017.05.005 |
| [18] | KRISHNAN A, NIJMEIJER S, DE GRAAF C, et al. Classification, nomenclature, and structural aspects of adhesion GPCRs[J]. Handb Exp Pharmacol, 2016, 234: 15–41. DOI:10.1007/978-3-319-41523-9_2 |
| [19] | V ZQUEZ-PRADO J, BRACHO-VALD S I, CERVANTES-VILLAGRANA R D, et al. Gβγ pathways in cell polarity and migration linked to oncogenic GPCR signaling: Potential relevance in tumor microenvironment[J]. Mol Pharmacol, 2016, 90(5): 573–586. DOI:10.1124/mol.116.105338 |
| [20] | HART S, FISCHER O M, PRENZEL N, et al. GPCR-induced migration of breast carcinoma cells depends on both EGFR signal transactivation and EGFR-independent pathways[J]. Biol Chem, 2005, 386(9): 845–855. DOI:10.1515/BC.2005.099 |
| [21] | TO J Y, SMRCKA A V. Activated heterotrimeric G protein αi subunits inhibit Rap-dependent cell adhesion and promote cell migration[J]. J Biol Chem, 2018, 293(5): 1570–1578. DOI:10.1074/jbc.RA117.000964 |
| [22] | ZHANG Y M, ZHANG Z Q, LIU Y Y, et al. Requirement of Gαi1/3-Gab1 signaling complex for keratinocyte growth factor-induced PI3K-AKT-mTORC1 activation[J]. J Invest Dermatol, 2015, 135(1): 181–191. DOI:10.1038/jid.2014.326 |



