乳腺癌(breast cancer)是威胁女性健康的主要恶性肿瘤之一,其中三阴性乳腺癌(triple negative breast cancer, TNBC)是雌激素、孕激素、生长因子受体均为阴性的乳腺癌。三阴性乳腺癌患者预后差,生存率低于其他非三阴性乳腺癌。传统的用于治疗乳腺癌的环磷酰胺、5-氟尿嘧啶(5-FU)和阿霉素等药物因为毒副作用大且患者产生耐药性从而使得治疗效果被限制。而靶向治疗药物具有高特异性,且对正常组织损伤较小,所以研究治疗乳腺癌的新靶点药物很有意义。
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,细胞分裂和DNA合成是细胞周期的两个主要事件。在进化过程中,生物细胞发展出一系列的调控机制来确保细胞周期严格有序地进行交替以及各个时相的有序变更。相关文献得知与细胞周期调控有关的分子主要有以下3大类[1]:细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)、细胞周期蛋白依赖性激酶抑制剂(CDK inhibitor, CKI)。CDKs是细胞周期调控网络的中心,Cyclins正性调控于CDKS,CKIs则对CDKS有负性调控作用,三者共同组成了细胞周期调控的分子基础;细胞周期调控紊乱会导致细胞失控性增殖,也是肿瘤发生的最基本生物学特征。细胞周期调控机制能够揭示癌症发生的机制,可以为临床的早期诊断提供分子标志物以及药物作用靶点。
有文献报道8-姜酚具有抗氧化、抗炎、强心、降压、降血脂、降血糖、抗凝等[2-4]生物活性。多项人群流行病学研究表明,亚洲地区结肠癌、肝癌、前列腺癌、直肠癌、乳腺癌等多种肿瘤的发病率均低于其他地区,与亚洲地区居民饮食中所包含的酚类物质有关[5]。在前期研究中,我们发现8-姜酚能够明显抑制乳腺癌细胞MDA-MB-231和MCF-7的增殖活性。本研究旨在对8-姜酚抑制乳腺癌细胞增殖的分子机制进行研究,为将8-姜酚开发成为一种新的用于乳腺癌治疗的周期治疗药物提供理论依据。
1 材料与方法 1.1 材料与试剂人乳腺癌细胞系MDA-MB-231和MCF-7购自美国ATCC细胞库;DMEM高糖培养基、胎牛血清(FBS)、胰蛋白酶、Western blot试剂均购自Bio-Basic公司;GAPDH抗体购自碧云天公司;P38、p-P38抗体购自Santa Cruz Technology公司;CyclinD1、p-CDC2购自Cell Signaling Technology公司;四甲基偶氮唑蓝(MTT)购自Sigma-Aldrich公司;P38 MAPK抑制剂SB203580、ROS抑制剂NAC购自Selleck公司;8-姜酚购自派瑞金(北京)生物科技有限公司。
1.2 方法 1.2.1 细胞株与细胞培养人乳腺癌MDA-MB-231、MCF-7细胞均使用DMEM完全培养基(10%胎牛血清、链霉素100 mg/L、青霉素1×105 U/L),在37 ℃、饱和湿度及5%CO2的恒温培养箱中培养,每隔2 d传代1次。
1.2.2 MTT比色法将对数生长期的乳腺癌细胞悬液按8 000个/孔接种于96孔板,每孔体积90 μL。置于37 ℃、饱和湿度及5%CO2的恒温培养箱中培养24 h后给药并使作用浓度分别为0、10、20、30、40 μmol/L,药物作用时间设置为24、48、72 h 3个组。给药时间到达之后加入0.5% MTT试剂20 μL,置于培养箱反应4 h后小心吸出96孔板中的液体,每孔加入二甲基亚砜150 μL,室温放在摇床上振摇30 min充分溶解甲瓒结晶,用酶标仪在490 nm波长处检测光密度值,并计算姜酚类化合物8-姜酚对乳腺癌MDA-MB-231和MCF-7细胞的IC50值。
1.2.3 细胞周期检测取人乳腺癌MD-MB-231、MCF-7细胞悬液接种于60 mm培养皿中,每皿3.5×105个细胞。培养体系为5 mL,置37 ℃、饱和湿度及5% CO2的恒温培养箱中培养24 h后加入药,使得8-姜酚的作用浓度分别为20、30、40 μmol/L。继续培养24 h后用胰酶消化收集于15 mL离心管中,800 r/min离心5 min,弃上清,用1 mL PBS混悬细胞后再次800 r/min离心5 min,弃上清,加入300 μL细胞周期染色液,涡旋分散(1次2 s,涡旋10次),避光冰浴2 h后转入1.5 mL EP管中进行流式检测。
1.2.4 ROS检测细胞计数后按照1.5×105/孔铺于6孔板中,37 ℃培养24 h后加药继续培养24 h,加入DCFH-DA探针孵育2 h,收集细胞于离心管中,用PBS混悬细胞,流式细胞仪检测。
1.2.5 凋亡检测细胞计数后按照1.5×105/孔铺于6孔板中,37 ℃培养18~24 h后给药培养24 h。细胞收集于离心管内,每管中加入200 μL binding buffer,再加入2 μL Annexin V-FITC,5 μL PI,混匀后避光染色15 min。加150 μL 1×binding buffer充分重悬细胞,流式细胞仪检测。
1.2.6 Western blot检测MDA-MB-231和MCF-7细胞8-姜酚给药处理24 h后,用碧云天蛋白提取试剂盒提取全细胞蛋白并用碧云天BCA蛋白浓度测定试剂盒测定蛋白浓度,全细胞蛋白液加入Loading buffer,96 ℃,金属浴10 min,保存于-80 ℃冰柜。经聚丙烯酰胺凝胶电泳(SDS-PAGE)电转3~4 h至PVDF膜,5%脱脂奶粉封闭1 h,于4 ℃摇床上孵育抗体过夜,TBST洗涤一抗,加入二抗于室温下孵育2 h,TBST洗涤后显影。
1.3 统计学分析流式检测数据采用FlowJo软件进行分析,计量数据以x±s表示,采用SPSS 19.0统计软件进行处理,两样本的组间比较采用t检验。检验水准α=0.01。
2 结果 2.1 8-姜酚抑制乳腺癌细胞增殖8-姜酚0、5、10、20、30、40、50、60、70、80 μmol/L分别作用于乳腺癌MDA-MB-231和MCF-7细胞24、48、72 h后,结果显示随着8-姜酚给药浓度和时间的增加其抑制乳腺癌细胞增殖的作用愈加明显(图 1)。8-姜酚作用于MDA-MB-231细胞24、48、72 h的IC50值分别为(42.39±5.71)、(38.15±6.19)、(22.06±2.93)μmol/L,72h的IC50值与24 h相比差异有统计学意义(P < 0.01);8-姜酚作用于MCF-7细胞24、48、72 h的IC50值分别为(56.41±7.81)、(47.87±5.33)、(35.77±5.96)μmol/L,72 h的IC50值与24 h相比差异有统计学意义(P < 0.01)。
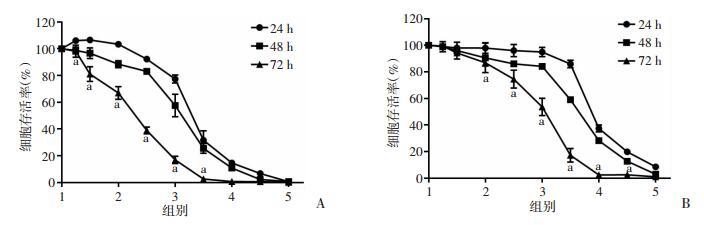
|
| A:8-姜酚对MDA-MB-231细胞活性的影响;B:8-姜酚对MCF-7细胞活性的影响;1:对照组,2:20 μmol/L 8-姜酚组,3:40 μmol/L 8-姜酚组,4:60 μmol/L 8-姜酚组,5:80 μmol/L 8-姜酚组;a:P < 0.01,与相同浓度作用24 h比较 图 1 8-姜酚对乳腺癌MDA-MB-231、MCF-7细胞活性的影响 |
2.2 8-姜酚可引起乳腺癌细胞G1期阻滞,但不诱导凋亡 2.2.1 8-姜酚作用24 h后对乳腺癌细胞MDA-MB-231和MCF-7周期的影响
8-姜酚0、20、30、40 μmol/L处理乳腺癌细胞MDA-MB-231 24 h后,20、30、40 μmol/L组G1期细胞所占比例分别为(53.46±4.39)%、(64.29±3.22)%、(69.23±3.77)%,显著高于对照组(0 μmol/L)G1期细胞所占比例[(47.39±1.97)%](P < 0.01,图 2A);8-姜酚0、20、30、40 μmol/L处理乳腺癌细胞MCF-7 24 h后,对照组(0 μmol/L)G1期细胞所占比例为(49.17±3.52)%,而20、30、40 μmol/L组G1期细胞占比分别为(58.11± 2.70)%、(63.20±3.93)%、(65.87±3.76)%,给药组的G1期细胞比例显著高于对照组(0 μmol/L),差异有统计学意义(P < 0.01,图 2B)。
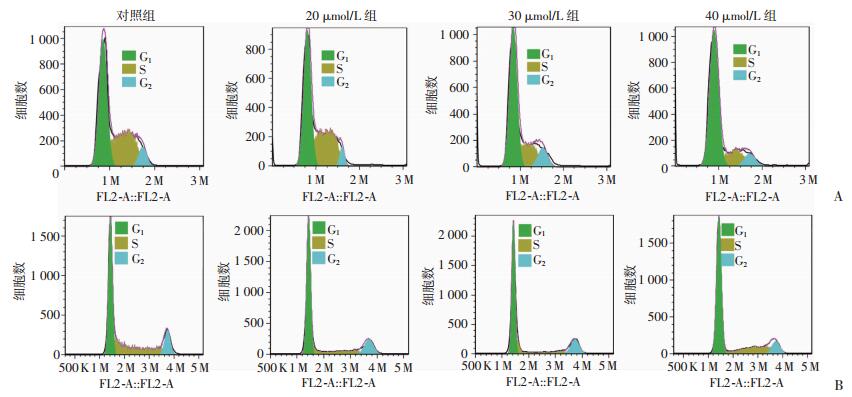
|
| A:8-姜酚对MDA-MB-231细胞周期的影响;B:8-姜酚对MCF-7细胞周期的影响 图 2 流式细胞仪检测8-姜酚对MDA-MB-231、MCF-7细胞周期的影响 |
2.2.2 流式细胞检测8-姜酚作用24 h后引起的MDA-MB-231细胞凋亡
8-姜酚0、20、30、40 μmol/L作用于MDA-MB-231细胞24 h,流式细胞仪检测细胞凋亡,结果发现给药组凋亡率和对照组相比无明显差异,表明8-姜酚并不导致MDA-MB-231细胞凋亡。见图 3。
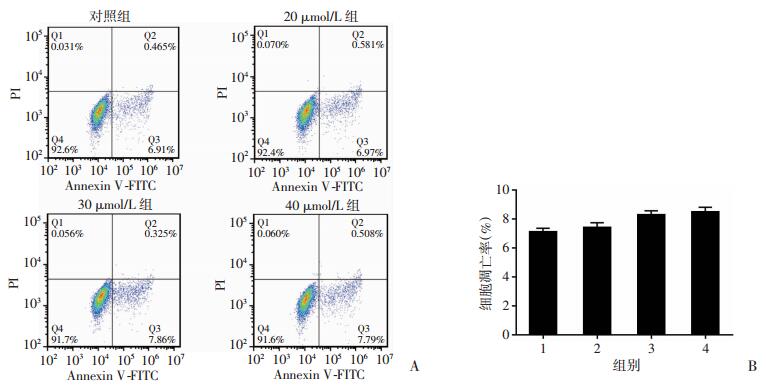
|
| A:8-姜酚对MDA-MB-231细胞凋亡的影响;B:细胞凋亡统计;1:对照组,2:20 μmol/L 8-姜酚组,3:30 μmol/L 8-姜酚组,4:40 μmol/L 8-姜酚组 图 3 流式细胞仪检测8-姜酚作用24h后引起的MDA-MB-231细胞凋亡 |
2.2.3 8-姜酚影响G1期相关蛋白的表达
8-姜酚0、10、20、30、40 μmol/L处理乳腺癌细胞MDA-MB-231、MCF-7 24 h后,可导致细胞G1期相关蛋白Cyclin D1和p-CDC2的表达呈剂量依赖性降低(图 4)。表明8-姜酚能够调控G1期相关蛋白的表达。

|
| A:MDA-MB-231细胞中周期相关蛋白变化;B:MCF-7细胞中周期相关蛋白变化;1:对照组,2:10μmol/L 8-姜酚组,3:20 μmol/L 8-姜酚组,4:30 μmol/L 8-姜酚组,5:40 μmol/L 8-姜酚组 图 4 Western blot检测8-姜酚对乳腺癌细胞周期相关蛋白表达的调控 |
2.3 8-姜酚通过上调P38蛋白的磷酸化水平从而导致乳腺癌细胞发生G1期阻滞 2.3.1 8-姜酚对乳腺癌细胞中P38蛋白磷酸化水平的影响
8-姜酚0、10、20、30、40 μmol/L作用于乳腺癌细胞MDA-MB-31和MCF-7 24h后Western blot检测发现MAPK信号通路中的P38蛋白磷酸化水平呈剂量依赖性增加(图 5)。

|
| A:8-姜酚对MDA-MB-231细胞MAPK信号通路蛋白的影响;B:8-姜酚对MCF-7细胞MAPK信号通路蛋白的影响;1:对照组,2:10 μmol/L 8-姜酚组,3:20 μmol/L 8-姜酚组,4:30 μmol/L 8-姜酚组,5:40 μmol/L 8-姜酚组 图 5 8-姜酚对乳腺癌细胞MAPK信号通路相关蛋白的调控 |
2.3.2 抑制P38蛋白磷酸化对周期相关蛋白表达的影响
Western blot检测发现P38抑制剂SB203580可明显降低P38蛋白的磷酸化水平(图 6A),用SB203580抑制P38磷酸化后,减弱了8-姜酚导致的Cyclin D1和p-CDC2降低的程度,说明8-姜酚下调周期相关蛋白CyclinD1、p-CDC2的作用与其上调P38磷酸化水平有关(图 6B)。

|
| A:抑制剂SB203580对P38蛋白的调控;1:对照组,2:SB203580组;B:8-姜酚联用抑制剂SB203580对周期相关蛋白表达的调控;1:对照组,2:8-姜酚组,3:SB203580组,4:8-姜酚和SB203580联合用药组 图 6 联用抑制剂SB203580对MDA-MB-231细胞周期相关蛋白表达的影响 |
2.3.3 抑制P38蛋白磷酸化对细胞周期的影响
流式检测发现,用SB203580抑制P38磷酸化后明显减弱了8-姜酚对乳腺癌细胞G1期阻滞作用(P < 0.01),说明8-姜酚引起细胞G1期阻滞作用与其上调P38蛋白的磷酸化水平有关(图 7)。
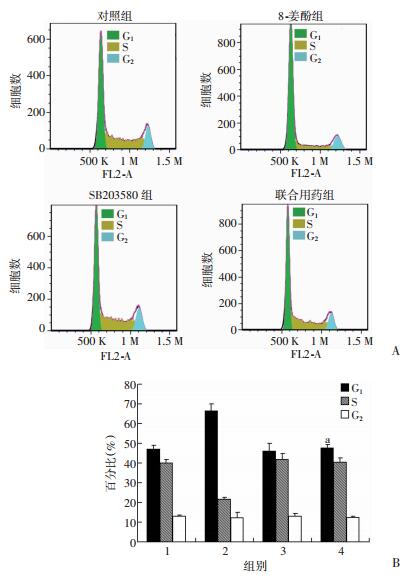
|
| A:流式检测联用P38 MAPK抑制剂SB203580对乳腺癌MDA-MB-231细胞周期的影响;B:各细胞周期比例统计1:对照组,2:8-姜酚组,3:SB203580组,4:联合用药组;a:P < 0.01,与8-姜酚组比较 图 7 8-姜酚联用P38 MAPK抑制剂SB203580对乳腺癌细胞MDA-MB-231周期的影响 |
2.3.4 联用P38 MAPK抑制剂SB203580对细胞存活率的影响
用SB203580抑制P38磷酸化后,明显减弱了8-姜酚抑制MDA-MB-231细胞增殖活性的作用(P < 0.01)。说明8-姜酚抑制乳腺癌MDA-MB-231细胞增殖的作用与其上调P38蛋白的磷酸化水平有关(图 8)。
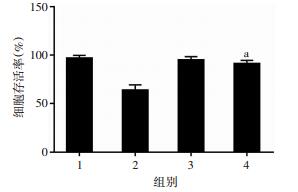
|
| 1:对照组,2:8-姜酚组,3:SB203580组,4:8-姜酚与SB203580联合用药组;a:P < 0.01,与8-姜酚组比较 图 8 8-姜酚联用P38 MAPK抑制剂对MDA-MB-231细胞活性的影响 |
2.4 8-姜酚通过诱导产生ROS而导致乳腺癌细胞G1期阻滞 2.4.1 8-姜酚诱导乳腺癌细胞MDA-MB-231产生ROS
8-姜酚0、10、20、30、40 μmol/L作用于MDA-MB-231细胞24 h后,流式细胞仪检测发现给药组产生ROS的细胞比例显著高于对照组,差异有统计学意义(P < 0.01,图 9),说明8-姜酚能够诱导细胞产生ROS。而ROS抑制剂NAC能减弱8-姜酚诱导MDA-MB-231细胞产生ROS的作用,差异有统计学意义(P < 0.01,图 10)。
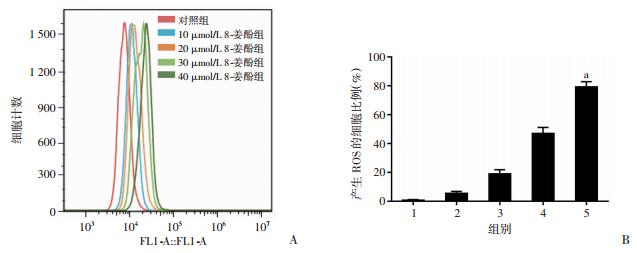
|
| A:流式细胞仪检测ROS;B:产生ROS的细胞比例;1:对照组,2:10 μmol/L 8-姜酚组,3:20 μmol/L 8-姜酚组,4:30 μmol/L 8-姜酚组,5:40 μmol/L 8-姜酚组;a:P < 0.01,与对照组比较 图 9 流式细胞仪检测产生ROS的细胞比例 |
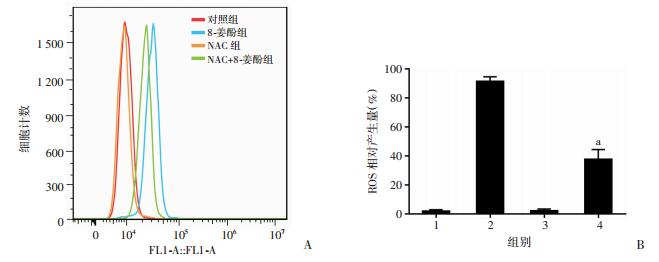
|
| A:流式细胞仪检测联用ROS抑制剂(NAC)后所产生的ROS;B:产生ROS的细胞比例;1:对照组,2:8-姜酚组,3:NAC组,4:8-姜酚和NAC联用用药组;a:P < 0.01,与8-姜酚组比较 图 10 流式细胞仪检测联用ROS抑制剂(NAC)后产生ROS的细胞比例 |
2.4.2 ROS抑制剂NAC对P38及周期相关蛋白的影响
用NAC抑制ROS之后降低了P38磷酸化水平,减弱了8-姜酚导致的Cyclin D1和p-CDC2降低程度,说明8-姜酚上调P38磷酸化水平以及下调G1期相关蛋白CyclinD1、p-CDC2的作用与其诱导细胞产生ROS的作用有关(图 11)。

|
| 1:对照组,2:8-姜酚组,3:NAC组,4:8-姜酚与NAC联合用药组 图 11 联用NAC对MDA-MB-231细胞周期及MAPK信号通路相关蛋白的调控 |
2.4.3 联用NAC后对细胞周期的影响
联用ROS抑制剂NAC后明显减弱了8-姜酚对乳腺癌细胞G1期阻滞作用,说明8-姜酚引起乳腺细胞G1期阻滞作用与其诱导乳腺癌细胞产生ROS有关,差异有统计学意义(P < 0.05,图 12)。
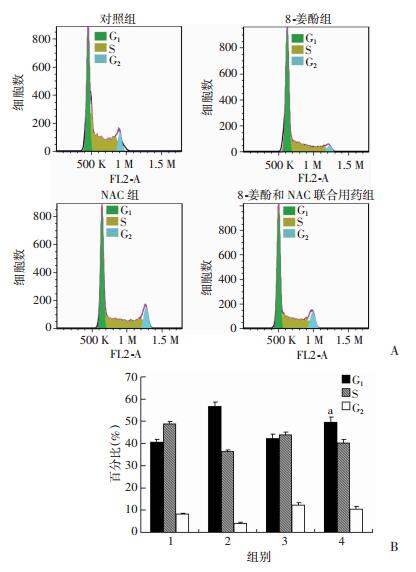
|
| A:流式检测8-姜酚与NAC联合用药24h后乳腺癌MDA-MB-231的细胞周期;B:各细胞周期比例统计;a:P < 0.05,与8-姜酚组比较 图 12 流式检测8-姜酚与NAC联合用药组的细胞周期 |
2.4.4 联用NAC对细胞活性的影响
用NAC抑制MDA-MB-231产生ROS后能够显著减弱8-姜酚对MDA-MB-231细胞增殖的抑制作用,说明8-姜酚抑制MDA-MB-231增殖的主要原因是其诱导乳腺癌细胞产生了ROS,差异有统计学意义(P < 0.01,图 13)。
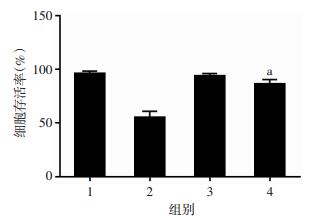
|
| 1:对照组,2:8-姜酚组,3:NAC组,4:8-姜酚与NAC联合用药组;a:P < 0.01,与8-姜酚组比较 图 13 抑制ROS后8-姜酚作用24h对MDA-MB-231细胞活性的影响 |
3 讨论
乳腺癌是威胁女性健康的主要恶性肿瘤之一,在乳腺癌治疗中,三阴性乳腺癌缺少有效的内分泌及靶向治疗手段,更容易发生转移[6]。由细胞周期调控紊乱所导致的失控性增殖和恶性转化是判断肿瘤是否恶性的基本生物学特征之一[7]。大多数的恶性肿瘤细胞都有由于周期调控机制的破坏所导致的细胞生长失控、分化受阻、凋亡异常等特征[8]。因此开发具有选择性保护正常组织并诱导肿瘤细胞分化和凋亡的新治疗方案将是今后抗肿瘤治疗的新策略之一[9]。目前选择性CDK4/6抑制剂已经被批准用于ER阳性/HER-2阴性晚期乳腺癌的治疗[10],可以直接调节细胞周期的蛋白CDKs、检查点激酶(checkpoint kinase,CHK)[11]、Aurora激酶[12]、Polo样激酶和WEE1激酶[13]是常见的周期药物作用靶点。目前细胞周期药物中ribociclib,abemaciclib,palbociclib已被批准临床应用,作用靶标为CDK4/6,其作用机制为阻滞细胞周期从G1期进入S期,激活抗肿瘤免疫,控制代谢功能和调节转录水平;prexasertib和TC-A2317 alisertib处于临床前研究阶段,其中prexasertib作用靶标为CHK,其作用机制为阻滞细胞周期[14],TC-A2317 alisertib作用靶标为Aurora激酶,其作用机制为控制细胞周期从G2期进入M期[15];volasertib进入了Ⅲ期临床,作用靶标为Polo样激酶,其作用机制为引起有丝分裂阻滞和细胞凋亡[16];AZD1775处于Ⅱ期临床试验阶段,作用靶标为WEE1激酶,其作用机制为控制细胞周期从G2期进入M期[17]。在细胞周期治疗的应用模式中,联合内分泌治疗为细胞周期治疗中最主要的应用模式。由于获批临床应用的CDK4/6抑制剂导致的不良反应可能治疗中断和缺乏相应的疗效生物标记物,且在治疗过程中很快产生耐受,为了克服在CDK4/6抑制剂的获得性耐药,寻找针对细胞周期的新调控靶标是细胞周期治疗的未来方向。
目前有关姜酚对乳腺癌治疗方面的研究较少,有文献报道:8-姜酚具有抑制卵巢癌、结肠癌、肺癌和前列腺癌细胞[18-21]增殖的活性,但是对8-姜酚用于乳腺癌治疗的分子机制研究却很少。本课题通过Western blot、流式细胞术等技术研究表明8-姜酚可引起MDA-MB-231细胞发生G1期阻滞从而抑制乳腺癌MDA-MB-231细胞的增殖,进一步深入研究发现,8-姜酚诱导了细胞产生ROS,并且通过抑制ROS可减弱8-姜酚抑制乳腺癌细胞增殖的作用,并在蛋白水平通过Western blot检测到周期和MAPK信号通路相关蛋白的变化,这些结果初步证实了8-姜酚首先是诱导乳腺癌细胞MDA-MB-231产生ROS,从而激活了MAPK信号通路的P38蛋白最终导致了细胞发生G1期阻滞,为乳腺癌周期联合内分泌治疗提供了新的靶标。
| [1] | BARRAGAN S, RUEDA C, FERNANDEZ M. Circular order aggregation and its application to cell-cycle genes expressions[J]. IEEE/ACM Trans Comput Biol Bioinform, 2017, 14(4): 819–829. DOI:10.1109/TCBB.2016.2565469 |
| [2] | FUZER A M, LEE S Y, MOTT J D, et al. [10]-gingerol reverts malignant phenotype of breast cancer cells in 3D culture[J]. J Cell Biochem, 2017, 118(9): 2693–2699. DOI:10.1002/jcb.25906 |
| [3] | GENG S, ZHENG Y, MENG M, et al. Gingerol reverses the cancer-promoting effect of capsaicin by increased TRPV1 level in a urethane-induced lung carcinogenic model[J]. J Agric Food Chem, 2016, 64(31): 6203–6211. DOI:10.1021/acs.jafc.6b02480 |
| [4] | LI B, ZHANG L, ZHANG Z Y, et al. Differentiation of noncalculous periampullary obstruction: comparison of CT with negative-contrast CT cholangiopancreatography versus MRI with MR cholangiopancreatography[J]. Eur Radiol, 2015, 25(2): 391–401. DOI:10.1007/s00330-014-3430-4 |
| [5] | TERVONEN H, FOLIAKI S, BRAY F, et al. Cancer epidemiology in the small nations of Pacific Islands[J]. Cancer Epidemiol, 2017, 50(Pt B): 184–192. DOI:10.1016/j.canep.2017.09.002 |
| [6] | JANSSON S, BENDAHL P O, GRABAU D A, et al. The three receptor tyrosine kinases c-KIT, VEGFR2 and PDGFRα, closely spaced at 4q12, show increased protein expression in triple-negative breast cancer[J]. PLoS ONE, 2014, 9(7): e102176. DOI:10.1371/journal.pone.0102176 |
| [7] | LIM S, KALDIS P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation[J]. Development, 2013, 140(15): 3079–3093. DOI:10.1242/dev.091744 |
| [8] | ANGTHONG W, JIARAKOOP K, TANGTIANG K. Differentiation of benign and malignant ampullary obstruction by multi-row detector CT[J]. Jpn J Radiol, 2018, 36(8): 477–488. DOI:10.1007/s11604-018-0746-z |
| [9] | LI J M, BROOKS G. Cell cycle regulatory molecules (cyclins, cyclin-dependent kinases and cyclin-dependent kinase inhibitors) and the cardiovascular system; potential targets for therapy?[J]. Eur Heart J, 1999, 20(6): 406–420. DOI:10.1053/euhj.1998.1308 |
| [10] | GARRIDO-CASTRO A C, GOEL S. CDK4/6 inhibition in breast cancer: mechanisms of response and treatment failure[J]. Curr Breast Cancer Rep, 2017, 9(1): 26–33. DOI:10.1007/s12609-017-0232-0 |
| [11] | ZHU S, BJORGE J D, CHENG H C, et al. Decreased CHK protein levels are associated with Src activation in colon cancer cells[J]. Oncogene, 2008, 27(14): 2027–2034. DOI:10.1038/sj.onc.1210838 |
| [12] | MIN Y H, KIM W, KIM J E. The Aurora kinase A inhibitor TC-A2317 disrupts mitotic progression and inhibits cancer cell proliferation[J]. Oncotarget, 2016, 7(51): 84718–84735. DOI:10.18632/oncotarget.12448 |
| [13] | TANAKA N, PATEL A A, WANG J, et al. Wee-1 kinase inhibition sensitizes high-risk HPV+HNSCC to apoptosis accompanied by downregulation of MCl-1 and XIAP antiapoptotic proteins[J]. Clin Cancer Res, 2015, 21(21): 4831–4844. DOI:10.1158/1078-0432.CCR-15-0279 |
| [14] | BRILL E, YOKOYAMA T, NAIR J, et al. Prexasertib, a cell cycle checkpoint kinases 1 and 2 inhibitor, increases in vitro toxicity of PARP inhibition by preventing Rad51 foci formation in BRCA wild type high-grade serous ovarian cancer[J]. Oncotarget, 2017, 8(67): 111026–111040. DOI:10.18632/oncotarget.22195 |
| [15] | MAETENS M, BROWN D, IRRTHUM A, et al. The AURORA pilot study for molecular screening of patients with advanced breast cancer-a study of the breast international group[J]. NPJ Breast Cancer, 2017, 3: 23. DOI:10.1038/s41523-017-0026-6 |
| [16] | VAN DEN BOSSCHE J, LARDON F, DESCHOOLMEESTER V, et al. Spotlight on volasertib: preclinical and clinical evaluation of a promising Plk1 inhibitor[J]. Med Res Rev, 2016, 36(4): 749–786. DOI:10.1002/med.21392 |
| [17] | LEIJEN S, VAN GEEL R M, SONKE G S, et al. Phase Ⅱ study of WEE1 inhibitor AZD1775 plus carboplatin in patients with TP53-mutated ovarian cancer refractory or resistant to first-line therapy within 3 months[J]. J Clin Oncol, 2016, 34(36): 4354–4361. DOI:10.1200/JCO.2016.67.5942 |
| [18] |
丁贤彬, 吕晓燕, 毛德强, 等. 2006-2014年重庆市肿瘤登记地区卵巢癌发病率及趋势变化[J].
中华预防医学杂志, 2016, 50(3): 274–276.
DING X B, LYU X Y, MAO D Q, et al. Incidence and trend change of oophoroma in 11 tumor registration stations, Chongqing[J]. Chin J Prevent Med, 2016, 50(3): 274–276. DOI:10.3760/cma.j.issn.0253-9624.2016.03.017 |
| [19] | ZHU Y, WANG F, ZHAO Y, et al. Gastroprotective [6]-gingerol aspirinate as a novel chemopreventive prodrug of aspirin for colon cancer[J]. Sci Rep, 2017, 7(1): 40119. DOI:10.1038/srep40119 |
| [20] | PYENSON B S, TOMICKI S M. Lung cancer screening: a cost-effective public health imperative[J]. Am J Public Health, 2018, 108(10): 1292–1293. DOI:10.2105/AJPH.2018.304659 |
| [21] | PRENDEVILLE S, Al-BOZOM I, COMPÉRAT E, et al. Prostate carcinoma with amphicrine features: further refining the spectrum of neuroendocrine differentiation in tumours of primary prostatic origin?[J]. Histopathology, 2017, 71(6): 926–933. DOI:10.1111/his.13330 |



