2. 401122 重庆,重庆医科大学附属儿童医院呼吸中心
2. Department of Respiratory Medicine, Children's Hospital of Chongqing Medical University, Chongqing, 401122, China
人鼻病毒(human rhinovirus, HRV)是引起普通感冒最常见的病原,也是导致婴幼儿感染住院的主要原因[1]。同时HRV与儿童哮喘的发作密切相关[2]。流行病学调查显示90%在3岁时因HRV感染引起喘息的患儿在6岁时被诊断为支气管哮喘;另一方面,学龄期儿童哮喘急性发作时HRV检出率约60%~70%,HRV感染是哮喘日常症状存在的危险因素。哮喘患儿感染HRV时,其呼吸道症状更严重且持续时间更长[3]。
哮喘是多基因遗传疾病,最新研究表明人类钙黏蛋白相关家族成员3(CDHR3)基因与哮喘相关。CDHR3的单核苷酸多态性(SNP)rs6967330上有2个等位基因G和A,呈现TGT和TAT密码子,A等位基因是儿童早期哮喘加重的易感基因位点之一[1]。日本的1项研究也表明,rs6967330 A与日本人群中早发性成人哮喘相关[4]。
HRV是诱导儿童哮喘发作最常见的病毒,分为A、B、C三种亚型,其中RVC引起的哮喘发作病情更重[3]。A、B亚型的HRV多使用细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)作为其细胞受体,少数RVA分离株倾向于低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)家族成员。RVC的受体一直不清楚,近年来,CDHR3被认为是RVC的受体。其rs6967330 A能够增强RVC在宿主细胞中的结合和复制,并增加体外子代产量[5],也有研究表明呼吸道感染儿童中HRV病毒载量与病情的严重程度密切相关,那么CDHR3基因多态性是否与儿童HRV感染及感染后病情相关?目前尚少有报道CDHR3基因单核苷酸基因多态性与HRV所致下呼吸道感染的关系。
为此,本研究对2012年1月至2014年11月因HRV所致下呼吸道感染在重庆医科大学附属儿童医院住院的患儿进行CDHR3基因多态性检测和病毒载量的检测,并与其临床特征的相关性进行分析。
1 资料与方法 1.1 研究对象纳入标准:2012年1月至2014年11月在重庆医科大学附属儿童医院呼吸中心因HRV所致下呼吸道感染住院的5岁以下儿童。排除标准:排除有免疫缺陷或自身免疫性疾病、呼吸道结构异常、先天性心脏病、哮喘、肺纤维化等疾病的患儿。本研究获得患儿家长的知情同意及医院伦理委员会同意。
1.2 标本采集与处理使用一次性无菌可控式吸痰管采集患儿入院当天鼻咽分泌物(nasopharyngeal aspirates,NPAs),标本采集均由呼吸专科护士进行。采集后4 ℃保存运输至儿科研究所呼吸实验室。加入3 mL病毒保护液充分震荡混匀,于超净工作台分装3管后保存在-80 ℃冰箱待用。
1.3 核酸的提取使用QIAmpMiniElute Virus Spin试剂盒(Qiagen试剂盒,货号:57704),严格按照说明书进行核酸的提取[3]。提取的核酸用试剂盒SuperScriptTM Ⅲ Reverse Transcriptase System(Invitrogen试剂盒,货号:18080-044)进行逆转录,逆转录过程按照说明书进行[3]。
1.4 呼吸道病毒的检测采用实时荧光PCR(Q-PCR)的方法检测博卡病毒(HBoV)和腺病毒(ADV)[6-7]。多重巢式PCR方法用以检测呼吸道合胞病毒(RSV)、副流感病毒(PIV)、流感病毒(Ⅳ)、偏肺病毒(HMPV)、冠状病毒(HCoV)。普通PCR方法检测人鼻病毒(HRV)[8-9]。PCR产物用1.5%琼脂糖凝胶进行电泳,凝胶成像系统观测目的条带。其中Ⅳ、HRV阳性的产物送华大基因测序,测序结果进行Blast用以区分亚型。
1.5 HRV病毒载量检测采用实时荧光PCR的方法,使用HRV通用引物进行HRV病毒载量的检测。引物序列如下:RVA上游5′-GACAGTGTTCYAGCCTGCG-3′;RVB上游5′-RACHGTGTCYYAGCCTGCG-3′;HRV下游5′-GAAACACGGACACCCAAAGTA-3′;HRV探针FAM-TCCTCCGGCCCCTGAATGYGGC-BHQ1。PCR反应试剂为TaKaRa OneStep PCR试剂盒,反应条件:逆转录42 ℃ 2 min,95 ℃激活15 min,95 ℃变性30 s,60 ℃退火1 min,共40个循环[10]。
1.6 CDHR3基因多态性检测采用单轮PCR的方法,用CDHR3的引物对该基因进行扩增,产物送华大测序。上游引物:5′-ATTCCTCCAGCCAGAACCC-3′,下游引物:5′-TGTTTCTCACCACATCCGCAG-3′,目的片段长度为370 bp[11]。反应条件:95 ℃ 5 min,95 ℃ 15 s,62 ℃ 15 s,72 ℃ 60 s,72 ℃ 7 min,共40个循环。测序结果用MEGA5.0进行比对分型。
1.7 临床资料的收集根据病例资料用epidata收集以下临床资料,姓名、性别、年龄、住院时间、主要症状、实验室检查、影像学检查、临床诊断等。
重症呼吸道疾病诊断标准:患儿诊断为呼吸衰竭或需要转入ICU进行治疗。呼吸衰竭的诊断标准为:血气分析显示H+异常,O2分压降低,CO2分压升高,氧饱和度小于90%,需要给氧治疗[12]。
1.8 统计学分析应用SPSS 22.0进行统计学分析,符合正态分布的定量资料采用x±s表示,不符合正态分布的定量资料采用中位数(范围)表示,计数资料用例数(百分比)表示。计量资料用t检验或秩和检验,计数资料用卡方检验或Fisher精确检验。检验水准:α=0.05。
2 结果 2.1 研究对象人口学特征及HRV分型共纳入1 628例5岁以下患儿NPAs进行了呼吸道相关病毒检测,其人口学特点及病毒检出情况见表 1。其中HRV阳性的标本383份(23.5%),排除84例基础疾病的患儿,CDHR3基因多态性扩增成功200份,以上200例均进行了HRV病毒载量测定,最终纳入200例因HRV所致下呼吸道感染的患儿,详见图 1。所有患儿均为重庆及周边地区的儿童。在以上200例患儿中,男性143例,女性57例,中位年龄8(1~ 60)个月。其中≤6个月87例,7~12个月56例,13~24岁35例,25~60个月22例;RVA 132例,RVB 16例,RVC 49例,RV未分型3例,详见表 1。
| 组别 | 性别 | 年龄 | 诊断 | ||||||||
| 男 | 女 | ≤6个月 | 7~12个月 | 13~24个月 | 25~60个月 | 肺炎 | 毛细支气管炎 | 支气管炎 | |||
| 呼吸道感染住院儿童 | 1091(67.0) | 637(33.0) | 678(41.6) | 417(25.6) | 282(17.3) | 251(15.4) | 1334(81.9) | 182(11.2) | 63(3.9) | ||
| 纳入患儿 | 143(71.5) | 57(28.5) | 87(43.5) | 56(28.0) | 35(17.5) | 22(11.0) | 168(84.0) | 25(12.5) | 7(3.5) | ||
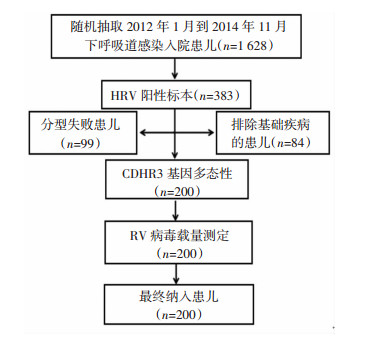
|
| 图 1 纳入研究病例筛查流程 |
2.2 CDHR3 rs6967330位点基因型结果及其HRV亚型
在CDHR3基因rs6967330位点成功分型的200例患儿中,AA/AG基因型30例,GG基因型170例,基因型符合Hardy-Weinberg平衡定律(P > 0.05)。其中,AA/AG基因型检出RVA 18例,RVB 2例,RVC 9例,GG基因型检出RVA 114例,RVB 14例,RVC 40例,病毒分布差异无统计学意义,见表 2。
| 组别 | AA/AG | GG |
| RVA | 18(60.0) | 114(67.1) |
| RVB | 2(6.7) | 14(8.2) |
| RVC | 9(30.0) | 40(23.5) |
| RV未分型 | 1(3.3) | 2(1.2) |
2.3 CDHR3 rs6967330位点基因型与RV感染临床特征分析
HRV感染患儿中,CDHR3 rs6967330位点AA/AG基因型与GG基因型临床特征比较,AA/AG基因型患儿更容易出现喘息症状(86.7% vs 57.1%,OR=4.892,P=0.002),而且更易致重症肺炎(30.0% vs 11.2%,OR=3.406,P=0.018),一级亲属也更多具有特应性疾病病史(16.7% vs 5.88%,P=0.039)。年龄、性别、住院时间、个人史、相关实验室检查等差异均无统计学意义(表 3)。对纳入患儿进行Logistic回归分析结果显示,除呼吸困难(OR: 26.149,95% CI: 8.529~80.165,P < 0.001)外,rs6967330 A(OR: 3.379,95% CI: 1.009~11.315,P=0.048)是HRV感染患儿发展为重症病例的危险因素。同时,Logistic回归分析结果显示rs6967330 A(OR: 4.585,95% CI: 1.446~14.541,P=0.010)也是HRV感染患儿喘息的危险因素。
| 临床特征 | 人鼻病毒感染(n=200) | ||
| AA/AG(n=30) | GG(n=170) | P值 | |
| 一般情况 | |||
| 年龄(中位数,月) | 8.5(1~60) | 8(1~58) | 0.840 |
| 男:女 | 24:6 | 119:51 | 0.263 |
| 住院时间(中位数,d) | 7(1~19) | 6(1~19) | 0.520 |
| 个人史 | |||
| 湿疹史 | 4(13.3%) | 35(20.6%) | 0.355 |
| 吼喘史 | 10(33.3%) | 43(25.3%) | 0.368 |
| 家族史a | 5(16.7%) | 10(5.88%) | 0.039 |
| 症状及体征 | |||
| 喘息 | 26(86.7%) | 97(57.1%) | 0.002 |
| 发热(>38 ℃) | 5(16.7%) | 51(30.0%) | 0.134 |
| 呼吸困难 | 10(33.3%) | 37(21.8%) | 0.168 |
| 实验室检查 | |||
| 白细胞计数 (×109/L) |
11.52(2.73~24.22) | 11.85(3.01~34.31) | 0.811 |
| 中性粒细胞(%) | 32(18~78) | 38(8~91) | 0.931 |
| 血小板计数 (×109/L) |
472.73±165.66 | 456.99±163.21 | 0.633 |
| C反应蛋白>8 mg/L | 1(3.3%) | 20(11.8%) | 0.212 |
| 细菌 | 15(50.0%) | 61(35.9%) | 0.142 |
| RVC | 9(30.0%) | 40(23.5%) | 0.491 |
| 病毒载量 (中位数,copies/mL) |
5.6×104 | 2.6×104 | 0.912 |
| 诊断 | |||
| 肺炎(非重症) | 20(66.7%) | 145(85.3%) | 0.013 |
| 支气管炎 | 1(3.3%) | 6(3.5%) | 1 |
| 重症肺炎 | 9(30.0%) | 19(11.2%) | 0.018 |
| a:家族史指一级亲属有过敏性鼻炎、哮喘等特应性疾病病史 | |||
3 讨论
CDHR3是钙黏蛋白相关家族成员,经典的钙粘蛋白是多功能的Ca2+依赖性细胞黏附蛋白,其主要功能是通过同源连接将细胞表面连接在一起。CDHR3基因定位于染色体7q22,是最新确定的支气管哮喘致病基因[5]。全基因组关联分析(GWAS)也将CDHR3的rs6967330位点鉴定为早期儿童哮喘严重恶化的易感基因位点[13]。
CDHR3在单核苷酸多态性rs6967330上具有不同等位基因G和A,导致编码的氨基酸由半胱氨酸(Cys)转变为络氨酸(Tyr)。日本的1项研究表明CDHR3的rs6967330 A与日本人群中的早发性成人哮喘有相关性[4]。美国的研究表明CDHR3基因多态性与慢性鼻窦炎有相关性[11]。最近的研究表明,体外培养哮喘患者的上皮细胞显示CDHR3 mRNA表达低于非哮喘患者,在感染RV A16时CDHR3的mRNA表达进一步降低,其降低与病毒感染高度相关(Pearson相关P值= 1.6e-04和q值= 2.944e-03)[14]。也有研究表明AA/AG基因型哮喘患儿外周血白细胞CDHR3的mRNA表达较GG基因型有减少的趋势[15]。故研究人员推测CDHR3表达的减少可能导致气道上皮层完整性受损,通透性增加,从而更易发生喘息。也有研究证明CDHR3基因多态性与RSV阳性的毛细支气管炎无关,而与RSV阴性的毛细支气管炎有相关性[16],而HRV是除RSV外最常见的毛细支气管炎病原体。本研究发现,CDHR3基因单核苷酸多态性位点rs6967330与HRV感染患儿是否喘息有显著相关性。与GG基因型患儿相比,AA/AG基因型患儿感染HRV后更容易出现喘息的症状,一级亲属也更多具有特应性疾病病史。
HRV常常引起婴幼儿呼吸道感染住院,也是重症哮喘发作、鼻窦炎的常见病原体。HRV引起的重症呼吸道感染可能与患儿的年龄、免疫状况、病毒载量、病毒亚型等多种因素有关[10]。有研究表明RVC更容易引起重症下呼吸道感染[17-18]。也有研究表明,HRV载量越高,呼吸道感染越重[19]。我们的前期研究发现,哮喘发作住院患儿RVA高载量时病情重,且高于RVC,而RVC载量和哮喘发作严重度无明显相关[3]。最近的研究认为CDHR3作为RVC的受体,其Tyr529变体可导致RVC与宿主细胞的结合和复制的增加,但在喘息急性发作时HRV种类和CDHR3表达水平之间没有关系[15]。本研究中AA/AG基因型患儿HRV感染后更容易发展为重症肺炎,这可能是因为CDHR3 Tyr529变体的mRNA表达相对较少,气道上皮屏障缺陷,从而感染HRV后更容易发展为重症病例。
本研究为单中心小样本的研究,单一HRV感染患儿较少,且无随访研究,导致本研究有一定局限性,因此CDHR3基因单核苷酸多态性和HRV所致下呼吸道感染的关系仍需进一步的研究。
综上所述,CDHR3基因单核苷酸多态性位点rs6967330可能与HRV感染后的重症及喘息相关。哮喘的防治策略中,早期预防至关重要。本研究结果提示需进一步研究明确是否能将CDHR3基因rs6967330位点作为生物学指标之一,对AA/AG型HRV感染患儿重点观察预防其喘息症状的产生,从而促进儿童健康成长。
| [1] | PALMENBERG A C. Rhinovirus C, asthma, and cell surface expression of virus receptor CDHR3[J]. J Virol, 2017, 91(7): e00072–C00017. DOI:10.1128/JVI.00072-17 |
| [2] | JACOBS S E, LAMSON D M, ST GEORGE K, et al. Human rhinoviruses[J]. Clin Microbiol Rev, 2013, 26(1): 135–162. DOI:10.1128/CMR.00077-12 |
| [3] |
郑首燕.支气管哮喘急性发作患儿鼻病毒检出率及其分子流行病学研究[D].重庆: 重庆医科大学, 2016.
ZHENG S Y. Detection rate of rhinovirus in children with acute asthma attack and its molecular epidemiology[D]. Chongqing: Chongqing Medical University, 2016. |
| [4] | KANAZAW A J, MASUKO H, YATAGAI Y, et al. Genetic association of the functional CDHR3 genotype with early-onset adult asthma in Japanese populations[J]. Allergol Int, 2017, 66(4): 563–567. DOI:10.1016/j.alit.2017.02.012 |
| [5] | BOCHKOV Y A, WATTERS K, ASHRAF S, et al. Cadherin-related family member 3, a childhood asthma susceptibility gene product, mediates rhinovirus C binding and replication[J]. Proc Natl Acad Sci USA, 2015, 112(17): 5485–5490. DOI:10.1073/pnas.1421178112 |
| [6] | HEIM A, EBNET C, HARSTE G, et al. Rapid and quantitative detection of human adenovirus DNA by real-time PCR[J]. J Med Virol, 2003, 70(2): 228–239. DOI:10.1002/jmv.10382 |
| [7] | ALLANDER T, JARTTI T, GUPTA S, et al. Human bocavirus and acute wheezing in children[J]. Clin Infect Dis, 2007, 44(7): 904–910. DOI:10.1086/512196 |
| [8] | COIRAS M T, AGUILAR J C, GARC A M L, et al. Simultaneous detection of fourteen respiratory viruses in clinical specimens by two multiplex reverse transcription nested-PCR assays[J]. J Med Virol, 2004, 72(3): 484–495. DOI:10.1002/jmv.20008 |
| [9] | COIRAS M T, P REZ-BRE A P, GARC A M L, et al. Simultaneous detection of influenza A, B, and C viruses, respiratory syncytial virus, and adenoviruses in clinical samples by multiplex reverse transcription nested-PCR assay[J]. J Med Virol, 2003, 69(1): 132–144. DOI:10.1002/jmv.10255 |
| [10] |
肖秋艳.重庆地区人鼻病毒和肠道病毒D68在呼吸道感染住院患儿中的分子流行病学研究[D].重庆: 重庆医科大学, 2015.
XIAO Q Y. Epidemiological analysis of human rhinovirus and enterovirus in hospitalized children with respiratory infections in Chongqing[D]. Chongqing: Chongqing Medical University, 2015. |
| [11] | CHANG E H, WILLIS A L, MCCRARY H C, et al. Association between the CDHR3 rs6967330 risk allele and chronic rhinosinusitis[J]. J Allergy Clin Immunol, 2017, 139(6): 1990–1992. DOI:10.1016/j.jaci.2016.10.027 |
| [12] | ZHAO B, YU X, WANG C, et al. High human bocavirus viral load is associated with disease severity in children under five years of age[J]. PLoS ONE, 2013, 8(4): e62318. DOI:10.1371/journal.pone.0062318 |
| [13] | B NNELYKKE K, SLEIMAN P, NIELSEN K, et al. A genome-wide association study identifies CDHR3 as a susceptibility locus for early childhood asthma with severe exacerbations[J]. Nat Genet, 2014, 46(1): 51–55. DOI:10.1038/ng.2830 |
| [14] | BAI J, SMOCK S L, JACKSON G R Jr, et al. Phenotypic responses of differentiated asthmatic human airway epithelial cultures to rhinovirus[J]. PLoS ONE, 2015, 10(2): e0118286. DOI:10.1371/journal.pone.0118286 |
| [15] | STENBERG HAMMAR K, NIESPODZIANA K, VAN HAGE M, et al. Reduced CDHR3 expression in children wheezing with rhinovirus[J]. Pediatr Allergy Immunol, 2018, 29(2): 200–206. DOI:10.1111/pai.12858 |
| [16] | HUSBY A, PASANEN A, WAAGE J, et al. CDHR3 gene variation and childhood bronchiolitis[J]. J Allergy Clin Immunol, 2017, 140(5): 1469–1471. DOI:10.1016/j.jaci.2017.06.044 |
| [17] | LAUINGER I L, BIBLE J M, HALLIGAN E P, et al. Patient characteristics and severity of human rhinovirus infections in children[J]. J Clin Virol, 2013, 58(1): 216–220. DOI:10.1016/j.jcv.2013.06.042 |
| [18] | LINDER J E, KRAFT D C, MOHAMED Y, et al. Human rhinovirus C: age, season, and lower respiratory illness over the past 3 decades[J]. J Allergy Clin Immunol, 2013, 131(1): 69–77. DOI:10.1016/j.jaci.2012.09.033 |
| [19] | ESPOSITO S, DALENO C, SCALA A, et al. Impact of rhinovirus nasopharyngeal viral load and viremia on severity of respiratory infections in children[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(1): 41–48. DOI:10.1007/s10096-013-1926-5 |



