2. 610083 成都,西部战区总医院:信息科;
3. 610083 成都,西部战区总医院:检验科
2. Department of Information, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China;
3. Department of Clinical Laboratory, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China
空肠弯曲菌(Campylobacter jejuni, C.jejuni)是一种重要的食源性人畜共患病病原菌,常通过污染食物造成暴发性流行[1]。C.jejuni可引起腹泻型肠炎、胆囊炎、脑膜炎、脓毒血症等,甚至出现Miller-Fischer和Guillain-Barré综合征导致患者死亡[2-3]。随着C.jejuni对红霉素、四环素及喹诺酮类药物的耐药性不断增强[4],其感染率在世界各地普遍呈上升趋势[5-7]。因此,深入研究C.jejuni的防治措施具有重要意义,而通过接种疫苗预防C.jejuni感染是目前最有效、最科学、最经济的手段。C.jejuni的致病机制主要包括侵袭、黏附、定植及产生毒素,C.jejuni黏附蛋白PEB1在这一过程中发挥重要作用,并和机体细胞免疫密切相关[8-9]。研究表明PEB1是一种有效的保护性抗原,且在不同的血清型C.jejuni中均有表达[10-11]。因此本研究拟研究候选抗原PEB1,采用合成重叠肽技术、ELISA分析方法,系统筛选PEB1抗原中包含的B细胞应答的免疫优势表位,并对其保护效果进行初步评价,旨在为C.jejuni多价表位疫苗的研发提供候选表位。
1 材料与方法 1.1 实验动物及分组8周龄SPF级雄性BALB/c小鼠60只,体质量(23±2)g,由北京华阜康生物科技公司提供。B细胞缺失(immunoglobulin heavy chain deleted Jh)小鼠购买于Taconic Farms Inc。BALB/c小鼠在成都军区总医院实验动物中心SPF级动物房饲养,温度20~25 ℃,12 h/12 h昼夜规律,2周后分笼,自由进食饮水,每日早晚添加饲料、换水。用随机数字表法将小鼠分为CFA/IFA组、PEB1免疫优势表位组(PEB155-72aa-KLH+CFA/IFA、PEB197-114aa-KLH+CFA/IFA、PEB1211-228aa-KLH+CFA/IFA)以及重组PEB1+ CFA/IFA组,每组5只。本研究2017年8月获得成都军区总医院实验动物伦理委员会批准。
1.2 实验试剂分别有:C.jejuni菌株C.jejuni 11168国家标准菌种库NCTC;C.jejuni 11168培养所需哥伦比亚血琼脂平板购于重庆庞通生物公司;总RNA提取试剂TRIzol、逆转录试剂盒、实时荧光定量聚合酶链反应(qRT-PCR)试剂盒均购自大连TaKaRa公司;HRP标记山羊抗小鼠IgG(H+L)抗体购于北京中杉生物科技有限公司;可溶性单组分TMB底物溶液购于北京天根生物公司。
1.3 肽段的合成与偶联PEB1(GenBank: NC_002163)由260个氨基酸组成。合成肽段的策略为步移重叠法,即每次步移6个氨基酸,重叠12个氨基酸,每个肽段的长度为18个氨基酸。所需18肽由上海吉尔生化公司合成,并由上述公司完成初步筛选出的免疫优势肽段偶联KLH。
1.4 动物的免疫PEB1+CFA/IFA组用PBS稀释PEB1蛋白抗原,加入CFA/IFA佐剂(初次免疫采用CFA, 第2、3次免疫采用IFA),调整重组蛋白PEB1终浓度为0.2 mg/mL;用DMSO稀释偶联肽段用于PEB1免疫优势表位组,CFA/IFA佐剂加入,调整肽段终浓度为0.4 mg/mL;阴性对照组CFA/IFA组采用CFA/IFA和PBS混合。免疫途径为双后肢肌肉注射。免疫剂量为每只BALB/c小鼠注射量100 μL。各组小鼠在首次免疫后的第7、21天,加强免疫,共计免疫3次。
1.5 抗体检测末次免疫后的第7天,小鼠尾静脉取血后分离血清,用ELISA法检测IgG抗体的应答水平。分别使用合成的重叠肽段(KLH偶联)、PEB1重组蛋白、BSA包被酶标板,血清中抗体应答水平以HRP标记的羊抗鼠IgG抗体作为二抗进行检测。以光密度值和滴度作为抗体应答水平的评价指标。ELISA滴度以最后稀释度表示,A样品∕A阴性值≥2.1为阳性作为结果判断标准。
1.6 动物感染和空肠组织C.jejuni的定植检测在每组BALB/c小鼠末次免疫后的第7天,每组6只BALB/c小鼠经过断食、断水5 h后,灌喂C.jejuni菌液,每只0.3 mL(菌液浓度为1.0×109 CFU/mL),连续3 d,每天1次,灌喂1 h后进食水。并在末次感染后的28 d,处死小鼠,取出空肠组织,称重后匀浆,将匀浆液吸离心收集沉淀,按照细菌基因组试剂盒说明书抽提细菌基因组。采用实时荧光定量PCR检测C.jejuni 16S rDNA含量以计算C.jejuni在各组小鼠空肠组织中的定植量[12]。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)检测TNF-α表达按照RNA逆转录试剂盒的说明书加入如下试剂: 4 μL缓冲液、RNA含量2 μg、1.0 μL Enzyme Mix、4 μL Random 6 mers和1.0μL Oligo dT Primer。反应条件为37 ℃,15 min/s;85 ℃条件灭活15 s。根据定量PCR试剂盒说明加入:SYBgreen mix、逆转录后的cDNA、TNF-α正向引物、TNF-α反向引物。qRT-PCR反应条件为:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火20 s,共行40次循环;结果根据得到的Ct数值,采用2-ΔΔCt方法对TNF-α的表达进行定量分析。
1.8 抗体介导的调理吞噬作用复苏培养HL-60细胞,细胞密度调至1.0×106/mL。补体制作:分离新生兔血的血清,与C.jejuni 11168共孵育30 min(4 ℃),后离心并过滤。将C.jejuni 11168的菌量调整为1.0×104CFU/mL, 按1 :1 :1 :1等体积的100 μL的HL-60细胞、C.jejuni 11168、补体,血清抗体在37 ℃条件下,共孵育90 min,涂布在固体培养基上,培养48 h,置于37 ℃,做菌落计数,计算调理吞噬比例。
1.9 统计学分析采用SPSS 16.0统计软件分析数据,各组间利用单因素方差分析进行统计学分析。检验水准:α=0.05。
2 结果 2.1 免疫PEB1重组蛋白对小鼠感染C.jejuni后的空肠定植量的影响及抗体滴度检测C.jejuni感染后空肠定植量结果显示:PEB1+CFA/IFA组,CFA/IFA组和PBS组的定植量分别为log (6.08±0.31),log (6.20±0.21),log (4.76±0.16),与CFA/IFA对照组相比较,实验组PEB1+CFA/IFA显著降低了小鼠感染后C.jejuni的定植量(P=0.005 2)。为分析PEB1特异性抗体的滴度,采用ELISA方法检测了各组小鼠末次免疫后血清中抗PEB1抗体的应答水平。ELISA结果如图 1所示,PEB1+CFA/IFA产生的平均抗体滴度达到了1︰8 000, 显著高于CFA/IFA组和PBS组(P < 0.01)。该结果表明PEB1+CFA/IFA免疫后产生了较高效价针对PEB1的特应性的体液免疫应答。
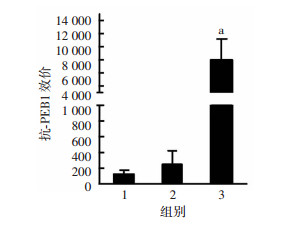
|
| 1: PBS组;2:CFA/IFA组;3:PEB1+ CFA/IFA组;a:P < 0.05,与CFA/IFA组比较 图 1 ELISA方法检测各组小鼠免疫后血清中抗PEB1抗体的应答水平 |
2.2 B细胞免疫优势表位筛选及鉴定
我们收集了PEB1免疫BALB/c小鼠后的抗血清以期鉴定PEB1的免疫优势肽段。采用42条步移合成重叠18mer肽(KLH偶联),BSA、重组蛋白包被ELISA微孔板,并用ELISA检测PEB1免疫后的抗血清。如图 2A所示,PEB155-72aa(DQATGEIKGFEVDVAKLL),PEB197-114aa(LDNGSVDAVIATFTITPE), PEB1211-228aa (DKSEILPDSFEPQSYGIV),与对照组BSA相比较,均能与抗血清产生强烈IgG抗体反应,差异具有统计学意义(P < 0.01)。为进一步确定重组PEB1蛋白与抗免疫优势肽血清的反应,收集优势肽偶联KLH免疫后的抗血清。采用重组PEB1蛋白包被ELISA微孔板,KLH偶联优势肽免疫后的抗血清进行ELISA检测。如图 2B所示,与正常血清相比较,抗PEB155-72aa, 抗PEB197-114aa和抗PEB1211-228aa血清均能与重组蛋白PEB1产生较强的抗原抗体反应,差异具有统计学意义(P < 0.05)。因此这些结果表明,18肽PEB155-72aa,PEB197-114aa和PEB1211-228aa包含线性的B细胞免疫优势表位。
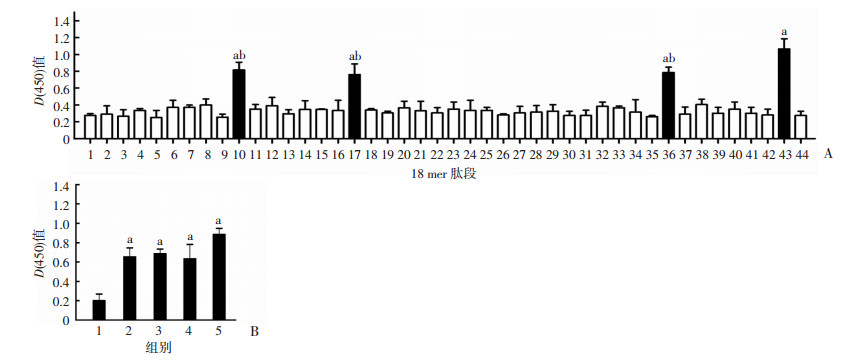
|
| A: ELISA筛选PEB1重叠18 mer肽中的免疫优势肽段 1:1-18aa;2:7-24aa;3:13-30aa;4:19-36aa;5:25-42aa;6:31-48aa;7:37-54aa;8:43-60aa;9:49-66aa;10:55-72aa;11:61-78aa;12:67-84aa;13:73-90aa;14:79-96aa;15:85-102aa;16:91-108aa;17:97-114aa;18:103-120aa;19:109-126aa;20:115-132aa;21:121-138aa;22:127-142aa;23:133-150aa;24:139-156aa;25:145-162aa;26:151-168aa;27:157-174aa;28:163-180aa;29:169-186aa;30:175-192aa;31:181-198aa;32:187-204aa;33:193-210aa;34:199-216aa;35:205-222aa;36:211-228aa;37:217-234aa;38:223-240aa;39:229-246aa;40:235-252aa;41:241-258aa;42:247-260aa;43:PEB1;44:BSA;a:P < 0.05,与BSA比较;b:P < 0.05,与PEB1比较;B: KLH偶联优势肽免疫后的抗血清效价检测 1:Control组;2:Anti-PEB155-72aa组;3:Anti-PEB197-114aa组:4:Anti-PEB1211-228aa组;5:Anti-PEB1组;a:P < 0.05,与Control组比较 图 2 筛选鉴定PEB1的B细胞优势表位 |
2.3 PEB1免疫优势表位发挥抗C.jejuni感染的免疫保护作用
C.jejuni感染后空肠定植量结果显示:PEB155-72aa-KLH+CFA/IFA组,PEB197-114aa-KLH+CFA/IFA组,PEB1211-228aa-KLH+CFA/IFA组和PEB1+ CFA/IFA组的空肠定植量分别为log (4.88±0.24),log (4.80±0.20),log (5.06±0.19)和log (4.62±0.16),与CFA/IFA对照组相比较,均显著降低了小鼠感染C.jejuni后的定植量(P < 0.01)。同时通过qRT-PCR法检测感染后各组空肠组织中炎性因子TNF-α的表达水平,结果如图 3所示,与CFA/IFA对照组相比较,PEB155-72aa-KLH+CFA/IFA组,PEB197-114aa-KLH+CFA/IFA组,PEB1211-228aa-KLH+CFA/IFA组和PEB1+ CFA/IFA组,在感染后的第28天,空肠组织中炎性因子TNF-α表达水平均显著降低(P < 0.01)。以上结果表明PEB1免疫优势表位能够降低C.jejuni在空肠组织中的定植并降低炎性因子TNF-α的表达,能够有效发挥抗C.jejuni感染的免疫保护作用。
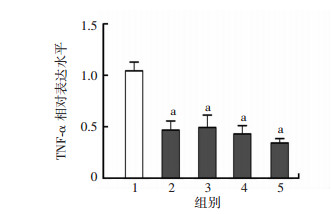
|
| 1:CFA/IFA组;2:PEB155-72aa-KLH+CFA/IFA组;3:PEB197-114aa-KLH+CFA/IFA组;4:PEB1211-228aa-KLH+CFA/IFA组;5:PEB1+CFA/IFA组;a:P < 0.05,与CFA/IFA组比较 图 3 qRT-PCR检测免疫优势表位肽各组小鼠在感染C.jejuni后TNF-α的相对表达水平 |
2.4 PEB1免疫优势表位介导的调理吞噬作用
如何证实PEB1免疫优势表位免疫后的血清,产生抗体能够介导中性粒细胞进行调理吞噬作用,可能增强对C.jejuni的杀伤作用,我们比较了PEB155-72aa-KLH+CFA/IFA组,PEB197-114aa-KLH+CFA/IFA组,PEB1211-228aa-KLH+CFA/IFA组和PEB1+CFA/IFA组与CFA/IFA组小鼠的分离血清,检测HL-60细胞在补体存在的条件下调理吞噬杀伤和对C.jejuni的杀伤比率,结果如图 4所示,与CFA/IFA组相比,免疫PEB155-72aa,PEB197-114aa, PEB1211-228aa的血清中的抗体能够明显增强在抗体介导下的HL-60细胞的调理吞噬作用(P < 0.01),HL-60细胞对C.jejuni的杀伤作用增强。

|
| 1: CFA/IFA组;2:PEB155-72aa-KLH+CFA/IFA组;3:PEB197-114aa-KLH+CFA/IFA组;4:PEB1211-228aa-KLH+CFA/IFA组;5:PEB1+CFA/IFA组;a:P < 0.05,与CFA/IFA组比较 图 4 免疫优势表位产生的抗体介导的调理吞噬作用 |
2.5 PEB1免疫优势表位介导的免疫保护依赖B细胞
为了进一步确证重叠肽技术筛选的免疫优势表位是依赖于B细胞产生的抗体介导的免疫保护作用。采用PEB155-72aa,PEB197-114aa, PEB1211-228aa分别免疫了WT(野生型)小鼠和B cell Knock out(B细胞缺失)小鼠。免疫后感染保护实验结果显示:CFA/IFA组中,免疫B细胞缺失小鼠攻毒后,C.jejuni在空肠组织中的定植量与免疫WT(野生型)小鼠相比,定植量差异无统计学意义(图 5)。PEB155-72aa-KLH+CFA/IFA组,PEB197-114aa-KLH+CFA/IFA组,PEB1211-228aa-KLH+CFA/IFA组中,免疫B细胞缺失小鼠攻毒后,C.jejuni在空肠组织中的定植量均显著高于WT(野生型)小鼠的定植量(P < 0.01)。该结果表明PEB1免疫优势表位介导的免疫保护依赖B细胞对抗C.jejuni在空肠组织中的定植感染。
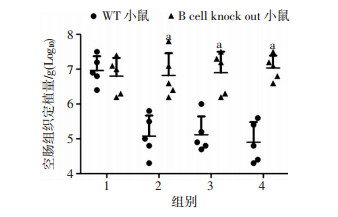
|
| 1:CFA/IFA组;2:PEB155-72aa-KLH+CFA/IFA组;3:PEB197-114aa-KLH+CFA/IFA组;4:PEB1211-228aa-KLH+CFA/IFA组;a:P < 0.05,与WT小鼠比较 图 5 免疫优势表位免疫野生型和B细胞缺失小鼠后空肠组织细菌定植量 |
3 讨论
C.jejuni引起的食源性感染已成为亟待解决的公共卫生问题,因此寻求一种新的、安全、有效的疫苗具有重要的现实意义和社会经济价值。表位疫苗是以抗原表位为基础制备的疫苗,是感染性疾病、恶性肿瘤以及自身免疫性疾病等疫苗研制的新方向。国内外一些研究均证实表位疫苗是对抗病原菌的一种有效手段,如UreB403-420能够对幽门螺旋杆菌的感染产生免疫保护,SEB97-114能够显著降低小鼠感染金黄色葡萄球菌后的死亡率[13-14],而MEHLA等[15]的研究则进一步表明抗原表位预测分析对研制C.jejuni疫苗同样具有重要价值。因此,有必要对此深入研究,以期为C.jejuni疫苗研制提供候选表位。
C.jejuni外膜黏附蛋白PEB1,由peb1A基因编码,peb1A位点失活显著降低C.jejuni对宿主细胞的粘附[8, 16],而PEB1突变体在肠道定植的速率和持续时间同样显著低于野生型菌株[17]。上述研究均提示PEB1在C.jejuni黏附与定植过程中发挥重要作用,而这一过程是C.jejuni在胃肠道繁殖、扩散、产生毒素最终致病的必要条件。除此之外,刘琳琳等[11]及YASMIN等[8]研究证实,PEB1免疫原性强,利用PEB1基因制备的DNA疫苗能够有效诱导T细胞活化增殖,引起机体较强的免疫应答[8, 11]。因此,制备PEB1表位疫苗的关键是确定可被免疫细胞识别的免疫优势表位。
在本研究中,我们首先证实了重组PEB1蛋白免疫BALB/c小鼠后能够显著降低感染C.jejuni在其肠道组织的定植量,重组PEB1蛋白在ELISA实验中表明,其能诱导机体产生较强的抗体应答水平。采用合成重叠肽技术、ELISA分析方法,系统的筛选重组PEB1蛋白抗原中包含的B细胞应答的免疫优势表位,研究发现PEB155-72aa、PEB197-114aa和PEB1211-228aa为PEB1的B细胞免疫优势表位。免疫后感染实验进一步表明,单独免疫优势表位PEB155-72aa、PEB197-114aa、PEB1211-228aa均能够显著降低BALB/c小鼠降低炎性细胞因子TNF-α的相对表达水平,小鼠感染C.jejuni后的定植量。调理吞噬杀伤实验表明,PEB1免疫优势表位PEB155-72aa,PEB197-114aa, PEB1211-228aa诱导的抗体介导对C.jejuni的杀伤,能够发挥调理吞噬的功能。免疫B cell缺失小鼠,未能够显著降低小鼠感染C.jejuni后的定植量。本研究通过阵列方式,筛选出了3个PEB1的B细胞优势表位(PEB155-72aa、PEB197-114aa、PEB1211-228aa),为多价亚单位疫苗的构建提供了重要的实验依据。但由于佐剂对抗原的应答类型会产生一定的影响,同时会引起表位疫苗优势和非优势之间的转换,且最近的研究表明CD4+T细胞介导的免疫应答在抗C.jejuni的感染中发挥越来越重要的作用[8]。
因此,本研究不足之处在于对PEB1优势表位的筛选未考虑PEB1与多种佐剂的配伍,并且只筛选了传统的B细胞优势表位,而忽略了CD4+辅助性T细胞的优势表位,这就需要我们进一步对PEB1介导CD4+辅助性T细胞的应答效应进行研究,对其免疫保护效果和作用机制进行系统筛选鉴定。
综上所述,本研究最终成功鉴定出3个具有良好免疫原性和免疫保护作用的优势B细胞抗原表位(PEB155-72aa、PEB197-114aa、PEB1211-228aa),可以作为C.jejuni疫苗研发的重要候选表位。在后续的研究中,我们将构建多个串联多肽表位并对PEB1介导CD4+辅助性T细胞的应答效应进行研究,通过动物保护实验对其免疫保护效果和作用机制进行系统筛选及鉴定。
| [1] | ABOUTALEB N, KUIJPER E J, VAN DISSEL J T. Emerging infectious colitis[J]. Curr Opin Gastroenterol, 2014, 30(1): 106–115. DOI:10.1097/MOG.0000000000000030 |
| [2] | LUCCHESE G, DELFINO A P. Developing an anti-Campylo- bacter jejuni vaccine[J]. Immunopharmacol Immunotoxicol, 2012, 34(3): 385–390. DOI:10.3109/08923973.2011.608685 |
| [3] | RIDDLE M S, GUERRY P. Status of vaccine research and development for Campylobacter jejuni[J]. Vaccine, 2016, 34(26): 2903–2906. DOI:10.1016/j.vaccine.2016.02.080 |
| [4] | GIACOMELLI M, SALATA C, MARTINI M, et al. Antimicrobial resistance of Campylobacter jejuni and Campylobacter coli from poultry in Italy[J]. Microb Drug Resist, 2014, 20(2): 181–188. DOI:10.1089/mdr.2013.0110 |
| [5] | MEUNIER M, GUYARD-NICOD ME M, DORY D, et al. Control strategies against Campylobacter at the poultry production level: biosecurity measures, feed additives and vaccination[J]. J Appl Microbiol, 2016, 120(5): 1139–1173. DOI:10.1111/jam.12986 |
| [6] | FIEDORUK K, DANILUK T, ROZKIEWICZ D, et al. Conventional and molecular methods in the diagnosis of community-acquired diarrhoea in children under 5 years of age from the north-eastern region of poland[J]. International Journal of Infectious Diseases, 2015, 37(C): 145–151. |
| [7] | JAIN R, SINGH S, VERMA S K, et al. Genome-Wide prediction of potential vaccine candidates for Campylobacter jejuni using reverse vaccinology[J]. Interdiscipl Sci: Comput Life Sci, 2017. DOI:10.1007/s12539-017-0260-5 |
| [8] | YASMIN T, AKTER S, DEBNATH M, et al. In silico proposition to predict cluster of B- and T-cell epitopes for the usefulness of vaccine design from invasive, virulent and membrane associated proteins of C.jejuni[J]. In Silico Pharmacology, 2016, 4: 5. DOI:10.1186/s40203-016-0020-y |
| [9] | MAHDAVI J, PIRINCCIOGLU N, OLDFIELD N J, et al. A novel O-linked glycan modulates Campylobacter jejuni major outer membrane protein-mediated adhesion to human histo-blood group antigens and chicken colonization[J]. Open Biology, 2014, 4(1): 130202–130202. DOI:10.1098/rsob.130202 |
| [10] | DU L F, LI Z J, TANG X Y, et al. Immunogenicity and immunoprotection of recombinant PEB1 in Campylobacter-jejuni-infected mice[J]. World J Gastroenterol, 2008, 14(40): 6244–6248. DOI:10.3748/wjg.14.6244 |
| [11] |
刘琳琳, 来卫东, 胡娜, 等. 空肠弯曲菌PEB1 DNA和PEB1蛋白联合免疫小鼠的效果评价[J].
细胞与分子免疫学杂志, 2014, 30(6): 576–580.
LIU L L, LAI W D, HU N, et al. Evaluation of immunological efficiency induced by Campylobacter jejuni PEB1 DNA combined with PEB1 protein in mice[J]. Chin J Cell Mol Immunol, 2014, 30(6): 576–580. |
| [12] |
张睿, 熊怡淞, 刘媛, 等. 空肠弯曲菌血红素氧化酶ChuZ促进巨噬细胞NLRP3炎性小体激活[J].
免疫学杂志, 2017, 33(11): 955–959.
ZHANG R, XIONG Y S, LIU Y, et al. Campylobacter jejuni heme oxygenase ChuZ promotes inflammasome activation[J]. Immunol J, 2017, 33(11): 955–959. DOI:10.13431/j.cnki.immunol.j.20170167.immunol.j.20170167 |
| [13] | YANG J, DAI L X, PAN X, et al. Protection against helicobacter pylori infection in BALB/c mice by oral administration of multi-epitope vaccine of CTB-UreI-UreB[J]. Pathog Dis, 2015, 73(5). DOI:10.1093/femspd/ftv026 |
| [14] | ZHAO Z, SUN H Q, WEI S S, et al. Multiple B-cell epitope vaccine induces a staphylococcus enterotoxin B-specific IgG1 protective response against MRSA infection[J]. Sci Rep, 2015, 5: 12371. DOI:10.1038/srep12371 |
| [15] | MEHLA K, RAMANA J. Surface proteome mining for identification of potential vaccine candidates against Campylobacter jejuni: an in silico approach[J]. Funct Integr Genomics, 2017, 17(1): 27–37. DOI:10.1007/s10142-016-0530-z |
| [16] | MEUNIER M, GUYARD-NICOD ME M, VIGOUROUX E, et al. A DNA prime/protein boost vaccine protocol developed against Campylobacter jejuni for poultry[J]. Vaccine, 2018, 36(16): 2119–2125. DOI:10.1016/j.vaccine.2018.03.004 |
| [17] | PEI Z, BURUCOA C, GRIGNON B, et al. Mutation in the peb1A locus of Campylobacter jejuni reduces interactions with epithelial cells and intestinal colonization of mice[J]. Infect Immun, 1998, 66(3): 938–943. |



