Pim(proviral integration site of murine)是哺乳动物细胞中的丝/苏氨酸激酶家族,包括Pim-1、Pim-2和Pim-3,均可通过磷酸化作用参与调节细胞增殖、凋亡及恶性转化[1-4]。其中Pim-2活性最强,体外实验结果显示Pim-2可抑制多种肿瘤细胞株如FL5.12细胞、WEHI3B细胞、HeLa细胞及HepG2细胞的凋亡[5],即使是在不产生内源性Pim-2的细胞中转染外源性Pim-2也可使该细胞获得抗凋亡活性[6]。目前,Pim-2抗凋亡作用已被证实参与淋巴瘤、白血病及多发性骨髓瘤的发生、发展[7]。另有研究表明:Pim-2可通过激活抗凋亡信号通路使前列腺癌细胞株DU-145更具侵犯性[8],针对Pim-2的反义寡聚核苷酸可明显降低前列腺癌细胞株DU-145的增殖[9]。提示Pim-2的抗凋亡效应可能参与前列腺癌的发生、发展。
Pim-2通过磷酸化下游底物的丝/苏氨酸残基发挥作用。研究表明丝氨酸残基前的保守序列“RXRHXS”是Pim-2磷酸化作用的识别位点[10]。另有研究通过氨基酸序列分析发现:在凋亡抑制因子5(apoptosis inhibitor 5,API-5)和真核起始因子4B(eukaryotic initiation factor 4B,eIF4B)的丝氨酸磷酸化位点前也存在“RXRHXS”保守序列,故API-5和eIF4B可能是Pim-2磷酸化底物[11]。在前期研究中,我们采用激光共聚焦显微镜分别检测了前列腺癌(prostate cancer,PCA)细胞株DU-145中API-5、eIF4B与Pim-2的共表达情况,结果显示Pim-2和eIF4B可共表达于DU-145细胞[12],提示前列腺癌细胞中Pim-2和eIF4B可能存在相互作用。国外研究也证实eIF4B参与前列腺癌发生[13]。由此推测eIF4B可能是前列腺癌细胞中Pim-2的磷酸化底物。
eIF4B是真核细胞中的翻译起始因子,不同的上游激活因子激活eIF4B可诱导不同的下游蛋白翻译。Bcl-2、Cdc-25、C-myc和XIAP是常见的由eIF4B诱导翻译并且与前列腺癌发生相关的下游蛋白[14],但其与Pim-2的关系尚需进一步探索。因此,本研究拟在前列腺癌细胞中探索Pim-2抗凋亡信号通路的组成及其与前列腺癌发生的关系。
1 材料与方法 1.1 临床标本获取试验第1阶段收集2011年本科手术治疗的前列腺癌患者标本24例,同期良性前列腺增生(benign prostatic hyperplasia,BPH)患者标本32例,用于前列腺组织中Pim-2表达检测。第2阶段收集2012年1月至2015年6月本科诊治的前列腺癌患者标本88例。其中局限性前列腺癌组织标本46例,均为前列腺癌根治手术获得,经术后病检证实为前列腺腺癌,病理分期在pT2以内,切缘阴性且无精囊及淋巴结转移;转移性前列腺癌组织标本42例,均为前列腺穿刺活检获得,经病检证实为前列腺腺癌,且全身骨扫描证实肿瘤骨转移。同时收集了40例同期诊治的前列腺增生患者标本,均为前列腺电切术获得,经病检证实为前列腺增生。以前列腺癌组织标本作为研究组(PCA组),以良性前列腺增生组织标本作为对照组(BPH组)。两组患者在年龄、种族等基线资料方面差异无统计学意义(P > 0.05)。临床标本的获取均得到患者或家属的知情同意,研究方案2018年3月通过本院伦理委员会审核,并符合《赫尔辛基宣言》关于人体组织用于实验的要求。
1.2 细胞培养与转染前列腺癌细胞株DU-145、LNCaP、PC-3以及非肿瘤性前列腺上皮细胞株RWPE-1、PNT1a均购自美国ATCC公司,并在5% CO2、37 ℃温度下培养于RPMI1640完全培养基(9 mL RPMI1640+1 mL胎牛血清+100 mL 1%青/链霉素)。
将Pim-2转染入非肿瘤性前列腺上皮细胞RWPE-1中以增强其中Pim-2蛋白表达。Pim-2 cDNA序列通过RT-PCR克隆自DU-145 cDNA文库,引物设计如下:正义链5′-AAAGAATTCATGTTGACCAAGCC-TCTACA-3′,反义链5′-AAAGTCGACTTAGGGTAGCA-AGGACCAGG-3′,斜体标记为EcoRⅠ和SalⅠ酶切位点。将构建好的cDNA导入真核表达质粒PCI-neo并测序鉴定。细胞转染采用Lipofectamine TM试剂盒(Invitrogen, Carlsbad, CA)。DMEM+400 mg/mL新霉素用以筛选稳定表达Pim-2的细胞(RWPE-1/Pim-2)。同时,将空载体(Vector)上述方法转染入RWPE-1细胞作为对照组(RWPE-1/Vector)。
用相同方法将XIAP基因转染入RWPE-1中以增强其中XIAP蛋白表达。引物设计如下:正义链3′-GATCCGCAGGTTGTAGATATATCAGATTCAAGAGATC-TGATATATCTACAACCTGCTTTTTTG,反义链3′-AATTCAAAAAAGCAGGTTGTAGATATATCAGATCTCTTGA-ATCTGATATATCTACAACCTGCG-5′。最后用Western blot检测转染效果。
1.3 RNAi将Pim-2 SiRNA分别转染入前列腺癌细胞株DU-145及PC-3,以沉默其中Pim-2蛋白表达。构建针对Pim-2 SiRNA的pGenesil-1真核表达质粒。Pim-2 SiRNA序列设计如下:BamHⅠ-sense DNA-loop (TTCAAGACG)-antisense DNA-stop code-Hind Ⅲ。Sense DNA序列: 5′-CTTGTAGGACTATCTGGAT-3′。Pim-2 SiRNA由上海生工生物公司合成并测序。采用LipofectamineTM试剂盒(Invitrogen)将Pim-2 SiRNA转染至靶细胞。沉默效果用Western blot检测。同时将空载体(Vector)转染DU-145细胞作对照。XIAP SiRNA购自Cell Signaling Technology (Danvers, MA, USA),同样采用LipofectamineTM试剂盒转染PC-3细胞。沉默效果用Western blot检测。
1.4 免疫组化染色手术获取的前列腺组织标本经10%福尔马林溶液固定24 h后石蜡包埋,切片(厚度4 μm)后置于载玻片,二甲苯脱蜡,水合并封闭抗原。按比例加入一抗,37 ℃孵育1 h。PBS洗片后加入HRP标记的二抗,室温孵育30 min。洗片后加入DAB,室温孵育5 min。显微镜下读片。结果判定:Pim-2蛋白主要表达于胞质,阳性细胞表现为胞质染色。无染色细胞或染色细胞数不超过5%者定为阴性(-),细胞呈淡棕黄色或(和)染色细胞数小于50%定为弱阳性(+),细胞呈深棕黄色或(和)染色细胞数大于50%定为强阳性(+ +)。
1.5 Western blot检测Pim-2单抗(SC-13674)、Bcl-2单抗(SC-509)、c-Myc单抗(SC-70469)、Cdc-25单抗(SC-13138)以及XIAP单抗(sc-55550)均购自Santa Cruz公司,p-eIF4B抗体(Ser-422)购自Cell Signaling公司。组织匀浆或细胞溶解后,用M-PER蛋白抽提试剂盒(PIERCE)提取总蛋白,Bradford法测定蛋白浓度(Bio-Rad),取10 μL总蛋白加入1×上样缓冲液,10% SDS-PAGE电泳。400 mA电转1 h将蛋白转移至PVDF膜,0.1% TBST+ 7%脱脂牛奶室温下封闭1 h。加入按比例稀释的一抗(Pim-2 1 :800, p-eIF4B 1 :1 000, GAPDH 1 :400),加入HRP标记的二抗后曝光洗片。
1.6 细胞凋亡检测收集对数生长期细胞,调整细胞浓度至106/mL,1 000 r/min离心5 min后加入100 μL结合缓冲液重悬,加入5 μL Annexin V-FITC及10 μL PI。室温避光静置20 min,加入400 μL 1×结合缓冲液,流式细胞检测细胞凋亡率。在前列腺癌细胞株DU-145中转染Pim-2 SiRNA,比较转染前后细胞凋亡率变化,同时在正常前列腺上皮细胞株RWPE-1中转染Pim-2,比较转染前后细胞凋亡率变化。用凋亡细胞数与总细胞数比值表示该组细胞凋亡率,每组细胞分3个培养基实验,在培养细胞中加入化疗药物多西他赛(100 μg/mL,Sanofi公司)后,于24、48、72 h分别检测凋亡率。每组实验重复3次。
1.7 统计学分析数据以x±s表示,采用SPSS 13.0统计软件。多组数据间均数比较采用单因素方差分析,两组间比较采用t检验。检验水准:α=0.05。
2 结果 2.1 Pim-2在前列腺癌组织和细胞中异常高表达免疫组化结果显示,在试验第1阶段的24例前列腺癌组织中,Pim-2蛋白表达强阳性17例(70.8%),弱阳性7例(29.2%),无阴性病例;在32例前列腺增生组织中,Pim-2蛋白表达均为阴性(图 1)。提示Pim-2蛋白在前列腺癌组织中的表达显著增高。
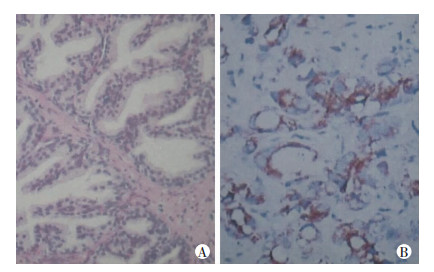
|
| A:在BPH组织中阴性表达;B:在PCA组织中阳性表达 图 1 免疫组化观察临床前列腺组织标本中Pim-2的表达(S-P ×200) |
Western blot检测结果显示,PCA组Pim-2蛋白表达为(0.350±0.042);BPH组Pim-2蛋白表达为(0.094±0.016),两组间差异有统计学意义(t=36.702,P < 0.01,图 2),提示Pim-2蛋白在前列腺癌组织中表达显著增高。Pim-2蛋白在前列腺癌细胞株LNCaP、DU-145中表达水平为(0.894±0.078)、(0.719±0. 035),两组差异无统计学意义(P > 0.05);Pim-2在非肿瘤性前列腺上皮细胞株RWPE-1、PNT1a中表达水平为(0.257±0.023)、(0.046±0.011),两组差异也无统计学意义(P > 0.05)。但在前列腺癌细胞组的表达水平显著高于非肿瘤性前列腺上皮细胞组(P < 0.05)。提示Pim-2蛋白在前列腺癌细胞株中的表达水平显著高于非肿瘤性前列腺上皮细胞株(图 3)。

|
| 图 2 Pim-2在临床前列腺组织标本中的表达 |
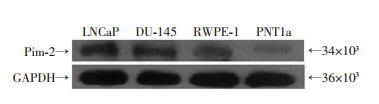
|
| 图 3 Pim-2在不同前列腺细胞株中的表达 |
2.2 Pim-2抑制前列腺癌细胞凋亡
结果显示:培养72 h后细胞凋亡率趋于稳定。在前列腺癌细胞DU-145中转染Pim-2 SiRNA沉默Pim-2表达后,DU-145/Pim-2 SiRNA组细胞凋亡率显著增高(P < 0.05),而转染空载体的DU-145/Vector组细胞凋亡率与转染前DU-145组细胞相比无显著变化。在正常前列腺癌细胞RWPE-1中转染Pim-2增强其中Pim-2表达后,RWPE-1/Pim-2组细胞凋亡率显著下降(P < 0.05),而转染空载体的细胞RWPE-1/Vector凋亡率与转染前RWPE-1细胞相比无显著变化(表 1)。提示Pim-2具有抑制前列腺癌细胞凋亡活性。
| 组别 | 24 h | 48 h | 72 h |
| DU-145组 | 3.74±1.25 | 21.23±2.42 | 24.15±1.50 |
| DU-145/Pim-2 SiRNA组 | 5.51±2.82 | 16.55±2.81 | 33.49±2.14a |
| DU-145/Vector组 | 2.66±0.34 | 17.62±1.41 | 21.04±2.52 |
| RWPE-1组 | 10.45±2.29 | 26.30±2.31 | 47.52±2.48 |
| RWPE-1/Pim-2组 | 5.63±0.41 | 17.48±0.53 | 23.38±2.62b |
| RWPE-1/Vector组 | 7.93±0.85 | 29.33±3.92 | 41.67±3.60 |
| a:P < 0.05,与DU-145组培养72 h比较;b:P < 0.05,与RWPE-1组培养72 h比较 | |||
2.3 eIF4B是前列腺癌细胞中Pim-2的磷酸化底物
Western blot检测结果显示,在前列腺癌细胞DU-145细胞株中,与转染前(DU-145细胞组)及转染空载体的DU-145/Vector组比较,DU-145/Pim-2 SiRNA组Pim-2的表达水平显著降低(P < 0.05,图 4)。提示构建并转染的Pim-2 SiRNA能够成功抑制DU-145前列腺癌细胞中高表达的Pim-2。在非肿瘤性前列腺上皮细胞RWPE-1细胞株中,与转染前(RWPE-1细胞组)及转染空载体的RWPE-1/Vector组比较,转染Pim-2基因的RWPE-1/Pi m-2组Pim-2的表达水平显著增高(P < 0.05,图 4),提示Pim-2基因转染成功。
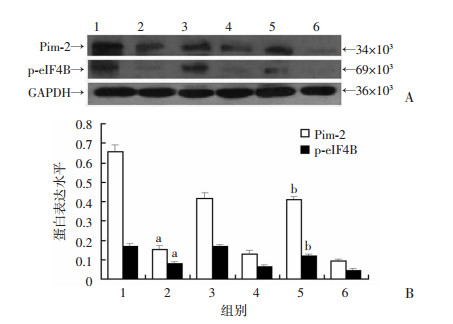
|
| 1:DU-145组;2:DU-145/Pim-2 SiRNA组;3:DU-145/Vector组;4:RWPE-1组;5:RWPE-1/Pim-2组;6:RWPE-1/Vector组 A:Western blot检测;B:半定量分析 a:P < 0.05,与DU-145组比较;b:P < 0.05,与RWPE-1组比较 图 4 Western blot检测前列腺细胞中p-eIF4B与Pim-2表达 |
磷酸化eIF4B(p-eIF4B)在各组中的表达水平与Pim-2呈正相关变化趋势(图 4),提示eIF4B的磷酸化可能与Pim-2表达水平有关,eIF4B可能是前列腺癌细胞中Pim-2的磷酸化底物。
2.4 XIAP是Pim-2/eIF4B信号通路的下游因子Western blot检测前列腺癌组织和前列腺增生组织中XIAP、Bcl-2、C-myc和Cdc-25蛋白表达的差异及其与Pim-2、p-eIF4B表达水平相关性。结果显示:XIAP蛋白在前列腺癌组织中的表达水平显著高于前列腺增生组织(P < 0.05,图 5),与Pim-2及p-eIF4B表达趋势相同。而Bcl-2、C-myc和Cdc-25在前列腺癌组织和前列腺增生组织中的表达差异无统计学意义(图 5)。提示XIAP可能与Pim-2/eIF4B信号通路相关。
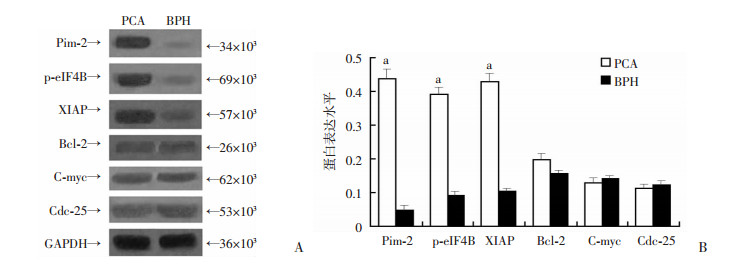
|
| A:Western blot检测结果; B:半定量分析 a:P < 0.05,与BPH比较 图 5 eIF4B磷酸化底物在前列腺组织中的表达 |
进一步细胞实验在前列腺癌细胞PC-3中分别转染Pim-2 SiRNA和XIAP SiRNA,分别沉默细胞内Pim-2及XIAP表达,同时在正常前列腺上皮细胞RWPE-1中分别转染Pim-2及XIAP,分别增强细胞内Pim-2及XIAP的表达,观察转染前后Pim-2、p-eIF4B及XIAP表达变化。结果显示:在PC-3细胞中,当沉默Pim-2后,p-eIF4B及XIAP表达水平显著下降(P < 0.05);而当沉默XIAP时,Pim-2及p-eIF4B表达无显著变化。在RWPE-1细胞中,当Pim-2表达增强后,p-eIF4B及XIAP表达水平显著增加(P < 0.05);而当XIAP表达增强时,Pim-2及p-eIF4B水平无显著变化(图 6)。提示Pim-2表达可以影响p-eIF4B和XIAP,而XIAP表达不能影响Pim-2及p-eIF4B水平。由此可推断:Pim-2是eIF4B上游因子,而XIAP是eIF4B下游因子。

|
| A:Western blot检测结果 1:PC-3组;2:PC-3/Pim-2 SiRNA组;3:PC-3/XIAP SiRNA组;4:RWPE-1组;5:RWPE-1/Pim-2组;6:RWPE-1/XIAP组;B:半定量分析 a:P < 0.05,与PC-3细胞比较;b:P < 0.05,与RWPE-1细胞比较 图 6 XIAP表达水平始终与Pim-2及p-eIF4B水平正相关 |
2.5 Pim-2与XIAP协同作用抑制前列腺癌细胞凋亡
通过检测上述各组细胞的凋亡率我们发现(图 7),在PC-3细胞及RWPE-1/Pim-2细胞中,Pim-2及XIAP蛋白表达均显著增高时,细胞凋亡率显著减低(P < 0.05)。在PC-3/Pim-2 SiRNA细胞及RWPE-1细胞中,Pim-2及XIAP蛋白均显著低表达,相应的细胞凋亡率则显著增高(P < 0.05)。在PC-3/XIAP SiRNA细胞中,虽然Pim-2蛋白仍显著高表达,但XIAP表达水平显著低表达,此时细胞凋亡水平仍显著增高(P < 0.05)。在RWPE-1/XIAP细胞中,虽然XIAP蛋白呈显著高表达,但Pim-2显著低表达,此时细胞凋亡水平仍显著增高(P < 0.05)。提示仅当Pim-2及XIAP同时高表达时,前列腺细胞凋亡水平会显著降低。前列腺癌的发展是Pim-2与XIAP协同作用的结果。
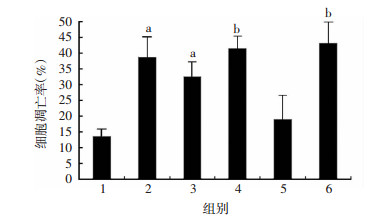
|
| 1:PC-3组;2:PC-3/Pim-2 SiRNA组;3:PC-3/XIAP SiRNA组;4:RWPE-1组;5:RWPE-1/Pim-2组;6:RWPE-1/XIAP组;a:P < 0.05,与DU-145组比较;b:P < 0.05,与RWPE-1/ Pim-2组比较 图 7 Pim-2与XIAP同时高表达的细胞凋亡率显著降低 |
3 讨论
癌基因Pim家族在前列腺癌发病中的作用已经得到众多研究的认可。YE等[15]报道自然界化合物Myricetin可通过抑制Pim-1、干扰Pim-1/CXCR4相互作用,从而抑制前列腺癌进展。MOLOGNI等[16]报道Pim-1抑制剂NMS-P645联合PI3K抑制剂GDC-0941可抑制前列腺癌细胞增殖。QU等[17]报道Pim-3是前列腺癌进展和预后的生物标记物。与上述研究结论类似,本研究通过细胞实验和临床标本实验证实Pim-2信号通路在前列腺癌细胞中异常高表达,并参与抑制前列腺癌细胞凋亡,为Pim-2参与前列腺癌发展的理论增加了新的证据。
作为一种丝/苏氨酸激酶,Pim-2通过磷酸化下游底物发挥作用。eIF4B具有Pim-2磷酸化特异性识别位点“RXRHXS”序列,并且被多项研究证实参与前列腺癌发展[13]。本研究发现,eIF4B与Pim-2共表达于前列腺癌细胞,但在前列腺增生组织及非肿瘤性前列腺上皮细胞中低表达,通过RNAi技术沉默前列腺癌细胞中Pim-2表达后,eIF4B的磷酸化水平也随之显著降低,通过基因转染技术增强非肿瘤性前列腺上皮细胞中Pim-2表达后,eIF4B磷酸化水平随之显著增高。同期进行的细胞凋亡检测实验结果显示,前列腺癌细胞凋亡水平与Pim-2表达水平及eIF4B磷酸化水平呈反比。上述结果充分证明,Pim-2可通过磷酸化eIF4B抑制前列腺癌细胞凋亡。
eIF4B是真核细胞转录起始因子(eukaryotic initiation factor,eIF)家族成员之一。真核细胞转录起始因子复合物在mRNA识别、解螺旋、核糖体招募等过程中发挥重要作用,而eIF4B在其中负责识别mRNA的5′端帽子结构并激活解螺旋过程。研究表明eIF4B可选择性的识别抑制凋亡的蛋白进行转录,例如干扰素可通过激活S6K及RSK促进eIF4B磷酸化,从而抑制原始白血病细胞凋亡[18],D-葡萄糖可通过抑制p70S6K/eIF4B磷酸化通路从而抑制乳腺癌细胞增殖[13],血清生长因子可通过激活Ras/MAPK通路和PI3K/Akt/mTOR通路磷酸化eIF4B,从而抑制肝癌细胞和HeLa细胞凋亡[14]。本研究证实Pim-2通过磷酸化eIF4B抑制前列腺癌细胞凋亡,与上述研究结论一致。
通过eIF4B识别转录的抗凋亡蛋白最常见的有Cdc25C,C-myc,Bcl-2和XIAP[19],但不同肿瘤中eIF4B可能转录不同的下游抗凋亡蛋白。例如在白血病细胞中,Pim-2通过磷酸化作用激活eIF4B,eIF4B通过促进C-myc转录翻译来抑制白血病细胞凋亡[20]。而本研究通过逐一筛查,发现前列腺癌细胞中XIAP与Pim-2及p-eIF4B表达正相关,而Cdc25C,C-myc及Bcl-2均没有异常表达。提示前列腺癌细胞中,XIAP才是Pim-2/ eIF4B的下游因子。本研究还发现,Pim-2与XIAP协同作用才能抑制前列腺癌细胞凋亡,缺一不可。究其原因,可能与NF-κB有关。有研究证实Pim-2与NF-κB协同作用促进前列腺癌细胞增殖[21],也有研究表明在白血病细胞、骨髓瘤细胞及肝癌细胞中Pim-2的抗凋亡作用均与NF-κB相关[5, 22-23]。另一方面,研究表明XIAP的抗凋亡作用也依赖NF-κB,有报道称辛伐他汀可以通过抑制NF-κB调控的XIAP表达,从而促进去势抵抗前列腺癌细胞凋亡[24];刺槐黄素可通过抑制NF-κB下调XIAP表达,从而抑制前列腺癌发展[25]。上述研究结果提示NF-κB在Pim-2和XIAP的抗凋亡机制中都起到关键作用,NF-κB可能是Pim-2与XIAP的抗凋亡机制的总调控。
我们同时也注意到有研究提出了相反观点,认为XIAP的高表达与前列腺癌预后良好有关[26-27]。动物实验结果显示XIAP表达缺陷的小鼠前列腺癌模型更具侵袭性[28]。在其他肿瘤中也有类似报道[29-30]。那么,到底XIAP对于前列腺癌是促进作用还是抑制作用,目前尚无定论。据本研究结果推测,与XIAP协同作用的因子可能起到决定性作用,例如当XIAP与Pim-2协同作用的时候,则表现为抗凋亡作用,可能当其与其他抗肿瘤蛋白协同表达时又反过来发挥促凋亡效应。具体机制有待对XIAP的进一步研究证实。
综上所述,本研究在前列腺癌细胞中探讨Pim-2/eIF4B/XIAP信号通路的抗凋亡机制,证实Pim-2通过磷酸化eIF4B,促进XIAP过表达,Pim-2与XIAP协同作用抑制前列腺癌细胞凋亡,促进前列腺癌的发展。下一步研究将继续深入探索XIAP下游信号通路在前列腺癌发生、发展中的作用。
| [1] | REBELLO R J, HUGLO A V, FURIC L. Pim activity in tumours: a key node of therapy resistance[J]. Adv Biol Regul, 2018, 67: 163–169. DOI:10.1016/j.jbior.2017.10.010 |
| [2] | AZIZ A U R, FARID S, QIN K, et al. Pim kinases and their relevance to the pi3k/akt/mtor pathway in the regulation of ovarian cancer[J]. Biomolecules, 2018, 8(1): E7. DOI:10.3390/biom8010007 |
| [3] | ISHIKAWA C, SENBA M, HASHIMOTO T, et al. Expression and significance of Pim-3 kinase in adult T-cell leukemia[J]. Eur J Haematol, 2017, 99(6): 495–504. DOI:10.1111/ejh.12940 |
| [4] | HIASA M, TERAMACHI J, ODA A, et al. Pim-2 kinase is an important target of treatment for tumor progression and bone loss in myeloma[J]. Leukemia, 2015, 29(1): 207–217. DOI:10.1038/leu.2014.147 |
| [5] | REN K, ZHANG W, SHI Y, et al. Pim-2 activates API-5 to inhibit the apoptosis of hepatocellular carcinoma cells through NF-κB pathway[J]. Pathol Oncol Res, 2010, 16(2): 229–237. DOI:10.1007/s12253-009-9215-4 |
| [6] | FOX C J, HAMMERMAN P S, CINALLI R M, et al. The serine/threonine kinase Pim-2 is a transcriptionally regulated apoptotic inhibitor[J]. Genes Dev, 2003, 17(15): 1841–1854. DOI:10.1101/gad.1105003 |
| [7] | KEANE N A, REIDY M, NATONI A, et al. Targeting the Pim kinases in multiple myeloma[J]. Blood Cancer J, 2015: e325. DOI:10.1038/bcj.2015.46 |
| [8] | DAI H, LI R, WHEELER T, et al. Pim-2 upregulation: biological implications associated with disease progression and perinueral invasion in prostate cancer[J]. Prostate, 2005, 65(3): 276–286. DOI:10.1002/pros.20294 |
| [9] | DAI J M, ZHANG S Q, ZHANG W, et al. Antisense oligodeoxynucleotides targeting the serine/threonine kinase Pim-2 inhibited proliferation of DU-145 cells[J]. Acta Pharmacol Sin, 2005, 26(3): 364–368. DOI:10.1111/j.1745-7254.2005.00050.x |
| [10] | WHITE E. The pims and outs of survival signaling: role for the Pim-2 protein kinase in the suppression of apoptosis by cytokines[J]. Genes Dev, 2003, 17(15): 1813–1816. DOI:10.1101/gad.1123103 |
| [11] | PENG C, KNEBEL A, MORRICE N A, et al. Pim kinase substrate identification and specificity[J]. J Biochem, 2007, 141(3): 353–362. DOI:10.1093/jb/mvm040 |
| [12] | REN K, GOU X, XIAO M, et al. The over-expression of Pim-2 promote the tumorigenesis of prostatic carcinoma through phosphorylating eIF4B[J]. Prostate, 2013, 73(13): 1462–1469. DOI:10.1002/pros.22693 |
| [13] | OH H J, LEE J S, SONG D K, et al. D-glucosamine inhibits proliferation of human cancer cells through inhibition of p70S6K[J]. Biochem Biophys Res Commun, 2007, 360(4): 840–845. DOI:10.1016/j.bbrc.2007.06.137 |
| [14] | SHAHBAZIAN D, PARSYAN A, PETROULAKIS E, et al. Control of cell survival and proliferation by mammalian eukaryotic initiation factor 4B[J]. Mol Cell Biol, 2010, 30(6): 1478–1485. DOI:10.1128/MCB.01218-09 |
| [15] | YE C, ZHANG C, HUANG H, et al. The natural compound myricetin effectively represses the malignant progression of prostate cancer by inhibiting PIM1 and disrupting the PIM1/CXCR4 interaction[J]. Cell Physiol Biochem, 2018, 48(3): 1230–1244. DOI:10.1159/000492009 |
| [16] | MOLOGNI L, MAGISTRONI V, CASUSCELLI F, et al. The novel PIM1 inhibitor NMS-P645 reverses PIM1-dependent effects on TMPRSS2/ERG positive prostate cancer cells and shows anti-proliferative activity in combination with PI3K inhibition[J]. J Cancer, 2017, 8(1): 140–145. DOI:10.7150/jca.15838 |
| [17] | QU Y, ZHANG C, DU E, et al. Pim-3 is a critical risk factor in development and prognosis of prostate cancer[J]. Med Sci Monit, 2016, 22: 4254–4260. DOI:10.12659/msm.898223 |
| [18] | SHAHBAZIAN D, ROUX P P, MIEULET V, et al. The mTOR/PI3K and MAPK pathways converge on eIF4B to control its phosphorylation and activity[J]. EMBO J, 2006, 25(12): 2781–2791. DOI:10.1038/sj.emboj.7601166 |
| [19] | KROCZYNSKA B, KAUR S, KATSOULIDIS E, et al. Interferon-dependent engagement of eukaryotic initiation factor 4B via S6 kinase (S6K)- and ribosomal protein S6K-mediated signals[J]. Mol Cell Biol, 2009, 29(10): 2865–2875. DOI:10.1128/MCB.01537-08 |
| [20] | CHEN L S, REDKAR S, TAVERNA P, et al. Mechanisms of cytotoxicity to Pim kinase inhibitor, SGI-1776, in acute myeloid leukemia[J]. Blood, 2011, 118(3): 693–702. DOI:10.1182/blood-2010-12-323022 |
| [21] | ZEMSKOVA M, SAHAKIAN E, BASHKIROVA S, et al. The PIM1 kinase is a critical component of a survival pathway activated by docetaxel and promotes survival of docetaxel-treated prostate cancer cells[J]. J Biol Chem, 2008, 283(30): 20635–20644. DOI:10.1074/jbc.M709479200 |
| [22] | KAPELKO-SŁOWIK K, URBANIAK-KUJDA D, WOŁO-WIEC D, et al. Expression of Pim-2 and NF-κB genes is increased in patients with acute myeloid leukemia (AML) and acute lymphoblastic leukemia (ALL) and is associated with complete remission rate and overall survival[J]. Postepy Hig Med Dosw (Online), 2013, 67: 553–559. DOI:10.5604/17322693.1052449 |
| [23] | ASANO J, NAKANO A, ODA A, et al. The serine/threonine kinase Pim-2 is a novel anti-apoptotic mediator in myeloma cells[J]. Leukemia, 2011, 25(7): 1182–1188. DOI:10.1038/leu.2011.60 |
| [24] | PARK Y H, SEO S Y, LEE E, et al. Simvastatin induces apoptosis in castrate resistant prostate cancer cells by deregulating nuclear factor-κB pathway[J]. J Urol, 2013, 189(4): 1547–1552. DOI:10.1016/j.juro.2012.10.030 |
| [25] | KIM H R, PARK C G, JUNG J Y. Acacetin (5, 7-dihydroxy-4'-methoxyflavone) exhibits in vitro and in vivo anticancer activity through the suppression of NF-κB/Akt signaling in prostate cancer cells[J]. Int J Mol Med, 2014, 33(2): 317–324. DOI:10.3892/ijmm.2013.1571 |
| [26] | RODRíGUEZ-BERRIGUETE G, TORREALBA N, ORTEGA M A, et al. Prognostic value of inhibitors of apoptosis proteins (IAPs) and caspases in prostate cancer: caspase-3 forms and XIAP predict biochemical progression after radical prostatectomy[J]. BMC Cancer, 2015, 15: 809. DOI:10.1186/s12885-015-1839-z |
| [27] | SELIGSON D B, HONGO F, HUERTA-YEPEZ S, et al. Expression of X-linked inhibitor of apoptosis protein is a strong predictor of human prostate cancer recurrence[J]. Clin Cancer Res, 2007, 13(20): 6056–6063. DOI:10.1158/1078-0432.CCR-07-0960 |
| [28] | HWANG C, OETJEN K A, KOSOFF D, et al. X-linked inhibitor of apoptosis deficiency in the TRAMP mouse prostate cancer model[J]. Cell Death Differ, 2008, 15(5): 831–840. DOI:10.1038/cdd.2008.15 |
| [29] | OWENS T W, FOSTER F M, VALENTIJN A, et al. Role for X-linked inhibitor of apoptosis protein upstream of mitochondrial permeabilization[J]. J Biol Chem, 2010, 285(2): 1081–1088. DOI:10.1074/jbc.M109.072322 |
| [30] | GOGADA R, PRABHU V, AMADORI M, et al. Resveratrol induces p53-independent, X-linked inhibitor of apoptosis protein (XIAP)-mediated bax protein oligomerization on mitochondria to initiate cytochrome crelease and caspase activation[J]. J Biol Chem, 2011, 286(33): 28749–28760. DOI:10.1074/jbc.M110.202440 |



