2015年中国癌症统计数据分析结果显示,肺癌是中国最常见的肿瘤和癌症死亡的主要原因[1],并且大部分肺癌患者确诊时已经处于晚期。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)的出现使得晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗模式发生了很大变化,显著提高了EGFR突变阳性NSCLC患者的客观缓解率(objective response rate,ORR),并延长无进展生存期(progression-free survival,PFS)[2-4]。即便如此,并非所有的EGFR突变患者都能从EGFR-TKIs中获得好的疗效。既往有研究报道一些动态的血液指标,如中性粒淋巴细胞比值(NLR)、血清乳酸脱氢酶(LDH)、环氧化酶-2(Cox-2)[5-7],可以预测NSCLC患者EGFR-TKIs疗效。但这些方法存在一些共性的问题:①口服EGFR-TKIs的患者大多在门诊随诊,流动性较大,不方便动态观察这些指标;②动态观察为服药前后的对比,不能真正做到预测EGFR-TKIs疗效的作用;③单个标志物的预测作用有限。因此,本研究旨在找到简便、可联合的临床参数预测一线使用EGFR-TKIs的NSCLC患者疗效,从而提高Ⅳ期NSCLC患者一线服用EGFR-TKIs的生存获益。
1 资料与方法 1.1 研究对象收集2010-2016年本院行病理组织学或者细胞学检查诊断为Ⅳ期非小细胞肺癌,同时组织基因检测出EGFR突变[包括19外显子缺失(19del)、21外显子突变(L858R)或突变位点未明确记录]的患者。纳入标准:接受EGFR-TKIs(厄洛替尼、吉非替尼或埃克替尼)作为一线治疗,有详细的病历、治疗前及治疗8周后影像资料及临床参数记录。排除标准:原发病灶不可测量,有化疗、放疗或者免疫治疗干扰,未按医嘱定期复诊的患者。
1.2 方法 1.2.1 临床参数统计通过军字一号病案系统收集患者临床参数:年龄、性别、PS评分、吸烟状态、组织学类型、EGFR突变位点、EGFR-TKIs种类、转移部位(肺、骨、肝、脑、胸膜、肾上腺)、治疗前外周血肺癌相关肿瘤标志物[神经元特异性烯醇化酶(neuronspecific enolase,NSE)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原15-3(carbohydrate antigen 15-3,CA15-3)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(Cyfra21-1)]、治疗前后肿瘤影像变化、肿瘤进展部位及时间、生存状态。治疗前外周血NSE、CA125、CA15-3、SCC、CEA、Cyfra21-1由本院检验科定量检测,方法为化学发光微粒子免疫检测法。
1.2.2 治疗方案入组患者均接受一代EGFR-TKIs单药一线治疗(吉非替尼250 mg,1次/d,或厄洛替尼150 mg,1次/d,或埃克替尼125 mg,3次/d),直到疾病进展或者发生不可耐受的毒副反应。
1.2.3 疗效及预后评价收集患者EGFR-TKIs治疗前和治疗8周的影像学资料,特别是胸部计算机断层扫描(CT),按实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST 1.1)进行评估。客观缓解率(ORR)=完全缓解(complete response,CR)+部分缓解(partial response,PR);疾病控制率(disease control rate,DCR)=CR+PR+SD。PFS定义为治疗开始到疾病进展或死亡的时间,总生存期(overall survival,OS)定义为治疗开始到死亡的时间(因肿瘤死亡)。
1.3 统计学分析采用SPSS 21.0统计软件。组间临床基线特征比较采用卡方检验,PFS和OS分析采用Kaplan-Meier方法,组间比较采用Log-rank检验。临床参数对PFS及OS影响的多因素分析采用Cox比例风险回归模型,双侧检验,检验水准:α=0.05。
2 结果 2.1 临床参数基本特征共纳入123例患者,年龄28~84岁,中位年龄58岁,其中男性43例,女性80例;PS评分0~1分104例,≥2分19例;腺癌121例,腺鳞癌2例;19外显子缺失61例,21外显子突变43例,EGFR突变但未详细记录突变基因19例;使用厄洛替尼67例,吉非替尼53例,埃克替尼3例;单个转移灶55例,多个转移灶68例。双肺转移46例,骨转移77例,脑转移38例,肝转移20例,肾上腺转移8例,胸膜转移38例。疗效评估PR 59例,SD 64例,无CR和PD病例。ORR 47.97%,DCR 100%。中位PFS 11.0个月(95%CI:6.0~12.4),中位OS 22.7个月(95%CI:19.8~25.6)。NSE中位值14.77 (1.00~88.01)ng/mL,CA125中位值64.60(3.00~909.40)U/mL,CA15-3中位值36.36(3.50~436.36)U/mL,Cyfra21-1中位值5.44(0.20~100.00)ng/mL,CEA中位值18.7(0.37~1 013.10)ng/mL,SCC中位值0.60(0.10~6.40)ng/mL。
2.2 临床参数单因素生存分析将患者年龄、肿瘤标志物按中位值分为高组(≥中位值)和低组(<中位值),PS评分分为0~1分组及≥2分组,按是否转移分有转移组和无转移组。单因素生存分析发现NSE、CA125或Cyfra21-1低组较各自高组PFS长。中位PFS分别为:14.2 vs 9.1个月,P < 0.001;12.4 vs 9.5个月,P=0.024;12.3 vs 9.5个月,P=0.033。PS评分0~1分较≥2分组OS长(24.0 vs 16.5个月,P=0.001),NSE、CA125、Cyfra21-1或CA15-3低组较各自高组OS长,中位OS分别为:27.7 vs 17.3个月,P < 0.001;25.4 vs 20.2个月,P=0.002;25.7 vs 18.1个月,P=0.010;25.5 vs 18.7个月,P=0.009。其余临床参数单因素生存分析差异无统计学意义(图 1)。
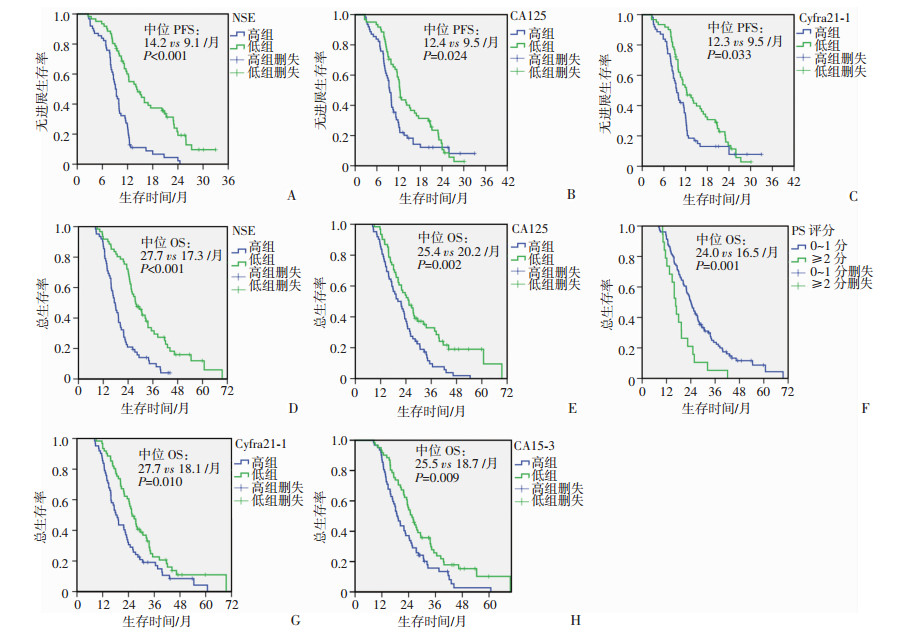
|
| A~C:分别为不同NSE、CA125、Cyfra21-1无进展生存率;D~H:分别为不同NSC、CA125、PS评分、Cyfra21-1、CA15-3总生存率分析 图 1 临床参数单因素生存分析 |
2.3 临床参数多因素生存分析
以年龄、PS评分、双肺转移、骨转移、脑转移、肝转移、胸膜转移、NSE、CA125、Cyfra21-1、CA15-3为变量,采用Cox回归模型输入法对PFS和OS分别进行多因素生存分析。结果显示:CA125和NSE是PFS的独立影响因素,相对危险度分别为1.623(95%CI:1.063~2.478,P=0.025)和3.143(95%CI:1.961~5.037,P < 0.001),即高CA125或高NSE者无进展生存期短。而CA125、NSE、CA15-3、肝转移、PS评分为OS的独立影响因素,相对危险度分别为1.742(95%CI:1.156~2.625,P=0.008),3.180(95%CI:1.958~5.165,P < 0.001),1.911(95%CI:1.234~2.959,P=0.004),2.060(95%CI:1.178~3.604,P=0.011),1.947(95%CI:1.121~3.381,P=0.018),即高CA125、NSE或CA15-3者,肝转移者,PS评分≥2分者总生存期短(表 1)。
| 因素 | 无进展生存期 | 总生存期 | |||||
| 相对危险度 | 95% CI | P值 | 相对危险度 | 95% CI | P值 | ||
| 肝转移 | - | - | - | 2.060 | 1.178~3.604 | 0.011 | |
| PS评分 | - | - | - | 1.947 | 1.121~3.381 | 0.018 | |
| NSE | 3.143 | 1.961~5.037 | <0.001 | 3.180 | 1.958~5.165 | <0.001 | |
| CA125 | 1.623 | 1.063~2.478 | 0.025 | 1.742 | 1.156~2.625 | 0.008 | |
| CA15-3 | - | - | - | 1.911 | 1.234~2.959 | 0.004 | |
2.4 多个临床参数联合预测疗效
基于上述单因素及多因素分析结果,选择CA125、Cyfra21-1、CA15-3和NSE 4个参数,按其表达水平将123个病例分为单个参数升高组(n=32)和多个参数升高组(n=75),两组人群的基线特征经卡方检验差异无统计学意义(P>0.05,表 2)。Kaplan-Meier法分析两组间PFS及OS的差异,结果显示多个参数升高组PFS和OS都较单个参数升高组短(mPFS:9.3 vs 11.8个月,P=0.045;mOS:18.7 vs 27.4个月,P=0.001,图 2)。
| 特征 | 单个参数升高组(n=32) | 多个参数升高组(n=75) | P值 |
| 年龄/岁 | |||
| < 58 | 15(46.9) | 36(48.0) | 0.676 |
| ≥58 | 17(53.1) | 39(52.0) | |
| 性别 | |||
| 女 | 24(75.0) | 47(62.7) | 0.267 |
| 男 | 8(25.0) | 28(37.3) | |
| 吸烟 | |||
| 是 | 7(21.9) | 24(32.0) | 0.356 |
| 否 | 25(78.1) | 51(68.0) | |
| PS评分 | |||
| 0~1 | 27(84.4) | 59(78.7) | 0.601 |
| ≥2 | 5(15.6) | 16(21.3) | |
| 突变状态 | |||
| 19Del | 16(50.0) | 32(42.7) | 0.761 |
| 21Mt | 11(34.4) | 31(41.3) | |
| 不详 | 5(15.6) | 12(16.0) | |
| EGFR-TKIs | |||
| 厄洛替尼 | 15(46.9) | 41(54.7) | 0.327 |
| 吉非替尼 | 15(46.9) | 33(44.0) | |
| 埃克替尼 | 2(6.3) | 1(1.3) | |
| 转移灶 | |||
| 1 | 15(46.9) | 30(40.0) | 0.288 |
| >1 | 17(53.1) | 45(60.0) |
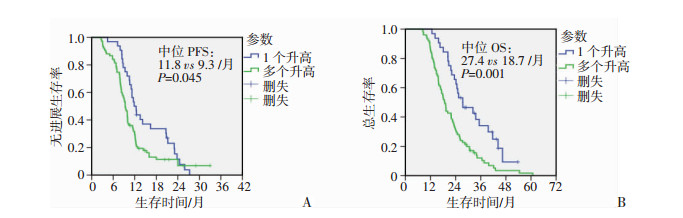
|
| A:PFS;B:OS 图 2 多参数联合的生存曲线 |
3 讨论
本研究中单因素生存分析提示NSE、CA125、Cyfra21-1为影响PFS的重要临床参数;而多因素生存分析显示CA125和NSE为PFS的独立危险因素,所以我们认为治疗前低水平的CA125或NSE预示Ⅳ期非小细胞肺癌患者接受一线EGFR-TKIs治疗可能获得较长的PFS。同理,单因素和多因素分析显示PS评分、NSE、CA125、CA15-3为显著影响OS的临床参数。因此,治疗前PS评分为0~1分,低水平的NSE、CA125或者CA15-3的Ⅳ期非小细胞肺癌患者接受一线EGFR-TKIs治疗可能获得较长的OS。本研究中多因素分析显示肝转移为OS的独立危险因素,相对危险度为2.060,P=0.011,而IMpower150临床研究结果显示EGFR突变阴性的肝转移患者PFS较没有肝转移患者长[8]。那么EGFR突变阳性的肝转移患者一线耐药后使用免疫治疗的效果相对没有肝转移的患者,效果是好还是差?这也许只有期待相应的临床研究来解答。本研究中有肝、脑、骨、双肺转移的患者较没有转移的患者PFS和OS都有所缩短,虽然差异未达到统计学意义,但我们相信扩大样本量可以得到更可靠的结果。
本研究发现Ⅳ期NSCLC患者一线EGFR-TKIs治疗前高水平NSE预示着较差的预后,PFS、OS都较NSE低水平组短。SUH等[9]研究也有类似的结果,不同的是他们关注的是Ⅲ B~Ⅳ期的患者,而本研究的目标人群为Ⅳ期患者。Ⅳ期患者都有远处转移,预后更差,所以一线治疗前的预后预测显得尤为重要。本研究中NSE的高组定义为NSE≥中位值(14.77 ng/mL),而SUH等[9]的研究中NSE定义为高于正常值(16.3 ng/mL),本研究有利于发现NSE正常偏高值但EGFR-TKIs预后不良的这部分人群。既往研究认为血清NSE是小细胞肺癌(SCLC)诊断及预后较好的标志物[10-12]。本研究中NSE在预测NSCLC预后中也很有意义,可能存在以下原因:部分肺癌患者存在小细胞和非小细胞混合成分[13],针尖活检并不能反映其病理类型的全貌,而这部分有混合成分的患者预后较差。此外,SCLC转化是EGFR-TKIs耐药的一个机制[14],所以治疗前的NSE高者是否可能预示着SCLC转化的可能,进而导致EGFR-TKIs疗效不佳?这需要二次活检来证实。总之,我们推测治疗前NSE检测有利于筛选EGFR-TKIs治疗有生存获益的人群。
细胞角蛋白19(Cyfra21-1)是上皮细胞细胞骨架的一部分,是NSCLC特异性和敏感性高的血清标志物。Cyfra21-1在鳞癌中高表达[15],但肺鳞癌对EGFR-TKIs治疗效果差[16]。TAKEUCHI等[17]报道EGFR野生型或者突变状态未知的患者,血清Cyfra21-1升高者PFS和OS较短,但本研究中Cyfra21-1高组PFS、OS也都较短。这是否提示当血清中Cyfra21-1升高,不管EGFR突变与否都意味着预后不良?那么当初诊NSCLC患者使用EGFR-TKIs前检验结果提示Cyfra21-1高,则需要慎重用药或更改治疗方案。当然,这需要进一步的研究来证实。CA125主要在癌变的卵巢上皮细胞膜上表达,是卵巢癌的主要肿瘤标志物。既往研究表明血清CA125高水平与卵巢癌[18]、子宫乳头状浆液性腺癌(UPSC)[19]、胃癌[20]等恶性肿瘤的不良预后有关。CA125用于预测肺癌预后还存在一定争论,本研究中高CA125组的PFS和OS都较低CA125组短,与陈含笑[21]、KIMURA等[22]的研究报道结果较一致。CA15-3多用于乳腺癌的诊断,术后复发监测及预后预测[23-24],而用于预测NSCLC预后的研究报道较少。本研究中CA15-3高水平组OS较短,并且多因素分析提示CA15-3是影响生存期的独立因素,但CA15-3水平并不能预测PFS。因此,需要联合CA15-3及其他临床参数来预测EGFR-TKIs的预后。本研究发现CA125、Cyfra21-1、CA15-3和NSE中多个参数升高组的PFS和OS较单个参数升高组短。文献[25]报道利用基于4种生物标志物(CA125、Cyfra21-1、CEA、Pro-SFTPB)的风险预测模型与传统的风险预测模型相比可以改善肺癌风险评估。提示联合多个临床参数在预测EGFR-TKIs预后中可能发挥更大的作用,如果治疗前发现患者有多个临床参数升高,那么该患者可能对一代EGFR-TKIs预后不良。此时,可以考虑使用二代或者三代EGFR-TKIs,或者联合化疗、抗血管生成治疗等。此外,对于这群多参数升高的患者,要缩短随访间隔时间,及时更改治疗方案。
综上,治疗前低水平CA125或NSE预示着Ⅳ期NSCLC一线EGFR-TKIs治疗PFS较长,而PS评分0~1分、低水平NSE、CA125或CA15-3则预示OS较长。CA125、Cyfra21-1、CA15-3和NSE 4个临床参数联合有望成为预测Ⅳ期NSCLC一线EGFR-TKIs疗效的简易标志物。但由于本研究为回顾性研究,所以需要前瞻性研究来进一步证实。
| [1] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | MOK T S, WU Y L, THONGPRASERT S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947–957. DOI:10.1056/NEJMoa0810699 |
| [3] | WU Y L, ZHOU C, LIAM C K, et al. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase Ⅲ, randomized, open-label, ENSURE study[J]. Ann Oncol, 2015, 26(9): 1883–1889. DOI:10.1093/annonc/mdv270 |
| [4] | SHI Y K, WANG L, HAN B H, et al. First-line icotinib versus cisplatin/pemetrexed plus pemetrexed maintenance therapy for patients with advanced EGFR mutation-positive lung adenocarcinoma (CONVINCE): a phase 3, open-label, randomized study[J]. Ann Oncol, 2017, 28(10): 2443–2450. DOI:10.1093/annonc/mdx359 |
| [5] | LIN G N, PENG J W, LIU P P, et al. Elevated neutrophil-to-lymphocyte ratio predicts poor outcome in patients with advanced non-small-cell lung cancer receiving first-line gefitinib or erlotinib treatment[J]. Asia Pac J Clin Oncol, 2017, 13(5): e189–e194. DOI:10.1111/ajco.12273 |
| [6] | LI H, WANG Y, SU F, et al. Monitoring of cyclooxygenase-2 levels can predict EGFR mutations and the efficacy of EGFR-TKI in patients with lung adenocarcinoma[J]. Int J Clin Exp Pathol, 2015, 8(5): 5577–5583. |
| [7] | FIALA O, PESEK M, FINEK J, et al. Change in serum lactate dehydrogenase is associated with outcome of patients with advanced-stage NSCLC treated with erlotinib[J]. Anticancer Res, 2016, 36(5): 2459–2465. DOI:10.1007/s13277-015-3660-3 |
| [8] | SOCINSKI M A, JOTTE R M, CAPPUZZO F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288–2301. DOI:10.1056/NEJMoa1716948 |
| [9] | SUH K J, KEAM B, KIM M, et al. Serum neuron-specific enolase levels predict the efficacy of first-line epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors in patients with non-small cell lung cancer harboring EGFR mutations[J]. Clin Lung Cancer, 2016, 17(4): 245–252. DOI:10.1016/j.cllc.2015.11.012 |
| [10] | JØRGENSEN L G, OSTERLIND K, GENOLL J, et al. Serum neuron-specific enolase (S-NSE) and the prognosis in small-cell lung cancer (SCLC): a combined multivariable analysis on data from nine centres[J]. Br J Cancer, 1996, 74(3): 463–467. DOI:10.1038/bjc.1996.383 |
| [11] | JØRGENSEN L G, OSTERLIND K, HANSEN H H, et al. Serum neuron-specific enolase (S-NSE) in progressive small-cell lung cancer (SCLC)[J]. Br J Cancer, 1994, 70(4): 759–761. DOI:10.1038/bjc.1994.391 |
| [12] | BONNER J A, SLOAN J A, ROWLAND KM Jr, et al. Significance of neuron-specific enolase levels before and during therapy for small cell lung cancer[J]. Clin Cancer Res, 2000, 6(2): 597–601. |
| [13] | YESNER R, CARTER D. Pathology of carcinoma of the lung. Changing patterns[J]. Clin Chest Med, 1982, 3(2): 257–289. |
| [14] | OSER M G, NIEDERST M J, SEQUIST L V, et al. Transformation from non-small-cell lung cancer to small-cell lung cancer: molecular drivers and cells of origin[J]. Lancet Oncol, 2015, 16(4): e165–e172. DOI:10.1016/S1470-2045(14)71180-5 |
| [15] | PUJOL J L, GRENIER J, DAUR S J P, et al. Serum fragment of cytokeratin subunit 19 measured by CYFRA 21-1 immunoradiometric assay as a marker of lung cancer[J]. Cancer Res, 1993, 53(1): 61–66. |
| [16] | SHUKUYA T, TAKAHASHI T, KAIRA R, et al. Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports[J]. Cancer Sci, 2011, 102(5): 1032–1037. DOI:10.1111/j.1349-7006.2011.01887.x |
| [17] | TAKEUCHI A, OGURI T, SONE K, et al. Predictive and prognostic value of CYFRA 21-1 for advanced non-small cell lung cancer treated with EGFR-TKIs[J]. Anticancer Res, 2017, 37(10): 5771–5776. DOI:10.21873/anticanres.12018 |
| [18] | FERRARO S, ROBBIANO C, TOSCA N, et al. Serum human epididymis protein 4 vs carbohydrate antigen 125 in ovarian cancer follow-up[J]. Clin Biochem, 2018, 60: 84–90. DOI:10.1016/j.clinbiochem.2018.08.003 |
| [19] | SCHMIDT M, SEGEV Y, SADEH R, et al. Cancer antigen 125 levels are significantly associated with prognostic parameters in uterine papillary serous carcinoma[J]. Int J Gynecol Cancer, 2018, 28(7): 1311–1317. DOI:10.1097/IGC.0000000000001300 |
| [20] | NAKATA B, HIRAKAWA-YS CHUNG K, KATO Y, et al. Serum CA 125 level as a predictor of peritoneal dissemination in patients with gastric carcinoma[J]. Cancer, 1998, 83(12): 2488–2492. DOI:10.1002/(ISSN)1097-0142 |
| [21] |
陈含笑, 杨雪, 刘慧君, 等. 血清肿瘤标志物与一线EGFR-TKIs治疗晚期EGFR突变型肺腺癌患者疗效相关性分析[J].
中国肺癌杂志, 2017, 20(9): 589–597.
CHEN H X, YANG X, LIU H J, et al. Correlation between serum tumor markers and efficacy of first-line EGFR-TKIs in patients with advanced lung adenocarcinoma[J]. Chin J Lung Cancer, 2017, 20(9): 589–597. DOI:10.3779/j.issn.1009-3419.2017.09.01 |
| [22] | KIMURA Y, FUJⅡ T, HAMAMOTO K, et al. Serum CA125 level is a good prognostic indicator in lung cancer[J]. Br J Cancer, 1990, 62(4): 676–678. DOI:10.1038/bjc.1990.355 |
| [23] | SHAO Y, SUN X, HE Y, et al. Elevated levels of serum tumor markers CEA and CA15-3 are prognostic parameters for different molecular subtypes of breast cancer[J]. PLoS ONE, 2015, 10(7): e133830. DOI:10.1371/journal.pone.0133830 |
| [24] | WU S G, HE Z Y, ZHOU J, et al. Serum levels of CEA and CA15-3 in different molecular subtypes and prognostic value in Chinese breast cancer[J]. Breast, 2014, 23(1): 88–93. DOI:10.1016/j.breast.2013.11.003 |
| [25] | Integrative Analysis of Lung Cancer Etiology and Risk (INTEGRAL) Consortium for Early Detection of Lung Cancer. Assessment of lung cancer risk on the basis of a biomarker panel of circulating proteins[J]. JAMA Oncol, 2018, 4(10): e182078. DOI:10.1001/jamaoncol.2018.2078 |



