2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院心内科
2. Department of Cardiology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
钙离子是已知的参与调节细胞功能的信使离子。其主要作用方式是通过位于细胞膜的钙离子通道进入细胞,引起胞内钙离子浓度在时间及空间的变化,从而参与调节细胞增殖、凋亡、基因转录、细胞分泌等诸多生理功能。目前已知的钙离子通道类型包括电压门控型(voltage dependent calcium channel,VDC)、受体操纵型(receptor operated calcium channel,ROC)以及钙库操纵型(store operated calcium channel,SOC)。既往研究提示,钙离子参与调节血管内皮细胞功能[1],例如在原发性高血压患者,钙通道阻滞剂依福地平(L型及T-型钙通道阻滞剂)不仅能有效降压,还能显著改善患者的血管内皮功能[2-3],此作用主要是通过阻断T型钙通道实现。THUESEN等[4]进一步证实,敲除T-型钙通道能够显著改善老龄小鼠的血管内皮功能。
SOC介导的钙库操纵性钙内流(store operated calcium entry,SOCE)不同于VDC和ROC介导的钙内流,其激活方式依赖细胞内钙库的耗竭,位于细胞质的STIM1蛋白作为钙离子浓度感受器,通过感受自身钙离子浓度耗竭而激活,随后与位于胞膜的Orai蛋白偶联激活形成钙离子通道。作为非兴奋细胞的一种基本钙内流方式,SOCE参与调节细胞的诸多生理功能,如细胞分泌、基因转录、增殖、凋亡等。但目前有关SOCE与EC功能的关系不明,因此本研究利用体外培养的人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs),初步探讨SOCE对EC功能的影响。
1 材料与方法 1.1 细胞培养及处理分组HUVECs细胞(HUM-CELL-0020,武汉原生原代)以含20%胎牛血清的1640培养基(Hyclon)的培养瓶贴壁培养,培养瓶置于37 ℃、5%CO2培养箱中。每3 d传代1次,第3次传代根据目标实验分别接种于激光共聚焦培养皿、96孔板和6孔培养板中。培养于激光共聚焦培养皿的细胞用于检测SOCE,随机分为对照组和不同剂量(10、25、50、75、100 μmol/L)2-APB干预组,共6组(n=10)。培养于6孔板的细胞用于分析EC的增殖(n=9)、迁移(n=10)、NO产量(n=6)及eNOS合成(n=10),随机分为对照组和不同剂量(50、75、100 μmol/L)2-APB干预组。
1.2 钙离子探针孵育取接种于激光共聚焦培养皿并培养1 d的细胞,加入终浓度为5 μmol/L的Fluo-3/AM钙离子探针(碧云天),37 ℃避光孵育30 min后,吸弃培养液并以PBS漂洗3次,加入新鲜培养液再次避光孵育60 min后即于激光共聚焦下检测SOCE。
1.3 SOCE检测取孵育钙离子探针的细胞对照组细胞,吸弃原培养液,以无钙离子的HBSS漂洗3次后每个培养皿加入1 mL无钙离子的HBSS并置于显微镜载物台。干预组细胞于扫描前5 min分别加入不同浓度(10、25、50、75、100 μmol/L)的2-APB(Sigma),对照组细胞给予等量HBSS。选取视野后,共聚焦显微镜行基线扫描1 min(激发波长488 nm,发射波长530 nm,连续扫描模式),向培养皿中加入终浓度为2 μmol/L的毒胡萝卜素(TG,Sigma,可特异性抑制内质网上G2+-ATP酶,从而引起细胞内钙库的耗竭)并继续扫描直至基线稳定,向培养皿中加入钙离子终浓度为2 mmol/L的氯化钙溶液,继续扫描10 min。
1.4 EC增殖功能检测本研究采用CCK-8试剂盒检测细胞的增殖功能。取接种于96孔板并培养1 d的细胞,干预组细胞加入不同浓度的(50、75、100 μmol/L)的2-APB,对照组给予等量的HBSS。培养24 h后,吸弃原培养基,每孔加入100 μL新鲜培养基以及10 μL CCK-8染液,37 ℃孵育4 h,继之以450 nm波长测每孔吸光度。
1.5 血管内皮细胞迁移功能检测取接种于6孔板并培养2 d的细胞,吸弃原培养基并以PBS漂洗3次,加入0.25%胰酶-EDTA消化细胞,以含10%胎牛血清的培养基终止消化,收集细胞悬液,离心沉淀后以不含血清的培养基重悬细胞,调整细胞密度为4×104/mL,取100 μL细胞悬液加入Transwell小室上层。干预组加入不同浓度(50、75、100 μmol/L)的2-APB,对照组给予等量的HBSS。下层加入含10%胎牛血清和50 ng/mL的VEGF的培养基200 μL,37 ℃培养24 h后,取出Transwell小室,PBS漂洗3次后加入4%多聚甲醛室温固定15 min,再次漂洗后加入0.1%的结晶紫染液,37 ℃染色20 min,PBS漂洗3次后,以棉签擦拭渗透膜上层,显微镜下观察并计数渗透膜下层细胞。
1.6 NO测定NO极不稳定,在细胞内很快代谢为硝酸盐和亚硝酸盐。利用硝酸盐还原酶将硝酸盐还原为亚硝酸盐后,通过经典的Griess Reagent方法检测亚硝酸盐含量(实为硝酸盐和亚硝酸盐总量),即可推算出总的NO含量。本研究利用总NO含量检测试剂盒(内含硝酸盐还原酶及Griess Rreagent,碧云天)检测培养细胞NO产量。取接种于6孔板并培养2 d的细胞,干预组加入不同浓度(50、75、100 μmol/L)的2-APB预处理2 h,对照组给予等量的HBSS。根据试剂盒说明书于96孔板加入不同浓度的标准品,细胞培养液离心沉淀后取50 μL上清加入96孔板。待测孔分别加入Griess Reagent Ⅰ和Griess Reagent Ⅱ各50 μL/孔,于540 nm测吸光度。根据标准品吸光度制定的标准曲线换算各样本NO含量。
1.7 eNOS检测取接种于6孔板并培养2 d的细胞,干预组加入不同浓度(50、75、100 μmol/L)的2-APB预处理2 h,对照组给予等量的HBSS。RIPA裂解液(按1 :100添加PMSF,碧云天)裂解细胞提取总蛋白,离心后取上清,BCA法测蛋白浓度。添加SDS上样缓冲液(碧云天)后95 ℃变性5 min,取20 μg蛋白进行SDS-PAGE胶电泳后转移至PVDF膜,5%BSA室温封闭1 h,孵育eNOS抗体(1 :1 000,Santa)、β-actin(1 :1 000,碧云天)于4 ℃过夜,漂洗后与HRP标记的IgG抗体37 ℃孵育1 h,以ECL试剂盒显影,Quantity One软件分析条带吸光度值。
1.8 统计学分析结果以x±s表示,采用SPSS 16.0进行统计分析,均数比较采用t检验或单因素方差分析。
2 结果 2.1 2-APB显著抑制EC的SOCE本研究选用2-APB作为SOCE的抑制剂,观察干预SOCE对EC功能的影响。如图 1A所示,钙离子探针荧光强度的实时曲线提示,培养体系无钙条件下,给予TG后引起内源性钙释放(第1个波峰),随后给予含钙离子的缓冲液,引起的钙内流即为SOCE(第2个波峰),统计细胞的钙内流振幅显示(图 1B),较低剂量的2-APB(10、20 μmol/L)对SOCE有抑制趋势,但无统计学意义,较高剂量的2-APB(50、75、100 μmol/L)能够显著抑制SOCE的振幅(与对照组比较,SOCE振幅分别下降39.6%、66.5%和90.5%,P < 0.05)。

|
| A:钙离子探针荧光强度的实时曲线;B:钙内流振幅统计(n=10,x±s),a:P < 0.05与对照组比较 图 1 2-APB抑制血管内皮细胞的钙库操纵性钙内流 |
2.2 抑制SOCE对EC增殖的影响
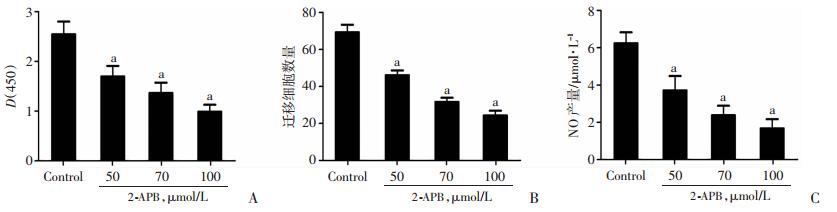
根据前述2-APB对SOCE的抑制效应,用具有显著抑制作用浓度的2-APB(50、75、100 μmol/L),观察抑制SOCE对EC增殖的影响。结果如图 2A显示,抑制SOCE能够显著抑制EC的增殖能力,且随着对SOCE抑制效应增加,对EC的增殖功能抑制愈加明显(与对照组比较,EC的增殖分别下降33.2%、46.3%和61.2%,P < 0.05)。
|
| A:EC的增殖(n=9);B:EC的迁移(n=10);C:NO产量(n=6) a:P < 0.05与对照组比较 图 2 钙库操纵性钙内流的降低显著抑制血管内皮细胞的增殖、迁移及NO产量(x±s) |
2.3 抑制SOCE对EC迁移功能的影响
研究用Transwell小室观察EC由渗透膜上层迁移到下层的能力,在观察时间内,计数不同组间迁移到渗透膜下层的细胞,结果显示(图 2B),抑制SOCE能够显著降低EC的迁移能力,且随2-APB剂量增加,抑制效果俞加明显(与对照组比较,分别下降33.5%、54.3%和64.9%,P < 0.05)。
2.4 抑制SOCE对NO的影响研究用经典的Griess Reagent测定EC的NO产量,结果显示(图 2C),抑制SOCE能够显著降低EC的NO产量,且随2-APB剂量增加,抑制效果俞加明显(与对照组比较,分别下降40.5%、61.9%和73.1%,P < 0.05)。
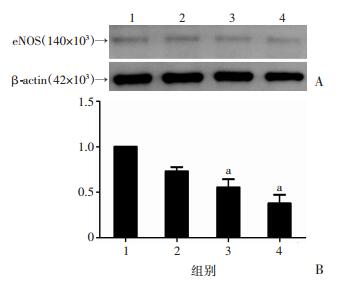
2.5 抑制SOCE对eNOS的影响本研究利用Western blot方法测定eNOS的合成,结果显示(图 3),抑制SOCE能够显著降低eNOS的合成,且随2-APB剂量增加,抑制效果俞加明显(与对照组比较,50 μmol/L组有降低趋势,但无统计学意义,75和100 μmol/L组分别下降45.1%和62.4%,P < 0.05)。
|
| 1~4分别为对照组,2-APB 50、75、100 μmol/L干预组A:Western blot检测不同剂量2-APB抑制SOCE后eNOS合成情况;B:各组灰度统计(n=3,x±s) a:P < 0.05,与对照组比较 图 3 钙库操纵性钙内流降低对血管内皮细胞eNOS合成的抑制 |
3 讨论
本研究应用SOCE阻滞剂观察阻断SOCE对EC增殖、迁移功能和NO产量的影响,结果显示:①2-APB能够有效抑制SOCE;②阻断SOCE能够显著抑制EC的增殖、迁移功能以及抑制NO产量;③此作用可能是通过抑制eNOS实现。
EC是位于血流与血管腔之间的单层扁平状细胞,其作用不仅仅是血流与血管腔的物理性屏障,更具有多种生物学功能。目前认为,EC损伤是动脉粥样硬化发展过程中的最初环节,多种心血管病危险因素如高血压、糖尿病、吸烟、肥胖等均可引起EC功能异常。因此,对EC功能的调节机制研究凸显重要。
钙离子拮抗剂是临床常用的降压药物,而既往研究也发现,除降压作用外,此类药物对改善血管内皮功能具有显著作用,但其具体机制仍不明确。众所周知,钙离子是已知的参与调节细胞功能的基础信使离子。其对细胞功能的调节方式主要依靠多种钙离子通道的开闭从而引起细胞内外钙离子浓度差异,此种空间和时间上的离子浓度变化被细胞内的感受器及作用单元识别,从而进一步调节细胞功能。相对于VOC和ROC,SOC是相对较新的另一类钙离子通道,其介导的钙离子内流称为SOCE。SOCE的概念最初于1986年由PUTENY[5]提出,其激活依赖于细胞内钙库的消耗,随后的大量研究集中于寻找钙库钙离子浓度改变的信号向细胞膜传递的机制,直至2005年,ZHANG[6]首次证实STIM1蛋白一种位于内质网上钙离子浓度感受器,可以将内质网钙离子浓度改变的信号传递至胞膜并激活SOCE。ORAI1蛋白是构成SOC的通道蛋白,其位于细胞膜上,能够与STIM1蛋白偶联并被其激活,从而引起构象变化形成钙离子通道[7]。
伴随对SOC构成的解密,有关SOCE对细胞功能调节的报道越来越多。例如,在体外培养的血管平滑肌细胞,通过抑制介导SOCE的通道组成蛋白STIM1和Orai1后,不仅有效抑制SOCE,并且显著抑制血管紧张素Ⅱ诱导[8]或尾加压素诱导[9]的血管平滑肌细胞增殖,而上调STIM1表达能显著促进血管平滑肌细胞增殖和迁移[10]。在非小细胞腺癌细胞,药物抑制Orai3或基因沉默Orai3后,SOCE受到显著抑制并显著抑制非小细胞腺癌细胞的增殖[11]。相似的,在恶性胶质瘤细胞,药物阻断SOCE或者基因沉默STIM1和Orai1后,其增殖受到显著抑制[12]。相似的,本研究利用药物(2-APB)阻断SOCE后,EC的增殖也受到显著抑制,并且随着对SOCE的抑制增加,对细胞增殖的抑制俞加明显。此结果与上述的其他细胞类型观察到的现象是一致的。除了增殖功能,我们还发现,抑制SOCE对EC的迁移功能和NO产量均产生显著的抑制效应。这提示SOCE可能作为一种上游的基本方式调节细胞诸多生理功能。
既往研究证实,eNOS对调节EC的增殖、迁移以及NO产量都具有关键作用[13-14],同时,其也是多种因素调节EC功能的共同靶点[14-16]。而本研究也证实,抑制SOCE能够显著抑制eNOS的合成。这提示上述抑制SOCE引起EC增殖功能、迁移功能和NO产量的作用,可是通过(至少是部分地)抑制eNOS的合成而实现的。而SOCE的降低是以何种方式影响eNOS的合成,则需要我们以后进一步去探讨。
上述研究我们采用2-APB抑制SOCE,以此观察SOCE与EC功能的关系。2-APB是一种膜渗透性药物,被广泛应用于SOCE的研究,但其对SCOE作用机制仍未阐明。起初认为是2-APB通过抑制磷脂酰肌醇3受体(IP3R)而抑制SOCE[17],但随后的研究证实在缺乏IP3R的细胞,2-APB也能抑制SOCE,这说明其作用机制是不依赖于IP3R的[18-19]。虽然目前对2-APB抑制SOCE的具体机制仍未阐明,但因为其具有快速、有效的抑制TG等诱发的SOCE的作用,仍是目前研究SOCE通用的抑制剂之一[20]。另外,据报道,2-APB对SOCE的作用具有剂量依赖的差异。例如在淋巴细胞,低浓度的2-APB(1~5 μmol/L)显著增加SOCE的,而高浓度的2-APB(>50 μmol/L)则具有显著的抑制作用[19]。本研究发现,较低浓度的2-APB(10、20 μmol/L)对EC的SOCE也显现出抑制趋势,但无统计学意义,而较高剂量的2-APB(50、75、100 μmol/L)能够显著抑制SOCE的振幅。相应的,较高剂量的2-APB能够显著影响EC的增殖、迁移功能以及NO产量。鉴于2-APB对SOCE抑制的机制不甚明确,其对细胞功能的影响可能存在其他机制,抑或2-APB也可能对细胞功能具有直接地作用,但本研究的结果至少说明2-APB可通过(至少是部分地)抑制SOCE而影响EC的功能。
综上,本研究进一步证实,钙离子参与调节EC功能,而与既往研究不同的是,我们观察到抑制SOCE能够显著抑制EC的增殖、迁移并降低NO产量,此作用可能是通过抑制eNOS的合成实现。这也说明钙离子可通过不同的离子通道作用于细胞而对细胞功能实现复杂的调控作用。
| [1] | CHEN W, XU C Q, WANG L Q, et al. K15 protein of kaposi's sarcoma herpesviruses increases endothelial cell proliferation and migration through store-operated calcium entry[J]. Viruses, 2018, 10(6): E282. DOI:10.3390/v10060282 |
| [2] | KOH K K, QUON M J, LEE S J, et al. Efonidipine simultaneously improves blood pressure, endothelial function, and metabolic parameters in nondiabetic patients with hypertension[J]. Diabetes Care, 2007, 30(6): 1605–1607. DOI:10.2337/dc06-2267 |
| [3] | OSHIMA T, OZONO R, YANO Y, et al. Beneficial effect of T-type calcium channel blockers on endothelial function in patients with essential hypertension[J]. Hypertens Res, 2005, 28(11): 889–894. DOI:10.1291/hypres.28.889 |
| [4] | THUESEN A D, ANDERSEN K, LYNGSØ K S, et al. eletion of T-type calcium channels Cav3.1 or Cav3.2 attenuates endothelial dysfunction in aging mice[J]. Pflugers Arch, 2018, 470(2): 355–365. DOI:10.1007/s00424-017-2068-x |
| [5] | PUTNEY J W JR. A model for receptor-regulated calcium entry[J]. Cell Calcium, 1986, 7(1): 1–12. DOI:10.1016/0143-4160(86)90026-6 |
| [6] | ZHANG S L, YU Y, ROOS J, et al. STIM1 is a Ca2+ sensor that activates CRAC channels and migrates from the Ca2+ store to the plasma membrane[J]. Nature, 2005, 437(7060): 902–905. DOI:10.1038/nature04147 |
| [7] | FESKE S, GWACK Y, PRAKRIYA M, et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function[J]. Nature, 2006, 441(7090): 179–185. DOI:10.1038/nature04702 |
| [8] | GUO R W, YANG L X, LI M Q, et al. Stim1- and Orai1-mediated store-operated calcium entry is critical for angiotensin Ⅱ-induced vascular smooth muscle cell proliferation[J]. Cardiovasc Res, 2012, 93(2): 360–370. DOI:10.1093/cvr/cvr307 |
| [9] | RODRÍGUEZ-MOYANO M, DÍAZ I, DIONISIO N, et al. Urotensin-Ⅱ promotes vascular smooth muscle cell proliferation through store-operated calcium entry and EGFR transactivation[J]. Cardiovasc Res, 2013, 100(2): 297–306. DOI:10.1093/cvr/cvt196 |
| [10] | MAO Y Y, WANG J Q, GUO X X, et al. Circ-SATB2 upregulates STIM1 expression and regulates vascular smooth muscle cell proliferation and differentiation through miR-939[J]. Biochem Biophys Res Commun, 2018, 505(1): 119–125. DOI:10.1016/j.bbrc.2018.09.069 |
| [11] | AY A S, BENZERDJEB N, BENZERDJERB N, et al. Orai3 constitutes a native store-operated calcium entry that regulates non small cell lung adenocarcinoma cell proliferation[J]. PLoS One, 2013, 8(9): e72889. DOI:10.1371/journal.pone.0072889 |
| [12] | LIU H L, HUGHES J D, ROLLINS S, et al. Calcium entry via ORAI1 regulates glioblastoma cell proliferation and apoptosis[J]. Exp Mol Pathol, 2011, 91(3): 753–760. DOI:10.1016/j.yexmp.2011.09.005 |
| [13] | THUM T, TSIKAS D, FROLICH J C, et al. Growth hormone induces eNOS expression and nitric oxide release in a cultured human endothelial cell line[J]. FEBS Lett, 2003, 555(3): 567–571. DOI:10.1016/S0014-5793(03)01356-5 |
| [14] | GENTILE C, MUISE-HELMERICKS R C, DRAKE C J. VEGF-mediated phosphorylation of eNOS regulates angioblast and embryonic endothelial cell proliferation[J]. Dev Biol, 2013, 373(1): 163–175. DOI:10.1016/j.ydbio.2012.10.020 |
| [15] | LIU D, WU M Q, LU Y, et al. Protective effects of 6-Gingerol on vascular endothelial cell injury induced by high glucose via activation of PI3K-AKT-eNOS pathway in human umbilical vein endothelial cells[J]. Biomed Pharmacother, 2017, 93: 788–795. DOI:10.1016/j.biopha.2017.07.037 |
| [16] | HE Z H, CHEN Y, HOU C, et al. Cigarette smoke extract changes expression of endothelial nitric oxide synthase (eNOS) and p16(INK4a) and is related to endothelial progenitor cell dysfunction[J]. Med Sci Monit, 2017, 23: 3224–3231. DOI:10.12659/MSM.902746 |
| [17] | MA H T, PATTERSON R L, VAN ROSSUM D B, et al. Requirement of the inositol trisphosphate receptor for activation of store-operated Ca2+ channels[J]. Science, 2000, 287(5458): 1647–1651. DOI:10.1126/science.287.5458.1647 |
| [18] | BROAD L M, BRAUN F J, LIEVREMONT J P, et al. Role of the phospholipase C-inositol 1, 4, 5-trisphosphate pathway in calcium release-activated calcium current and capacitative calcium entry[J]. J Biol Chem, 2018, 276(19): 15945–15952. DOI:10.1201/9781315152592-11 |
| [19] | PRAKRIYA M, LEWIS R S. Potentiation and inhibition of Ca(2+) release-activated Ca(2+) channels by 2-aminoethyldiphenyl borate (2-APB) occurs independently of IP(3) receptors[J]. J Physiol (Lond), 2001, 536(Pt 1): 3–19. |
| [20] | WU C Y, HSU W L, WANG C H, et al. A novel strategy for TNF-alpha production by 2-APB induced downregulated SOCE and upregulated HSP70 in O. tsutsugamushi-infected human macrophages[J]. PLoS ONE, 2016, 11(7): e0159299. DOI:10.1371/journal.pone.0159299 |



