细菌脂多糖(lipopolysaccharide,LPS)是革兰阴性菌的重要致病因子,能引起多种炎症反应,是常用的离体活化刺激因素[1]。LPS刺激后的中性粒细胞胞内炎症因子的水平增高,脱颗粒能力增强,以及表面趋化因子受体的过表达,这一系列的变化为中性粒细胞到达病灶并及时清除病原菌做好准备[2]。但若中性粒细胞过度活化则有可能造成炎症反应的失控,进而造成机体不必要的损伤。因而发现中性粒细胞活化调控的相关分子及靶点,对于炎症的可控性至关重要。
代谢型谷氨酸受体5(metabotropic glutamate receptor 5, mGluR5)是一种主要表达在中枢神经系统内各类细胞上的G蛋白偶联受体,其主要功能是参与在中枢神经细胞间的神经递质信号的传递[3]。越来越多的证据表明其在外周组织也有着密切的调控作用,如呼吸道的反应、胃肠蠕动、皮肤黏膜再生以及免疫调控[4]。曾有研究证实T淋巴细胞在发育的不同阶段,代谢型谷氨酸受体的表达也会发生改变,这提示mGluR5的表达水平可能参与了T淋巴细胞的成熟,同时激活mGluR5可以促进anti-CD3对T细胞的活化与增殖[5]。之前本课题组发现,敲除mGluR5能够明显抑制颅脑创伤后小鼠脑实质里的中性粒细胞的浸润[6],说明mGluR5的活化可能促进中性粒细胞的活化和募集,但关于mGluR5在中性粒细胞表面是否表达,以及其是否会影响中性粒细胞的功能尚不清楚。因此我们以LPS诱导中性粒细胞活化作为离体模型,并从野生型(wild type, WT)及mGluR5基因敲除(knockout, KO)小鼠分离得到原代中性粒细胞。分别探讨mGluR5在中性粒细胞的表达情况,其是否对LPS诱导的中性粒细胞活化有调节作用,及其可能的分子机制。
1 材料与方法 1.1 材料1640培养基购自HyClone公司,胎牛血清购自Gibco公司,LPS(Escherichia coli 0111:B4, L2630)购自上海Sigma公司,中性粒细胞提取试剂盒(TBD, 2013NHU)购自天津灏洋公司,IL-1β及TNF-α的ELISA试剂盒(BMS6002TWO和BMS607-2INST)购自Thermo Fisher公司,mGluR5抗体(76316)购自Abcam公司,p-ERK(4370)、p-JNK(9255)、p-AKT(4060)、p-P65(93H1)及GAPDH(5174)均购自CST公司。JNK抑制剂(SP600125)、PI3K抑制剂(LY294002)、NF-κB抑制剂(JSH23)及ERK抑制剂(SCH772984)均购自Selleck公司。mGluR5的选择性激动剂CHPG(3695)及选择性拮抗剂MPEP(1212)均购自TOCRIS公司。mGluR5全身敲除C57BL/6J小鼠和野生型C57BL/6J小鼠购自南京大学模式动物研究所,并在陆军军医大学第三附属医院实验动物中心SPF级饲养繁殖,鉴定基因型后用于实验。选取体质量20~25 g,8~12周龄,繁殖13~15代内的雄性小鼠。
1.2 方法 1.2.1 小鼠原代中性粒细胞的分离及处理mGluR5全身敲除和野生型C57BL/6小鼠脱颈处死后立即取出股骨和胫骨,在超净台内用无菌生理盐水冲洗出骨髓悬液,并用红细胞裂解液去除多余的红细胞。随后用200目的筛网过滤细胞悬液后,轻柔的加在Percoll上采用梯度离心的方式得到物理纯化的中性粒细胞(4 500 r/min, 30 min)。将纯化得到的中性粒细胞用洗涤液清洗3次后,用含10 %胎牛血清的1640培养基重悬并计数,于37 ℃,5% CO2培养箱内培养,根据后续相应的实验步骤处理细胞,分别收集细胞及细胞上清培养液进行Western blot、real time-PCR及ELISA的检测。LPS在培养基中的最终浓度为200 ng/mL。
1.2.2 Western blot检测实验分为两组:①对照组,无LPS刺激;②LPS组,用200 ng/mL的LPS刺激。24 h后收集细胞提取蛋白并检测mGluR5、p-ERK、p-JNK、p-AKT、p-P65及GAPDH蛋白的表达情况, 每一组样品均为独立试验样品。抑制剂处理实验分为6组:①对照组,无LPS刺激;②LPS组,用200 ng/mL的LPS刺激;③LPS+SCH772984组,用200 ng/mL LPS刺激合并ERK抑制剂SCH772984处理组; ④LPS+SP600125组,用200 ng/mL LPS刺激合并JNK抑制剂SP600125组;⑤LPS+LY2094002组,用200 ng/mL LPS刺激合并AKT抑制剂LY294002;⑥LPS+JSH23组,用200 ng/mL LPS刺激合并P65抑制剂JSH23处理,24 h后收集细胞蛋白并检测mGluR5及GAPDH的表达情况。各个抑制剂(SP600125, 50 nmol/L;LY294002, 50 μmol/L;JSH23, 5 μmol/L;SCH772984, 5 nmol/L)提前30 min加入培养基后再用LPS处理,mGluR5的激动剂(CHPG, 100 μmol/L)与拮抗剂(MPEP, 100 μmol/L)与LPS同时加入培养基24 h后离心,将细胞与上清培养基分离。处理完毕的细胞用RIPA冰上裂解30 min,4 ℃ 12 000×g,离心10 min,收集上清,并用BCA法测量蛋白浓度。将定量后的蛋白以每孔50 μg上样,在10%聚丙烯酰胺凝胶行电泳分离,半干法将蛋白转移至PVDF膜。含5%封闭蛋白干粉的TBST于37 ℃孵箱封闭PVDF膜1 h,其后分别以相应蛋白质的一抗37 ℃摇床中孵育2 h,TBST洗膜3次。漂洗后用相应二抗37 ℃摇床孵育PVDF膜1 h,孵育完毕后TBST漂洗3次。将化学发光底物滴至PVDF膜上,于暗室显影曝光。Image J软件分析目的蛋白条带的灰度值。目的蛋白片段相对表达量=目的片段灰度值/内参GAPDH灰度值。
1.2.3 免疫酶联反应将收集的细胞上清高速离心去除细胞碎片,用超纯水稀释待测样品5倍。实验分为两大组:野生型(WD)中性粒细胞组及mGluR5敲除中性粒细胞组,同时每个大组下又分为4个小组:①对照组,无LPS刺激;②LPS组,用200 ng/mL的LPS刺激,③LPS+CHPG组,LPS刺激合并mGluR5激动剂CHPG;④LPS+CHPG+MPEP组,LPS刺激合并CHPG及mGluR5拮抗剂MPEP处理。24 h后收集培养基上清,分别检测IL-1β及TNF-α的浓度。同时用超纯水稀释IL-1β及TNF-α的标准品(1 000、500、250、125、62.5、31.25、15.625、0 pg/mL)。将上述准备的样品及标准品加入反应板内,避光37 ℃孵育1 h,随后吸弃,并用清洗缓冲液洗涤2次。随后分别加入生物素标记抗体(Biotin-Antibody),级联酶标记抗体,以及最后显影的底物,最后加入反应终止液。用分光光度计在620 nm激发检测孔并获得相应的光密度值。通过标曲孔得到标准曲线,并根据此曲线计算出待测样品中相应炎症因子的浓度。
1.2.4 Real time-PCR检测实验分为两大组,野生型中性粒细胞组及mGluR5敲除中性粒细胞组,同时每个大组下又分为6个小组:①对照组,无LPS刺激;②LPS组,用200 ng/mL的LPS刺激;③LPS+SCH772984组;④LPS+SP600125组;⑤LPS+LY294002组;⑥LPS+JSH23组。各组处理同1.2.2,24 h后收集细胞并检测IL-1β及TNF-α的mRNA的表达水平。收集细胞后用TRIzol裂解并高速离心(12 000 r/min, 15 min)后,得到溶于水相的RNA,随后用异丙醇析出RNA并用乙醇洗涤纯化得到RNA样品。随后将RNA逆转录成为cDNA作为后续PCR的模板。用SYBN作为检测信号,反应体系内分别加入相应基因的扩增引物(表 1),并通过计算得到相应基因的相对表达水平。
| 基因名称 | 引物序列(5′→3′) |
| IL-1β | 上游:CTCAAAGCTCAGCGTGTCCAAACA |
| 下游:TATCAGGGTCTTCATTGCGGTGGA | |
| TNF-α | 上游:ACCACGCTCTTCTGTCTACT |
| 下游:AGGAGGTTGACTTTCTCCTG | |
| GAPDH | 上游:AGGTTGTCTCCTGCGACTTCA |
| 下游:TGGTCCAGGGTTTCTTACTCC |
1.3 统计学分析
获得的数据以x±s表示,在GraphPad Prism 5软件中采用单因素方差分析和Student’s t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 LPS对中性粒细胞mGluR5表达的影响以200 ng/mL的LPS处理新鲜分离到的小鼠骨髓中性粒细胞24 h后,检测mGluR5的蛋白水平(图 1)。结果显示mGluR5在中性粒细胞的表达并不显著,但经过LPS刺激后mGluR5的蛋白水平明显升高。

|
| 1~3:对照组;4~6:LPS组 图 1 LPS影响小鼠中性粒细胞mGluR5蛋白表达的情况 |
2.2 调控mGluR5对中性粒细胞炎症因子的影响
分别从WT及mGluR5小鼠的骨髓分离得到中性粒细胞,在用LPS刺激的同时,分别用mGluR5的激动剂CHPG(100 μmol/L)及其拮抗剂MPEP(100 μmol/L)联合刺激,24 h后分别收集培养基上清及细胞。结果显示在WT中性粒细胞组,激活mGluR5后明显增强了中性粒细胞释放的IL-1β及TNF-α的水平,胞内的mRNA水平也明显升高,该增强效应可以被mGluR5的拮抗剂明显抑制(P < 0.01, 图 2)。在mGluR5敲除小鼠LPS刺激后的炎症介质水平明显低于WT组,同时激动剂发挥增强作用(图 2)。提示特异性激活中性粒细胞表面的mGluR5可以明显促进LPS诱导的活化效应。
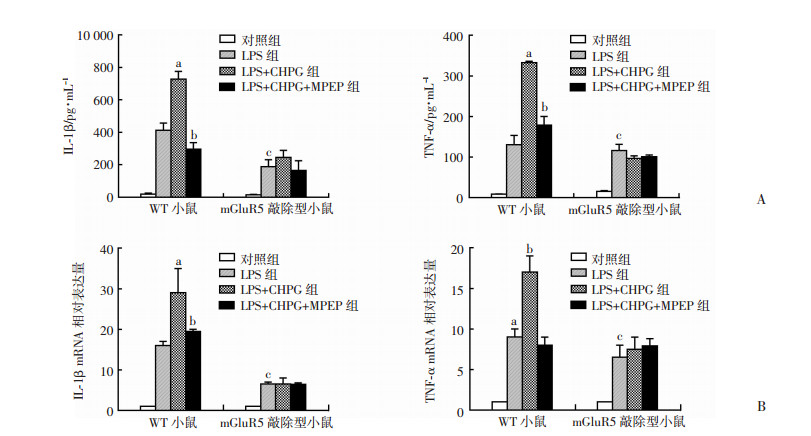
|
| A:ELISA结果;B:Real time-PCR结果 左:IL-1β; 右:TNF-α; a: P < 0.01, 与LPS组比较, b: P < 0.01, 与LPS+CHPG组比较; c: P < 0.01, 与WT小鼠LPS组比较 图 2 活化mGluR5影响小鼠中性粒细胞炎症因子的分泌和表达情况 |
2.3 LPS诱导后的中性粒细胞相关信号分子的改变
MAPK通路、PI3K通路以及NF-κB通路是LPS诱导后经典的3个活化通路,参与了中性粒细胞的活化。分别选取ERK、JNK、AKT及P65这4个下游分子作为研究对象。Western blot检测结果显示,200 ng/mL的LPS处理中性粒细胞24 h后,ERK的磷酸化水平,AKT的磷酸化及P65的磷酸化水平均明显上调(P < 0.05, 图 3)。
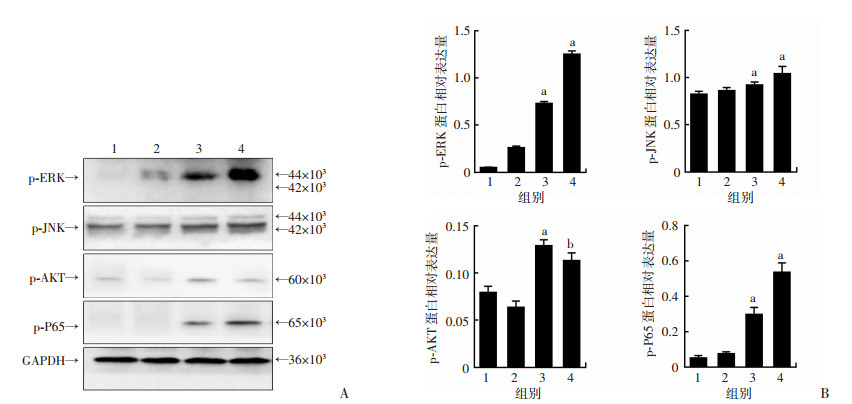
|
| A:Western blot结果;B:蛋白半定量分析 1、2:对照组;3、4:LPS组; a:P < 0.01,b:P < 0.05,与对照组比较 图 3 LPS对小鼠中性粒细胞磷酸化蛋白表达的影响 |
2.4 下游分子抑制剂对LPS诱导mGluR5的影响
上述结果提示LPS诱导后ERK的磷酸化水平,AKT的磷酸化及P65的磷酸化水平均明显上调,并伴随mGluR5表达的上调,提示ERK、AKT及P65可能参与mGluR5的上调。分别用ERK抑制剂(SCH772984)、JNK抑制剂(SP600125)、AKT抑制剂(LY294002)以及P65抑制剂(JSH23)处理细胞。图 4可见JNK抑制剂、AKT抑制剂以及P65抑制剂均可降低LPS诱导的mGluR5蛋白水平,提示JNK、AKT以及P65的磷酸化是LPS诱导中性粒细胞表达mGluR5的主要通路。
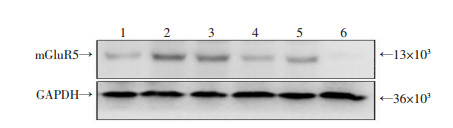
|
| 1:对照组;2:LPS组;3:LPS+SCH772984组;4:LPS+SP600125组;5:LPS+LY294002组;6:LPS+JSH23组 图 4 LPS和磷酸化蛋白拮抗剂对小鼠中性粒细胞mGluR5蛋白表达的影响 |
2.5 下游分子抑制剂对炎症因子的影响
为进一步验证JNK、AKT以及P65的磷酸化是LPS诱导中性粒细胞表达mGluR5的主要通路,进而促进炎症反应,分别对来源于野生型及mGluR5敲除型小鼠的中性粒细胞给予下游分子抑制剂的处理。Real time-PCR检测结果显示,在WT中性粒细胞组,LPS诱导上升的炎症因子(IL-1β及TNF-α)可以被JNK抑制剂、AKT抑制剂以及P65抑制剂明显降低(P < 0.05)。但在mGluR5敲除型小鼠的中性粒细胞中,JNK抑制剂、AKT抑制剂并没有使炎症介质进一步降低(图 5)。提示JNK分子和AKT分子的抑制剂可能通过抑制mGluR5的表达从而抑制了炎症介质的水平,而P65这个经典的炎症反应通路不仅对炎症介质有直接调控作用,同时也可能通过抑制mGluR5的表达,间接调控炎症反应。
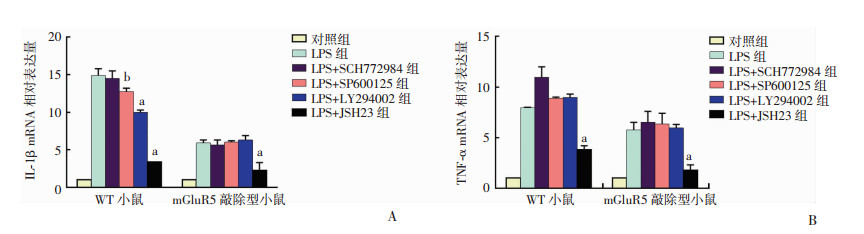
|
| a:P < 0.01, b:P < 0.05, 与LPS组比较 图 5 LPS和磷酸化蛋白拮抗剂影响小鼠中性粒细胞炎症因子的表达情况 |
3 讨论
神经免疫的交互调节越来越受到重视。其调节的基础之一就在于许多分子或受体在神经系统和免疫系统均有表达[7-9]。mGluR在中枢神经系统的功能研究较多,其在免疫调控方面的功能则知之甚少。本研究显示,mGluR5在中性粒细胞也有表达,并且可以被LPS明显诱导。活化mGluR5后可以促进中性粒细胞炎症因子水平的升高,提示mGluR5密切参与了中性粒细胞的活化与功能。
P65是NF-κB中主要的一个亚族,此前诸多文献报道NF-κB密切参与炎症调控,其中P65的活化与免疫细胞的炎症介质合成和释放密切相关[10-11]。本实验结果提示,P65通路也参与了LPS诱导中性粒细胞mGluR5的表达。利用生物信息学软件分析可见mGluR5启动子区有P65结合位点,提示P65可能通过直接影响mGluR5的表达调控从而影响mGluR5的蛋白水平,下一步我们会完成相关分子生物学实验来证实。同时本研究发现JNK和AKT也可能参与mGluR5的表达调控。此前有研究表明,在脑组织中Homer2-PI3K-AKT通路的激活可以诱导突触后mGluR5的受体亲和性和表达[12],在神经细胞系中,JNK也参与mGluR5的下游分子PKC的活化[13],均提示JNK和AKT通路参与了mGluR5自身表达和功能的调控。这增加了对中性粒细胞上mGluR5表达调控的认识。
基于mGluR5激动剂、抑制剂以及敲除mGluR5的实验结果,证实mGluR5在LPS诱导的中性粒细胞模型下,可以促进炎症反应。一方面LPS诱导下中性粒细胞表面mGluR5的表达上调,提示中性粒细胞在活化情况下需要mGluR5发挥作用。例如在我们之前的实验结果中,通过基因芯片筛查发现在mGluR5 KO的中性粒细胞中,趋化因子及其受体的表达明显降低(如CXCL1、CXCL5和CXCR2),中性粒细胞在损伤组织的浸润能力明显减弱[6],这对于急性期机体清除外界病原是不利的。另一方面,mGluR5的激活可以促进中性粒细胞炎症因子的合成与释放,提示mGluR5对炎症反应有正反馈调节,这对于炎症后期的消散也是不利的。同时以往研究提示炎症组织内谷氨酸的含量明显高于正常组织,这样也会进一步激活中性粒细胞表面的mGluR5,加重炎症反应[14]。所以mGluR5的表达对于炎症早期中性粒细胞的活化是必需的,而后期mGluR5的激活则会加重炎症反应,提示拮抗mGluR5可以作为新的抗炎靶点。
综上所述,本研究发现了LPS可以依赖活化P65和AKT通路诱导中性粒细胞表面mGluR5的表达,激活mGluR5会促进炎症反应,提示mGluR5是促进中性粒细胞活化的功能受体。该发现为谷氨酸受体对外周免疫系统的作用提出了新观点,将有望为外周及中枢炎症相关性疾病提供新的治疗思路。
| [1] | LU Y C, YEH W C, OHASHI P S. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145–151. DOI:10.1016/j.cyto.2008.01.006 |
| [2] | SHI J, ZHAO Y, WANG Y, et al. Inflammatory caspases are innate immune receptors for intracellular LPS[J]. Nature, 2014, 514(7521): 187–192. DOI:10.1038/nature13683 |
| [3] | HUETTNER J E. Glutamate receptor pores[J]. J Physiol (Lond), 2015, 593(1): 49–59. DOI:10.1113/jphysiol.2014.272724 |
| [4] | JULIO-PIEPER M, FLOR P J, DINAN TG, et al. Exciting times beyond the brain: metabotropic glutamate receptors in peripheral and non-neural tissues[J]. Pharmacol Rev, 2011, 63(1): 35–58. DOI:10.1124/pr.110.004036 |
| [5] | PACHECO R, GALLART T, LLUIS C, et al. Role of glutamate on T-cell mediated immunity[J]. J Neuroimmunol, 2007, 185(1/2): 9–19. DOI:10.1016/j.jneuroim.2007.01.003 |
| [6] | YANG T, LIU Y W, ZHAO L, et al. Metabotropic glutamate receptor 5 deficiency inhibits neutrophil infiltration after traumatic brain injury in mice[J]. Sci Rep, 2017, 7(1): 9998. DOI:10.1038/s41598-017-10201-8 |
| [7] | KIM D, HAYNES C L. The role of p38 MAPK in neutrophil functions: single cell chemotaxis and surface marker expression[J]. Analyst, 2013, 138(22): 6826–6833. DOI:10.1039/c3an01076g |
| [8] | LOPES Pinheiro M A, KOOIJ G, MIZEE M R, et al. Immune cell trafficking across the barriers of the central nervous system in multiple sclerosis and stroke[J]. Biochim Biophys Acta, 2016, 1862(3): 461–471. DOI:10.1016/j.bbadis.2015.10.018 |
| [9] | SCAPINI P, CASSATELLA M A. Social networking of human neutrophils within the immune system[J]. Blood, 2014, 124(5): 710–719. DOI:10.1182/blood-2014-03-453217 |
| [10] | MCCRACKEN J M, ALLEN L A. Regulation of human neutrophil apoptosis and lifespan in health and disease[J]. J Cell Death, 2014, 7: 15–23. DOI:10.4137/JCD.S11038 |
| [11] | OH S M, LEE S H, LEE B J, et al. A distinct role of neutrophil lactoferrin in RelA/p65 phosphorylation on Ser536 by recruiting TNF receptor-associated factors to Ikappa B kinase signaling complex[J]. J Immunol, 2007, 179(9): 5686–5692. DOI:10.4049/jimmunol.179.9.5686 |
| [12] | COZZOLI D K, GOULDING S P, ZHANG P W, et al. Binge drinking upregulates accumbens mGluR5-Homer2-PI3K signaling: functional implications for alcoholism[J]. J Neurosci, 2009, 29(27): 8655–8668. DOI:10.1523/JNEUROSCI.5900-08.2009 |
| [13] | XIAO X L, MA D L, WU J, et al. Metabotropic glutamate receptor 5 (mGluR5) regulates proliferation and differentiation of neuronal progenitors in the developmental hippocampus[J]. Brain Res, 2013, 1493: 1–12. DOI:10.1016/j.brainres.2012.11.015 |
| [14] | DAI S S, ZHOU Y G, LI W, et al. Local glutamate level dictates adenosine A2A receptor regulation of neuroinflammation and traumatic brain injury[J]. J Neurosci, 2010, 30(16): 5802–5810. DOI:10.1523/JNEUROSCI.0268-10.2010 |



