2. 402160 重庆, 重庆医科大学附属永川医院妇产科
2. Department of Obstetrics and Gynecology, Yongchuan Hospital, Chongqing Medical University, Chongqing, 402160, China
子宫内膜癌(endometrial carcinoma, EC)是发生于子宫内膜腺体的常见妇科恶性肿瘤之一[1-2]。据统计,2017年子宫内膜癌新增病例61 380例,估计2018年将新增病例63 230例,已严重影响女性生活质量,对于疾病转移或复发的患者,中位总生存时间 < 16周[3]。目前子宫内膜癌的病因尚未被完全阐明[4-6],但雌激素对子宫内膜癌的促进作用已被多次报道[7-8]。探索雌激素相关因子和通路在子宫内膜癌中的作用机制是提高疾病诊断、治疗和预后的首要任务。
PDZK1(PDZ domain protein kidney 1, 也被称为NHERF-3、PDZD1、CAP70)为4个PDZ结构域组成的相对分子质量为70×103的雌激素反应性蛋白和基因,属于钠(Na+)氢(H+)交换调节子(Na+/H+ exchanger regulatory factors, NHERF)家族成员。该家族被证明在多种疾病和蛋白相互作用中发挥靶向和募集作用,为公认的衔接/支架蛋白家族[9-13]。其成员PDZK1亦被认为是细胞膜衔接蛋白,调节大量蛋白间交互作用[14]。它最初主要发现于肾近端小管的顶端刷状缘膜[15],近年来也在高密度脂蛋白转运、胰腺癌、肾细胞癌[16]、小肠[17]、雌激素相关色素沉着[18]和ER(+)乳腺癌[19]中被发现和研究。除公认的支架蛋白作用,PDZK1被证明为雌激素反应性基因参与多种雌激素相关疾病:过表达的PDZK1影响雌激素诱导的酪氨酸表达进而调控雌激素相关色素沉着[18];在ER(+)乳腺癌中增强EGFR引起的MEK/ERK1/2信号通路和IGF引起的AKT信号通路而发挥促肿瘤生长作用[19]。子宫内膜癌是与雌激素密切相关的疾病,然而PDZK1是否参与子宫内膜癌及其可能的机制尚需探明。因此,本研究检测PDZK1在正常子宫内膜和子宫内膜癌组织中的表达并分析检测结果与临床病理因素的相关性,初步探索PDZK1在子宫内膜癌中的表达谱及临床意义。
1 资料与方法 1.1 组织标本收集重庆医科大学附属第一医院2012年1月至2017年6月妇产科收治入院经手术病理确诊为子宫内膜癌标本53例及同期32例正常子宫内膜标本。同时记录好患者年龄、是否绝经、病理编号、疾病分期、分化程度,病理诊断等资料信息。标本采集征得了患者及其亲属同意。本研究2017年3月获重庆医科大学伦理委员会批准。所有的子宫内膜癌患者依据FIGO指南行全子宫和双附件切除术,术前均未接受新辅助治疗,年龄27~69 (51.5±10.3)岁;正常组织取自于子宫脱垂或CINⅢ全子宫切除术患者,年龄29~76 (54.0±11.9)岁,两组患者年龄差异无统计学意义。这些组织的病理结果经重庆医科大学附属第一医院病理科医师诊断证实。收集的所有组织被分成两部分,部分用福尔马林固定石蜡包埋用于免疫组织化学实验,其余存储于-80 ℃冰箱中用于mRNA和蛋白质提取。
1.2 试剂和抗体RNA提取试剂盒、逆转录试剂盒和实时荧光定量PCR试剂购自TaKaRa公司(日本)。PDZK1和GAPDH引物由TaKaRa生物合成公司合成。用于蛋白免疫印迹的兔抗人PDZK1单克隆抗体购自Abcam公司(中国,上海);用于免疫组化的兔抗人PDZK1多克隆抗体购自武汉三鹰生物技术公司。HRP偶联的山羊抗兔和抗鼠IgG、抗β-actin抗体购自武汉博士德公司。免疫组化试剂盒(SP9001)和DAB显色试剂盒购自北京中山金桥公司。
1.3 RNA提取,逆转录和实时荧光定量PCR子宫内膜组织的总RNA提取应用TRIzol Reagent(美国Invitrogen公司)试剂盒,RNA的逆转录应用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa Biotechnology公司,日本),1 μL RNA应用Premix Ex TaqⅡ逆转录成20 μL反应体系。针对PDZK1的特异性引物序列上游:5′-GAATGGGGTGAATGTGCTAGATG-3′,下游:5′-CCAGGGAGGAAACAATAGGGA-3′。针对GAPDH的特异性引物序列上游:5′-CTTTGGTATCGTGGAAGGACTC-3′,下游:5′-GTAGAGGCAGGGATGATGTTCT-3′。PCR反应体系的配制应用SYBR ® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus,TaKaRa Biotechnology公司)试剂盒,在CFX96 Real-time PCR Detection System (Bio-Rad Laboratories,美国)仪器中进行反应和荧光检测。以GAPDH为内参。样本中目的cDNA定量以内参为参照(CtPDZK1-CtGAPDH=ΔCt),实验组以对照组为参照(ΔCtcancer -ΔCtnormal=ΔΔCt),目的基因表达结果用2-ΔΔCt表示。
1.4 Western blot检测依据组织蛋白提取试剂盒(碧云天生物技术公司,中国)说明书进行组织蛋白提取,蛋白浓度的测定使用BCA试剂盒。在SDS-PAGE凝胶泳道中加入等量的蛋白质进行电泳,并将蛋白转移到PVDF膜上,用5%脱脂牛奶进行封闭,然后用兔抗人PDZK1单克隆抗体(1:5 000)和β-actin抗体4 ℃孵育过夜。次日用结合辣根过氧化物酶(HRP)的二抗37 ℃孵育1 h后,使用ECL试剂盒进行酶联化学发光。将各条带的灰度值进行量化,各样本表达值为目的与内参的比值。
1.5 免疫组化新鲜组织标本及时浸泡于4%中性福尔马林中,后包埋于石蜡块,切4 μm薄片。组织切片在65 ℃下孵育2 h,用二甲苯脱蜡并梯度酒精进行水化。PBS清洗3次后,将标本载玻片浸没在10 mmol/L柠檬酸钠缓冲液中微波加热进行抗原修复。内源性过氧化物酶被3%过氧化氢阻断,正常动物血清用于减少非特异性结合。应用生物素-链霉抗生物素蛋白HRP检测试剂盒(中山金桥公司)继续进一步实验,后孵育PDZK1抗体(1:200),4 ℃过夜。阴性对照切片用PBS代替一抗进行孵育。洗涤后,将组织切片与生物素化的二抗孵育,用DAB显色试剂盒进行显色,最后用苏木精染核并拍照。通过Image-Pro Plus 6.0软件对细胞染色强度和着色细胞百分比共同评定量化。用累计光密度值表示着色蛋白量,除以有效统计区域的面积得到每个标本平均光密度百分比值。
1.6 统计学分析实验分别重复至少3次,数据以x±s表示,使用SPSS 20.0统计软件和GraphPad Prism 7.0软件。2组患者PDZK1表达差异采用双侧t检验;分析PDZK1表达与临床病理学特征之间的关联采用χ2检验;采用Kaplan-Meier方法和对数秩检验进行生存分析。检验水准α=0.05。
2 结果 2.1 PDZK1在子宫内膜癌组织中免疫反应性更高PDZK1主要表达于腺上皮细胞质,间充质细胞和细胞核中基本不着色,其在正常子宫内膜中着色较浅,而在子宫内膜癌组织的着色更深(图 1)。PDZK1在正常子宫内膜组织和子宫内膜癌组织中的免疫着色百分比值差异有统计学意义[(0.019±0.008) vs(0.051±0.017),P < 0.05]。
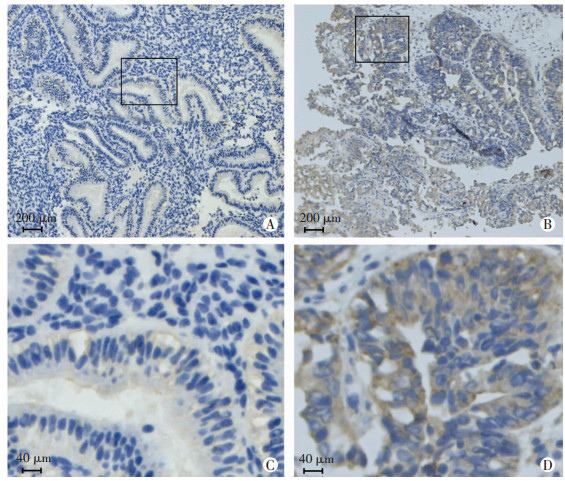
|
| A:正常子宫内膜;B:子宫内膜癌;C、D:分别为A、B图黑框部分放大 图 1 PDZK1在正常子宫内膜和子宫内膜癌组织中免疫着色情况 |
2.2 PDZK1蛋白和mRNA在子宫内膜癌中高表达
实时荧光定量PCR检测结果显示:与正常子宫内膜组织比较,PDZK1 mRNA在子宫内膜癌中表达显著增强(2.415±0.663 vs 0.986±0.322,P < 0.05)。Western blot检测结果显示:PDZK1蛋白在子宫内膜癌中的表达显著高于正常子宫内膜组织(1.412±0.280 vs 0.350±0.210,P < 0.05,图 2)。
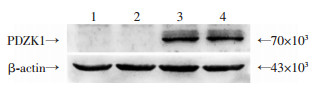
|
| 1、2:正常子宫内膜组织;3、4:子宫内膜癌组织 图 2 Western blot检测PDZK1在子宫内膜癌组织和正常子宫内膜组织中的蛋白表达 |
2.3 PDZK1与子宫内膜癌临床病理因素相关性
依据子宫内膜癌病例PDZK1免疫组化表达水平,以免疫反应性百分比平均值为分界线,将其分为2组(>平均值的为PDZK1高表达组,≤平均值的为PDZK1低表达组),对患者进行电话随访,每半年随访1次,共随访5年,生存、死亡情况及原因精确到月份。结果显示(表 1):PDZK1高表达与子宫内膜癌的低分化(P=0.007)、晚期FIGO分期(P=0.012)和淋巴结转移(P=0.014)呈正相关。而患者PDZK1表达与年龄、是否绝经无关(P>0.05)。
临床特征 |
例数 | PDZK1低表 达(n=20) |
PDZK1高表 达(n=33) |
P值 |
| 年龄/岁 | 0.688 | |||
| ≤50 | 22 | 9 | 13 | |
| >50 | 31 | 11 | 20 | |
| 分化程度 | 0.007 | |||
| 低分化 | 31 | 7 | 24 | |
| 高分化 | 22 | 13 | 9 | |
| FIGO分期 | 0.012 | |||
| Ⅰ+Ⅱ期 | 28 | 15 | 13 | |
| Ⅲ+Ⅳ期 | 25 | 5 | 20 | |
| 是否绝经 | 0.186 | |||
| 未绝经 | 31 | 14 | 17 | |
| 已绝经 | 22 | 6 | 16 | |
| 淋巴结转移 | 0.014 | |||
| 阴性 | 34 | 17 | 17 | |
| 阳性 | 19 | 3 | 16 |
2.4 较高的PDZK1表达提示子宫内膜癌患者的预后不良
Kaplan-Meier方法和对数秩检验结果显示:与PDZK1低表达组比较,PDZK1高表达组显示较短的无病生存(DFS)(P < 0.05,图 3A)和总体生存时间(OS)(P < 0.05,图 3B)。表明PDZK1具有充当子宫内膜癌预后标志物的潜能。
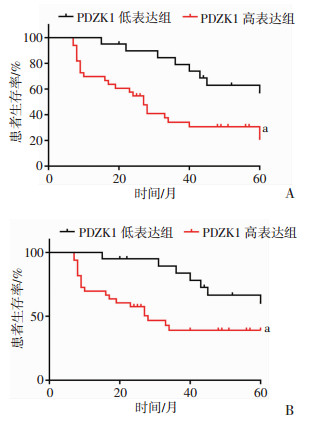
|
| A:DFS; B:OS; a: P < 0.05, 与PDZK1低表达组比较 图 3 不同PDZK1表达水平的子宫内膜癌患者生存分析 |
3 讨论
研究证明PDZ结构域家族为调节/支架蛋白影响多种质膜转运体和受体相互作用[13],已被公认参与HDL、胆汁运输、G蛋白偶联受体调节,并与痛风敏感性相关。除了公认的支架调节蛋白作用,PDZK1与雌激素的密切联系也被部分报道,在雌激素相关过度色素沉着病中,PDZK1通过与黑斑病中的转运蛋白CFTR、NHE2和SLC26A3相互作用而辅助雌激素功能发挥[18]。此外,在雌激素相关乳腺癌中,PDZK1被多次证明具有促肿瘤作用,这种致癌作用与增强癌基因c-Myc表达和EGFR相关信号转导有关,同时还能通过维持AKT的稳定性促进细胞生长,并对雌激素在相关疾病中的功能发挥有辅助作用。过表达乳腺癌细胞MCF-7中PDZK1能增强MEK/ERK1/2信号通路、促进cyclinD1表达和Akt磷酸化[19],通过形成E2/IGF-1R/PDZK1轴促进乳腺癌的生长,并激活PI3K/AKT通路促进细胞增殖[20],而敲低PDZK1可抑制肿瘤细胞生长,这些研究都提示了PDZK1的致癌潜能及与雌激素的密切关系。子宫内膜癌为常见妇科恶性肿瘤,其病因和发病机制尚不完全清楚,但雌激素对子宫内膜癌的促进作用已被公认[7]。因此,可以推断PDZK1在雌激素相关子宫内膜癌中起重要作用,可能参与雌激素调控PI3K/AKT、MAPK/ERK信号通路而对子宫内膜癌起促进作用[4-6]。然而目前关于PDZK1在妇科疾病及子宫内膜癌中的作用研究尚少。
本研究检测了PDZK1在正常子宫内膜和子宫内膜癌组织中的表达,发现PDZK1蛋白和mRNA表达在子宫内膜癌中较正常组织增加2~4倍,差异具有统计学意义。尽管其表达量与患者年龄、病程等变量没有相关性,但暗示PDZK1具有促子宫内膜癌作用,可能在肿瘤中发挥新的致癌作用。免疫组化显示子宫内膜癌组织的腺上皮细胞的细胞质中比正常子宫内膜组织有更明显的免疫着色,提示PDZK1的腺上皮表达特异性,表明了PDZK1与子宫内膜癌的发展密切相关。进而比较子宫内膜癌患者中PDZK1表达与临床病理因素的关系,结果表明PDZK1高表达与肿瘤低分化程度、FIGO晚期、淋巴结转移正相关。使用Kaplan-Meier法和Log-rank法分析PDZK1的表达与子宫内膜癌预后的关系,结果显示PDZK1高表达子宫内膜癌患者的存活时间更短,进一步证明了PDZK1的促子宫内膜癌作用,且高表达PDZK1患者往往预后不良,提示其可能为潜在的肿瘤标志物。此外,有研究表明PDZK1与耐药有关,在免疫治疗和提高化疗敏感性中发挥作用[21]。然而,它是否与子宫内膜癌的耐药性有关还有待进一步研究证实。
已有研究证明PDZK1是一种雌激素反应性基因,受ERα直接调控。本研究检测到在雌激素相关子宫内膜癌中PDZK1表达增高,且高表达PDZK1患者往往预后不良,提示了PDZK1对子宫内膜癌的促肿瘤作用。PDZK1与胰岛素样生长因子受体IGF-1R密切相关,可调节PI3K、Akt、mTOR、S6激酶、Ras-ERK (MAPK)/ERK1/2等信号通路促进细胞增殖、存活、生长、代谢、迁移和侵袭[22-25],也可通过增强c-Myc表达发挥促癌作用,提示其对肿瘤的作用机制涉及多个信号通路,主要通过激活MAPK/ERK、PI3K/AKT、Wnt/β和引起PTEN缺失或突变[4],意味着雌激素可能通过PDZK1调节MAPK/ERK和PI3K/AKT信号通路促进子宫内膜癌,但具体通路机制有待进一步探索,以明确雌激素的促子宫内膜癌的机制。
综上所述,本研究结果显示PDZK1蛋白和mRNA在子宫内膜癌中表达增高,且PDZK1高表达与肿瘤低分化、FIGO晚期、淋巴转移和不良预后正相关,提示PDZK1可能是新的子宫内膜癌标志物和治疗靶点。但作为一种新的子宫内膜癌影响因素,有待进一步体外细胞实验及体内动物实验以探索PDZK1与子宫内膜癌发生、发展的关系及确切分子机制,以期为子宫内膜癌的诊断和治疗提供新途径。
| [1] | PEARSON-STUTTARD J, ZHOU B, KONTIS V, et al. Worldwide burden of cancer attributable to diabetes and high body-mass index:a comparative risk assessment[J]. Lancet Diabetes Endocrinol, 2018, 6(2): 95–104. DOI:10.1016/S2213-8587(17)30366-2 |
| [2] | KITSON S J, LINDSAY J, SIVALINGAM V N, et al. The unrecognized burden of cardiovascular risk factors in women newly diagnosed with endometrial cancer:A prospective case control study[J]. Gynecol Oncol, 2018, 148(1): 154–160. DOI:10.1016/j.ygyno.2017.11.019 |
| [3] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [4] | MAKKER A, GOEL M M. Tumor progression, metastasis, and modulators of epithelial-mesenchymal transition in endometrioid endometrial carcinoma:an update[J]. Endocr Relat Cancer, 2016, 23(2): R85–R111. DOI:10.1530/ERC-15-0218 |
| [5] | WESTIN S, JU Z, BROADDUS R, et al. PTEN loss is a context-dependent outcome determinant in obese and non-obese endometrioid endometrial cancer patients[J]. Mol Oncol, 2015, 9(8): 1694–1703. DOI:10.1016/j.molonc.2015.04.014 |
| [6] | SLOMOVITZ B M, COLEMAN R L. The PI3K/AKT/mTOR pathway as a therapeutic target in endometrial cancer[J]. Clin Cancer Res, 2012, 18(21): 5856–5864. DOI:10.1158/1078-0432.CCR-12-0662 |
| [7] | NOGUEIRA A A, SANT'ANA DE ALMEIDA E C, POLI NETO O B, et al. Immunohistochemical expression of p63 in endometrial polyps:evidence that a basal cell immunophenotype is maintained[J]. Menopause, 2006, 13(5): 826–830. DOI:10.1097/01.gme.0000242274.32278.a2 |
| [8] | FOX E M, ANDRADE J, SHUPNIK M A. Novel actions of estrogen to promote proliferation:integration of cytoplasmic and nuclear pathways[J]. Steroids, 2009, 74(7): 622–627. DOI:10.1016/j.steroids.2008.10.014 |
| [9] | RITTER-MAKINSON S L, PAQUET M, BOGENPOHL J W, et al. Group Ⅱ metabotropic glutamate receptor interactions with NHERF scaffold proteins:Implications for receptor localization in brain[J]. Neuroscience, 2017, 353: 58–75. DOI:10.1016/j.neuroscience.2017.03.060 |
| [10] | CHA B, YANG J, SINGH V, et al. PDZ domain-dependent regulation of NHE3 protein by both internal class Ⅱ and C-terminal class I PDZ-binding motifs[J]. J Biol Chem, 2017, 292(20): 8279–8290. DOI:10.1074/jbc.M116.774489 |
| [11] | LEE H J, ZHENG J J. PDZ domains and their binding partners:structure, specificity, and modification[J]. Cell Commun Signal, 2010, 8: 8. DOI:10.1186/1478-811X-8-8 |
| [12] | LUCK K, CHARBONNIER S, TRAV G. The emerging contribution of sequence context to the specificity of protein interactions mediated by PDZ domains[J]. FEBS Lett, 2012, 586(17): 2648–2661. DOI:10.1016/j.febslet.2012.03.056 |
| [13] | KOCHER O, KRIEGER M. Role of the adaptor protein PDZK1 in controlling the HDL receptor SR-BI[J]. Curr Opin Lipidol, 2009, 20(3): 236–241. DOI:10.1097/MOL.0b013e32832aee82 |
| [14] | FERREIRA C, PRESTIN K, HUSSNER J, et al. PDZ domain containing protein 1(PDZK1), a modulator of membrane proteins, is regulated by the nuclear receptor THRβ[J]. Mol Cell Endocrinol, 2018, 461: 215–225. DOI:10.1016/j.mce.2017.09.017 |
| [15] | KOCHER O, COMELLA N, TOGNAZZI K, et al. Identification and partial characterization of PDZK1:a novel protein containing PDZ interaction domains[J]. Lab Invest, 1998, 78(1): 117–125. |
| [16] | TAO T, YANG X, ZHENG J, et al. PDZK1 inhibits the development and progression of renal cell carcinoma by suppression of SHP-1 phosphorylation[J]. Oncogene, 2017, 36(44): 6119–6131. DOI:10.1038/onc.2017.199 |
| [17] | LUO M, YERUVA S, LIU Y, et al. IL-1β-Induced downregulation of the multifunctional pdz adaptor pdzk1 is attenuated by ERK Inhibition, RXRα, or PPARα stimulation in enterocytes[J]. Front Physiol, 2017, 8: 61. DOI:10.3389/fphys.2017.00061 |
| [18] | KIM N H, CHEONG K A, LEE T R, et al. PDZK1 upregulation in estrogen-related hyperpigmentation in melasma[J]. J Invest Dermatol, 2012, 132(11): 2622–2631. DOI:10.1038/jid.2012.175 |
| [19] | KIM H, ABD ELMAGEED Z Y, DAVIS C, et al. Correlation between PDZK1, Cdc37, Akt and breast cancer malignancy:the role of PDZK1 in cell growth through Akt stabilization by increasing and interacting with Cdc37[J]. Mol Med, 2014, 20: 270–279. DOI:10.2119/molmed.2013.00166 |
| [20] | KIM H, ABD ELMAGEED Z Y, JU J, et al. PDZK1 is a novel factor in breast cancer that is indirectly regulated by estrogen through IGF-1R and promotes estrogen-mediated growth[J]. Mol Med, 2013, 19: 253–262. DOI:10.2119/molmed.2011.00001 |
| [21] | PARK J, KWAK J O, RIEDERER B, et al. Na+/H+exchanger regulatory factor 3 is critical for multidrug resistance protein 4-mediated drug efflux in the kidney[J]. J Am Soc Nephrol, 2014, 25(4): 726–736. DOI:10.1681/ASN.2013040438 |
| [22] | CODONY-SERVAT J, CUATRECASAS M, ASENSIO E, et al. Nuclear IGF-1R predicts chemotherapy and targeted therapy resistance in metastatic colorectal cancer[J]. Br J Cancer, 2017, 117(12): 1777–1786. DOI:10.1038/bjc.2017.279 |
| [23] | CHEN L, ZHU Z, GAO W, et al. Systemic analysis of different colorectal cancer cell lines and TCGA datasets identified IGF-1R/EGFR-PPAR-CASPASE axis as important indicator for radiotherapy sensitivity[J]. Gene, 2017, 627: 484–490. DOI:10.1016/j.gene.2017.07.003 |
| [24] | KASPRZAK A, KWASNIEWSKI W, ADAMEK A, et al. Insulin-like growth factor (IGF) axis in cancerogenesis[J]. Mutat Res Rev Mutat Res, 2017, 772: 78–104. DOI:10.1016/j.mrrev.2016.08.007 |
| [25] | TU C, WANG F, WAN J. MicroRNA-381 inhibits cell proliferation and invasion in endometrial carcinoma by targeting the IGF-1R[J]. Mol Med Rep, 2018, 17(3): 4090–4098. DOI:10.3892/mmr.2017.8288 |



