2. 401220 重庆,重庆市长寿区人民医院眼科;
3. 450003 郑州,河南省人民医院,河南省立眼科医院,河南省眼科研究所
2. Department of Ophthalmology, People's Hospital of Changshou District, Chongqing, 401220;
3. Henan Provincial Eye Hospital, Henan Eye Institute, Henan Provincial People's Hospital, Zhengzhou, Henan Province, 450003, China
炎症反应是机体对抗外来入侵物质的一种反应,可清除入侵物质,保护机体健康。但炎症反应应保持在正常范围,过低或过度的炎症反应都可引起疾病。内毒素(lipopolysaccharide,LPS)是革兰阴性细菌细胞壁的一种成分,又叫脂多糖[1]。LPS诱导的炎症反应与许多视网膜疾病如感染性葡萄膜炎有相似的病理过程。视网膜色素上皮细胞(retinal pigment epithelia cells,RPE)作为眼部组织细胞代谢最活跃的细胞,在炎症性视网膜疾病的发生、发展中起着重要作用[2]。慢性炎症反应会引起RPE和视网膜血管功能紊乱,继而导致脉络膜新生血管(choroidalneovascularization, CNV)形成,最终发展为不可逆的视觉损害[3-4]。目前,炎症性视网膜疾病还缺乏有效的治疗手段。因此,寻找新的有效治疗靶点便成为亟待解决的问题。
转录组测序(RNA-sequencing, RNA-seq)是描绘和定量转录组的一种新方法[5],可快速全面地获得某一物种特定细胞或组织在某一状态下的几乎所有转录本序列信息,具有通量高、成本低、灵敏度高等优势。因此,本实验以ARPE-19和hRPE细胞为研究对象,用LPS刺激ARPE-19细胞产生炎症反应,用RNA-seq研究其炎症反应的机制,为研发治疗视网膜炎症性疾病的新药靶点提供科学依据。
1 材料与方法 1.1 实验材料胎牛血清(FBS)、DMEM培养液、胰酶、双抗购自美国Gibco公司;RPE65抗体购自美国Sants Cruz公司;LPS购自美国Sigma-Aldrich公司;TRIzol Reagent购自美国Invitrogen公司;反转录试剂盒PrimeScript RT reagent Kit购自中国TaKaRa Biotechnology公司;Real-time PCR反应所需的SYBR Premix Ex TaqTM Ⅱ购自中国南京Vazyme Biotech Co公司;RT-PCR引物购自中国生工生物工程公司。
1.2 实验方法 1.2.1 细胞培养ARPE-19细胞系购自美国American Type Culture Collection (ATCC)公司。人类原代RPE(hRPE)细胞的分离方法参照文献[6]标准,分离后用RPE特异性抗体RPE65对hRPE细胞进行鉴定。ARPE-19和hRPE细胞均培养于含有10%的FBS、100 U/mL青霉素、100 U/mL链霉素的DMEM/F-12培养基中,置于37 ℃、5%CO2的培养箱孵育。ARPE-19和hRPE用于本实验的代数分别在15~23和2~5代之间。
1.2.2 ARPE-19和hRPE细胞鉴定RPE细胞特异性抗体RPE65用于细胞鉴定。将ARPE-19和hRPE细胞接种于提前放置好无菌玻片的24孔细胞培养板中,放入37 ℃、5% CO2的培养箱中培养至细胞融合;RPE65细胞染色步骤同本团队前期研究[7],将染好色的玻片置于正置荧光显微镜下观察,采集图片。
1.2.3 细胞分组第1阶段:建立LPS炎症模型和RNA-seq测序。将ARPE-19细胞分为2组:①空白对照组:不做任何处理;②LPS模型组:5 μg/mL的LPS刺激ARPE-19细胞24 h。第2阶段:RNA-seq结果中关键基因的PCR验证。将ARPE-19和hRPE细胞分别分为空白对照组和LPS模型组,细胞处理方法同第1阶段。
1.2.4 实时荧光定量PCRLPS刺激ARPE-19和hRPE细胞24 h后,采用TRIzol试剂提取细胞总RNA, Nanodrop分光光度计检测RNA样本的浓度;PrimeScript RT reagent kit试剂盒将RNA逆转录成cDNA,用于PCR反应。反应条件:95 ℃预变性10 min,循环1次;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,共循环40次。所有基因均使用β-actin作为内参基因,采用2-△△Ct方法进行结果统计分析,引物序列见表 1。
| 基因 | 引物序列 |
| IL-6 | 上游:5′-AGTGAGGAACAAGCCAGAGC-3′ |
| 下游:5′-CAGGGGTGGTTATTGCATCT-3′ | |
| IL-8 | 上游:5′-GACATACTCCAAACCTTTCCACCC-3′ |
| 下游:5′-CTCCTCCACTTGGTGGTTTG-3′ | |
| MCP-1 | 上游:5′-AGAATCACCAGCAGCAAGTGTCC-3′ |
| 下游:5′-TTGCTTGTCCAGGTGGTCCATG-3′ | |
| FOS | 上游:5′-TTGTGAAGACCATGACAGGAG-3′ |
| 下游:5′-CCATCTTATTCCTTTCCCTTCGG-3′ | |
| JUN | 上游:5′-AGCCCAAACTAACCTCACG-3′ |
| 下游:5′-TGCTCTGTTTCAGGATCTTGG-3′ | |
| JUNB | 上游:5′-GGACACGCCTTCTGAACG-3′ |
| 下游:5′-CGGAGTCCAGTGTGGTTTG-3′ | |
| SRF | 上游:5′-CAAGAGGAAGACGGGCATC-3′ |
| 下游:5′-TTCGGGTGGCAAAGGTATAC-3′ | |
| AKT1 | 上游:5′-TCTATGGCGCTGAGATTGTG-3′ |
| 下游:5′-TCTTAATGTGCCCGTCCTTG-3′ | |
| SRC | 上游:5′-CAATGCAGAGAACCCGAGAG-3′ |
| 下游:5′-TGCGGATCTTGTAGTGCTTC-3′ | |
| β-actin | 上游:5′-GGATGCAGAAGGAGATCACTG-3′ |
| 下游:5′-CGATCCACACGGAGTACTTG-3′ |
1.2.5 转录组测序分析
RNA-seq由北京诺禾致源公司完成。LPS刺激ARPE-19细胞24 h后,收集细胞并送至公司进行转录组测序。Illumina HiSeq平台用于转录组测序,原始数据(raw reads)通过去除带接头、带有N碱基和质量低的序列等过程得到高质量序列,同时计算高质量序列Q20、Q30和GC含量的分布;DESeq2软件用于差异表达基因(differential expression genes, DEGs)分析,差异显著性标准为Padj < 0.05;GOseq R package对差异表达基因进行GO (gene ontology)富集分析,富集显著性标准为Padj < 0.05。Omicsbean软件用于差异表达基因的KEGG (kyoto encyclopedia of genes and genomes)富集分析,富集显著性标准为Padj < 0.05。
1.3 统计学分析采用GraphPad Prism 5软件进行统计处理,数据以x±s表示。Real-time PCR数据采用两独立样本均数的t检验,检验水准α=0.05。
2 结果 2.1 ARPE-19和hRPE细胞鉴定RPE特异性蛋白RPE65抗体用于鉴定本实验所用的ARPE-19和hRPE细胞。在ARPE-19和hRPE细胞中,DAPI染核为蓝色,核周围的胞质中可见绿染的RPE65抗体标记阳性,提示ARPE-19和hRPE细胞为RPE来源细胞(图 1)。
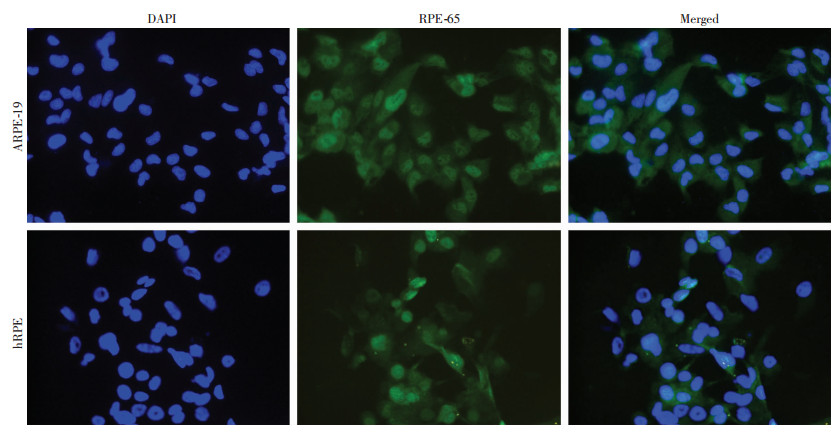
|
| 图 1 ARPE-19和hRPE细胞的RPE特异性抗体RPE65的染色鉴定(×400) |
2.2 LPS刺激ARPE-19细胞后炎症因子IL-6、IL-8和MCP-1的变化
Real-time PCR检测LPS刺激ARPE-19细胞24 h后IL-6、IL-8和MCP-1在mRNA水平的变化。与空白对照组相比,LPS组中IL-6、IL-8和MCP-1在mRNA水平的表达升高,且差异具有统计学意义(P < 0.01,图 2)。
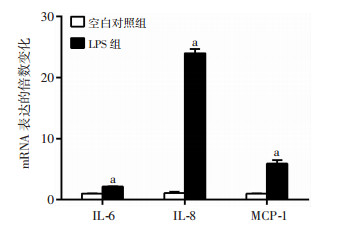
|
| a:P < 0.01, 与空白对照组比较 图 2 LPS刺激ARPE-19细胞后炎症因子IL-6、IL-8和MCP-1在mRNA水平的变化(n=4) |
2.3 差异表达基因分析
用火山图描绘LPS刺激ARPE-19细胞24 h后DEGs的分布情况。对于有生物学重复的数据,差异显著性的标准为Padj < 0.05。与空白对照组相比,LPS刺激后共有2 345个差异表达基因,其中上调的有1 594个,下调的有751个(图 3A)。排位前10的上调和下调差异表达基因见图 3B。

|
| A:差异基因火山图,横坐标表示基因的表达倍数变化(log2 Fold Change),纵坐标表示表达差异的显著性水平(-log10 Padj),红色点代表上调基因,绿色点代表下调基因;B:前10位上调和下调的差异表达基因 图 3 差异基因火山图及前10位上调和下调的差异表达基因(n=3) |
2.4 差异表达基因的GO和KEGG富集分析
为研究LPS在ARPE-19细胞中的促炎机制,本实验通过GO和KEGG数据库对2 345个DEGs进行功能注释。共发现681条显著富集的GO条目,53条显著富集的KEGG通路。其中与免疫相关的有固有免疫反应激活;与炎症相关的有NIK/NF-kappaB、HIF-1、TNF、PI3K-Akt、MAPK、NOD-like受体、mTOR、VEGF信号通路以及与调节凋亡相关通路(表 2、3)。
| GO通路 | ID | 描述 | 校正P值 |
| 免疫相关通路 | GO:0002218 | 天然免疫反应的激活 | < 0.001 |
| GO:0045089 | 天然免疫反应正向调控 | < 0.001 | |
| 炎症相关通路 | GO:0000186 | MAPK活性的激活 | < 0.001 |
| GO:0038061 | NIK/NF-kappaB信号 | < 0.001 | |
| GO:0048010 | 血管内皮生长因子受体信号通路 | 0.001 | |
| GO:0002224 | Toll-样受体信号通路 | 0.001 | |
| GO:0038066 | p38MAPK级联 | 0.040 | |
| 肿瘤相关通路 | GO:0038127 | ERBB信号通路 | < 0.001 |
| GO:0016055 | Wnt信号通路 | 0.001 | |
| 凋亡相关通路 | GO:2001233 | 凋亡信号通路的调控 | 0.003 |
| KEGG通路 | ID | 描述 | 校正P值 |
| 炎症相关通路 | hsa04066 | HIF-1信号通路 | < 0.001 |
| hsa04668 | TNF信号通路 | 0.002 | |
| hsa04151 | PI3K-Akt信号通路 | 0.002 | |
| hsa04010 | MAPK信号通路 | 0.003 | |
| hsa04621 | NOD-like受体信号通路 | 0.004 | |
| hsa04150 | mTOR信号通路 | 0.016 | |
| hsa04370 | VEGF信号通路 | 0.038 | |
| 凋亡相关通路 | hsa04210 | 凋亡 | 0.004 |
2.5 KEGG富集通路的蛋白相互作用
为探讨KEGG富集通路中各个基因的相互关系,我们对KEGG通路中的DEGs进行蛋白间相互作用(protein-protein interaction,PPI)分析(图 4)。在网络图中,与8条KEGG通路最相关的基因有38个,转录因子有4个(JUN、JUNB、SRF、ATF4)。图中基因圆点尺寸大小代表该基因权重的高低,尺寸越大,该基因权重越高。因此在38个基因中,权重最高的2个基因是AKT1和SRC。
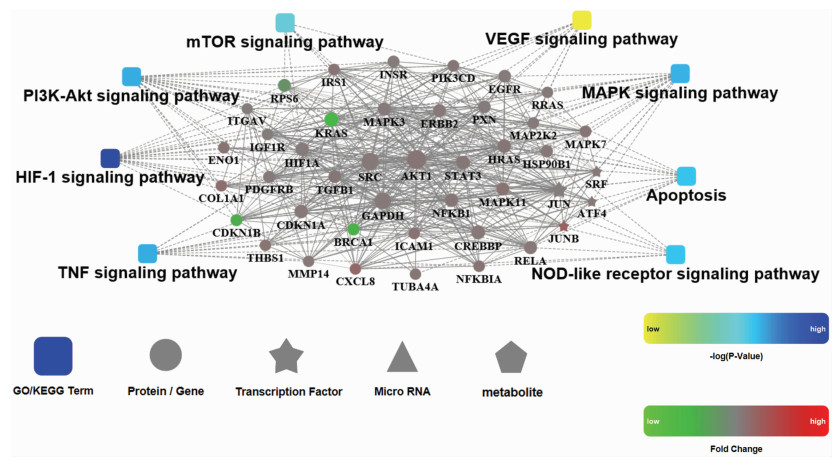
|
| 图 4 LPS刺激ARPE-19细胞后KEGG富集通路中基因的蛋白间相互作用分析 |
2.6 Real-time PCR鉴定差异表达基因
为了验证RNA-seq测序结果,采用ARPE-19和hRPE细胞对测序结果中的关键基因进行PCR验证。结果显示LPS刺激24 h后,转录因子FOS、JUN、JUNB、SRF和基因AKT1、SRC的表达上调,且差异具有统计学意义(P < 0.05,P < 0.01,图 5),此结果与RNA-seq一致。

|
| a:P<0.05,b:P<0.01,与空白对照组比较;A:ARPE-19细胞;B:hRPE细胞 图 5 KEGG通路中关键基因的验证(n=4~8) |
3 讨论
炎症反应是许多视网膜疾病的共同病理过程,主要包括年龄相关性黄斑变性(age-related macular degeneration, AMD)[4]、感染性葡萄膜炎和糖尿病视网膜病变(diabetic retinopathy, DR)等[8]。目前,寻找治疗视网膜炎症的新药靶点是当前研究的热点之一。因此,本实验选用常见的致炎物质LPS作为研究对象,用RNA-seq研究LPS诱导的ARPE-19细胞炎症反应的机制,为深入理解视网膜炎症性疾病的病理过程提供实验依据。以往的观点认为LPS的促炎机制主要是激活Toll样受体、MAPK信号通路及其下游的NF-κB/AP-1转录组因子,从而促进炎症因子、趋化因子和黏附分子的释放[9-11]。与以往观点一致,本测序结果也发现LPS刺激ARPE-19细胞后激活了经典的Toll样受体/MAPK/NF-κB信号通路。另外,我们还发现LPS激活了PI3K-Akt-mTOR信号通路、NOD-样受体信号通路和VEGF信号通路。研究表明PI3K-Akt-mTOR和NOD样受体信号通路都参与了炎症反应的调控,下调PI3K-Akt-mTOR信号通路可抑制M1型巨噬细胞极化,从而抑制炎症因子IL-6、TNF-α和IL-1β的表达[12]。而NOD-样受体(NOD-like receptors, NLRs)的3种主要蛋白NLRP1b、NLRC4和NLRP3组成的复合物可激活促炎因子Caspase-1和Caspase-11,从而促进炎症因子IL-1β和IL-18的分泌[13-14]。血管内皮生长因子(vascular endothelial growth factor, VEGF)是AMD病理过程中促进脉络膜新生血管(choroidal neovascularisation,CNV)形成的重要因子。VEGF还可引起微血管通透性增强,从而造成毛细血管渗漏,在DR的病理过程中发挥重要作用。因此,本研究结果表明PI3K-Akt-mTOR、NOD-样受体和VEGF信号通路也很有可能在LPS诱导的RPE细胞炎症反应中发挥了重要作用。
对以上通路中的DEGs进行PPI分析发现转录因子JUN、JUNB、SRF、ATF4和AKT1、SRC基因在所有DEGs中具有最高的权重,这意味着这些基因可能与LPS诱导的炎症反应有一定相关性。c-JUN和c-FOS参与转录因子AP-1的组成,调节细胞的生长分化[15],且相关研究证实AP-1在LPS诱导的炎症中起着重要作用,激活AP-1可促进下游炎症因子IL-6、IL-8、TNF-α以及IL-1β的表达[10]。血清反应因子(serum response factor, SRF)是转录因子MADS-box家族成员之一[16],可与转录因子c-FOS和JUNB的血清反应元件(serum response element, SRE)结合[17],通过MAPK或RhoA途径来调节c-FOS和JUNB的表达。因此,在LPS诱导的炎症反应中SRF因子可能通过与AP-1结合来激活下游的炎症因子IL-6和IL-8,从而促进炎症反应产生。SRC属于SRC家族激酶(Src family kinases, SFKs)成员之一,可通过调控MAPK和STAT等多种信号通路来调节炎症反应。而以往的研究报道活化转录因子4(activating transcription factor 4,ATF4)主要与细胞增殖、造血功能、脂类代谢等密切相关[18-19],与炎症的相关性不太明确。
综上所述,本研究发现LPS诱导ARPE-19细胞产生炎症反应除了与经典的Toll-样受体和MAPK信号通路密切有关,还可能与激活PI3K-Akt-mTOR信号通路、NOD-样受体和VEGF信号通路以及上调转录因子FOS、JUN、JUNB、SRF以及AKT1、SRC基因的表达有关,意味着这些炎症信号通路和基因可能参与了炎症性视网膜疾病的病理过程,而针对这些通路及基因的调控有望成为治疗炎症性视网膜疾病的新靶点。
| [1] | MORRISON D C, RYAN J L. Endotoxins and disease mechanisms[J]. Annu Rev Med, 1987, 38: 417–432. DOI:10.1146/annurev.me.38.020187.002221 |
| [2] | FERRINGTON D A, EBELING M C, KAPPHAHN R J, et al. Altered bioenergetics and enhanced resistance to oxidative stress in human retinal pigment epithelial cells from donors with age-related macular degeneration[J]. Redox Biol, 2017, 13: 255–265. DOI:10.1016/j.redox.2017.05.015 |
| [3] | MAKAREV E, CANTOR C, ZHAVORONKOV A, et al. Pathway activation profiling reveals new insights into age-related macular degeneration and provides avenues for therapeutic interventions[J]. Aging (Albany NY), 2014, 6(12): 1064–1075. DOI:10.18632/aging.100711 |
| [4] | CHEN M, XU H. Parainflammation, chronic inflammation, and age-related macular degeneration[J]. J Leukoc Biol, 2015, 98(5): 713–725. DOI:10.1189/jlb.3RI0615-239R |
| [5] | WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: a revolutionary tool for transcriptomics[J]. Nat Rev Genet, 2009, 10(1): 57–63. DOI:10.1038/nrg2484 |
| [6] | CINATL J JR, BLAHETA R, BITTOOVA M, et al. Decreased neutrophil adhesion to human cytomegalovirus-infected retinal pigment epithelial cells is mediated by virus-induced up-regulation of Fas ligand independent of neutrophil apoptosis[J]. J Immunol, 2000, 165(8): 4405–4413. DOI:10.4049/jimmunol.165.8.4405 |
| [7] | FU X, LIN R, QIU Y, et al. Overexpression of angiotensin-converting enzyme 2 ameliorates amyloid beta-induced inflammatory response in human primary retinal pigment epithelium[J]. Invest Ophthalmol Vis Sci, 2017, 58(7): 3018–3028. DOI:10.1167/iovs.17-21546 |
| [8] | ADAMIS A P. Is diabetic retinopathy an inflammatory disease?[J]. Br J Ophthalmol, 2002, 86(4): 363–365. DOI:10.1136/bjo.86.4.363 |
| [9] | LIU H M, LEE T Y, LIAO J F. GW4064 attenuates lipo-polysaccharide induced hepatic inflammation and apoptosis through inhibition of the Toll-like receptor 4mediated p38 mitogen activated protein kinase signaling pathway in mice[J]. Int J Mol Med, 2018, 41(3): 1455–1462. DOI:10.3892/ijmm.2018.3366 |
| [10] | ANSARI A R, LI N Y, SUN Z J, et al. Lipopolysaccharide induces acute bursal atrophy in broiler chicks by activating TLR4-MAPK-NF-kappaB/AP-1 signaling[J]. Oncotarget, 2017, 8(65): 108375–108391. DOI:10.18632/oncotarget.19964 |
| [11] | ANDONEGUI G, ZHOU H, BULLARD D, et al. Mice that exclusively express TLR4 on endothelial cells can efficiently clear a lethal systemic Gram-negative bacterial infection[J]. J Clin Invest, 2009, 119(7): 1921–1930. DOI:10.1172/JCI36411 |
| [12] | BAI D, ZHAO Y, ZHU Q, et al. LZ205, a newly synthesized flavonoid compound, exerts anti-inflammatory effect by inhibiting M1 macrophage polarization through regulating PI3K/AKT/mTOR signaling pathway[J]. Exp Cell Res, 2018, 364(1): 84–94. DOI:10.1016/j.yexcr.2018.01.033 |
| [13] | LAMKANFI M, DIXIT V M. Inflammasomes and their roles in health and disease[J]. Annu Rev Cell Dev Biol, 2012, 28: 137–161. DOI:10.1146/annurev-cellbio-101011-155745 |
| [14] | LAMKANFI M, DIXIT V M. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 157(5): 1013–1022. DOI:10.1016/j.cell.2014.04.007 |
| [15] | JANKNECHT R. Regulation of the c-fos promoter[J]. Immunobiol, 1995, 193(2/4): 137–142. DOI:10.1016/S0171-2985(11)80536-X |
| [16] | TREISMAN R. Ternary complex factors: growth factor regulated transcriptional activators[J]. Curr Opin Genet Dev, 1994, 4(1): 96–101. DOI:10.1016/0959-437X(94)90097-3 |
| [17] | NORMAN C, RUNSWICK M, POLLOCK R, et al. Isolation and properties of cDNA clones encoding SRF, a transcription factor that binds to the c-fos serum response element[J]. Cell, 1988, 55(6): 989–1003. DOI:10.1016/0092-8674(88)90244-9 |
| [18] | KOC M, MAYEROV- V, KRACˇMEROV- J, et al. Stress of endoplasmic reticulum modulates differentiation and lipogenesis of human adipocytes[J]. Biochem Biophys Res Commun, 2015, 460(3): 684–690. DOI:10.1016/j.bbrc.2015.03.090 |
| [19] | VAN GALEN P, KRESO A, MBONG N, et al. The unfolded protein response governs integrity of the haematopoietic stem-cell pool during stress[J]. Nature, 2014, 510(7504): 268–272. DOI:10.1038/nature13228 |



