2. 121000 辽宁 锦州, 锦州医科大学附属第一医院:烧伤整形外科
2. 2 Department of Burns and Plastic Surgery, First Affiliated Hospital of Jinzhou Medical University, Jinzhou, Liaoning Province, 121000, China
面神经损伤不仅造成了严重的功能障碍,而且会导致患者严重的心理疾病,所以面神经损伤后的再生及修复一直是国内外研究人员关注及研究的重点和难点[1]。目前周围神经损伤修复的方法有很多种,但是多数修复方法仍不能让神经功能的恢复达到理想效果。临床上依旧以自体神经断端吻合作为修复方法的“金标准”[2]。雪旺细胞(Schwann cells, SCs)作为神经的支持细胞,在周围神经中充当重要角色,对神经修复起到重要作用。但如何在短时间内获得大量的雪旺SCs[3],研究发现干细胞可以通过体外化学及细胞因子定向诱导的方式获得稳定增殖的类SCs。本研究通过自体富血小板血浆联合化学因子定向诱导脂肪间充质干细胞(adipose-derived stem cells, ADSCs)成类SCs复合脱细胞异种神经支架修复兔面神经缺损,为异种神经修复提供可行性实验方案。
1 材料与方法 1.1 实验动物3月龄成年日本大耳白兔31只,雌雄不限,体质量2.5~3.0 kg;3月龄Wistar大鼠11只,体质量250~ 300 g。以上动物均由锦州医科大学实验动物中心提供,且动物的养护及处理均已获得锦州医科大学实验动物伦理委员会批准(批准号:2018006)。
1.2 试剂及相关仪器试剂:DMEM/F12培养基(HyClone公司,美国),0.25%胰蛋白酶-0.02%EDTA、青链霉素双抗(GIBCO公司,美国),OriCellTM兔脂肪间充质干细胞成脂诱导分化培养基试剂盒、OriCellTM兔脂肪间充质干细胞成骨诱导分化培养基试剂盒(Cyagen公司,美国),Triton X-100、Ⅰ型胶原酶、脱氧胆酸、β-巯基乙醇、维甲酸(Sigma公司,美国),油红O、茜素红S染色液(北京索莱宝公司),CCK-8试剂盒、DAPI细胞染色液、免疫荧光试剂盒-抗兔FITC、Cy3标记的山羊抗兔IgG、山羊抗鼠IgG(上海碧云天生物技术有限公司),兔抗S-100B、兔抗NGF、鼠抗BDNF(北京博奥森生物公司),DiOC16(3)细胞活性染色剂(上海圣祥生物有限公司),甲苯胺蓝染色液(北京雷根生物公司)。仪器:多功能酶标仪(TECAN公司,瑞士),倒置相差显微镜(Olympus公司,日本),TS100荧光显微镜(Nikon公司,日本)。
1.3 兔ADSCs培养及鉴定取日本大耳白兔1只,称体质量后,以陆眠宁Ⅱ(0.1~0.2 mL/kg)及4%戊巴比妥钠(1 mL/kg)联合肌肉注射麻醉。术区备皮消毒,无菌条件下切取双侧腹股沟皮下脂肪,采用Ⅰ型胶原酶单独消化法[4]提取ADSCs,体外增殖纯化,并用CCK-8法绘制第3,6代及第10代的细胞增殖曲线并观察细胞形态。取第3代ADSCs,胰酶消化后加入15%FBS的基础培养基制备成1×105/L单细胞悬液,并接种于事前铺好细胞爬片的12孔板中,分别进行成脂及成骨的诱导分化,并于诱导4周结束后进行油红O及茜素红S染色鉴定。
1.4 异种神经支架的制备取Wistar大鼠11只,以10%水合氯醛(0.7 mL/100 g)腹腔注射麻醉,术区备皮消毒,无菌条件下切取双侧1 cm坐骨神经段。参照SONDELL等[5]方法,随机取出21根快速置于液氮,37 ℃恒温水浴2 min,重复3次操作。后依次转入蒸馏水中处理7 h,3% Triton X-100中12 h,蒸馏水中1 h,4%脱氧胆酸24 h,重复上述操作后,蒸馏水清洗3次后,置于1×双抗的PBS中,4 ℃保存备用,1周换液1次。并对未处理及脱细胞处理后神经段冰冻包埋切片进行特异性蛋白S-100B免疫荧光染色观察。
1.5 类SCs的诱导及鉴定 1.5.1 自体富血小板血浆的制备采用分步离心法制备富血小板血浆(platelet-rich plasma, PRP)[6]。切取双侧腹股沟皮下脂肪垫前,使用一次性采血针对耳中央静脉采血10 mL,置于紫色采血管中,留取0.1 mL行全血血小板计数,剩余则行分步离心,首次1 500 r/min离心15 min,吸取上层血浆及血小板转入另一离心管中,再次以3 000 r/min离心10 min,弃上层3/4血浆,剩余液体按9:1加入血小板激活剂(1 000 U凝血酶与10%CaCl2混合物),震荡混匀,4 ℃冰箱过夜,待血凝块充分收缩后,以4 200 r/min离心10 min,吸取全部上清液即为激活后的PRP,-20 ℃保存备用,同时进行自体PRP与全血PLT计数,以确保制备PRP中PLT数量是全血的4倍以上。
1.5.2 自体PRP体外诱导ADSCs成类SCs及其鉴定取第3代ADSCs,胰酶消化后制备成1×106个/L单细胞悬液,并以每孔1 000个细胞接种于12孔板中。待细胞融合达85%左右时,去除基础培养基,按文献[7]的方法,37 ℃培养24 h后,更换成1 mmol/L β-巯基乙醇培养基。24 h后PBS洗涤3次,更换含40 ng/mL维甲酸培养基。48 h后去除培养基,PBS洗涤加入20%体积分数的DMEM/F12培养基,再培养7 d后,镜下观察细胞形态。并随机选取2孔细胞加入4%多聚甲醛,固定后依次加入兔抗S-100B (1:200)。4 ℃过夜后,洗涤加入FITC标记山羊抗兔IgG(1:500),室温孵育1 h,荧光显微镜下观察。并将剩余孔内细胞消化后收集继续培养。
1.6 类SCs的荧光标记及与异种神经支架的复合 1.6.1 类SCs的荧光探针标记取生长良好并通过鉴定的类SCs,待细胞融合达80%左右时,采用0.25%胰蛋白酶-0.02%EDTA消化处理后,以1 000 r/min离心5 min。PBS轻柔洗涤细胞2次离心,加入适量DIOC16(3)细胞活性染色剂的工作液重悬细胞至密度为1×106/mL。37 ℃孵箱孵育15 min,以500 r/min离心5 min,倾倒上液。加入37 ℃预热的基础培养基重悬细胞,再次孵育15 min,500 r/min离心5 min,重复孵育、离心、重悬,重复此步骤2次。结束后荧光显微镜下以488 nm波长激发,观察荧光标记情况。
1.6.2 标记后的类SCs与异种神经支架复合将上述1.4中制备的脱细胞异种神经支架置于基础培养基中,并于37 ℃孵箱内预处理1 h。适当避光操作,将标记后的DiOC16-SCs制成1×105/mL的单细胞悬液,并通过微量进样器以四等分点,每点5 μL注射到脱细胞神经支架内,加入新的基础培养基37 ℃孵箱内培养1 d,备用。切取少许组织冰冻包埋切片后荧光显微镜下观察支架复合细胞情况。
1.7 面神经缺损的修复 1.7.1 建立面神经缺损模型及实验分组取日本大耳白兔30只,称体质量后,以陆眠宁Ⅱ(0.1~0.2 mL/kg)及4%戊巴比妥钠(1 mL/kg)联合臀大肌注射麻醉。待动物麻醉后左侧卧位固定于手术台上,取口角至耳前连线中点切开皮肤,分离咬肌表面筋膜,可见面神经主干及其分支,切断下颊支3 mm待自然回缩后成5 mm神经缺损,建立右侧面神经下颊支的缺损模型。采用随机数表法将动物分成3组(n=10), A组(自体神经修复组)采用自体神经倒置后原位桥接于神经缺损处;B组(复合DIOC16-SCs的异种神经支架修复组);C组(单纯异种神经支架修复组)。显微镜下以10-0无损伤丝线3~4针吻合神经外膜,庆大霉素喷洒创面后,逐层缝合。术后动物分笼饲养,并每2天以碘伏溶液消毒术区创面,连续3次。
1.7.2 神经电生理检测术后8周将各组实验动物全麻后固定于实验台上,原位切开术区皮肤,显露右侧面神经下颊支及其支配的肌肉组织。将电极分别置于神经吻合处两端,针刺深度为5 mm,近端刺激,远端记录。以波形达到最大振幅且不引起周围相关肌肉收缩为宜,以标尺记录两电极之间的距离,动作电位的潜伏期,以潜伏期除以两电极之间的距离计算出神经传导速度。
1.7.3 有髓神经纤维密度计数及再生神经内特异性蛋白检测术后8周整体切取各组实验动物再生神经移植段,使用超薄刀片取5 mm吻合段远端制备石蜡切片,部分组织切片后以甲苯胺蓝染色并使用图像分析仪计算再生神经内有髓神经纤维密度,剩余组织行NGF及BDNF的特异性蛋白荧光染色,抗体浓度为1:500;剩余再生神经组织提取蛋白后使用Western blot检测各组NGF及BDNF的蛋白表达情况。
1.8 统计学分析采用SPSS 21.0统计软件,计量资料以x±s表示。组间比较采用单因素方差分析,两两比较采用LSD检验。检验水准:α=0.05。
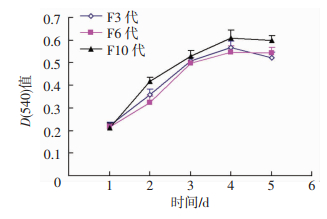
2 结果 2.1 ADSCs传代后的增殖情况及鉴定原代提取的ADSCs接种后2 h逐渐贴壁生长,初为短梭形、多角形,后呈长梭形。7 d后细胞成集落样生长,待细胞融合达90%进行传代。传代后的细胞增殖速度增快,且形态与原代相似,呈鱼群样。取第3代的ADSCs进行成脂诱导,4周后细胞体积增大,细胞质内形成较大脂滴,通过油红O染色,可见大量橘红色脂泡;通过成骨诱导,4周后细胞体积明显堆积,并见大量片状及斑块状基质沉淀,茜素红S染色后,可见红色钙结节(图 1)。通过CCK-8法绘制出第3、6代以及第10代的细胞增殖曲线,可见各代细胞生长周期趋于一致,无明显差异(图 2)。

|
| A:传代纯化后的ADSCs;B:油红O染色鉴定ADSCs的成脂诱导;C:茜素红S染色鉴定ADSCs诱导成骨 图 1 ADSCs的原代及成脂、成骨诱导观察 |
|
| 图 2 第3、6、10代ADSCs的生长曲线 |
2.2 异种神经支架的观察
通过脱细胞及冻融联合处理的大鼠坐骨神经与正常神经对比观察发现,长度及直径无明显变化,外膜呈乳白色,两端髓鞘略膨出,S-100B特异性染色可发现,未处理的神经支架有髓神经纤维外膜被染成黄褐色的蛋白颗粒,而处理后的神经支架无特异性染色(图 3)。

|
| A:未处理的神经支架S-100B蛋白特异性染色;B:处理后的神经支架S-100B蛋白特异性染色 图 3 神经支架的S-100B蛋白特异性免疫染色观察 |
2.3 类SCs的诱导及鉴定
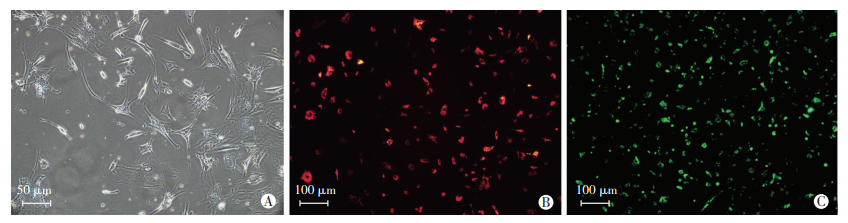
血球计数板肉眼计数结果显示:多步离心法提取的PRP是全血PLT浓度的4.3倍;联合使用化学试剂及PRP对ADSCs诱导,48 h后细胞质逐渐收缩并形成突起,细胞立体感增强并伴有光晕,并由最初的长梭形变成双极或多极细胞。对特异性蛋白S-100B免疫荧光染色后,荧光显微镜下可观察到被染成红色的SCs细胞,转化率达80%以上(图 4A、B)。
|
| A: ADSCs通过PRP联合化学试剂诱导成类SCs;B:通过特异性蛋白S-100B对诱导后的类SCs进行鉴定;C:类SCs通过DiOC16(3)标记绿色荧光细胞 图 4 类SCs的诱导及免疫染色、荧光标记 |
2.4 类SCs荧光标记及与异种神经支架的复合情况
荧光显微镜下观察类SCs通过DiOC16(3)标记绿色荧光细胞,标记率可达95%左右,传代后细胞标记情况并未明显减弱(图 4C)。复合入异种神经支架内培养后,制备横断面冰冻切片,细胞存活良好,标记良好,细胞密度适宜。后期桥接入面神经断端(图 5)。

|
| A:通过DiOC16(3)标记的类SCs细胞复合入神经支架内培养后横断面冰冻切片观察;B:异种神经支架桥接后的效果 图 5 DiOC16(3)标记的类SCs复合入神经支架及桥接后效果 |
2.5 术后行为观察
术后8周各组动物均成活,切口愈合良好。A组及B组的实验动物术侧面部肌力恢复相似,胡须摆动恢复明显,口角歪斜情况也有较大改善。C组各项均表现不明显,A、B组移植体以及所在神经段外观正常,与周围组织粘连均较轻,未见明显神经瘤形成;C组神经移植体与周围组织粘连较重。
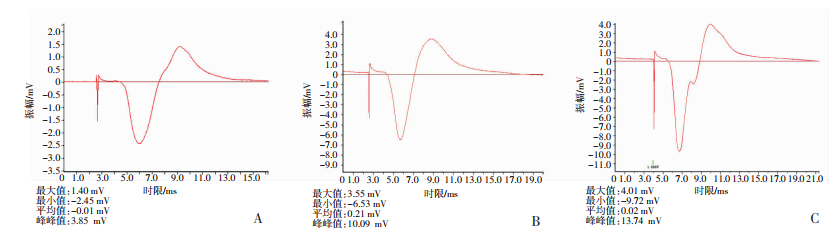
2.6 神经电生理检测及有髓神经纤维密度计数术后第8周,各组动物仍然存活良好,切口均未出现明显感染。原位解剖后再生神经连续性及完整性均良好,有不同程度血管膜覆盖,未形成明显的神经瘤。各组均可以引出动作电位,但与健侧相比动作电位潜伏期延长,且A、B组明显快于C组,且A组与B、C组比较均有统计学差异(P < 0.05,表 1、图 6)。甲苯胺蓝染色后图像分析仪计算相同面积内再生有髓神经纤维密度,发现A、B组明显高于C组(P < 0.05),A、B组之间比较差异无统计学意义(表 1、图 7)。
| 组别 | 传导速度/m·s-1 | 有髓神经纤维数量/n·mm-2 |
| A组 | 33.50±3.50a | 20 078.10±928.48a |
| B组 | 30.28±3.38a | 19 638.00±828.05a |
| C组 | 19.10±2.55 | 14 788.10±818.92 |
| a: P < 0.05, 与C组比较 | ||
|
| A:自体神经修复组;B:复合DiOC16-SCs的异种神经支架修复组;C:单纯异种神经支架修复组 图 6 各组损伤后再生面神经段的动作电位激发图 |

|
| A:自体神经修复组;B:复合DiOC16-SCs的异种神经支架修复组;C:单纯异种神经支架修复组 图 7 各组再生神经纤维甲苯胺蓝染色观察 |
2.7 再生神经内特异性蛋白NGF及BDNF的染色观察及定量分析
特异性荧光染色观察和Western blot检测发现:A、B组再生神经组织NGF及BDNF的蛋白含量均高于C组(P < 0.05),且A组NGF蛋白含量最高,B组BDNF蛋白含量最高(图 8)。

|
| A:Western blot检测各组NGF及BDNF蛋白含量;B:各组NGF蛋白灰度值分析;C:各组BDNF蛋白灰度值分析a: P < 0.05, 与C组比较 图 8 Western blot检测各组再生神经组织NGF及BDNF蛋白表达 |
3 讨论
周围神经损伤后再生必须具备以下条件:①神经损伤界面有足够量且具备活性的神经元存在;②再生的神经轴突能够通过神经损伤部位到达靶器官;③重建具有功能性突触联接[8]。任何一个条件的缺失都会导致神经再生及功能恢复过程中出现偏差,出现神经的失支配、感觉异常等情况。通过大量的临床试验及研究已经证实:自体神经具有神经修复因子,且基底膜完整,富含丰富的SCs及大量细胞外基质,成为天然的修复来源,并获得良好效果。但是获取过程中会不同程度地造成区域损伤,所以寻找可行性材料是目前周围神经损伤修复的研究重点[9-12]。通过大量的动物实验及临床研究发现:同种异体神经、自体血管及人工仿生导管支架材料在不同程度上均能获得一定的修复效果[13]。但是对于异种神经领域的研究却相对较少,虽然异种神经来源更加广泛,但是具有高免疫源性。研究发现仿照处理同种异体神经的方式,通过化学试剂处理并联合冻融的方式处理后的异种神经,能够有效脱除神经支架的髓鞘、细胞及作用形成的轴突成分,同时又能完整保留神经基底膜,不仅在一定程度上避免了移植后出现的免疫排异反应,并有利于支持细胞的增殖、迁移和细胞的黏附及轴突的再生[14-15]。但是处理后的再生神经作为神经移植供体,缺乏神经再生所必需的SCs细胞及相关神经营养因子、细胞外基质[16-17]。SCs作为终末细胞,增殖分化能力较差,同时具有高免疫性,那么如何获得低免疫性且具有SCs特性及功能的细胞?ZUK等[18]最先在人体脂肪中提取并体外培养出脂肪源性干细胞,并证实在一定诱导条件下可以分化成稳定的脂肪细胞、骨细胞、神经细胞、心肌细胞、上皮细胞等,而且相对其他干细胞其来源更丰富,扩增更容易。研究[19-22]发现PRP含有大量生长因子,不仅能促进干细胞的增殖,同时在联合其他化学试剂及细胞因子的作用下可以分化成SCs。
本研究成功利用组织工程学原理及方法,首先通过提取同种异体的脂肪源性干细胞,体外增殖后,使用化学试剂联合自身提取的PRP,体外诱导并通过SCs的特异性蛋白S-100B鉴定培养出类SCs。同时通过冻融联合化学脱细胞的方法制备出异种神经移植供体,并通过特异性蛋白的荧光染色及大体观察。通过此方法处理后神经供体在外观上与未处理的神经差别不大,但管腔内空虚,脱除了具有免疫性的神经细胞成分及细胞基质。细胞膜荧光探针DiOC16(3)是一种高效标记的亲脂性或细胞荧光染料,对细胞无毒,淬灭系数低,在体内可以很好地示踪。通过标记不仅可以观察体外诱导培养的类SCs的增殖及活性,同时便于观察与异种神经移植导管的复合情况。实验中将标记后的DiOC16-SCs通过微量进样器定点注射的方式复合入异种神经导管内,制备成异种神经支架(DiOC16-SCs-AXN),进而修复兔面神经5 mm的缺损,通过术后8周对再生神经移植段的神经电生理、有髓纤维的密度计数、再生神经内特异蛋白BDNF、NGF的特异性染色观察和蛋白定量分析得出结论:应用自体PRP诱导脂肪源性干细胞可以在体外获得稳定增殖的SCs,并将其复合入异种神经移植导管内形成异种神经支架,其在早期修复面神经损伤的效果与自体神经修复的效果相近,且与单纯的异种神经修复相比效果更佳。
综上所述,本研究与既往研究相比较,不仅合理应用了异种神经移植体及脂肪干细胞,同时通过体外干细胞联合PRP诱导的方式成功诱导成类SCs,并通过分段定点注射的方式与异种神经移植体相联合,不仅避免了干细胞不能在体内定向分化这个因素的影响,同时大大提高了损伤移植段的体内SCs浓度。再次说明通过自体PRP联合化学试剂对脂肪源性干细胞去甲基化诱导获得的类SCs联合大鼠脱细胞异种神经移植导管在早期修复周围神经损伤中可以获得满意的效果。如何保证体外培养的SCs在移植后仍能在体内发挥最大效果是今后进一步研究的方向。
| [1] |
陈彪, 张睿, 张文娟, 等. 牙髓干细胞对兔面神经损伤的修复作用及其机制[J].
吉林大学学报:医学版, 2018, 44(3): 504–509, 695.
CHEN B, ZHANG R, ZHANG W J, et al. Repair effect of dental pulp stem cells on facial nerve injury in rabbits and its mechanism[J]. J Jilin Univ: Med Ed, 2018, 44(3): 504–509, 695. DOI:10.13481/j.1671-587x.20180309 |
| [2] | DENG J X, ZHANG D Y, LI M, et al. Autologous transplantation with fewer fibers repairs large peripheral nerve defects[J]. Neural Regen Res, 2017, 12(12): 2077–2083. DOI:10.4103/1673-5374.221167 |
| [3] | DEAL D N, GRIFFIN J W, HOGAN M V. Nerve conduits for nerve repair or reconstruction[J]. J Am Acad Orthop Surg, 2012, 20(2): 63–68. DOI:10.5435/JAAOS-20-02-063 |
| [4] |
王琳, 吴国民, 孙秀梅, 等. 脂肪干细胞的培养鉴定及多向诱导分化[J].
口腔医学研究, 2017, 33(8): 807–810.
WANG L, WU G M, SUN X M, et al. Cultivation, identification and multiple differentiation of rabbit adipose-derived stem cells[J]. J Oral Sci Res, 2017, 33(8): 807–810. DOI:10.13701/j.cnki.kqyxyj.2017.08.002 |
| [5] | SONDELL M, KANJE M. Postnatal expression of VEGF and its receptor flk-1 in peripheral ganglia[J]. Neuroreport, 2001, 12(1): 105–108. DOI:10.1097/00001756-200101220-00028 |
| [6] | SHAHIDI M, VATANMAKANIAN M, ARAMI M K, et al. A comparative study between platelet-rich plasma and platelet-poor plasma effects on angiogenesis[J]. Med Mol Morphol, 2018, 51(1): 21–31. DOI:10.1007/s00795-017-0168-5 |
| [7] | XIA C, DING C, WANG Y, et al. In vitro differentiation of rabbit bone marrow mesenchymal stem cells into Schwann cells Induction effect of platelet-rich plasma[J]. Neural Regen Res, 2010, 5(1): 35–40. DOI:10.3969/j.issn.1673-5374.2010.01.006 |
| [8] |
徐筑秋, 杨晓楠, 祁佐良. 细胞自噬在周围神经损伤及再生中研究进展[J].
中国修复重建外科杂志, 2017, 31(1): 122–125.
XU Z Q, YANG X N, QI Z L. Role of cell autophagy in peripheral nerve injury and regeneration[J]. Chin J Repar Reconstr Surg, 2017, 31(1): 122–125. DOI:10.7507/1002-1892.201611136 |
| [9] |
全琦, 苌彪, 刘若西, 等. 周围神经损伤与再生:新型修补材料的应用研究与进展[J].
中国组织工程研究, 2017, 21(6): 962–968.
QUAN Q, CHANG B, LIU R X, et al. Peripheral nerve injury and regeneration: application and progress of novel nerve scaffolds[J]. Chin J Tissue Eng Res, 2017, 21(6): 962–968. DOI:10.3969/j.issn.2095-4344.2017.06.025 |
| [10] |
孙妍娜.脂肪间充质干细胞联合富血小板血浆修复兔面神经损伤的实验研究[D].锦州: 锦州医科大学, 2018: 45-48.
SUN Y N. Experimental study on the repair of facial nerve injury in rabbits with adipose-derived stem cells combined with platelet-rich plasma[D]. Jinzhou: Jinzhou Med Univ, 2018: 45-48. |
| [11] |
刘颜芬, 张雪晶, 段晓琴, 等. 富血小板血浆对周围神经损伤修复的研究现状[J].
中国实验诊断学, 2018, 22(1): 145–148.
LIU Y F, ZHANG X J, DUAN X Q, et al. Research status of platelet-rich plasma on repair of peripheral nerve injury[J]. Chin J Lab Diag, 2018, 22(1): 145–148. DOI:10.3760/cma.j.issn.1001-2036.2017.04.011 |
| [12] |
吴飞, 邓明, 杨越, 等. 复合脂肪源性干细胞的VPA/PRGD组织工程神经修复大鼠坐骨神经缺损的实验研究[J].
中华显微外科杂志, 2017, 40(4): 353–357.
WU F, DENG M, YANG Y, et al. Repair of sciatic nerve defects with VPA/PRGD conduits containing adipose-derived stem cells in a rat model[J]. Chin J Microsurg, 2017, 40(4): 353–357. DOI:10.3760/cma.j.issn.1001-2036.2017.04.011 |
| [13] |
陈勇, 范林, 付贞, 等. 神经导管支架修复外周神经损伤的研究与现状[J].
中国组织工程研究, 2017, 21(30): 4901–4907.
CHEN Y, FAN L, FU Z, et al. Repairing peripheral nerve injury with nerve conduits[J]. Chin J Tissue Eng Res, 2017, 21(30): 4901–4907. DOI:10.3969/j.issn.2095-4344.2017.30.024 |
| [14] |
陈少红, 季婉青, 侯博. 异种源性脱细胞神经支架修复坐骨神经损伤后再生的可行性[J].
中国医学创新, 2016, 13(20): 27–32.
CHEN S H, JI W Q, HOU B. The feasibility of xenogeneic acellular nerve scaffold to repair rat sciatic nerve defect regeneration[J]. Med Innov China, 2016, 13(20): 27–32. DOI:10.3969/j.issn.1674-4985.2016.20.007 |
| [15] |
崔勇, 张信英, 石作为, 等. 冻干去细胞异种神经和类许旺细胞共移植修复外周神经缺损的实验研究[J].
哈尔滨医科大学学报, 2007, 41(4): 316–319.
CUI Y, ZHANG X Y, SHI Z W, et al. Experimental study of repairing peripheral nerve defects with lyophilized acellular xenogeneic nerve seeded with Schwann-liked cells[J]. J Harbin Med Univ, 2007, 41(4): 316–319. DOI:10.3969/j.issn.1000-1905.2007.04.008 |
| [16] | WANG W, ITOH S, TAKAKUDA K. Comparative study of the efficacy of decellularization treatment of allogenic and xenogeneic nerves as nerve conduits[J]. J Biomed Mater Res A, 2016, 104(2): 445–454. DOI:10.1002/jbm.a.35589 |
| [17] |
周先虎, 冯世庆, 刘燊, 等. 激活态雪旺细胞联合脐血间充质干细胞移植修复脊髓损伤的研究[J].
中华实验外科杂志, 2017, 34(10): 1734–1737.
ZHOU X H, FENG S Q, LIU S, et al. Activated Schwann cells combined with umbilical cord blood mesenchymal stem cell transplantation for repair of spinal cord injury[J]. Chin J Exp Surg, 2017, 34(10): 1734–1737. DOI:10.3760/cma.j.issn.1001-9030.2017.10.036 |
| [18] | ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002, 13(12): 4279–4295. DOI:10.1091/mbc.e02-02-0105 |
| [19] |
楚佳奇, 孙杰聪, 李鹏, 等. 富血小板血浆联合人脐带间充质干细胞移植对大鼠骨质疏松骨折愈合的影响[J].
中国骨质疏松杂志, 2016, 22(3): 283–287.
CHU J Q, SUN J C, LI P, et al. Effect of platelet-rich plasma combined with human umbilical cord-mesenchymal stem cells on the healing of osteoporotic fracture in rats[J]. Chin J Osteoporos, 2016, 22(3): 283–287. DOI:10.3969/j.issn.1006-7108.2016.03.007 |
| [20] |
农桔安, 李小峰, 方德鹏, 等. 富血小板血浆联合柚皮甙体外诱导人骨髓间充质干细胞的成骨分化[J].
中国组织工程研究, 2018, 22(13): 2005–2010.
NONG J A, LI X F, FANG D P, et al. Platelet-rich plasma combined with naringin induces osteogenic differentiation of human bone marrow mesenchymal stem cells in vitro[J]. Chin J Tissue Eng Res, 2018, 22(13): 2005–2010. DOI:10.3969/j.issn.2095-4344.0511 |
| [21] |
郭洪刚, 姚芳莲, 汪涛, 等. 富血小板血浆联合人重组骨形态形成蛋白-2诱导羊脂肪基质干细胞成骨化趋势的研究[J].
中华显微外科杂志, 2016, 39(2): 138–142.
GUO H G, YAO F L, WANG T, et al. The experimental study on osteogenic potential of goat adipose derived stromal cells induced by PRP with rhBMP-2[J]. Chin J Microsurg, 2016, 39(2): 138–142. DOI:10.3760/cma.j.issn.1001-2036.2016.02.009 |
| [22] | XIA C, LI Y, CAO W, et al. Platelet-rich plasma-induced bone marrow mesenchymal stem cells versus autologous nerve grafting for sciatic nerve repair[J]. Neural Regen Res, 2010, 5(17): 1291–1295. DOI:10.3969/j.issn.1673-5374.2010.17.002 |



