2. 430070武汉, 解放军武汉总医院内分泌科;
3. 400041 重庆, 重庆市急救医疗中心内分泌科/糖尿病足诊治中心
2. Department of Endocrinology, Wuhan General Hospital of PLA, Wuhan, Hubei Province, 430070;
3. Department of Endocrinology and Multidisciplinary Diabetic Foot Medical Center, Chongqing Emergency Medical Center, Chongqing, 400041, China
糖尿病足是一种严重的糖尿病并发症, 可导致截肢, 约85%的截肢是由于糖尿病足溃疡(diabetic foot ulcers, DFUs)引发的。多种病理机制导致DFUs愈合困难, 其中感染创面是加重病情和阻碍愈合的一个重要因素[1]。DFUs常见革兰阳性球菌感染, 尤其以金黄色葡萄球菌(staphylococcus aureus, S. aureus)为主, 抗生素被用于控制DFUs感染, 但溃疡频繁再发及耐药菌株的感染导致单纯使用抗生素效果不佳[2-3]。近年来, 富血小板血浆(platelet-rich plasma, PRP)被广泛用于治疗各种慢性创面, 由PRP经凝血酶或钙剂激活后形成的富血小板凝胶(platelet-rich gel, PRG)被证实具有良好的抗细菌感染和促进DFUs愈合作用[4-5]。PRG不容易引起耐药, 与抗生素有协同作用, 对包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus, MRSA)在内的多种细菌均有抑制作用[6-7]。PRG抗感染的具体机制尚未明确, 离体实验为研究PRG的抗菌效应及机制提供了简单有效的途径。既往多数研究仅从抗菌角度出发观察PRG对细菌的抑制作用, 而我们试验中发现凝胶状的PRG在体外难以与研究对象均匀分布和作用, 无法达到理想的研究状态。因此, 本研究在既往报道采用人角质形成细胞(HaCaT细胞)与S. aureus共培养建立的经典体外感染创面模型[8]基础上加用高糖浓度模拟体外DFUs, 采用PRP、PRG以及富血小板凝胶萃取液(extract liquid of platelet-rich gel, EPG)对模型进行干预, 研究各干预物的抗菌效应及EPG对受感染细胞的保护作用, 旨在为PRP及其不同形式的临床应用提供支撑, 同时为进一步研究PRG抗感染和促进DFUs修复的调控机制提供一种简单有效的细胞模型和干预模式。
1 材料与方法 1.1 材料人永生化角质形成细胞株(HaCaT细胞)及S. aureus标准株(ATCC25923)为陆军军医大学(第三军医大学)军事预防医学系全军复合伤研究所保存。高糖DMEM培养基、胰蛋白胨大豆肉汤(TSB)培养基、胎牛血清购自赛默飞公司, CCK-8试剂盒、青霉素-链霉素溶液、Triton X-100、PBS溶液购自碧云天公司。
1.2 方法 1.2.1 PRP及贫血小板血浆的制备新鲜全血采集自2016年12月至2017年8月期间于陆军军医大学(第三军医大学)第一附属医院内分泌科住院的21例接受自体PRG治疗的糖尿病足患者, 其中男性12例, 女性9例, 平均年龄63岁, 患者均已签署相关知情同意书。将上述全血送至本院输血科制备获得PRP及贫血小板血浆(platelet-poor plasma, PPP), PRP血小板浓度为(1 024±111)×109/L, PPP血小板浓度 < 10×109/L。在保证患者治疗所需用量的情况下, 回收剩余PRP用于本研究。
1.2.2 PRG及EPG的制备将含有100 U凝血酶粉的10%葡萄糖酸钙溶液100 μL与1 mL PRP混合, 室温静置5 min待PRG形成。将PRG于37 ℃静置1 h后用无菌玻璃棒充分捣碎凝胶, 3 000×g室温离心10 min后收集上清即EPG。
1.2.3 体外感染创面模型的构建与干预将S. aureus标准株接种于TSB固体培养基平板上, 37 ℃恒温箱中培养18 h, 挑单个菌落接种于10 mL TSB液体培养基中, 37 ℃条件下振荡培养4 h后收集菌液, 以紫外分光光度计测定光密度D(600)值确定细菌浓度, 用高糖DMEM培养基将菌液稀释至104 CFU/mL备用。将HaCaT细胞以30 000 /cm2的密度接种于96孔板中, 以含10%胎牛血清的高糖DMEM培养48 h后吸去孔内培养液, 替换为80 μL新鲜高糖DMEM培养液或上述备用的S. aureus菌液。待HaCaT细胞与S. aureus在37 ℃预先共培养1 h后, 分别加入20 μL的PPP、PRP、PRG和EPG进行干预。
1.2.4 细菌生长测定采用PPP、PRP、PRG或EPG干预12、24、48、72 h, 收集96孔板内培养液, 以含有100 U/mL青霉素及0.1 mg/mL链霉素的PBS洗3次, 随后以Triton X-100裂解细胞。将上述培养液和细胞裂解液以TSB液体培养基作10~107倍梯度稀释后取100 μL稀释液分别涂布TSB琼脂平板, 37 ℃培养12 h后对平板中菌落进行计数。
1.2.5 细胞增殖测定在12、24、36、48 h吸去单纯细胞培养组(HaCaT), 细胞与细菌共培养组(HaCaT+S. aureus)及EPG干预组(HaCaT+S. aureus+EPG)孔内培养液, 无菌PBS洗3次, 随后每孔加入含有10%CCK-8试剂的高糖DMEM培养液100 μL, 于37 ℃孵育2 h后以紫外分光光度计测定光密度D(450)值。根据CCK-8试剂盒说明书, D(450)值高低与细胞数目呈线性关系。以单纯细胞培养组为对照, 不同时间点各组结果与对照组比较的比值表示。
1.3 统计学分析各试验组设3个样本, 数据以x±s表示, 数据采用单因素方差分析和LSD检验进行分析。以SPSS 20.0统计软件进行处理, 检验水准:α=0.05。
2 结果 2.1 PRP、PRG及EPG的抑菌活性比较与PPP相比, PRP、PRG和EPG在24 h内均能显著抑制S. aureus的生长(P < 0.01)。干预48 h, PRP不能显著抑制细菌生长(P>0.05), 而PRG和EPG能够继续显著抑制细菌生长(P < 0.01)。在48 h内PRG和EPG抑菌作用相当, 之后二者抑菌作用逐渐出现差距。干预72 h, PRG的抑菌作用强于EPG(P < 0.05, 图 1)。
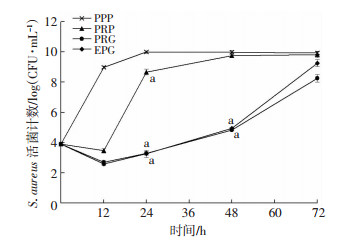
|
| a:P < 0.01, 与PPP比较 图 1 PRP、PRG和EPG在不同时间点对S. aureus的抑制作用(n=3, x±s) |
2.2 PRP、PRG及EPG对HaCaT细胞内S. aureus的抑制作用
干预48 h, 对各组细胞内S. aureus计数(图 2A), PRP组和PPP组比较差异无统计学意义(P>0.05)。PRG组和EPG组较PPP组显著降低(P < 0.05)。对各组细胞外S. aureus计数(图 2B), PRP组和PPP组比较差异无统计学意义(P>0.05)。PRG组和EPG组较PPP组显著降低(P < 0.05)。
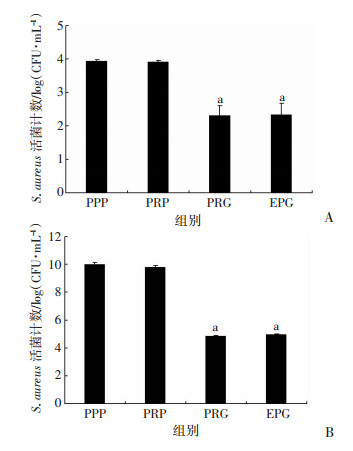
|
| a:P < 0.01, 与PPP比较 图 2 PRP、PRG和EPG干预48 h后对细胞内(A)外(B) S. aureus的抑制作用(n=3, x±s) |
2.3 S. aureus对HaCaT细胞的损伤效应及EPG对细胞的增殖作用
与HaCaT组相比, HaCaT+S. aureus组在12 h即观察到细胞增殖的显著下降(P < 0.05), 24 h后细胞增殖严重受损(P < 0.01), 到48 h细胞损失殆尽。HaCaT+S. aureus+EPG组在12、24 h未见细胞增殖下降(P>0.05), 在36、48 h可见细胞增殖显著增加(P < 0.05)。
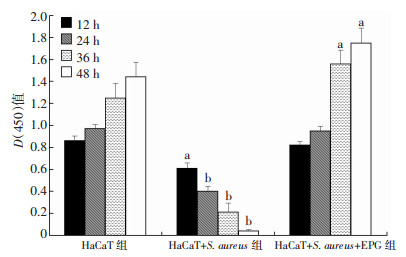
|
| a:P < 0.05, b:P < 0.01, 与HaCaT组比较 图 3 S. aureus及EPG对HaCa T细胞增殖的影响(n=3, x±s) |
3 讨论
糖尿病足溃疡是临床上常见的难愈合性创面之一, 代谢紊乱和免疫异常导致创面容易合并细菌感染, 感染进一步加重溃疡和阻碍愈合。S. aureus是一种常见的DFUs感染源并阻碍创面愈合[9]。角质形成细胞是表皮中最主要的细胞类型, 参与形成机体屏障抵御病原体入侵。在创面愈合过程中角质形成细胞增殖、迁移和分化, 最终完成再上皮化过程[10]。此外角质形成细胞在皮肤免疫反应中发挥着抗原提呈、释放免疫介质、分泌细胞因子等多种作用[11]。因此, 在文献[8]报道的基础上, 我们将HaCaT细胞与S. aureus在高糖条件下共培养, 模拟DFUs建立体外感染创面模型。本模型是基于角质形成细胞在皮肤免疫防御和创面修复中的主要地位, 结合S. aureus作为糖尿病溃疡创面常见感染源, 采用高糖培养条件模拟糖尿病病理状态下的高血糖环境, 建立的体外模型符合临床实际。该模型细胞成分简单明确, 可精确控制培养条件, 重复性良好, 规避各混杂因素, 是研究糖尿病创面非常有用的一种工具。相对于既往单纯的体外抗菌实验, 我们将细胞和细菌同步纳入, 不仅可以观察干预措施对细菌生长的影响, 还能观察细菌感染导致的细胞毒作用以及干预措施对细胞所产生的保护效应。在探索PRP及其不同形式干预本模型所产生的生物学效应的基础上, 为进一步通过检测模型中细胞内相关信号通路的变化, 可为更深入的机制研究提供途径。
鉴于PRP及其不同形式均为富含血小板的血浆制品, 因此我们在研究中采用PPP作为对照排除血浆成分的影响来观察各干预物的作用。结果显示PRG和EPG展现出了较PRP更强的抗菌活性, 分析上述干预物之间的成分差异, 反映出血小板是发挥抗菌作用的核心, 而经过凝血酶和钙剂的激活能够进一步促进血小板抗菌功能的发挥。既往研究提示血小板释放的α颗粒、抗菌肽、趋化因子、过氧化物、免疫球蛋白等物质能够产生抗菌作用, 这些物质可以直接抑制或杀灭病原体, 也可以通过趋化和激活免疫细胞间接产生抗菌效应[12]。有研究表明激活剂对血小板释放生物活性物质具有刺激作用[13]。PRG中的血小板浓度是正常人血液中浓度的3~5倍, 大量的血小板在受到激活后释放的丰富抗菌物质是PRG展现良好抗菌活性的基础。在研究过程中鉴于PRG胶冻样的物理形态不方便被移液器所吸取, 我们萃取PRG获得了EPG。结果显示两者在48 h内具有基本等同的抗菌能力, 而之后PRG较EPG展现出更持久的抗菌能力。该现象一方面可能与我们的萃取方式不能完全获得PRG中的血小板及其释放物质有关; 另一方面可能与PRG中纤维蛋白构成的三维网架结构吸附血小板释放的活性物质并缓慢释放有关[14], 正是这种缓释效应带来了持久的临床治疗作用。然而考虑到EPG作为液体形态使用方便, 可以做到用量精确, 有利于减少误差, 更适合微量实验操作, 我们认为EPG作为PRG的有效成分, 在48 h内可以替代PRG用于实验, 这种改进目前尚少见报道。
在我们的模型中发现细菌对细胞增殖有显著损害作用, 这种损害作用随着时间延长和细菌的生长而加剧。S. aureus不仅能够通过释放毒素导致细胞坏死, 还能侵入细胞引起细胞凋亡[15]。既往有研究表明PRP及其不同形式在体外对细菌的抑制作用[16-17], 但少有研究报道其对细胞内细菌生长的影响。我们的数据显示采用PRG和EPG干预本模型到48 h, 两者对细胞内S. aureus也有显著的抑制作用, 且程度上较胞外抑菌作用更加明显。这种效应可能是由于PRG和EPG抑制细胞外细菌后减少了细菌对细胞的入侵, 亦可能是两者直接作用细胞所产生的胞内抑菌效应, 提示存在受两者调控的胞内抗菌机制, 这需要我们后继研究去进一步阐明。由于凝胶状的PRG加入细胞培养孔中不易清除, 影响后续的细胞增殖检测, 我们用代表PRG有效成分的EPG进行干预。数据显示20% EPG能够有效保护HaCaT细胞对抗S. aureus感染, 在干预后24 h内恢复细胞的正常增殖, 随着干预时间的延长还能够显著促进细胞增殖。我们认为这种促细胞增殖作用一方面与EPG抑制细菌后减轻细菌对细胞的毒力作用有关, 另一方面与EPG中所含有的血小板分泌的血小板源性生长因子、血管内皮细胞生长因子、转化生长因子β、表皮生长因子、类胰岛素生长因子等多种细胞因子发挥功能有关[18]。综合看来, PRP经过凝血酶和钙剂激活后形成的PRG能够更持久地发挥抗菌和促细胞增殖作用, 本研究结果为临床工作中优选应用PRG治疗DFUs提供了基础数据支撑, 同时本模型及干预模式的建立也为进一步研究细胞中相关信号通路的变化, 诠释PRG发挥功能所涉及的调控机制提供便利。
| [1] | ARMSTRONG D G, BOULTON A J M, BUS S A. Diabetic foot ulcers and their recurrence[J]. N Engl J Med, 2017, 376(24): 2367–2375. DOI:10.1056/NEJMra1615439 |
| [2] | SPICHLER A, HURWITZ B L, ARMSTRONG D G, et al. Microbiology of diabetic foot infections: from louis pasteur to 'crime scene investigation'[J]. BMC Med, 2015, 13: 2. DOI:10.1186/s12916-014-0232-0 |
| [3] | UCKAY I, GARIANI K, DUBOIS-FERRIERE V, et al. Diabetic foot infections: recent literature and cornerstones of management[J]. Curr Opin Infect Dis, 2016, 29(2): 145–52. DOI:10.1097/QCO.0000000000000243 |
| [4] | PICARD F, HERSANT B, BOSC R, et al. The growing evidence for the use of platelet-rich plasma on diabetic chronic wounds: a review and a proposal for a new standard care[J]. Wound Repair Regen, 2015, 23(5): 638–43. DOI:10.1111/wrr.12317 |
| [5] | DENG W, BOEY J, CHEN B, et al. Platelet-rich plasma, bilayered acellular matrix grafting and negative pressure wound therapy in diabetic foot infection[J]. J Wound Care, 2016, 25(7): 393–7. DOI:10.12968/jowc.2016.25.7.393 |
| [6] | MERCIER R C, DIETZ R M, MAZZOLA J L, et al. Beneficial influence of platelets on antibiotic efficacy in an in vitro model of staphylococcus aureus-induced endocarditis[J]. Antimicrob Agents Chemother, 2004, 48(7): 2551–7. DOI:10.1128/AAC.48.7.2551-2557.2004 |
| [7] | BIELECKI T M, GAZDZIK T S, ARENDT J, et al. Antibacterial effect of autologous platelet gel enriched with growth factors and other active substances: an in vitro study[J]. J Bone Joint Surg Br, 2007, 89(3): 417–20. DOI:10.1302/0301-620X.89B3.18491 |
| [8] | WIEGAND C, ABEL M, RUTH P, et al. HaCaT keratinocytes in co-culture with staphylococcus aureus can be protected from bacterial damage by polihexanide[J]. Wound Repair Regen, 2009, 17(5): 730–8. DOI:10.1111/j.1524-475X.2009.00536.x |
| [9] | BOWLER P G, DUERDEN B I, ARMSTRONG D G. Wound microbiology and associated approaches to wound management[J]. Clin Microbiol Rev, 2001, 14(2): 244–69. DOI:10.1128/CMR.14.2.244-269.2001 |
| [10] | HOSOYA A, LEE J M, ChO S W, et al. Morphological evidence of basal keratinocyte migration during the re-epithelialization process[J]. Histochem Cell Biol, 2008, 130(6): 1165–75. DOI:10.1007/s00418-008-0499-3 |
| [11] | NESTLE F O, DI MEGLIO P, Qin J Z, et al. Skin immune sentinels in health and disease[J]. Nat Rev Immunol, 2009, 9(10): 679–91. DOI:10.1038/nri2622 |
| [12] | DEPPERMANN C, KUBES P. Platelets and infection[J]. Semin Immunol, 2016, 28(6): 536–545. DOI:10.1016/j.smim.2016.10.005 |
| [13] | GIRALDO C E, ALVAREZ M E, CARMONA J U. Influence of calcium salts and bovine thrombin on growth factor release from equine platelet-rich gel supernatants[J]. Vet Comp Orthop Traumatol, 2017, 30(1): 1–7. DOI:10.3415/VCOT-16-02-0026 |
| [14] | DOHAN D M, CHOUKROUN J, DISS A, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. part Ⅱ: platelet-related biologic features[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006, 101(3): e45–50. DOI:10.1016/j.tripleo.2005.07.009 |
| [15] | VÁZQUEZ-SÁNCHEZ E A, RODRÍGUEZ-ROMERO M, SÁNCHEZ-TORRES L E, et al. Peptidoglycan from staphylococcus aureus has an anti-apoptotic effect in HaCaT keratinocytes mediated by the production of the cellular inhibitor of apoptosis protein-2[J]. Microbiol Immunol, 2014, 58(2): 87–95. DOI:10.1111/1348-0421.12126 |
| [16] | CHEN L, WANG C, LIU H, et al. Antibacterial effect of autologous platelet-rich gel derived from subjects with diabetic dermal ulcers in vitro[J]. J Diabetes Res, 2013, 2013: 269527. DOI:10.1155/2013/269527 |
| [17] | BURNOUF T, CHOU M L, WU Y W, et al. Antimicrobial activity of platelet (PLT)-poor plasma, PLT-rich plasma, PLT gel, and solvent/detergent-treated PLT lysate biomaterials against wound bacteria[J]. Transfusion, 2013, 53(1): 138–46. DOI:10.1111/j.1537-2995.2012.03668.x |
| [18] | ETULAIN J. Platelets in wound healing and regenerative medicine[J]. Platelets, 2018, 29(6): 556–568. DOI:10.1080/09537104.2018.1430357 |



