2. 056001 河北 邯郸, 解放军第980医院邯郸分院药剂科
2. Department of Pharmacy, Handan Branch of No. 980 Hospital of PLA, Handan, Hebei Province, 056001, China
雷诺嗪(ranolazine)是一种新型的代谢调节剂和选择性的抗心绞痛药, 最早由美国Syntex制药公司于20世纪80年代后期开始研发, 2003年下半年由CV Therapeutics公司向美国FDA提交新药申请, 用于治疗慢性稳定性心绞痛。其具有抗心肌缺血、抗心律失常和抗心力衰竭作用[1-2], 作用特点是减少脂肪酸氧化, 增加葡萄糖氧化而发挥抗缺血和抗心绞痛作用, 同时对血流动力学无影响, 也不会增加心肌负荷量[3-5]。2006年1月, 美国FDA正式批准CV Therapeutics公司的雷诺嗪500 mg薄膜包衣缓释片(Ranexa)上市, 目前国内尚未上市和进口该药。该药为10年来FDA批准的首个治疗心绞痛药物。
近年来国内外对雷诺嗪的药动学特征已有报道, 但中国健康人体药动学特征的报道不多。本研究参照国外同类产品在中国健康人体中进行雷诺嗪缓释片单次3个剂量组(500、1 000、1 500 mg)和多次2个剂量组(500、1 000 mg)给药试验的临床研究[6-7], 评估其在健康志愿者体内的安全性, 观察其毒性反应及其与剂量的相关性;了解其在中国健康人体内吸收、分布和消除(代谢和排泄)的动态变化特点, 为临床的合理应用提供依据。
1 材料与方法 1.1 仪器主要仪器:Agilent 1100 Series液相色谱仪(美国Agilent公司);AB QTRAP2000质谱仪(美国AB Sciex公司);高速离心机(美国Abbott公司);GENIUS 3型漩涡混匀器(德国IKA公司);BP211D型赛多利斯电子天平(德国赛多利斯公司);超纯水器(Milli-Q plus, 美国Millipore公司), 994型超低温冰箱(美国Thermo公司);BT-Ⅱ水浴式氮吹仪(北京踏锦科技有限公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司)。数据采集和处理系统为Analysis 1.4.1(美国AB Sciex公司)。
1.2 药品和试剂药品和试剂:雷诺嗪对照品(批号:110902, 含量100%, 国内某制药有限公司);盐酸苯海拉明对照品(批号:10066-9705, 含量100%, 中国药品生物制品检定所);乙腈(色谱纯, 美国迪马公司);甲酸(色谱纯, 美国福禄克公司);甲基叔丁基醚(分析纯, 天津市光复精细化工研究所);空白血浆由陆军军医大学第一附属医院血库提供;水为自制超纯水。雷诺嗪缓释片(国内某制药有限公司;批号:110801;规格为500 mg/片)。
1.3 受试者的筛选试验分为单次和多次给药, 受试者人口学信息见表 1。试验方案经陆军军医大学第一附属医院伦理委员会审批[2011年伦审药第(25)号]。志愿者本人签署知情同意书后, 进行体格检查, 心电图、血压、血常规、尿常规及肝、肾功能等各项指标均正常。受试者无药物过敏史和药物依赖史, 无慢性疾病史, 2周内未服用任何药物;试验期间忌烟、酒, 统一清淡饮食。
| 组别 | 例数 | 性别(男/女) | 年龄/岁 | 体质量/kg | 身高/m | 体质量指数/kg·m-2 |
| 单次给药组 | 10 | 5/5 | 27.25±4.62 | 59.38±8.48 | 1.68±0.05 | 20.94±1.95 |
| 多次给药组 | 10 | 5/5 | 24.30±7.82 | 54.80±5.98 | 1.62±0.07 | 20.87±1.44 |
1.4 方法 1.4.1 试验方案
单次给药[6]:受试者分3个周期依次服用500、1 000 mg和1 500 mg受试药物。清洗期为7 d。受试者于试验前1 d晚餐后开始禁食10 h后, 于试验当日晨单次口服设定剂量药物, 200 mL温水送服。服药2 h后方可饮水, 4 h和10 h后进食统一标准餐。各剂量组均为服药前(0 h)及服药后30 min, 1、2、3、4、5、6、8、10、12、24、36、48 h抽取前臂静脉血4 mL, 收集于肝素化试管中, 离心分离血浆, -70 ℃冷冻贮存至分析。
多次给药[6]:受试者分2个周期依次服用500 mg和1 000 mg受试药物, 12 h 1次, 连续服用9次。清洗期为14 d。受试者于试验前1 d晚餐后开始禁食10 h后, 于多次给药第1天晨口服设定剂量药物(第1次给药), 200 mL温水送服, 12 h 1次, 连续给药9次。各剂量组均为给药第3、4、5天晨给药前和第5天晨给药后30 min, 1、2、3、4、5、6、8、10、12、24、36、48 h抽取前臂静脉血4 mL, 收集于肝素化试管中, 离心分离血浆, -70 ℃冷冻贮存至分析。
1.4.2 色谱条件色谱柱:ZORBAX SB-C18(2.1 mm×50 mm, 1.8 μm, 美国安捷伦公司);柱温:25 ℃;流动相:乙腈:0.1%甲酸=80 :20;流速:0.2 mL/min;进样量:4 μL。
1.4.3 质谱条件检测方式:多反应监测(MRM), 正离子检测;选择离子对:雷诺嗪m/z为428.4→279.1, 苯海拉明m/z为256.0→167.0;气帘气:30.0 PSI;离子源电压:5 000 V;离子源温度:350.0 ℃;去簇电压(DP):44 V/17 V;碰撞能(CE):31 V/21 V。
1.4.4 溶液的配制精密称取雷诺嗪10 mg至10 mL容量瓶中, 乙腈溶解, 定容, 混匀, 即为1 mg/mL。精密称取盐酸苯海拉明对照品11 mg至10 mL容量瓶, 乙腈溶解, 定容, 混匀, 即为1.1 mg/mL, 从中取出0.1 mL至10 mL容量瓶中, 乙腈定容, 混匀, 即为0.011 mg/mL, 再从中取出0.2 mL至10 mL容量瓶中, 乙腈定容, 混匀, 即为0.22μg/mL, 以上储备液均在4 ℃冰箱内保存备用。
1.4.5 血浆样品处理取待测血浆0.1 mL, 加入10 μL内标(0.22 μg/mL盐酸苯海拉明), 混匀, 加入0.8 mL甲基叔丁基醚, 涡旋混匀3 min, 13 000 r/min离心3 min, 取上层有机相0.4 mL于40 ℃ N2吹干, 残留物加入乙腈1 mL溶解, 进样4 μL。
1.4.6 专属性分别取6份不同来源的空白血浆各200 μL, 加入800 μL甲醇溶液(不含内标), 其余按1.4.5项下操作;空白血浆中加入雷诺嗪(400 ng/mL)标准溶液和健康人单次给药2 h后的血浆样品, 按1.4.5项下操作, 考察雷诺嗪和苯海拉明的专属性。
1.4.7 标准曲线与最低定量限从浓度分别为2、4、10、20、50、100、200 μg/mL的雷诺嗪标准溶液适量中各取10 μL分别加入490 μL空白血浆中, 得浓度分别为40、80、200、400、1 000、2000、4 000 μg/L的雷诺嗪血样, 按样品处理方法处理后进样分析。以待测物浓度为横坐标, 待测物与内标的峰面积比值为纵坐标, 进行回归运算, 求得雷诺嗪的标准曲线。配制成相当于雷诺嗪血浆浓度为40 μg/L的样品, 对该浓度样品进行5样本分析, 并根据当日标准曲线计算每一样本测得浓度即为定量下限。
1.4.8 绝对回收率按1.4.7项下的方法配制低、中、高3个浓度的质控样品, 每一浓度进行5样本分析。根据血浆中雷诺嗪、苯海拉明的峰面积与相同浓度水溶液测得的峰面积之比计算其提取回收率。
1.4.9 精密度和准确度按1.4.7项下的方法配制最低定量限、低、中、高4个浓度的质控样品, 每一浓度进行5样本分析, 在同1 d内计算本法的批内精密度;连续测定3批, 计算本法的批间精密度。根据标准曲线计算所得浓度与理论浓度的比值即为准确度。
1.4.10 基质效应取6个不同来源200 μL空白血浆按1.4.5项下处理血样, 取乙腈复溶液作为溶剂, 配制(浓度分别为4、160 μg/L)低、高浓度质控样品进样后所得峰面积为AMatrix;另用乙腈作溶剂配制与其相同浓度的低、高浓度对照品进样后所得峰面积为AStandard, 按公式AMatrix·AStandard-1×100%计算所得基质效应因子(matrix factor, MF), 同法处理内标, 得到内标的MF, 雷诺嗪与内标的比值为内标归一化基质效应因子(IS-normalized MF)。
1.4.11 稳定性考察分别将雷诺嗪和内标物标准储备液于第0、2、4、7天各进行3样本分析, 考察储备液的稳定性。配制低、中、高3个浓度的血浆样品, 每一种浓度水平进行3样本分析, 分别考察雷诺嗪血浆样品经处理后室温放置4 h的稳定性, 血浆样品室温放置3 h的稳定性, 血浆样品经历3次冷冻-解冻循环的稳定性(-70 ℃), 血浆样品-70 ℃冷冻保存6周的稳定性。
2 结果 2.1 专属性本实验条件下, 雷诺嗪和苯海拉明的保留时间分别为0.90、1.04 min, 人空白血浆中的内源性物质不干扰雷诺嗪和苯海拉明的测定(图 1)。

|
| A:空白血浆;B:空白血浆+雷诺嗪(400 μg/L)+苯海拉明;C:500 mg单次给药后2 h血浆样品 图 1 健康受试者血浆中雷诺嗪和苯海拉明的典型色谱图 |
2.2 标准曲线与最低定量限
以雷诺嗪浓度X为横坐标, 雷诺嗪与苯海拉明的峰面积比值Y为纵坐标, 进行回归运算得标准曲线方程为Y=0.000 617X+0.000 349(权重系数1/X2), R=0.999 1。雷诺嗪的线性范围为40~4 000 μg/L。雷诺嗪的定量下限为40 μg/L, 该浓度下雷诺嗪的批间精密度(RSD)为2.2%。
2.3 提取回收率雷诺嗪低、中、高3个浓度(80、400、3 200 μg/L)水平样品的提取回收率为53.9%~63.0%, RSD均小于11%。
2.4 精密度和准确度雷诺嗪最低定量下限、低、中、高4个浓度(40、80、400、3 200 μg/L), 每一浓度水平样品的批内精密度(RSD)为3.0%~10.8%, 准确度(RE)为-5.7%~1.8%;批间精密度(RSD)为5.3%~8.3%, RE为-3.1%~8.0%。
2.5 基质效应雷诺嗪低、高浓度相对基质效应分别为(92.5±9.1)%、(106.6±5.8)%, RSD分别为9.8%、5.5%。表明在本实验色谱与质谱条件下可忽略基质效应的影响。
2.6 稳定性考察了雷诺嗪和内标物标准储备液第0、2、4、7天的稳定性, 其RSD分别为5.3%、2.2%。考察雷诺嗪低、中、高3个浓度(80、400、3 200 μg/L)血浆样品经处理后室温放置4 h的稳定性, 血浆样品室温放置3 h的稳定性, 血浆样品经历3次冷冻-解冻循环的稳定性(-70 ℃), 血浆样品-70 ℃冷冻保存第1、3、6周3次的稳定性。各样品浓度的RSD < 10.5%(表 2)。
| 理论浓度/μg·L-1 | 室温稳定性 | 处理后稳定性 | 反复冻融稳定性 | 长期稳定性 | |||||||
| 测得浓度/μg·L-1 | RSD/% | 测得浓度/μg·L-1 | RSD/% | 测得浓度/μg·L-1 | RSD/% | 测得浓度/μg·L-1 | RSD/% | ||||
| 80 | 80.1±5.2 | 6.5 | 77.5±8.1 | 10.5 | 78.4±4.9 | 6.2 | 83.7±6.1 | 7.3 | |||
| 400 | 416.3±15.4 | 3.7 | 400.7±29.9 | 7.5 | 421.3±19.0 | 4.5 | 413.1±27.2 | 6.6 | |||
| 3 200 | 3 475.0±1 211.8 | 3.5 | 3 454.4±127.6 | 3.7 | 3 317.8±144.6 | 4.4 | 3 337.8±255.2 | 7.6 | |||
2.7 药代动力学 2.7.1 血药浓度-时间曲线
采用本研究建立的方法对健康受试者3个单次给药剂量组和2个多次给药剂量组口服给予雷诺嗪缓释片后血浆浓度进行测定, 血药浓度-时间曲线见图 2。可见各剂量组的Tmax、t1/2z相近, Cmax、AUC0-t、AUC0-∞与剂量呈线性关系, 故在剂量500~1 500 mg雷诺嗪在人体内符合线性动力学特征。
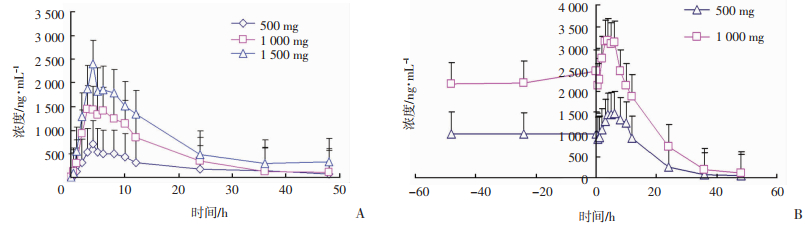
|
| A:3个剂量组单次给药;B:2个剂量组多次给药 图 2 雷诺嗪缓释片给药后健康受试者平均血药浓度-时间曲线 |
2.7.2 药代动力学参数
采用DAS3.3.1软件非房室模型方法对其药动学参数进行统计, 单次给药剂量组和多次给药剂量组主要药动学参数见表 3、4。单次给药1 000、1 500 mg剂量组Cmax 是500 mg的2.35、3、57倍, AUC0-t分别是2.47、3.84倍, AUC0-∞分别是2.69、3.81倍, 随给药剂量的增加, Cmax 和AUC均呈正比增加。经独立样本t检验, 单次给药与多次给药的MRT0-t、VRT0-t、t1/2z差异无统计学意义(P > 0.05), Cmax、AUC0-t、CLz差异具有统计学意义(P < 0.05)。
| 给药剂量/mg | Cmax /μg·L-1 | AUC0-t /(μg·h)·L-1 | AUC0-∞ /(μg·h)·L-1 | MRT0-t/h | MRT0-∞/h | VRT(0-t)/h2 | t1/2z/h | Vz/L | CLz/F (L·h-1) | Tmax/h |
| 500 | 774±157 | 8 470±2 765 | 10 042±4 296 | 11.1±3.7 | 15.4±8.9 | 58.4±56.4 | 8.2±6.8 | 546±243 | 61.0±34.2 | 4.9±1.8 |
| 1 000 | 1 818±554 | 20 936±6 957 | 26 968±8 732 | 10.0±2.5 | 17.3±11.3 | 43.8±31.5 | 10.3±8.7 | 530±306 | 41.4±16.9 | 4.9±2.6 |
| 1 500 | 2 762±1 099 | 32 554±17 780 | 38 306±19 823 | 10.7±2.7 | 17.2±16.7 | 48.5±39.8 | 9.7±12.0 | 574±477 | 51.8±31.3 | 4.9±1.5 |
| 给药剂量/mg | Cmin-1 /μg·L-1 | Cmin-2 /μg·L-1 | Cmin-3 /μg·L-1 | Cminss /μg·L-1 | Cmax /μg·L-1 | Tmax/h | AUCss /(μg·h)·L-1 | AUC0-48ss /(μg·h)·L-1 | AUC0-∞ /(μg·h)·L-1 | Cavss/μg·L-1 | t1/2z/h | Vz/L | CLz/F (L·h-1) | DF | RAUC |
| 500 | 1 025±561 | 1 018±541 | 1 023±619 | 1022±3 | 1 826±904 | 5.0±1.9 | 15 032±7 605 | 22 452±12 359 | 23 759±11 881 | 1 253±634 | 5.5±2.3 | 219±147 | 29.4±20.5 | 0.67±0.27 | 3.11±2.60 |
| 1 000 | 2 176±375 | 2 201±774 | 2 470±835 | 2 282±163 | 3 635±620 | 4.5±1.4 | 31 384±6 428 | 53 232±15 909 | 54 493±16 772 | 2 615±536 | 6.3±3.0 | 166±45 | 20.7±8.9 | 0.47±0.21 | 2.86±1.54 |
3 讨论
雷诺嗪的检测方法国内外已有报道, 主要为HPLC-UV[7]和HPLC-MS、HPLC-MS-MS[8-9]。本研究采用HPLC-MS-MS建立了测定人体血浆中雷诺嗪的分析方法, 该方法具有较高的灵敏度和专属性, 且回收率稳定, 无基质效应, 精密度、准确度参数均达到规定标准, 故能有效地进行生物样品的分析。
根据本试验单次给药药动学研究结果, 雷诺嗪缓释片Cmax、AUC0-t、AUC0-∞等主要参数与文献报道基本一致[10]。试验发现单次给药中一些主要药动学参数个体差异比较大, 例如t1/2。根据文献[6, 11]报道, 雷诺嗪的代谢主要是通过肠道和肝脏酶CYP3A(细胞色素P450, 家族3A), 受酶CYP2D6影响较小。雷诺嗪是CYP3A的温和抑制剂, 同时也是某种活跃的转运蛋白肠外排泵pglycoprotein(P-GP)的底物和中度抑制剂。由此推论, 较大的个体差异可能与其上述功能影响了吸收和代谢有关, 建议可进行更深入的研究。
单次和多次给药药动学结果表明:健康受试者口服给药后血浆中雷诺嗪浓度和AUC随剂量依赖性增加。多次给药药动学研究数据显示:500 mg和1 000 mg每日2次, 连续9次给药后的Cmax和AUC较单次同剂量组有显著差异;根据公式(Rcmax=Cmaxss/Cmax)计算蓄积因子(R), 结果显示500 mg和1 000 mg剂量组多次给药后雷诺嗪在人体内的积蓄因子分别为3.11±2.60、2.86±1.54。提示按该用药方案给药后在人体内有蓄积, 此结论与文献[12]报道基本一致。受试者在受试剂量下均能良好地耐受。整个试验过程中无严重不良事件发生。
综上所述, 本研究考察了雷诺嗪单次和多次给药后在中国健康人体内的药动学特征, 主要参数均与文献报道一致, 为后续Ⅱ、Ⅲ期临床试验的开展以及临床的合理用药提供了试验依据。
| [1] | CODOLOSA J N, ACHARJEE S, FIGUEREDO V M. Update on ranolazine in the management of angina[J]. Vasc Health Risk Manag, 2014, 10: 353–362. DOI:10.2147/VHRM.S40477 |
| [2] | SIDDIQUI M A, KEAM S J. Ranolazine: a review of its use in chronic stable angina pectoris[J]. Drugs, 2006, 66(5): 693–710. DOI:10.2165/00003495-200666050-00010 |
| [3] | ROSANO G M C, VITALE C, VOLTERRANI M. Pharmacological management of chronic stable angina focus on ranolazine[J]. Cardiovasc Drugs Ther, 2016, 30(4): 393–398. DOI:10.1007/s10557-016-6674-1 |
| [4] | FUMAGALLI F, RUSSO I, STASZEWSKY L, et al. Ranolazine ameliorates postresuscitation electrical instability and myocardial dysfunction and improves survival with good neurologic recovery in a rat model of cardiac arrest[J]. Heart Rhythm, 2014, 11(9): 1641–1647. DOI:10.1016/j.hrthm.2014.05.023 |
| [5] | FRAGAKIS N, KOSKINAS K C, VASSILIKOS V. Ranolazine as a promising treatment option for atrial fibrillation electrophysiologic mechanisms experimental evidence, and clinical implications[J]. Pacing Clin Electrophysiol, 2014, 37(10): 1412–1420. DOI:10.1111/pace.12486 |
| [6] | JERLING M. Clinical pharmacokinetics of ranolazine[J]. Clin Pharmacokinet, 2006, 45(5): 469–491. DOI:10.2165/00003088-200645050-00003 |
| [7] |
贾晶莹, 刘罡一, 陈钧, 等. 高效液相色谱法测定犬血浆中雷诺嚓的含量及相对生物利用度[J].
中国新药与临床杂志, 2011, 30(7): 537–540.
JIA J Y, LIU G Y, CHEN J, et al. Determination of ranolazine in Beagle dog plasma by HPLC-UV method[J]. Chin J New Drugs Clin Rem, 2011, 30(7): 537–540. |
| [8] | TIAN L, JIANG J, HUANG Y, et al. Sensitive quantification of ranolazine in human plasma by liquid chromatography-tandem mass spectrometry with positive electrospray ionization[J]. J Chromatogr B, 2007, 846(1): 346–350. DOI:10.1016/j.jchromb.2006.08.010 |
| [9] |
王志宏, 李扬, 侯文静, 等. 雷诺嗪缓释片在中国健康受试者中的药动学研究[J].
中国药学杂志, 2014, 49(6): 496–500.
WANG Z H, LI Y, HOU W J, et al. Pharmacokinetic study of ranolazine in Chinese healthy volunteers[J]. Chin Pharm J, 2014, 49(6): 496–500. DOI:10.11669/cpj.2014.06.014 |
| [10] | TAN Q Y, ZHU R H, LI H D, et al. Development and validation of a sensitive U-HPLC-MS/MS method with electrospray ionization for quantitation of ranolazine in human plasma: application to a clinical pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 901: 119–124. DOI:10.1016/j.jchromb.2012.06.011 |
| [11] | MASTERS J C, SHAH M M, FEIST A A. Drug interaction between sirolimus and ranolazine in a kidney transplant patient[J]. Case Rep Transplant, 2014, 2014: 548243. DOI:10.1155/2014/5482432 |
| [12] |
谭亲友, 朱荣华, 李焕德, 等. HPLC-MS/MS法测定雷诺嗪血药浓度及其缓释制剂的药代动力学研究[J].
中国临床药理学与治疗学, 2012, 17(5): 549–553.
TAN Q Y, ZHU R H, LI H D, et al. Quantification of Ranolazine in human plasma using HPLC-MS/MS for pharmacokinetic study of its sustained-release preparation[J]. Chin J Clin Pharmacol Ther, 2012, 17(5): 549–553. |



