骨肉瘤作为骨科最常见的原发性恶性骨肿瘤,好发于儿童和青少年时期,易发生肺转移及形成化疗耐药,预后极差。多年来,传统方法的疗效尚无明显提高[1-2]。因此,寻找新的治疗方法是目前研究的热点。光动力疗法(photodynamic therapy,PDT)具有毒副作用小、无耐药性、保护其他重要脏器、治疗更彻底、可协同多种方法提高疗效等优势,临床已应用于头颈部肿瘤及肺癌、食管癌、膀胱癌等多种恶性疾病的治疗中[3]。内质网作为蛋白合成的细胞器,在维持细胞稳态中发挥着至关重要的作用。当细胞受到理化、生物等不利因素刺激时,未折叠或错误折叠的蛋白蓄积,发生内质网应激,进而诱导对抗应激的适应性反应称为未折叠蛋白反应(unfolded protein response,UPR)。蛋白激酶样内质网激酶(RNA-activated protein kinase-like endoplasmic reticulum kinase,PERK)通路作为UPR进展的重要通路之一,在细胞生存和死亡的调节中发挥着重要作用[4-6]。研究发现光动力疗法可诱导细胞发生内质网应激、凋亡和自噬[7-11],而关于PERK通路在光动力治疗骨肉瘤中所起作用的研究较少。因此,本研究探讨焦脱镁叶绿酸-a甲酯介导的光动力疗法(pyropheophorbide-a methyl ester-mediated photodynamic therapy,MPPa-PDT)诱导人骨肉瘤HOS细胞内质网应激、自噬、凋亡及PERK通路在其中发挥的作用,以期为MPPa-PDT联合PERK通路阻滞应用于骨肉瘤治疗提供理论和依据。
1 材料与方法 1.1 主要试剂和仪器人骨肉瘤HOS细胞来自中国科学院上海细胞库;MPPa购自美国Sigma公司;GSK2656157购自上海Selleck公司,Bafilomycin A1购自上海MCE公司,均溶于DMSO中;DMEM细胞培养基购自美国HyClone公司;胎牛血清购自美国Gibco公司;Annexin Ⅴ-PI双染检测试剂盒购自江苏凯基生物技术股份有限公司;胰蛋白酶、青霉素-链霉素溶液、Hoechst染色试剂盒、RIPA裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、PVDF膜、磷酸酶抑制剂混合物均购自上海碧云天生物技术有限公司;兔单克隆PERK、ATF4、LC3B、SQSTM1/p62、Cleaved- caspase3、Cleaved-PARP抗体和鼠单克隆抗CHOP抗体购自美国CST公司;DAPI染液、兔多克隆抗β-actin、Phospho-PERK抗体、辣根过氧化物酶标记的羊抗兔和羊抗鼠IgG、FITC标记的羊抗兔IgG购自北京博奥森生物技术有限公司;光动力治疗仪购自重庆京渝激光生物研究所;倒置相差显微镜、荧光显微镜购自日本Nikon公司;流式细胞仪购自美国B & D Biosciences公司。
1.2 细胞培养人骨肉瘤HOS细胞用含100 U/mL青霉素、0.1 mg/mL链霉素和10%胎牛血清的DMEM培养基(完全培养基),置于37 ℃、5% CO2培养箱中,避光常规培养和传代。
1.3 实验分组及处理将对数生长期的HOS细胞按照不同处理进行分组。验证MPPa-PDT诱导凋亡、自噬、内质网应激,取对数生长期的HOS细胞,分为6组:①空白组;②MPPa组;③LED组;④MPPa-PDT 3 h组;⑤MPPa-PDT 6 h组;⑥MPPa-PDT 12 h组。换液后,将MPPa组,MPPa-PDT 3、6、12 h组在避光条件下加入终浓度为0.15 μmol/L的MPPa[12],空白组及LED组加入等量DMEM培养基。各组置于37 ℃、5% CO2条件下避光孵育20 h,去掉培养基,PBS缓冲液冲洗3遍,加新的完全培养基。LED组,MPPa-PDT 3、6、12 h组分别使用集成LED特种光源(波长630 nm、连续输出方式、光功率密度40 mW/cm2、输出时间120 s)处理,使细胞接受的光能量密度达到4.8 J/cm2,继续避光条件下培养,MPPa-PDT 3、6、12 h组分别于MPPa-PDT处理3、6、12 h后行相关检测,其余各组均在相应处理12 h后行检测[7, 11]。分析抑制剂及DMSO对相关蛋白指标表达水平有无影响时,取对数生长期的HOS细胞,分为6组:①空白a组;②DMSO a组;③GSK2656157组;④空白b组;⑤DMSO b组;⑥Bafilomycin A1组。换液后,GSK2656157组在避光条件下加入终浓度为5 mmol/L的GSK2656157,DMSO a组加入与GSK2656157组等量DMSO,Bafilomycin A1组在避光条件下加入终浓度为100 nmol/L的Bafilomycin A1,DMSO b组加入与Bafilomycin A1组等量DMSO。各组置于37 ℃、5% CO2条件下避光孵育2 h,去掉培养基,PBS缓冲液冲洗3遍,加新的完全培养基,继续避光培养。对细胞进行单独或联合处理,取对数生长期的HOS细胞,分为4组:①空白组;②MPPa-PDT组;③MPPa-PDT+GSK2656157组;④MPPa-PDT+Bafilomycin A1组。换液后,将MPPa-PDT组、MPPa-PDT+GSK2656157组、MPPa-PDT+Bafilomycin A1组在避光条件下加入终浓度为0.15 μmol/L的MPPa,空白组加入等量DMEM培养基。各组置于37 ℃、5% CO2条件下避光孵育。当孵育至18 h,将MPPa-PDT+GSK2656157组在避光条件下加入终浓度为5 mmol/L的GSK2656157,MPPa-PDT+Bafilomycin A1组在避光条件下加入终浓度为100 nmol/L的Bafilomycin A1,置于37 ℃、5% CO2条件下避光继续孵育2 h。当MPPa孵育时间满20 h时,去掉培养基,PBS缓冲液冲洗3遍,加新的完全培养基;MPPa-PDT组、MPPa-PDT+GSK2656157组、MPPa-PDT+Bafilomycin A1组使用集成LED特种光源,继续避光培养。
1.4 Hoechst染色观察细胞凋亡形态取对数生长期的HOS细胞,按2×105/孔接种于6孔板。细胞培养20 h后,分为空白组、MPPa组、LED组和MPPa-PDT组,行相应处理后,继续避光培养12 h。弃培养基,各孔加入试剂盒中固定液1 mL,固定10 min。弃固定液,PBS缓冲液洗2遍,各孔加入质量浓度为10 μg/mL的Hoechst33258染料1 mL,避光反应10 min。弃染色液,PBS洗2遍,使用荧光显微镜观察细胞凋亡形态学改变。
1.5 流式细胞仪检测凋亡分组同1.3、1.4。收集各组细胞,每组取3孔,PBS洗2遍,Annexin V-PI双染,流式细胞仪检测细胞凋亡。
1.6 免疫荧光检测p-PERK表达变化取对数生长期的HOS细胞,按2×105/孔接种于6孔板中25 mm细胞爬片。细胞培养20 h后,分为空白组、GSK2656157组、MPPa-PDT组、MPPa-PDT+GSK2656157组,行相应处理后,继续避光培养12 h。4%多聚甲醛固定细胞30 min,PBS清洗3次,0.1% TritonX-100(PBS配置)破膜15 min,5%胎牛血清封闭50 min,兔多克隆Phospho-PERK抗体用PBS稀释后(1:150)4 ℃过夜。避光条件下FITC标记的羊抗兔IgG荧光二抗室温下孵育30 min,DAPI染核5 min,封片。荧光显微镜观察。以ImageJ 1.52进行荧光强度分析。
1.7 Western blot检测凋亡蛋白、PERK通路相关标志蛋白和自噬蛋白的表达取对数生长期的HOS细胞接种于直径为10 cm培养皿中,培养20 h后分为空白组、MPPa组、LED组、MPPa-PDT 3 h组、MPPa-PDT 6 h组、MPPa-PDT 12 h组、空白a组、DMSO a组、GSK2656157组、空白b组、DMSO b组、Bafilomycin A1组、MPPa-PDT组、MPPa-PDT+GSK2656157组、MPPa-PDT+Bafilomycin A1组。按分组方法进行相应处理,收集细胞,800 r/min离心5 min,去除上清液,RIPA裂解液(含1%PMSF与1%磷酸酶抑制剂混合物)于冰上充分裂解细胞30 min,12 000 r/min 4 ℃条件下离心15 min后获取上清液为蛋白,取上清液,并用BCA试剂盒测定各组蛋白浓度,碧云天5×Buffer按4:1(4份蛋白上清液与1份5×Buffer)混匀,100 ℃加热10 min。取上述蛋白样品行SDS凝胶电泳,转膜、室温5%牛奶封闭(磷酸化蛋白以5%BSA封闭),分别加入1:1 000稀释的PERK、ATF4、LC3B、SQSTM1/p62、Cleaved-caspase3、Cleaved-PARP、β-actin、Phospho-PERK、CHOP一抗,4 ℃条件下孵育过夜。TBST洗3次(10 min/次),再加入相应辣根过氧化物酶标记二抗,室温孵育2 h,再经TBST洗3次(10 min/次),ECL化学发光法显影。以β-actin作为内参。用Image Lab 5.2.1软件进行图像分析,以目标蛋白与β-actin灰度值比值作为目标蛋白相对表达量。
1.8 统计学分析采用SPSS 23.0统计软件。数据以x±s表示,实验均独立重复3次。多组间均数比较采用单因素方差分析,两组间均数比较采用student t检验;P < 0.05表示差异有统计学意义。
2 结果 2.1 MPPa-PDT诱导人骨肉瘤HOS细胞发生凋亡Hoechst33258染色见MPPa-PDT组HOS细胞核染色质凝集,呈现高亮蓝色以及核固缩、碎裂等细胞凋亡形态学变化,而各对照组细胞均未出现明显的细胞凋亡形态学变化(图 1)。流式细胞仪检测结果提示:MPPa-PDT处理HOS细胞12 h后,MPPa-PDT组凋亡率为(30.70±2.28)%,显著高于空白组[(9.81±1.10)%]、MPPa组[(10.69±1.24)%]、LED组[(10.65±1.65)%] (P < 0.05,图 2)。Western blot检测结果显示:空白组、MPPa组、LED组凋亡相关蛋白Cleaved-caspase3、Cleaved-PARP表达差异均无统计学意义(P > 0.05);MPPa-PDT处理HOS细胞3、6、12 h后,Cleaved-caspase3、Cleaved-PARP表达呈升高趋势,与各对照组比较,差异均具有统计学意义(P < 0.05,图 3)。
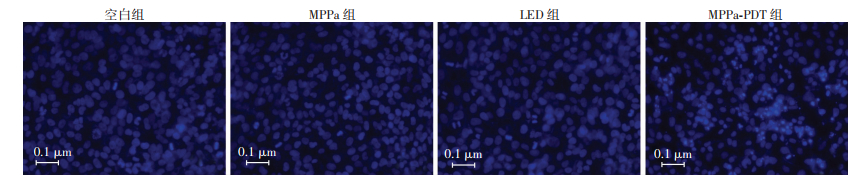
|
| 图 1 荧光显微镜观察各组细胞凋亡形态变化 (Hoechst染色) |
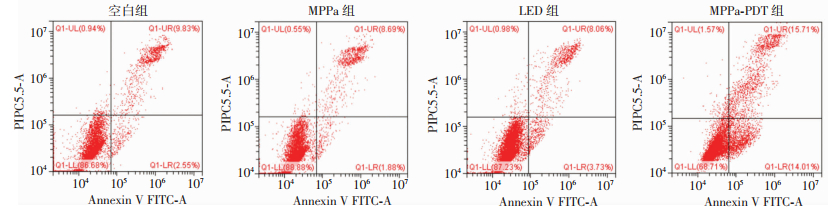
|
| 图 2 流式细胞仪检测各组细胞凋亡率 |
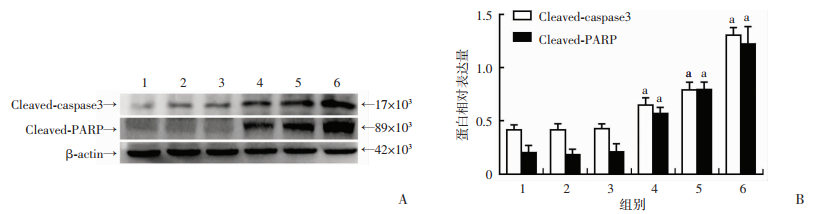
|
| 1:空白组;2:MPPa组;3:LED组;4:MPPa-PDT 3 h组;5:MPPa-PDT 6 h组;6:MPPa-PDT 12 h组A:Western blot检测;B:半定量分析a:P < 0.05,分别与空白组、MPPa组、LED组比较 图 3 Western blot检测各组Cleaved-caspase3、Cleaved-PARP表达 |
2.2 MPPa-PDT诱导人骨肉瘤HOS细胞PERK通路相关标志蛋白表达升高
Western blot检测结果显示:空白组、MPPa组、LED组PERK、p-PERK、ATF4、CHOP表达差异均无统计学意义(P > 0.05);MPPa-PDT处理HOS细胞后,p-PERK、ATF4、CHOP表达随处理时间延长而增高,MPPa-PDT 12 h组的表达显著高于各对照组(P < 0.05),PERK表达随处理时间延长呈下降趋势,与各对照组比较,差异具有统计学意义(P < 0.05,图 4)。
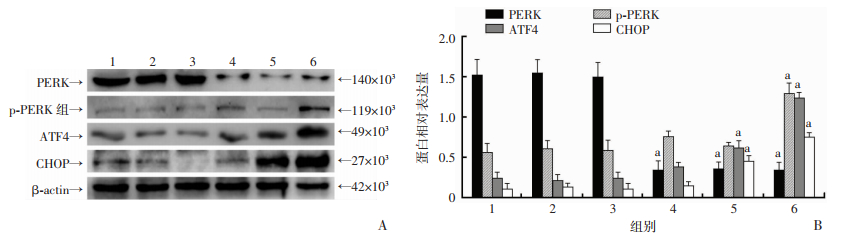
|
| 1:空白组;2:MPPa组;3:LED组;4:MPPa-PDT 3 h组;5:MPPa-PDT 6 h组;6:MPPa-PDT 12 h组A:Western blot检测;B:半定量分析a:P < 0.05,分别与空白组、MPPa组、LED组比较 图 4 Western blot检测各组PERK、p-PERK、ATF4、CHOP蛋白表达 |
2.3 MPPa-PDT诱导人骨肉瘤HOS细胞自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、P62的表达
Western blot检测结果显示:空白组、MPPa组、LED组LC3-Ⅱ/LC3-Ⅰ、P62表达差异均无统计学意义(P > 0.05);MPPa-PDT处理HOS细胞3、6、12 h后,LC3-Ⅱ/LC3-Ⅰ的表达呈升高趋势,而P62的表达下降,与各对照组比较,差异均有统计学意义(P < 0.05,图 5)。
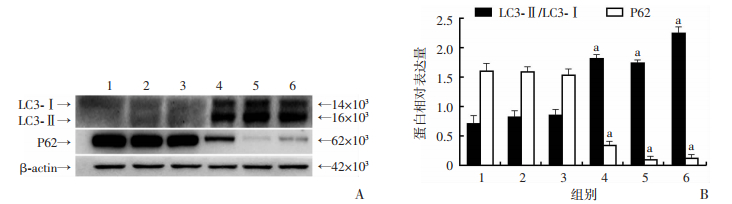
|
| 1:空白组;2:MPPa组;3:LED组;4:MPPa-PDT 3 h组;5:MPPa-PDT 6 h组;6:MPPa-PDT 12 h组A:Western blot检测;B:半定量分析a:P < 0.05,分别与空白组、MPPa组、LED组比较 图 5 Western blot检测各组LC3-Ⅱ/LC3-Ⅰ、P62蛋白表达 |
2.4 GSK2656157抑制MPPa-PDT作用下PERK通路激活
p-PERK蛋白免疫荧光检测提示:与空白组(6.03± 0.74)比较,GSK2656157组PERK通路关键蛋白p-PERK的表达(6.11±1.23)差异无统计学意义(P > 0.05),MPPa-PDT组p-PERK蛋白的荧光强度显著增强(10.21±0.60,P < 0.05),MPPa-PDT+GSK2656157组PERK通路受到阻滞,p-PERK蛋白的荧光强度显著降低(6.92±0.71,P < 0.05,图 6)。提示GSK2656157能阻滞MPPa-PDT介导的PERK通路激活。
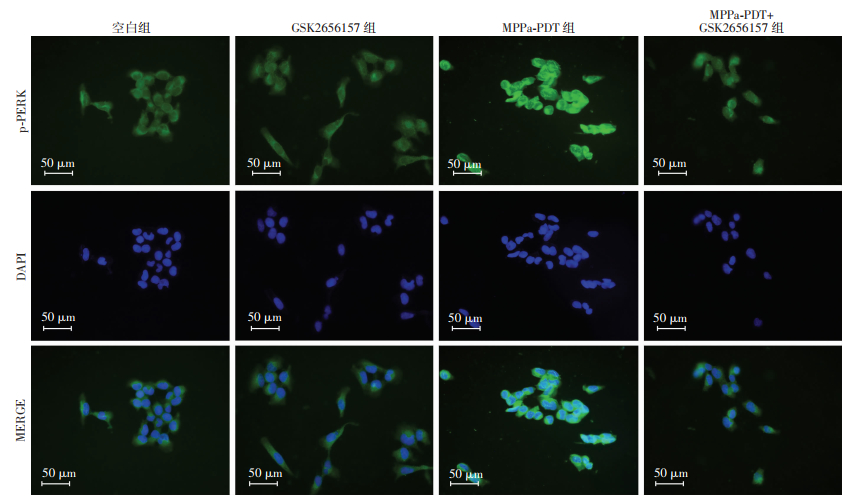
|
| 图 6 免疫荧光检测各组p-PERK的表达 |
2.5 阻滞PERK通路增强人骨肉瘤HOS细胞对MPPa-PDT的敏感性
流式细胞仪检测结果显示:MPPa-PDT可诱导人骨肉瘤HOS细胞凋亡,MPPa-PDT组凋亡率为(31.76± 2.34)%,显著高于空白组[(9.92±1.48)%,P < 0.05];而MPPa-PDT+GSK2656157组凋亡率最高,为(89.77± 3.83)%,MPPa-PDT+Bafilomycin A1组为(64.29±2.68)%,均显著高于MPPa-PDT组(P < 0.05);单独的GSK2656157和Bafilomycin A1处理组凋亡率分别为(10.71±1.76)%和(11.61±3.02)%,与空白组相比并不影响凋亡水平,两组差异无统计学意义(P > 0.05,图 7)。
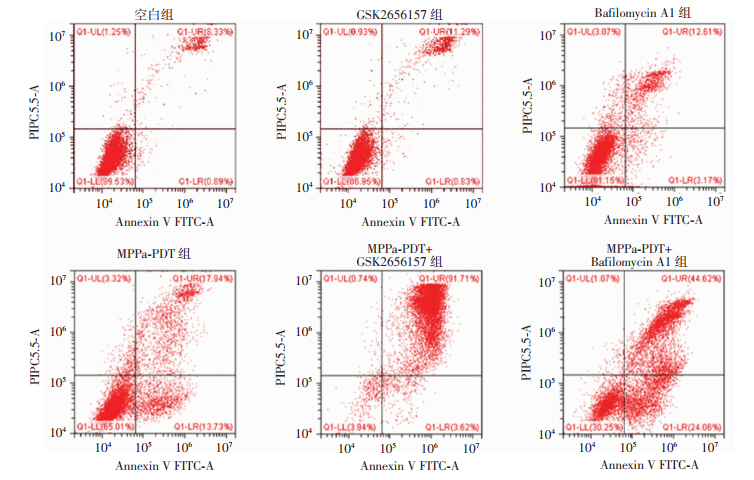
|
| 图 7 流式细胞仪检测各组细胞凋亡率 |
2.6 抑制PERK通路介导的保护性自噬及UPR可能是增强敏感性的关键机制
Western blot检测结果显示:与空白a组比较,DMSO a组、GSK2656157组PERK通路、自噬、凋亡相关蛋白表达未见明显改变,PERK通路关键蛋白PERK、p-PERK、ATF4,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、P62,凋亡相关蛋白Cleaved-caspase3、Cleaved-PARP表达差异无统计学意义(P > 0.05);与空白b组比较,DMSO b组、Bafilomycin A1组PERK通路、凋亡相关蛋白表达未见明显改变,PERK、p-PERK、ATF4、Cleaved-caspase3、Cleaved-PARP表达差异无统计学意义(P > 0.05);与空白b组比较,DMSO b组细胞自噬活性并无明显改变,LC3-Ⅱ/LC3-Ⅰ、P62表达差异无统计学意义(P > 0.05);与空白b组比较,Bafilomycin A1组LC3-Ⅱ/LC3-Ⅰ及P62表达显著升高(P < 0.05,图 8A、B)。

|
| A、B:各通路相关蛋白表达及半定量分析1:空白a组;2:DMSO a组;3:GSK2656157组;4:空白b组;5:DMSO b组;6:Bafilomycin A1组;a:P < 0.05,与空白b组比较;C、D:阻滞各通路后相关蛋白表达及半定量分析1:空白组;2:MPPa-PDT组;3:MPPa-PDT+GSK2656157组;4:MPPa-PDT+Bafilomycin A1组;a:P < 0.05,与空白组比较;b:P < 0.05,与MPPa-PDT组比较;c:P < 0.05,与MPPa-PDT+GSK2656157组比较 图 8 Western blot检测各组PERK、p-PERK、ATF4、LC3-Ⅱ/LC3-Ⅰ、Cleaved-caspase3、Cleaved-PARP、P62蛋白的表达 |
阻滞PERK通路及抑制自噬后,再行MPPa-PDT处理。Western blot检测结果显示:与空白组比较,MPPa-PDT处理能诱导HOS细胞自噬及凋亡,并激活PERK通路,PERK通路相关蛋白PERK表达降低,p-PERK及ATF4表达升高,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达升高,P62表达降低,凋亡相关蛋白Cleaved-caspase3与Cleaved-PARP表达升高,差异均有统计学意义(P < 0.05);与MPPa-PDT组比较,MPPa-PDT+GSK2656157组PERK通路相关蛋白PERK表达升高,p-PERK及ATF4表达降低,自噬相关蛋白LC3-Ⅱ/ LC3-Ⅰ表达下降,P62表达升高,凋亡相关蛋白Cleaved- caspase3与Cleaved-PARP表达升高,差异均有统计学意义(P < 0.05);与MPPa-PDT组比较,MPPa-PDT+Bafilomycin A1组自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ及P62表达升高,凋亡相关蛋白Cleaved-caspase3与Cleaved-PARP表达升高,差异均有统计学意义(P < 0.05);与MPPa-PDT+GSK2656157组比较,MPPa-PDT+Bafilomycin A1组PERK通路相关蛋白PERK表达降低,p-PERK、ATF4表达升高,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达升高,凋亡相关蛋白Cleaved-caspase3与Cleaved-PARP表达降低,差异有统计学意义(P < 0.05),P62表达未见明显改变(P > 0.05,图 8C、D)。
3 讨论光动力疗法的主要机制为通过特定波长的光诱导富集在肿瘤组织中的光敏剂发生光化学反应,产生大量活性氧(reactive oxygen species,ROS),从而对肿瘤细胞造成氧化损伤[3]。MPPa作为第二代光敏剂,介导的光动力疗法即MPPa-PDT在抗肿瘤方面具有较好的疗效[13-14]。本研究结果显示:人骨肉瘤HOS细胞经MPPa-PDT处理,细胞核呈固缩、碎裂,凋亡率高于其他对照组,凋亡相关蛋白Cleaved-caspase3、Cleaved-PARP表达升高。提示MPPa-PDT能诱导人骨肉瘤HOS细胞凋亡。
自噬作为调控细胞存活与死亡的重要机制,促细胞生存还是促细胞死亡,目前还存在较大争议[15]。研究表明光动力疗法也会诱导肿瘤细胞发生自噬[16]。本研究结果显示:MPPa-PDT处理人骨肉瘤HOS细胞,自噬活性增加,LC3-Ⅱ/LC3-Ⅰ高于各对照组,而P62表达低于各对照组。提示MPPa-PDT能诱导人骨肉瘤HOS细胞自噬。
MPPa-PDT产生的ROS在杀伤肿瘤细胞的同时,诱导肿瘤细胞内质网功能失衡,产生内质网应激[9],进而触发未折叠蛋白反应。GRP78与内质网跨膜信号传感蛋白IRE1、PERK、ATF6分离并使其活化,激活各自下游的信号通路,以重建内质网功能稳定性,增强细胞对不利刺激的适应性[17]。PERK/ATF4通路激活时,GRP78与PERK解离,诱导PERK形成二聚体和自磷酸化,产生活化的磷酸化PERK,并进一步诱导下游的eIF2α发生磷酸化修饰,一方面抑制内质网mRNA翻译及蛋白合成功能,另一方面却又增加ATF4的表达,高表达的ATF4最终诱导内质网应激特异性转录因子CHOP表达升高。本研究结果显示:与各对照组比较,MPPa-PDT处理人骨肉瘤HOS细胞12 h,PERK表达降低,下游信号分子p-PERK、ATF4、CHOP表达升高。这说明MPPa-PDT诱导人骨肉瘤HOS细胞发生内质网应激并激活PERK/ATF4/CHOP通路。
内质网应激时,PERK/ATF4/CHOP通路的激活对拮抗凋亡及促进细胞存活发挥了非常重要的作用[18-21]。其主要机制可能为:①PERK/ATF4/CHOP通路的激活诱导细胞发生了保护性自噬现象。本研究结果显示:以PERK通路抑制剂GSK2656157预处理人骨肉瘤HOS细胞后行MPPa-PDT处理,PERK通路受到阻滞,PERK表达升高,下游信号分子p-PERK、ATF4表达降低。同时,与MPPa-PDT组比较,LC3-Ⅱ/LC3-Ⅰ表达降低,P62表达升高,自噬活性受到抑制,提示MPPa-PDT诱导人骨肉瘤HOS细胞自噬可能依赖于PERK/ATF4/CHOP通路激活。ATF4是PERK/ATF4/CHOP通路激活介导自噬的关键分子,ATF4活化可诱导ATG12-ATG5-ATG16复合体的形成,而复合体与ATG8联结参与了自噬小体形成的过程。同时,ATF4活化诱导下游CHOP表达升高,抑制mTORC1通路及其标志蛋白p-p70S6K1和p-4EBP1的表达,从而增强自噬活性[22-25]。为了验证MPPa-PDT诱导的自噬对人骨肉瘤HOS细胞生存和死亡的调控作用,本研究以Bafilomycin A1预处理后再行MPPa-PDT处理,与MPPa-PDT组比较,自噬活性受到抑制,LC3-Ⅱ/LC3-Ⅰ及P62表达升高,凋亡率增加,凋亡相关蛋白Cleaved-caspase3、Cleaved-PARP表达升高,提示MPPa-PDT诱导的自噬促人骨肉瘤HOS细胞生存。以GSK2656157阻滞PERK通路,再行MPPa-PDT处理,与MPPa-PDT组比较,也得到了自噬活性受到抑制及凋亡率增加的结果。因此,MPPa-PDT处理人骨肉瘤HOS细胞可诱导PERK/ATF4/CHOP通路激活并介导保护性自噬拮抗MPPa-PDT的毒性作用,而以GSK2656157阻滞PERK通路则可解除该保护作用,增强人骨肉瘤HOS细胞对MPPa-PDT的敏感性。WANG等[26]以PERK抑制剂(GSK2606414)预处理和siRNA敲低PERK表达的方法均能显著降低GANT-61介导的自噬活性,并能增强其毒性促细胞凋亡。MA等[27]以GSK2606414联合BRAFi处理能抑制BRAFi诱导的自噬并增加细胞凋亡。与本结果相似。②PERK/ATF4/CHOP通路介导的UPR保护了细胞。本研究也发现,虽然MPPa-PDT+GSK2656157组与MPPa-PDT+Bafilomycin A1组的凋亡率分别高于MPPa-PDT组,但MPPa-PDT+GSK2656157组的凋亡率最高,提示PERK/ATF4/CHOP通路激活时还存在其他机制拮抗MPPa-PDT的促凋亡作用。MPPa-PDT+GSK2656157组中因PERK/ATF4/CHOP通路阻滞,UPR关键蛋白ATF4表达较另外两组显著降低。研究表明,ATF4编码大量应激反应基因,参与细胞对外界刺激适应的过程中,ATF4缺失将增加ROS造成的氧化损伤,以CRISPR/Cas9技术下调ATF4基因将会抑制TERS介导的细胞保护效应[20, 28-29]。③PERK/ATF4/CHOP通路激活,下调cyclin D1表达,使细胞处于休眠态,周期阻滞在G1期,以对抗外界不利刺激[30]。
综上所述,本研究发现MPPa-PDT作用于人骨肉瘤HOS细胞时,激活PERK/ATF4/CHOP通路,诱导保护性自噬和UPR保护性作用,并且以GSK2656157阻滞PERK通路能解除该保护性效果,增强MPPa-PDT的抗骨肉瘤作用。这为PERK通路阻滞联合MPPa-PDT用于骨肉瘤治疗提供了一定的实验依据。
| [1] | DUCHMAN K R, GAO Y, MILLER B J. Prognostic factors for survival in patients with high-grade osteosarcoma using the Surveillance, Epidemiology, and End Results (SEER) Program database[J]. Cancer Epidemiol, 2015, 39(4): 593–599. DOI:10.1016/j.canep.2015.05.001 |
| [2] |
黄志鹏, 宋科官. 骨肉瘤的诊断及治疗进展[J].
国际骨科学杂志, 2018, 39(3): 150–153.
HUANG Z P, SONG K G. Progress in the diagnosis and treatment of osteosarcoma[J]. Int J Orthop, 2018, 39(3): 150–153. DOI:10.396/j.issn.1673-7083.2018.03.007 |
| [3] |
孙旭, 孟宪瑛, 王瑶琪, 等. 光动力疗法的抗肿瘤作用及其机制的研究进展[J].
吉林大学学报(医学版), 2018, 44(1): 200–204.
SUN X, MENG X Y, WANG Y Q, et al. Research progress in anti-tumor effect and mechanism of photodynamic therapy[J]. J Jilin Univ(Med Ed), 2018, 44(1): 200–204. DOI:10.13481/j.1671-587x.20180140 |
| [4] | IURLARO R, MUÑOZ-PINEDO C. Cell death induced by endoplasmic reticulum stress[J]. FEBS J, 2016, 283(14): 2640–2652. DOI:10.1111/febs.13598 |
| [5] | CORAZZARI M, GAGLIARDI M, FIMIA G M, et al. Endoplasmic reticulum stress, unfolded protein response, and cancer cell fate[J]. Front oncol, 2017, 7: 78. DOI:10.3389/fonc.2017.00078 |
| [6] | TAALAB Y M, IBRAHIM N, MAHER A, et al. Mechanisms of disordered neurodegenerative function: concepts and facts about the different roles of the protein kinase RNA-like endoplasmic reticulum kinase (PERK)[J]. Rev Neurosci, 2018, 29(4): 387–415. DOI:10.1515/revneuro-2017-0071 |
| [7] |
陶勇, 黄秋, 欧云生, 等. 焦脱镁叶绿酸-a甲酯介导的光动力疗法诱导人骨肉瘤MG63细胞凋亡的研究[J].
中国修复重建外科杂志, 2016, 30(6): 669–674.
TAO Y, HUANG Q, OU Y S, et al. Apoptosis in human osteosarcoma cell line mg63 induced by pyropheophorbide-a methyl ester-mediated photodynamictherapy[J]. Chin J Repar Reconstr Surg, 2016, 30(6): 669–674. |
| [8] | HUANG Q, OU Y S, TAO Y, et al. Apoptosis and autophagy induced by pyropheophorbide-a methyl ester-mediated photodynamic therapy in human osteosarcoma MG-63 cells[J]. Apoptosis, 2016, 21(6): 749–760. DOI:10.1007/s10495-016-1243-4 |
| [9] | LI K T, CHEN Q, WANG D W, et al. Mitochondrial pathway and endoplasmic reticulum stress participate in the photosensitizing effectiveness of AE-PDT in MG63 cells[J]. Cancer Med, 2016, 5(11): 3186–3193. DOI:10.1002/cam4.895 |
| [10] | LIN S, YANG L, SHI H, et al. Endoplasmic reticulum-targeting photosensitizer hypericin confers chemo-sensitization towards oxaliplatin through inducing pro-death autophagy[J]. Int J Biochem Cell Biol, 2017, 87: 54–68. DOI:10.1016/j.biocel.2017.04.001 |
| [11] |
黄秋, 涂平华, 欧云生, 等. MPPa-PDT诱导人骨巨细胞瘤细胞自噬[J].
第三军医大学学报, 2015, 37(17): 1755–1760.
HUANG Q, TU P H, OU Y S, et al. MPPa-PDT induces autophagy in human bone giant cell tumor cell line SGC-0404[J]. J Third Mil Med Univ, 2015, 37(17): 1755–1760. DOI:10.16016/j.1000-5404.201412133 |
| [12] | TAO Y, OU Y, YIN H, et al. Establishment and characterization of human osteosarcoma cells resistant to pyropheophorbide-a methyl ester-mediated photodynamic therapy[J]. Int J Oncol, 2017, 51(5): 1427–1438. DOI:10.3892/ijo.2017.4136 |
| [13] | QIAN G, WANG L, ZHENG X, et al. Deactivation of cisplatin-resistant human lung/ovary cancer cells with pyropheophorbide-a methyl ester-photodynamic therapy[J]. Cancer Biol Ther, 2017, 18(12): 984–989. DOI:10.1080/15384047.2017.1385683 |
| [14] | TU P H, HUANG W J, WU Z L, et al. Induction of cell death by pyropheophorbide-a methyl ester-mediated photodynamic therapy in lung cancer A549 cells[J]. Cancer Med, 2017, 6(3): 631–639. DOI:10.1002/cam4.1012 |
| [15] | SINGH S S, VATS S, CHIA A Y, et al. Dual role of autophagy in hallmarks of cancer[J]. Oncogene, 2018, 37(9): 1142–1158. DOI:10.1038/s41388-017-0046-6 |
| [16] | HAN X B, LI H X, JIANG Y Q, et al. Upconversion nanoparticle-mediated photodynamic therapy induces autophagy and cholesterol efflux of macrophage-derived foam cells via ROS generation[J]. Cell Death Dis, 2017, 8(6): e2864. DOI:10.1038/cddis.2017.242 |
| [17] | DOMÍNGUEZ-MARTÍN E, HERNÁNDEZ-ELVIRA M, VINCENT O, et al. Unfolding the endoplasmic reticulum of a social amoeba: Dictyostelium discoideum as a new model for the study of endoplasmic reticulum stress[J]. Cells, 2018, 7(6): 56. DOI:10.3390/cells7060056 |
| [18] | MA Y, HENDERSHOT L M. The role of the unfolded protein response in tumour development: friend or foe?[J]. Nat Rev Cancer, 2004, 4(12): 966–977. DOI:10.1038/nrc1505 |
| [19] | CHEN J, ZHANG Z Q, SONG J, et al. 18β-glycyrrhetinic-acid-mediated unfolded protein response induces autophagy and apoptosis in hepatocellular carcinoma[J]. Sci Rep, 2018, 8(1): 9365. DOI:10.1038/s41598-018-27142-5 |
| [20] | RODVOLD J J, CHIU K T, HIRAMATSU N, et al. Intercellular transmission of the unfolded protein response promotes survival and drug resistance in cancer cells[J]. Sci Signal, 2017, 10(482): eaah7177. DOI:10.1126/scisignal.aah7177 |
| [21] | ZHU Z C, LIU J W, LI K, et al. KPNB1 inhibition disrupts proteostasis and triggers unfolded protein response-mediated apoptosis in glioblastoma cells[J]. Oncogene, 2018, 37(22): 2936–2952. DOI:10.1038/s41388-018-0180-9 |
| [22] | FRACCHIOLLA D, SAWA-MAKARSKA J, MARTENS S. Beyond Atg8 binding: The role of AIM/LIR motifs in autophagy[J]. Autophagy, 2017, 13(5): 978–979. DOI:10.1080/15548627.2016.1277311 |
| [23] | ZHANG Y, QU X, JIANG L. An oasis in the desert of cancer chemotherapeutic resistance: The enlightenment from reciprocal crosstalk between signaling pathways of UPR and autophagy in cancers[J]. Biomed Pharmacother, 2017, 92: 972–981. DOI:10.1016/j.biopha.2017.05.132 |
| [24] | JI G R, YU N C, XUE X, et al. PERK-mediated autophagy in osteosarcoma cells resists ER stress-induced cell apoptosis[J]. Int J Biol Sci, 2015, 11(7): 803–812. DOI:10.7150/ijbs.11100 |
| [25] | SHI D, NIU P, HENG X, et al. Autophagy induced by cardamonin is associated with mTORC1 inhibition in SKOV3 cells[J]. Pharmacol Rep, 2018, 70(5): 908–916. DOI:10.1016/j.pharep.2018.04.005 |
| [26] | WANG J, HUANG S, TIAN R, et al. The protective autophagy activated by GANT-61 in MYCN amplified neuroblastoma cells is mediated by PERK[J]. Oncotarget, 2018, 9(18): 14413–14427. DOI:10.18632/oncotarget.24214 |
| [27] | MA X H, PIAO S F, DEY S, et al. Targeting ER stress-induced autophagy overcomes BRAF inhibitor resistance in melanoma[J]. J Clin Invest, 2014, 124(3): 1406–1417. DOI:10.1172/JCI70454 |
| [28] | FUSAKIO M E, WILLY J A, WANG Y, et al. Transcription factor ATF4 directs basal and stress-induced gene expression in the unfolded protein response and cholesterol metabolism in the liver[J]. Mol Biol Cell, 2016, 27(9): 1536–1551. DOI:10.1091/mbc.E16-01-0039 |
| [29] | MELBER A, HAYNES C M. UPRmt regulation and output: a stress response mediated by mitochondrial-nuclear communication[J]. Cell Res, 2018, 28(3): 281–295. DOI:10.1038/cr.2018.16 |
| [30] | ROZPEDEK W, PYTEL D, MUCHA B, et al. The role of the PERK/eIF2α/ATF4/CHOP signaling pathway in tumor progression during endoplasmic reticulum stress[J]. Curr Mol Med, 2016, 16(6): 533–544. DOI:10.2174/1566524016666160523143937 |



