2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:神经外科
2. Department of Neurosurgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
神经胶质瘤简称胶质瘤,起源于上皮细胞,是最常见的原发性恶性脑肿瘤。胶质瘤呈侵袭性生长,总体疗效不佳,常规的治疗方法包括手术切除、化疗和放疗等,但仍具有复发率高、病程进展快、死亡率高的特点[1-2]。最近越来越多的证据表明,在胶质瘤组织中存在一类极少数的肿瘤细胞亚型,具有致瘤性。由于其在胶质瘤浸润性生长、局部复发和远处转移过程中表现出与干细胞十分相似的特点,被称为是胶质瘤干细胞[3](glioma stem cells,GSC),具有自我更新、多向分化潜能、无限增殖和异质性等特征[1, 4]。胶质瘤干细胞对放化疗十分耐受,目前一致认为胶质瘤干细胞是胶质瘤起源和生长中重要的始动和促进因素,是胶质瘤高恶性程度和复发的根源。因此,对胶质瘤干细胞的各方面研究以及针对的靶向性治疗药物的研发,对于今后的基础研究和临床应用均有重要的意义。但是目前仍缺乏胶质瘤干细胞准确鉴定和筛选的方法。
肿瘤干细胞的分子特性与干细胞相似,因此CD133标记阳性被认为是各类肿瘤干细胞筛选和鉴定的基础。SINGH等[5-6]从不同类型胶质瘤中分离出表型为CD133+的胶质瘤干细胞,但微环境的改变,可调控标记物的表达水平。有研究发现,胶质瘤细胞中CD133——一类亚群也具备肿瘤干细胞的特性[7-9]。因此,在临床中利用CD133标记对早期检测胶质瘤的发生、评判预后以及基础研究中对胶质瘤干细胞的筛选均有一定的限制。
最近MIRANDA-LORENZO等[10]研究发现肿瘤中存在一类荧光干细胞(fluorscent glioma stem cell, FGSC),不受肿瘤微环境和肿瘤本身异质性的影响。同时,体外培养和体内实验证明,荧光细胞在恶性程度及致瘤能力中明显高于以传统方式筛选的肿瘤干细胞。胶质瘤同样存在有胶质瘤干细胞,这类干细胞是否具有自发荧光,能否通过自发荧光对胶质瘤干细胞进行筛选,目前未见文献报道。本研究对GL261胶质瘤干细胞系中自发荧光细胞进行筛选并加以观察和对比分析,所得结果可以为胶质瘤干细胞统一标志物,为其筛选提供依据。再者,可为今后临床胶质瘤的治疗提供新的靶点,对胶质瘤的早期识别检测、预防和预后都具有重要意义。
1 材料与方法 1.1 主要材料 1.1.1 材料和试剂人恶性胶质瘤GL261干细胞系(CD133+)由本院神经外科提供。CCK-8试剂检测盒购于日本东仁化学科技有限公司。PCNA抗体购于Dako公司;Ki67抗体购于碧云天生物科技有限公司;Nestin抗体购于MILLIPORE公司。
1.1.2 实验动物严重联合免疫缺陷小鼠(severe combined immunodeficiency mouse, SCID mouse),雌性,4~5周龄,体质量10~15 g,共40只。由陆军军医大学动物试验中心提供,按SPF(specific pathogen free animals)标准饲养。
1.2 胶质瘤干细胞的培养将GL261干细胞制备细胞悬液,在新鲜配制的DMEM/F-12培养基(含2%B27、rhEGF 10 ng/mL、bFGF 10 ng/mL、100 U/mL盘尼西林G和100 μg/mL链霉素)中培养。培养基每24小时更换一次直到悬浮的胶质瘤干细胞球趋于稳定状态。为了诱导干细胞贴壁便于观察,悬浮的干细胞球先用细胞消化液分散溶解,用多聚赖氨酸包被培养于含有1%FBS的培养基中进行相差显微镜观察。
1.3 荧光干细胞筛选将培养的GL261干细胞悬液中添加30 μmol/L核黄素于37 ℃中孵育12 h,取少量悬液于载玻片上,并在荧光显微镜(BX60,Olympus)下观察自发荧光细胞。将细胞重悬于分选液中[1×PBS;3%FBS(体积分数);3 mmol/L EDTA],悬液内含106细胞/mL。利用流式细胞仪(BDFACSCanto Ⅱ flow cytometer)进行分选,滤镜选用530/40和580/30,分选出具有自发荧光的细胞。
1.4 异种移植物肿瘤模型的建立所有动物实验执行陆军军医大学实验动物标准施行。将已筛选的荧光干细胞FGSC和GL261源干细胞分别准备细胞悬液(注入10 μL/只,104细胞/只),将裸鼠分为GL261干细胞组(GSC,n=10)和荧光干细胞组(FGSC,n=10),前者将GL261干细胞皮下种植于裸鼠腹股沟,后者将荧光干细胞皮下种植于裸鼠腹股沟。每间隔1 d测量肿瘤的长径(a)和短径(b),以公式V=a×b2/2(mm2)计算肿瘤生长体积。待饲养裸鼠28 d后断颈处理。取出肿瘤并称量。再另饲养小鼠以上述同样方法分组后对小鼠荷瘤,观察荧光干细胞组和GL261干细胞组小鼠的生存情况。
1.5 CCK-8检测为了检测荧光干细胞(FGSC)和GL261干细胞(GSC)增殖能力,选用CCK-8试剂盒完成操作。首选将已筛选和未筛选的悬浮的神经干细胞球吹打成单个神经干细胞,并种植于96孔板内(100 μL/孔,2×105细胞/mL),孵育24 h。然后加入CCK-8溶液(10 μL/孔)并孵育4 h。使用microplate reader (Bio-RAD, Model 680)在450 nm参考波长下测量每孔光密度值[D(450)]。
1.6 免疫组化将取出的裸鼠肿瘤组织实施石蜡包埋,并以5 μm厚度切片。将切片贴于载玻片上,根据染色原则,用含有0.8%过氧化氢的PBS和含有0.3%Tween-20和5%BSA的PBS分别清除内源性过氧化物酶活性和封闭非特异性反应;然后用一抗(1 :200)在4 ℃环境下孵育12 h,包括Ki67(鼠源,Beyotime)、PCNA(鼠源,Dako)和Nestin(兔源,Millipore);再用二抗(1 :1 000)于室温下孵育5 h,包括Anti-mouse-HRP(Santa Cruz)和Anti-rabbbit-HRP(Santa Cruz);最后加入ABC过氧化物酶孵育并行DAB(Boster,China)显色反应,在光镜下观察结果。
1.7 统计学处理采用SPSS 16.0统计软件进行分析。数据以x±s表示。组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 GL261干细胞中荧光干细胞的检测为了检测常规培养的GL261干细胞中是否存在荧光干细胞,首先培养GL261干细胞系(图 1);再向培养基内添加核黄素培养,显微镜下观察发现了自体荧光干细胞(图 2)。随后,通过流式细胞仪从GL261(CD133+)干细胞中分选发现,荧光肿瘤干细胞占总数百分比85.21%,同时非荧光的肿瘤干细胞占14.79%。继而,从荧光干细胞中分选发现,CD133+细胞占总数72.88%;CD133-占总数27.12%。

|
| 图 1 相差显微镜观察CD133+GL261胶质瘤干细胞形态 |

|
| A:白视野; B:暗视野 图 2 荧光显微镜下嗜核黄素胶质瘤干细胞自体荧光观察 |
2.2 荧光干细胞的增殖能力的检测
CCK-8检测结果发现,荧光干细胞的增殖能力明显高于GL261干细胞(图 3,P < 0.01)。

|
| a:P < 0.01,与Blank组及GSC组比较 图 3 CCK-8检测荧光干细胞和GL261干细胞的增殖能力 |
进一步在体内实验中比较荧光干细胞(FGSC)和GL261干细胞(GSC)的增殖能力。分别将二者等量的细胞皮下种植于裸鼠腹股沟区,每隔1 d观察FGSC组合GSC组小鼠皮下肿瘤增殖情况。从第11天起,FGSC组肿瘤体积明显大于GSC组(图 4,P < 0.01)。小鼠饲养28 d后断颈处死,取出肿瘤称其质量发现,FGSC组小鼠肿瘤质量明显高于GSC组肿瘤(图 5,P < 0.01)。随后比较两组小鼠的生存能力,发现GSC组的小鼠生存能力明显高于FGSC组小鼠(图 6,P < 0.01)。
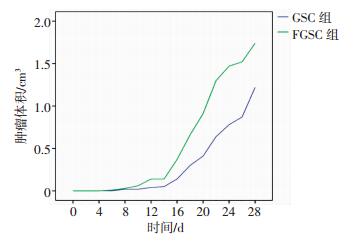
|
| 图 4 FGSC和GSC荷瘤小鼠肿瘤体积变化的比较 |

|
| a:P < 0.01,与GSC组相比 图 5 FGSC和GSC肿瘤质量的比较 |
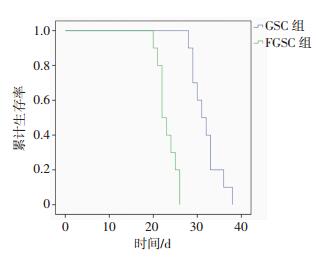
|
| 图 6 FGSC和GSC荷瘤小鼠生存情况的比较 |
2.3 荧光干细胞的干性和恶性程度的检测
为了说明荧光干细胞的恶性程度更高,即表现为增殖能力和细胞本身干性更强,挑选与细胞增殖和干性相关的抗原PCNA、Ki67和Nestin,通过取出荷瘤小鼠的肿瘤、制定石蜡切片并行酶联免疫染色处理后发现,FGSC组中PCNA、Ki67和Nestin的表达量均明显高于GSC组(图 7、8,P < 0.05)。

|
| 图 7 荧光干细胞源(FGSC)肿瘤和GL261干细胞源(GSC)肿瘤组织PCNA、Ki67和Nestin抗原表达分布的比较(ABC) |
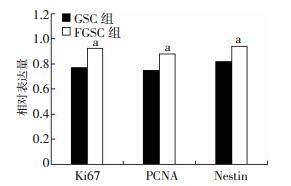
|
| a:P < 0.05,与GSC组相比 图 8 FGSC和GSC肿瘤组织的PCNA、Ki67和Nestin抗原的表达 |
3 讨论
脑胶质瘤治疗的有效方法一直是研究中的重点和热点。最初,SINGH等[5-6]从不同类型胶质瘤中分离出表型为CD133+的胶质瘤干细胞, 与正常干细胞对比具有相似的标记。不同的是,胶质瘤干细胞具有异质性,其细胞表面的标记及细胞的功能状态通常受肿瘤微环境的影响[11-12],如血管内皮细胞分泌的相关因子,可调控胶质瘤干细胞表面标记物CD133的表达水平,在功能上影响胶质瘤干细胞的自我更新和增殖的能力[1, 13]。同时标记物与胶质瘤干细胞的发生及其功能特点并没有相关性。MIRANDA-LORENZO等[10]研究发现,在一些肿瘤中存在有一类细胞亚群具有固有的荧光表型。这类细胞具有肿瘤干细胞的特性,其中CD133+细胞所占比重大,但仍有CD133-细胞存在。通过相关分子和免疫技术探测发现,这类荧光细胞的细胞质中存在数个嵌有ABCG2的囊泡,内含荧光特性的核黄素。其表达是荧光细胞固有的特性,不受肿瘤微环境和肿瘤本身异质性的影响。
目前认为CD133+胶质瘤细胞或许是我们所要针对的干细胞,但也有研究表明CD133-的胶质瘤细胞仍然有成为恶性程度最高的潜能,追其根源是肿瘤细胞具有异质性的特点,其中的干细胞也不例外。利用上皮来源的肿瘤干细胞嗜核黄素荧光染料这一特性,在GL261胶质瘤干细胞探究存在CD133+表型中的荧光干细胞,旨在说明胶质瘤中存在一类嗜核黄素荧光干细胞,其恶性程度高,且不受外界微环境影响,表达为固有表型。为今后对胶质瘤干细胞的筛选提供新的方向和可能,准确靶向杀伤胶质瘤干细胞。
本研究首先系统的培养了GL261胶质瘤干细胞,待其稳定成球、悬浮生长后再进行实验。将胶质瘤干细胞中加入核黄素培养,并在荧光显微镜下观察发现数个带有绿色荧光的肿瘤干细胞。通过流氏细胞仪对CD133+细胞筛选发现,荧光干细胞所占比重高于非荧光的肿瘤干细胞。这或许说明目前筛选的肿瘤干细胞中仍存在一类有恶性程度较低的肿瘤细胞。与此同时,对荧光干细胞筛选发现,CD133+细胞所占比重高于CD133-,表明荧光干细胞中仍有一类不表达CD133+细胞,总之,或许荧光是肿瘤干细胞的固有表型,荧光并不随肿瘤的微环境改变而改变,这或许也间接说明并弥补CD133-也可能是肿瘤干细胞的假说。或许核黄素的引入能提高对肿瘤干细胞筛选的精准度。对比荧光干细胞和普通的胶质瘤干细胞的增殖能力,利用CCK-8试剂盒检测发现24 h内,荧光干细胞的增殖能力明显大于普通胶质瘤干细胞,从此角度说明,荧光干细胞的恶性程度相对更高。最后,通过体外实验和免疫组化等研究相继表明CD133+肿瘤干细胞中仍然存在荧光干细胞,并且这些干细胞的恶性程度,增殖能力均高于目前所利用CD133表型筛选的干细胞。这表明CD133+标记并不能将恶性程度最高的肿瘤干细胞完全筛选,可以推测,CD133-肿瘤细胞中仍有部分恶性程度较高的干样肿瘤细胞。这可能是目前靶向CD133+治疗药物的缺陷所在。
综上所述,荧光肿瘤干细胞可能是肿瘤干细胞的固有表型,恶性程度均相对较高,不随微环境的改变而改变。以荧光肿瘤干细胞为目标有望成为一种有效的筛选策略,同时为以后的临床靶向治疗提供了新的靶点。继续深入研究荧光的发生机制,有利于我们更全面的理解这一表型的产生过程,从而为临床治疗提供更充分的理论和实验依据。
| [1] | SCHONBERG D L, LUBELSKI D, MILLER T E, et al. Brain tumor stem cells: Molecular characteristics and their impact on therapy[J]. Mol Aspects Med, 2014, 39: 82–101. DOI:10.1016/j.mam.2013.06.004 |
| [2] | UNG N, YANG I. Nanotechnology to augment immunotherapy for the treatment of glioblastoma multiforme[J]. J Neurooncol, 2015, 123(3): 473–481. DOI:10.1007/s11060-015-1814-1 |
| [3] | REYA T, MORRISON S J, CLARKE M F, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001, 414(6859): 105–111. DOI:10.1038/35102167 |
| [4] | DONNENBERG V S, DONNENBERG A D. Multiple drug resistance in cancer revisited: the cancer stem cell hypothesis[J]. J Clin Pharmacol, 2005, 45(8): 872–877. DOI:10.1177/0091270005276905 |
| [5] | SINGH S K, HAWKINS C, CLARKE I D, et al. Identification of human brain tumour initiating cells[J]. Nature, 2004, 432(7015): 396–401. DOI:10.1038/nature03128 |
| [6] | SINGH S K, CLARKE I D, TERASAKI M, et al. Identification of a cancer stem cell in human brain tumors[J]. Cancer Res, 2003, 63(18): 5821–5828. |
| [7] | CLÉMENT V, DUTOIT V, MARINO D, et al. Limits of CD133 as a marker of glioma self-renewing cells[J]. Int J Cancer, 2009, 125(1): 244–248. DOI:10.1002/ijc.24352 |
| [8] | HILL R P. Identifying cancer stem cells in solid tumors: case not proven[J]. Cancer Res, 2006, 66(4): 1891–1895. DOI:10.1158/0008-5472.CAN-05-3450 |
| [9] | KERN S E, SHIBATA D. The fuzzy math of solid tumor stem cells: a perspective[J]. Cancer Res, 2007, 67(19): 8985–8988. DOI:10.1158/0008-5472.CAN-07-1971 |
| [10] | MIRANDA-LORENZO I, DORADO J, LONARDO E, et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells[J]. Nat Methods, 2014, 11(11): 1161–1169. DOI:10.1038/nmeth.3112 |
| [11] | LATHIA J D, GALLAGHER J, HEDDLESTON J M, et al. Integrin alpha 6 regulates glioblastoma stem cells[J]. Cell Stem Cell, 2010, 6(5): 421–432. DOI:10.1016/j.stem.2010.02.018 |
| [12] | SOEDA A, PARK M, LEE D, et al. Hypoxia promotes expansion of the CD133-positive glioma stem cells through activation of HIF-1alpha[J]. Oncogene, 2009, 28(45): 3949–3959. DOI:10.1038/onc.2009.252 |
| [13] | CALABRESE C, POPPLETON H, KOCAK M, et al. A perivascular niche for brain tumor stem cells[J]. Cancer Cell, 2007, 11(1): 69–82. DOI:10.1016/j.ccr.2006.11.020 |





