皮肤创面愈合是一个复杂而有序的动态修复过程,主要由特征鲜明而又互有重叠的三个阶段构成,即炎症反应期、增殖期和重塑期[1]。整个过程涉及炎症细胞反应、修复细胞反应、细胞外基质反应和生长因子作用等几个基本环节的相互网络联动。皮肤创面修复不足会导致以糖尿病足、静脉性溃疡和压力性溃疡为代表的慢性难愈创面;修复过度则导致增生性瘢痕或瘢痕疙瘩。慢性难愈创面与过度瘢痕修复都是棘手的医学难题。因此,深入探讨皮肤创面修复的细胞、分子机制,研究修复不足与修复过度的原因,仍是重要的医学科学问题。
自噬(autophagy)是细胞内一种依赖溶酶体系统的自我降解过程,细胞可以通过自噬平衡营养能量来源,也可以通过自噬消除受损的细胞器与病原体[2]。研究表明,自噬失调与机体自身免疫、纤维化、癌变等多种疾病相关[3-4]。目前,对于在体创面愈合过程中自噬水平的报道有限,方法学上常采用电镜与LC3抗体免疫荧光标记技术[5]。采用GFP-LC3转基因小鼠可通过GFP直接标记LC3,能够更加直观清晰地呈现体内自噬现象[6]。本研究通过观察GFP-LC3转基因小鼠创面愈合过程中的自噬发生情况,结合自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)抑制创面自噬水平这一干预手段探索自噬对创面愈合的可能影响。
1 材料与方法 1.1 实验动物纯合GFP-LC3转基因小鼠由美国圣路易斯华盛顿大学Jason Mills教授馈赠,本室保种饲养,遗传背景为C57BL/6J。小鼠饲养于陆军军医大学实验动物中心的SPF级动物房。小鼠的繁殖均采用2只雌性小鼠与1只雄性小鼠配对杂交,取其6~8周龄雄性后代小鼠进行皮肤创面愈合相关实验。
1.2 主要试剂和仪器3-MA购自MCE公司(货号:HY-19312),GFP抗体购自碧云天公司(AG279-1),α-SMA抗体购自Sigma公司(A5228),F4/80抗体购自Abcam公司(Ab6640),Ki-67抗体购自Abcam公司(Ab15580),所有荧光二抗购自Life Technology公司。共聚焦显微镜来自Leica公司(TCS SP8),正置荧光显微镜与拍照系统来自Olympus公司。
1.3 模型制备、3-MA干预和标本采集纯合雄性6~8周龄GFP-LC3转基因小鼠,体质量18.5~21.6 g,按照体质量编号随机分组。用于创面愈合过程自噬水平观察的小鼠采用0.1%戊巴比妥钠麻醉后,在背部制备2个等距的6 mm直径创面,伤后2 h、6 h、12 h、3 d、7 d、14 d共6个时间点,每个时间点3只小鼠,分别进行组织取材,4%多聚甲醛固定,并取正常背部皮肤作为伤前对照。用于自噬抑制剂在体干预实验的小鼠分为3-MA处理组与对照组,致伤方法同前。3-MA采用公司推荐方法溶解至1 mg/mL,按照10 mg/kg剂量连续10 d腹腔注射,对照组注射同样体积的PBS。伤后0、3、7、10 d拍照观察创面愈合情况并做取材处理,每个时间点5只小鼠。用于分子生物学检测取材组织大小为距离创面2 mm,取材后立即用液氮速冻,后放置于-80 ℃冰箱保存;用于组织学检测取材大小为距离创面6~8 mm,取材后放置于10%中性甲醛固定48 h再进行后续处理。3-MA干预实验重复2~3次,结果取1次实验为代表。
1.4 免疫荧光染色皮肤组织按照常规方法制备蜡块,石蜡切片厚度4 μm。石蜡切片脱蜡至水,采用柠檬酸溶液高压修复,晾凉后3%H2O2室温孵育5 min,PBS浸泡5 min×2次,5%山羊血清室温孵育15 min,倾去血清,滴加一抗工作液GFP抗体(1 :400)标记自噬点,α-SMA抗体(1 :500)标记肌成纤维细胞,F4/80抗体(1 :300)标记巨噬细胞。将GFP抗体分别与α-SMA和F4/80抗体共同4 ℃孵育过夜双标。PBS洗5 min×2次,二抗anti-Rabbit IgG (H+L) AF488、anti-Rat IgG (H+L) AF 594与anti-Mouse AF 594(1 :500),同样混合孵育1 h,PBS洗5 min×2次,DAPI复染细胞核后封片。
1.5 共聚焦图像获取与分析上述免疫荧光切片采用共聚焦显微镜在62×镜下获取荧光图片,LAS AF Liter软件进行编辑。在3个独立视野下连拍3张图像,GFP-LC3自噬点≥5的细胞计为LC3阳性细胞,方法参见文献[7]。每只小鼠至少分析200个细胞,统计LC3阳性细胞百分比。
1.6 Ki-67免疫组化染色3-MA处理组与对照组伤后7、10 d石蜡组织块进行连续切片,一张进行常规HE染色,观察组织创面愈合情况;另一张进行Ki-67抗体免疫组化染色,Ki-67一抗工作液(1 :200)用于标记表皮基底层增殖细胞的细胞核。计数新生表皮Ki-67阳性细胞数,同时测量所对应的新生表皮长度,以每毫米表皮上的Ki-67阳性细胞数作为统计获得的Ki-67阳性细胞数(/mm)。
1.7 组织病理学分析在10×放大镜下采集3-MA处理组与对照组创面伤后7 d与10 d HE染色图像,采用Image J软件分析图像。指标测量方法:两端皮肤损伤真皮胶原断裂处之间的距离代表创面宽度(mm);在新生表皮处随机选取5个位点测量表皮厚度,取平均值作为创面表皮厚度(mm);测量两端真皮胶原断裂处之间的新生皮肤面积代表创面新生组织面积(mm2)。
1.8 定量PCR检测以RNAiso(TaKaRa)提取正常皮肤与伤后7、10 d创面组织RNA,在NANO2000仪器上测量RNA浓度与纯度,根据TaKaRa逆转录试剂盒操作说明将1 μg总RNA逆转录为cDNA,进行PCR扩增。引物由擎科生物技术有限公司合成。内参基因36B4上游引物:5′-AGATGCAGCAGATCCGCAT-3′,下游引物:5′-GTTCTTGCCCATCAGCACC-3′(58 bp);α-SMA上游引物:5′-ATGCAGAAGGAGATCACAGC-3′,下游引物:5′-GTATTCCTGTTTGCTGATCCAC-3′(149 bp);College1a1上游引物:5′-AGCCGCAAAGAGTCTACATG-3′, 下游引物:5′-CTTAGGCCATTGTGTATGCAG-3′(143 bp);College1a2上游引物:5′-CCGTGCTTCTCAGAACATCA-3′, 下游引物:5′-CTTGCCCCATTCATTTGTCT-3′(192 bp);College3a1上游引物:5′-TTGGGATGCAGCCACCTTG-3′,下游引物:5′-CGCAAAGGACAGATCCTGAG-3′(100 bp);PAI-1上游引物:5′-GTCTTTCCGACCAAGAGCAG-3′,下游引物:5′-ATCACTTGGCCCATGAAGA-3′(207 bp);TGF-β1上游引物:5′-GTGTGGAGCAACATGTGGAA-CTCTA-3′,下游引物:5′-TTGGTTCAGCCACTGCCGTA-3′(142 bp)。
在96孔PCR板中,按照说明书将SYBR-Ⅱ与需要的引物等混合,后加入1 μL cDNA离心数秒,混匀后迅速置入Bio-Rad实时荧光定量PCR仪中。PCR扩增程序:预变性95 ℃ 5 min,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40个循环,获得各样本待测基因的Ct值。采用2-△△Ct法进行数据处理,以0 d样本值作为标准化参照。
1.9 统计学分析采用GraphPad Prism 5软件进行数据分析,计量资料数据以x±s表示,两组间数据比较采用t检验,多组间比较采用单因素方差分析。检验水准α=0.05。
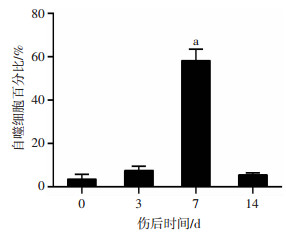
2 结果 2.1 创面愈合过程中自噬水平的动态变化GFP抗体组化方法可清晰显示GFP-LC3转基因小鼠创面修复过程中的自噬点。结果表明,正常与致伤后2 h皮肤组织创面前缘表皮与真皮未见自噬发生;而致伤后12 h表皮上层角质细胞发生明显自噬(图 1A)。伤后3 d,创面表皮前缘迁移与增殖的角质细胞自噬水平增强,且增殖表皮的颗粒层与棘层角质细胞自噬水平较基底层强;几乎未见创面间质中的细胞发生自噬(图 1B、C)。伤后7 d,从颗粒层到基底层创面表皮细胞均发生强自噬,细胞中的LC3自噬点较创面修复3 d明显增多(图 1D、E);创面肉芽组织间质中有较多细胞发生自噬,但单个细胞中LC3自噬点较表皮少(图 1F)。伤后14 d,创面表皮自噬水平较7 d显著下降,接近正常的表皮组织,自噬水平几乎回落到伤后12 h的状态(图 1G、H);创面肉芽间质中仅有个别细胞发生自噬(图 1I)。进一步量化计数各时间点发生自噬的阳性细胞数目显示,伤后7 d自噬阳性细胞数目显著高于其他各时间点(图 2)。总体来说,创面修复初期自噬阳性细胞逐渐增多,炎症期表皮细胞自噬增强,到增殖期表皮与间质自噬水平达到最强,重塑期自噬水平逐渐回落到正常水平。另一方面,创面表皮自噬水平强于间质肉芽组织,而表皮的颗粒层与棘层细胞的自噬水平又比基底层强。

|
| A:伤后12 h皮肤;B:伤后3 d创面前缘表皮;C:伤后3 d创面表皮;D:伤后7 d新生表皮(上层);E:伤后7 d创面表皮(下层);F:伤后7 d肉芽组织间质;G:伤后14 d接近正常部位表皮;H:伤后14 d创面表皮;I:伤后14 d肉芽组织间质 图 1 GFP抗体免疫组化标记创面愈合过程中皮肤组织LC3的表达 |
|
| a:P < 0.01,与伤后0 d比较 图 2 皮肤创面愈合过程中发生自噬的细胞百分比 |
2.2 肉芽组织中间质发生自噬的主要细胞类型
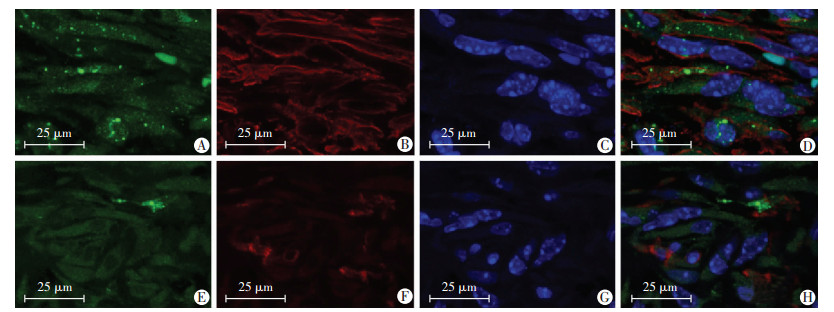
创面修复增殖期肉芽间质细胞丰富,含有多种类型的修复细胞。采用抗体双重荧光标记方法明确其细胞类型。结果显示,多数发生强自噬的细胞为α-SMA标记的肌成纤维细胞(图 3A~D)。肉芽组织中有少数F4/80抗体标记的巨噬细胞发生自噬(图 3E~H)。进一步量化分析显示,α-SMA与自噬双阳性细胞占比为(18.50±1.71)%,显著高于F4/80与自噬双阳性细胞占比[(2.06±0.51)%,P < 0.05]。
|
| A~D:免疫组化标记创伤后第7天创面肉芽组织中LC3与α-SMA阳性细胞的共表达;E~H:免疫组化标记创伤后第7天创面肉芽组织中LC3与巨噬细胞的共表达;A、E:GFP-LC3;B:α-SMA;F:F4/80;C、G:DAPI;D、H:叠加 图 3 免疫荧光双标确认增殖期间质发生自噬的主要细胞类型 |
2.3 3-MA能够显著抑制创面自噬水平
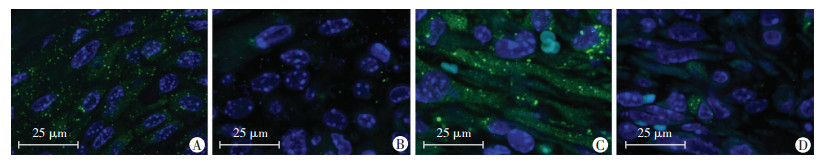
采用3-MA腹腔注射方法检测自噬发生水平最高的增殖期(伤后7 d)的抑制效果。结果显示,3-MA处理组发生自噬的表皮角质细胞占比为(5.31±1.00)%,显著低于对照组[(92.48±3.04)%,P < 0.01,图 4A、B]。同时,3-MA处理组肉芽组织中发生自噬的间质细胞占比[(11.00±1.35)%]显著低于对照组[(31.74±3.49)%,P < 0.01,图 4C、D]。提示该方法可显著抑制创面修复中的自噬水平。
|
| A:对照组表皮;B:3-MA处理组表皮;C:对照组真皮;D:3-MA处理组真皮 图 4 GFP抗体标记3-MA抑制自噬及创伤后第7天创面肉芽组织中LC3的表达 |
2.4 3-MA抑制创面自噬对愈合没有显著影响
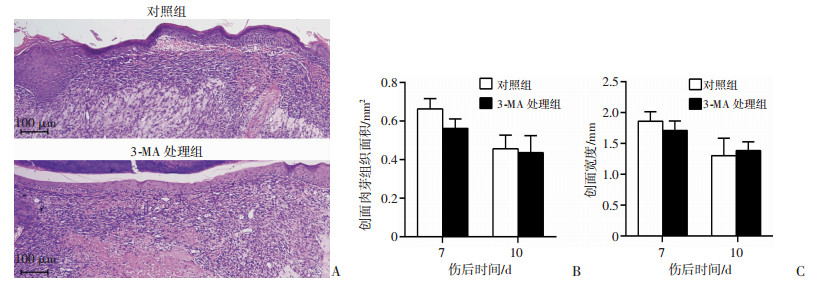
采用3-MA干预创面修复的第10天,观察处理组与对照组的创面大体愈合,与对照组相比,未见3-MA处理组对大体愈合过程有显著影响。组织病理学分析也表明3-MA处理组对创面面积、创面宽度等指标亦无显著影响(图 5)。
|
| A:HE染色观察伤后7 d创面大体愈合情况;B:3-MA对各组创面修复的肉芽组织面积的影响;C:3-MA对各组创面修复的宽度的影响 图 5 3-MA对创面愈合的组织病理学分析 |
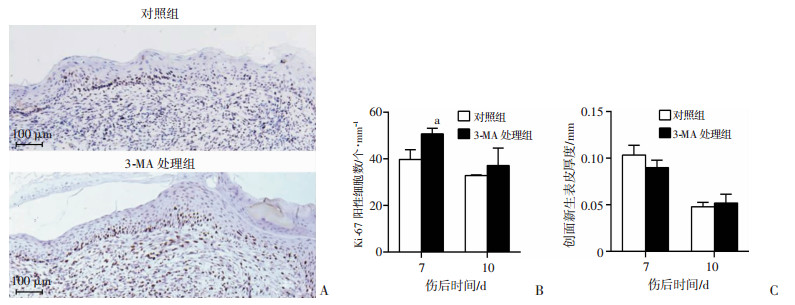
2.5 3-MA抑制创面自噬促进角质细胞增殖
Ki-67免疫组化结果(图 6)显示,3-MA处理组第7天创面角质细胞增殖活力较对照组显著增强(P < 0.05),而第10天两组差异无统计学意义。两个时相点的新生表皮厚度两组差异均无统计学意义。
|
| A:3-MA处理组与对照组伤后第7天创面Ki-67免疫组化观察;B:伤后不同时间创面Ki-67阳性细胞数a:P < 0.05,与对照组比较;C:伤后不同时间创面新生表皮厚度比较 图 6 3-MA对创面角质细胞增殖活性的影响 |
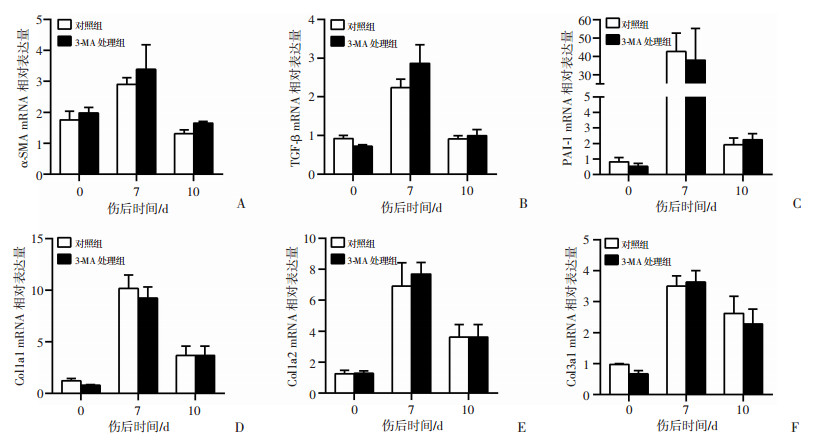
2.6 3-MA抑制创面自噬对胶原沉积相关分子mRNA表达的影响
以定量PCR检测3-MA处理对胶原沉积相关分子表达的影响,结果显示:处理组小鼠α-SMA与TGF-β1 mRNA水平在创面愈合第7天有升高趋势,但差异无统计学意义(图 7A、B),而Ⅰ、Ⅲ型胶原分子mRNA水平在创伤第7天与第10天均未发生明显变化,PAI-1分子的mRNA水平也无显著变化(图 7C~F)。
|
| A~C:定量PCR检测α-SMA、TGF-β1、PAI-1在创面愈合中的mRNA表达水平;D~F:定量PCR检测Ⅰ型胶原、Ⅲ型胶原分子在创面愈合中的mRNA表达水平 图 7 3-MA对创面修复胶原沉积相关分子mRNA表达的影响 |
3 讨论
本研究采用GFP-LC3转基因小鼠探索了皮肤创面愈合过程中自噬水平的动态变化,并初步观察了以3-MA抑制创面自噬后对皮肤创面愈合的影响。结果显示,创面愈合过程中自噬水平经历先增强后逐渐回落的变化,在增殖期(伤后7 d)自噬水平最高,肉芽中角质细胞和肌成纤维细胞是发生自噬的主要细胞类型;3-MA干预能够显著抑制创面自噬水平,虽然能够增加角质细胞的增殖活性,但对创面愈合以及胶原沉积相关分子表达无显著影响。以上结果表明,自噬这一基本细胞生物学事件活跃参与了皮肤创面愈合过程,但对正常创面的愈合似乎影响有限。
国内学者采用免疫组化的方法标识创面愈合过程中的LC3阳性细胞,通过组织切片LC3免疫组化评分评价自噬发生情况,认为伤后7~14 d存在持续高水平的自噬[8]。最近,日本学者通过免疫荧光计数LC3阳性自噬点观察大鼠创面愈合过程中自噬发生情况,认为在7~9 d存在肌成纤维细胞的高水平自噬[9]。我们采用GFP-LC3转基因小鼠不同时相点的皮肤创面组织进行GFP的免疫荧光,得到更加直观、典型的自噬图像,发现在修复的增殖期,即7 d,自噬水平最高,主要的细胞类型是角质细胞和肌成纤维细胞。本研究结果与既往报道相互印证,表明创面修复的增殖期存在高水平自噬。同时提示3种方法用以研究创面自噬变化均有一定可信性,但从原理上而言,简单的LC3免疫组化不能如实反映LC3切割后形成自噬小体的情况,其准确性稍差。此外我们注意到,在自噬出现的高峰期描述上又存有差异,我们分析认为主要原因在于致伤模型上的差别,已有报道分别采用了小鼠1.5 cm×1.5 cm的方形创面[8]和大鼠直径1 cm的圆形创面[9],而本研究采用了小鼠直径0.6 cm的圆形创面,前两种模型缺损大存在增殖期延长的问题。
既往研究表明,雷帕霉素(rapamycin)可导致创面修复削弱,表现为羟脯氨酸含量降低,抗拉强度减弱和再上皮化延迟[10]。雷帕霉素是一种自噬诱导剂,可以导致创面自噬水平增高,但其通过抑制mTOR活性还具有抑制免疫反应、细胞增殖和蛋白合成等多种功能,因此不能简单地将其削弱创面修复的作用归结为增加自噬水平。国内学者报道在糖尿病小鼠和患者的慢性创面存在过度自噬[8, 11],且通过3-MA干预能够缓解糖尿病小鼠创面愈合延迟的表型,但3-MA处理对正常创面愈合的影响不大。这与本研究的结果是一致的,表明适度的自噬是伴发于创面愈合过程中的细胞生物学事件,但正常情况下并不足以对愈合产生影响。
尽管3-MA处理对小鼠正常创面愈合的大体和基本病理未见显著影响,考虑到肉芽组织中角质细胞和肌成纤维细胞的高自噬水平,我们对这两种细胞的修复相关指标进行了进一步检测。针对角质细胞,我们发现3-MA处理能够显著促进伤后7 d的角质细胞增殖,尽管两组的新生表皮厚度没有显著差别。有报道表明自噬在角质细胞分化过程中活化,与FGF7等生长因子相互作用,参与了角质细胞增殖、存活与分化,进而维持皮肤稳态[12]。皮肤创伤愈合过程中存在角质细胞的激活、迁移、增殖、分化等多种表型的相互转换,自噬在增殖期表皮的颗粒层与棘层较基底层呈高水平活化,以3-MA进行干预后角质细胞增殖活性增强,这些结果提示自噬通过促进分化参与了修复过程中角质细胞增殖与分化的平衡。
有研究报道自噬与肌成纤维细胞转分化、胶原沉积、纤维化等事件密切相关,认为自噬促进肌成纤维细胞的转分化、胶原沉积,进而导致组织纤维化[13-14]。且自噬可差异调控牙龈及牙周组织创伤愈合过程中的肌成纤维细胞分化水平[15]。在人牙龈组织创面早期愈合过程中,自噬信号通路未被活化,且牙龈组织成纤维细胞α-SMA与胶原表达水平下调,这可能是牙龈组织创面愈合无瘢痕形成的重要原因。又如增生性瘢痕组织的研究表明,成纤维细胞LC3水平显著高于正常皮肤组织,采用ShLC3抑制敲降LC3可显著降低增生性瘢痕成纤维细胞的Ⅰ型与Ⅲ型胶原蛋白的分泌[16]。本研究结果显示,自噬抑制剂3-MA处理能够显著抑制间质的自噬水平,但创面肉芽中的Ⅰ型与Ⅲ型胶原,α-SMA、PAI-1与TGF-β1等肌成纤维细胞转分化,胶原沉积相关分子的mRNA水平在两组之间差异无统计学意义。这一结果表明了创面修复过程中肌成纤维细胞转分化、胶原沉积等事件调控的复杂性,自噬可能只是其中的一个调控环节,在体环境抑制自噬不足以对上述事件产生显著影响,应当存在其他的代偿机制。
综上所述,本研究揭示在皮肤创面修复的增殖期存在高水平自噬,主要细胞类型为角质细胞和肌成纤维细胞。但以3-MA抑制正常创面自噬除促进增殖期角质细胞增殖外,对整体愈合和胶原合成未见显著影响。自噬在慢性难愈性创面和增生性瘢痕中的发生情况以及可能作用有待进一步研究。
| [1] | GURTNER G C, WERNER S, BARRANDON Y, et al. Wound repair and regeneration[J]. Nature, 2008, 453(7193): 314–321. DOI:10.1038/nature07039 |
| [2] | MIZUSHIMA N, KOMATSU M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728–741. DOI:10.1016/j.cell.2011.10.026 |
| [3] | SARKAR S, PERLSTEIN E O, IMARISIO S, et al. Small molecules enhance autophagy and reduce toxicity in Huntington's disease models[J]. Nat Chem Biol, 2007, 3(6): 331–338. DOI:10.1038/nchembio883 |
| [4] | WANG S Y, YU Q J, ZHANG R D, et al. Core signaling pathways of survival/death in autophagy-related cancer networks[J]. Int J Biochem Cell Biol, 2011, 43(9): 1263–1266. DOI:10.1016/j.biocel.2011.05.010 |
| [5] | UCAR A, GUPTA S K, FIEDLER J, et al. The miRNA-212/132 family regulates both cardiac hypertrophy and cardiomyocyte autophagy[J]. Nat Commun, 2012, 3(1): 1078–1089. DOI:10.1038/ncomms2090 |
| [6] | MIZUSHIMA N, YAMAMOTO A, MATSUI M, et al. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker[J]. Mol Biol Cell, 2004, 15(3): 1101–1111. DOI:10.1091/mbc.e03-09-0704 |
| [7] | WAN G, XIE W, LIU Z, et al. Hypoxia-induced MIR155 is a potent autophagy inducer by targeting multiple players in the MTOR pathway[J]. Autophagy, 2014, 10(1): 70–79. DOI:10.4161/auto.26534 |
| [8] | GUO Y, LIN C, XU P, et al. AGEs induced autophagy impairs cutaneous wound healing via stimulating macrophage polarization to M1 in diabetes[J]. Sci Rep, 2016, 6(1): 36416–36432. DOI:10.1038/srep36416 |
| [9] | ASAI E, YAMAMOTO M, UEDA K, et al. Spatiotemporal alterations of autophagy marker LC3 in rat skin fibroblasts during wound healing process[J]. Fukushima J Med Sci, 2018, 64(1): 15–22. DOI:10.5387/fms.2016-13 |
| [10] | KAHN D, SPEARMAN C W, MALL A, et al. The effect of rapamycin on the healing of the ureteric anastomosis and wound healing[J]. Transplant Proc, 2005, 37(2): 830–831. DOI:10.1016/j.transproceed.2004.12.156 |
| [11] | LIU H, CAO M M, WANG Y, et al. Endoplasmic reticulum stress is involved in the connection between inflammation and autophagy in type 2 diabetes[J]. Gen Comp Endocrinol, 2015, 210: 124–129. DOI:10.1016/j.ygcen.2014.09.006 |
| [12] | BELLEUDI F, PURPURA V, CAPUTO S, et al. FGF7/KGF regulates autophagy in keratinocytes:a novel dual role in the induction of both assembly and turnover of autophagosomes[J]. Autophagy, 2014, 10(5): 803–821. DOI:10.4161/auto.28145 |
| [13] | BERNARD M, DIEUDÉ M, YANG B, et al. Autophagy fosters myofibroblast differentiation through MTORC2 activation and downstream upregulation of CTGF[J]. Autophagy, 2014, 10(12): 2193–2207. DOI:10.4161/15548627.2014.981786 |
| [14] | ZHENG W, QIAN Y, CHEN S, et al. Rapamycin protects against peritendinous fibrosis through activation of autophagy[J]. Front Pharmacol, 2018, 9: 402. DOI:10.3389/fphar.2018.00402 |
| [15] | VESCARELLI E, PILLONI A, DOMINICI F, et al. Autophagy activation is required for myofibroblast differentiation during healing of oral mucosa[J]. J Clin Periodontol, 2017, 44(10): 1039–1050. DOI:10.1111/jcpe.12767 |
| [16] | SHI J, SHI S, WU B, et al. Autophagy protein LC3 regulates the fibrosis of hypertrophic scar by controlling Bcl-xL in dermal fibroblasts[J]. Oncotarget, 2017, 8(55): 93757–93770. DOI:10.18632/oncotarget.20771 |



