阴茎的勃起主要通过激活NO/cGMP/PKG通路实现,以西地那非为代表的磷酸二酯酶抑制剂通过抑制5型磷酸二酯酶(phosphodiesterase type 5,PDE5)的活性,减少阴茎海绵体平滑肌细胞(cavernous smooth muscle cells,CSMC)中cGMP的水解,以达到维持CSMC舒张的作用[1]。除此之外,针对NO合成受损、氧化应激、内皮素(endothelin,ET)及受体、RhoA/Rho途径、神经损伤及激素等研究不能完全解释勃起功能障碍发生[2-4]。有研究表明,O-糖基化可能在勃起功能障碍(erectile dysfunction,ED)的发生中起着重要的作用[5]。O-糖基化作用以类似于磷酸化的修饰机制参与了信号转导、基因转录、蛋白质翻译、细胞应答以及蛋白质降解等一系列复杂的细胞活动[6]。
促分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路主要包括胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路和p38信号通路[7]。研究表明,MAPKs通路的改变对于调控阴茎勃起具有重要的生物学意义[8-9]。因此,本研究通过培养原代CSMC细胞,并向细胞中加入HBP通路中间产物β-N-乙酰氨基葡萄糖(β-N-acetylglucosamine, GlcNAc),以明确药物对细胞中MAPKs通路的影响,以期对提高ED治疗水平提供参考。
1 材料与方法 1.1 材料及试剂通过鼠爬背实验证实的3只性功能正常的健康成年雄性Sprague-Dawley(SD)大鼠,体质量200~250 g,购自陆军军医大学实验动物中心,大鼠的饲养条件为温度(25±2)℃,湿度(45±5)%,12 h昼夜节律。GlcNAc由陆军军医大学药学与检验医学系生药与中药学教研室赠送,Alloxan(OGT特异性抑制剂)、Thiamet G(OGA特异性抑制剂)、戊巴比妥钠、二甲基亚砜(DMSO)均购自Sigma公司,phospho-ERK1/2抗体、ERK1/2抗体、phospho-JNK1/2/3抗体、JNK1/2/3抗体、phospho-p38抗体、p38抗体、alpha smooth muscle actin(α-SM)抗体、desmin抗体均购自成都正能公司,胎牛血清(FBS)购自以色列BI公司,SignalStain ® Boost IHC Detection Reagent (HRP, Rabbit)购自CST公司, GADPH抗体、Dulbecco’s modified Eagle’s medium(DMEM)、HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)均购自武汉三鹰公司。
1.2 原代细胞分离培养及鉴定戊巴比妥钠溶液按30 mg/kg腹腔注射,固定大鼠,于无菌环境下分离阴茎组织,剔除表面血管、神经和结缔组织,将组织切成1 mm×1 mm×1 mm左右组织块,按间隔0.5 cm分布于25 mL培养瓶底部,加入含10%胎牛血清(FBS)和1%双抗(青霉素+链霉素)的DMEM高糖(10%)培养基,放入37 ℃、5%CO2的孵箱培养,待细胞从组织边缘爬出,去除组织块,补加培养液,此后每2~3天更换一次培养液,继续培养。待细胞融合至80%左右,加入0.25%胰蛋白酶消化并传代。将盖玻片置于6孔板,取传至第2代的细胞,以1×105/μL接种至载玻片,待细胞融合至70%时,按CST免疫荧光说明书流程SignalStain®Boost IHC Detection Reagent®试剂盒说明书分别染色α-SM和desmin。分别置于荧光显微镜和普通光学显微镜下观察并随机选取高倍(×200)镜下6个视野,计数并做好记录。
1.3 原代细胞药物处理取传第2代CSMC至6孔板,按前述方法培养,待细胞融合至70%~80%,加药处理。GlcNAc按5 μmol/L处理,Alloxan按5 mmol/L于饥饿的最后1 h时加入细胞培养基处理细胞,Thiamet G溶于DMSO,配成10 mmol/L母液,使用时稀释至1 μmol/L加入培养基。根据不同实验目的,进行如下分组与处理:①验证GlcNAc的糖基化作用,将CSMC细胞分成对照组、Thiamet G与GlcNAc组,处理24 h;②检测GlcNAc对MAPKs通路相关蛋白影响,GlcNAc处理0、10 min、1、2、4、8、12 h;③检测GlcNAc是否经O-糖基化依赖性途径影响MAPKs通路蛋白,分成对照组、GlcNAc组、Alloxan组与Thiamet G组,处理72 h;④检测GlcNAc是否具有协同OGT/OGA抑制剂作用,分成对照组、GlcNAc+Alloxan组、GlcNAc+Thiamet G组,处理72 h。以上各组药物剂量均按前述浓度配制后,加入培养基处理细胞,收集细胞裂解物,待后续测定使用。
1.4 Western blot检测细胞用PBS清洗2次,加入RIPA裂解液(50 mmol/L Tris,pH 7.4,150 mmol/L NaCl,1 mmol/L EDTA,0.1% SDS,1% Triton X-100,1% sodium deoxycholate,1 mmol/L PMSF)和蛋白酶抑制剂,于冰上用细胞刷刮取细胞裂解物于EP管,采用SDS-PAGE法分离蛋白,并转移至PVDF膜,然后膜分别孵phospho-ERK1/2、ERK1/2、phospho-JNK1/2/3、JNK1/2/3、phospho-p38、p38、O-GlcNAc、GADPH一抗,再孵HRP-耦合二抗,结果采用ECL底物发光法获取。
1.5 统计学分析采用SPSS 20.0统计软件,数据以x±s表示,采用独立样本t检验,检验水准α=0.05。
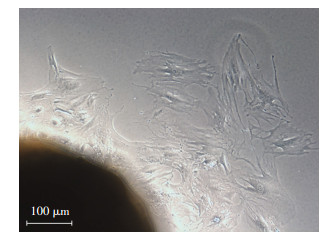
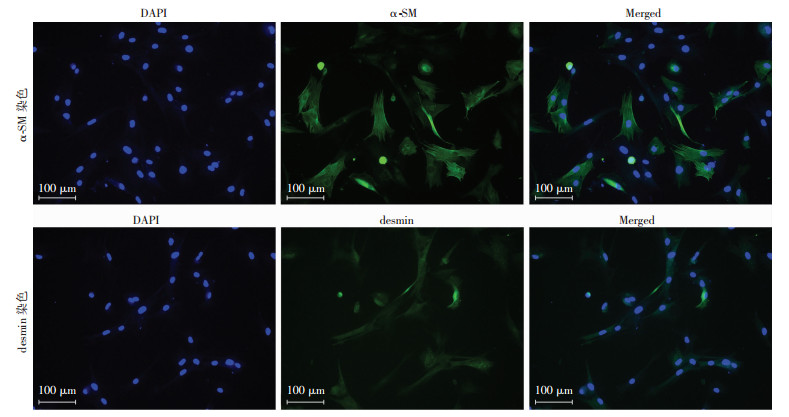
2 结果 2.1 原代细胞模型的建立细胞于第4周顺利从组织边缘爬出,细胞形态呈梭形(图 1),经过免疫荧光染色(图 2)和免疫组化染色(图 3)鉴定,细胞为阴茎海绵体平滑肌细胞。经过镜下(×200)计数,平滑肌细胞占75%~92%(表 1),占比符合实验要求。
|
| 图 1 高倍镜观察原代阴茎海绵体平滑肌细胞爬出组织块 |
|
| 图 2 免疫荧光鉴定平滑肌细胞 |

|
| 图 3 免疫组化染色鉴定平滑肌细胞 |
| 染色方法 | 荧光染色 | 组化染色 | ||||
| 细胞数 | 细胞总数 | 比值 | 细胞数 | 细胞总数 | 比值 | |
| α-SM-actin | 33±7 | 41±8 | 0.82±0.04 | 32±3 | 38±4 | 0.83±0.02 |
| desmin | 26±4 | 32±4 | 0.80±0.05 | 35±5 | 39±5 | 0.89±0.03 |
2.2 GlcNAc对CSMC蛋白糖基化水平的影响
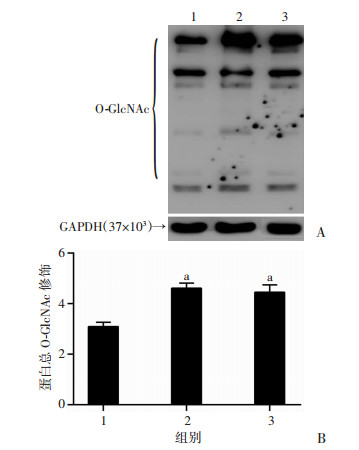
Western blot检测结果显示,GlcNAc处理CSMC可使细胞O-糖基化水平明显升高(P < 0.05,图 4)。
|
| 1:对照组;2:Thiamet G处理组;3:GlcNAc处理组 A:Western blot检测结果;B:半定量分析结果a:P < 0.05,与对照组比较 图 4 药物处理后CSMC细胞蛋白糖基化水平 |
2.3 GlcNAc对MAPKs通路的影响
GlcNAc在12 h内时间依赖性的抑制了阴茎海绵体平滑肌细胞的ERK1/2、JNK1/2/3和p38的磷酸化,2 h后明显(图 5)。

|
| 图 5 GlcNAc时间依赖性的抑制MAPKs通路的磷酸化 |
2.4 GlcNAc经O-糖基化依赖性途径影响MAPKs通路
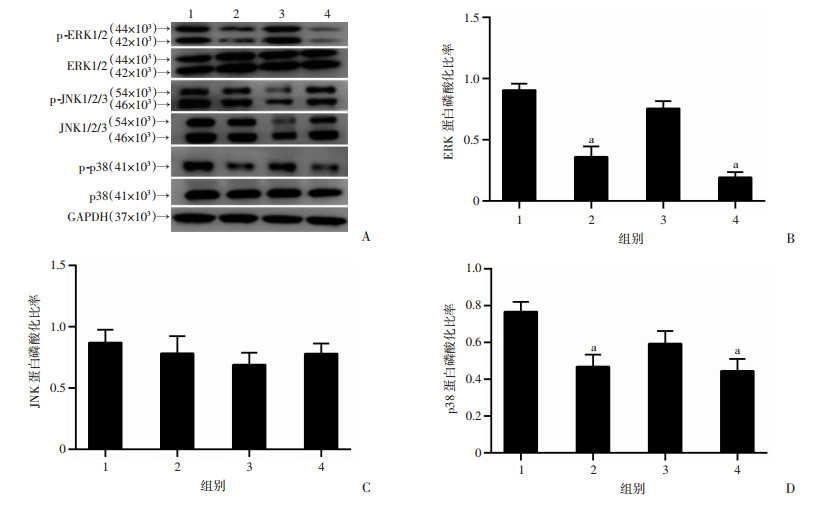
Western blot检测结果显示,GlcNAc在72 h显著抑制阴茎海绵体平滑肌细胞ERK和p38/MAPK通路的磷酸化(P < 0.05,图 6),且该作用与OGA抑制剂具有的协同作用,对JNK/MAPK通路的磷酸化没有影响, 而OGT抑制剂则无此作用。
|
| 1:对照组;2:GlcNAc处理组;3:Alloxan处理组;4:Thiamet G处理组; A:Western blot检测结果;B~D:分别为ERK、JNK、p38蛋白磷酸化分析结果a:P < 0.05,与对照组比较 图 6 GlcNAc经O-糖基化途径抑制MAPKs通路磷酸化 |
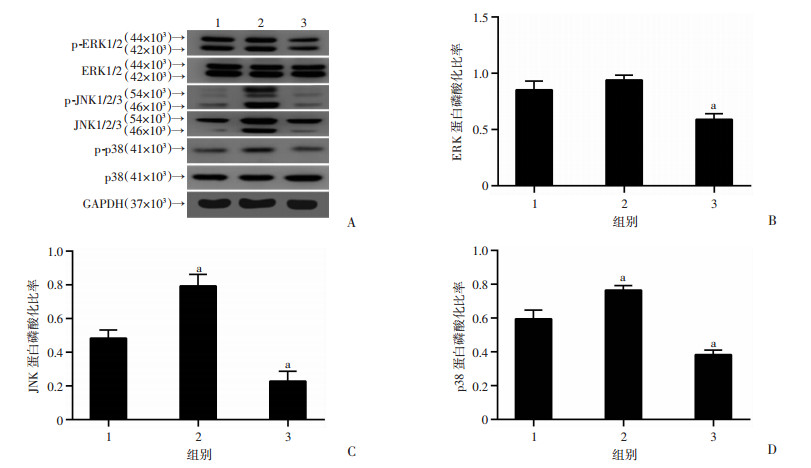
2.5 GlcNAc影响MAPKs通路的协同作用
GlcNAc分别与OGT抑制剂和OGA抑制剂联合处理CSMC,结果显示:GlcNAc与OGA抑制剂能够协同抑制ERK1/2、JNK1/2/3和p38蛋白的磷酸化,GlcNAc与OGT抑制剂合用能促进p38蛋白的磷酸化(图 7)。
|
| 1:对照组;2:GlcNAc+Alloxan处理组;3:GlcNAc+Thiamet G处理组; A:Western blot检测结果;B~D:分别为ERK、JNK、p38蛋白磷酸化分析结果a:P < 0.05,与对照组比较 图 7 GlcNAc协同Thiamet G抑制MAPKs通路磷酸化 |
3 讨论
ED是男性性功能障碍的高发疾病,其发病原因众多,发病机制错综复杂,机理仍不十分明确。当前的研究主要有NO/cGMP/PKG通路、Rho/RhoA相关性蛋白激酶(ROCK)、肾素-血管紧张素系统(RAS)、肿瘤坏死因子α(TNF-α)相关通路等[10]。阴茎勃起的信号转导通路主要发生在3个部位:性神经传出纤维末梢、阴茎内皮细胞和海绵体平滑肌细胞。本实验选用大鼠CSMC细胞作为研究对象,因海绵体平滑肌细胞较易分离和培养,MAPKs通路的改变可以直接影响平滑肌细胞的迁移和增殖[11],并且LIMA等[12]研究发现,O-糖基化的升高能够直接提高肌球蛋白轻链(myosin light chain,MLC)的磷酸化水平,降低肌球蛋白轻链激酶(myosin light chain kinase,MLCK)与Ca2+/钙调蛋白的亲和力,导致平滑肌收缩。因此,通过研究CSMC细胞O-糖基化的对细胞的MAPK通路的影响,能够明确关于CSMC细胞的增殖迁移或舒缩功能方面的影响。
O-糖基化是一种蛋白单糖修饰,类似于蛋白的磷酸化修饰。研究显示,O-糖基化主要通过OGT将GlcNAc以O-连接方式从活化的N乙酰氨基葡萄糖残基(UDP-GlcNAc)转移至胞质蛋白和核蛋白的丝氨酸或苏氨酸残基[13]。由于蛋白的丝氨酸或苏氨酸残基的磷酸化是细胞生命活动的重要组成部分,而磷酸化与O-糖基化具有互相调节作用,且这种调节作用有4种形式[14]:即分别为在同一个位点的竞争性修饰、不同位点的交替性修饰、邻近区域内的不同位点的各自修饰和位点依赖性的交替修饰或同时修饰。而OGA则通过水解蛋白残基上的O-GlcNAc来去除O-糖基化作用。因此,生理状态下胞内的O-糖基化只在OGT/OGA这一对酶的作用下保持动态平衡。这与蛋白的众多激酶/磷酸酶系统不同,理论上,蛋白的氨基酸残基的糖基化具有调节众多蛋白磷酸化的作用。
MAPK通路的基本组成是一种从酵母到人类都保守的三级激酶模式[15],包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和MAPKs。这3种激酶能依次激活,共同调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程。本研究的MAPKs通路是第3级激酶系统,是一个主要包括ERK、JNK和p38通路的并行系统。研究表明,ERK通路主要参与细胞形态的调节及细胞骨架的重分布,影响和调控细胞的增殖和分化[16],JNK和p38通路主要参与细胞的炎症反应和应激刺激[17]。研究发现O-糖基化能够引起许多细胞和组织的MAPKs通路受影响。如GOLDBERG等[18]发现,在肾小球系膜细胞中,降低O-糖基化可以激活ERK的磷酸化,而提升O-糖基化可以激活p38的磷酸化。KNEASS等[19]在中性粒细胞的运动和迁移中发现O-糖基化可以激活上游MAPK相关激酶来激活中性粒细胞的p38和p42/44 MAPK通路。
另外,MAPKs通路的改变对CSMC细胞的舒缩功能的影响也被许多研究所证实。XU等[9]在干细胞治疗前列腺切除术后的勃起功能障碍的研究中发现,阴茎中内源性干细胞中p38 MAPK通路的磷酸化激活,可能是调节干细胞分化,最终影响疗效的原因。MUNIZ等[8]研究也发现JNK磷酸化的抑制,可以逆转ET-1介导的CSMC细胞收缩,从而改善勃起功能。
本研究发现,O-糖基化可以显著抑制大鼠CSMC细胞中MAPKs通路。通过选用GlcNAc这一重要的HBP中间产物做底物,改进了以往选用葡萄糖、氨基葡萄糖或糖尿病造模等O-糖基化研究手段,避免了HBP途径的可逆反应的影响。研究发现,在大鼠CSMC细胞中,GlcNAc可以显著抑制ERK1/2、p38的磷酸化,该作用可能是通过O-GlcNAc基团竞争性结合蛋白MAPKs通路相关蛋白的丝氨酸/苏氨酸残基,以调节该残基的磷酸化。并且,该作用已经通过OGT和OGA抑制剂实验证实是经过糖基化依赖性途径完成的,当合用OGA抑制剂后,ERK1/2、JNK1/2/3与p38蛋白的磷酸化均可被抑制,证明两者具有协同作用。另外,研究发现,OGT抑制剂合用GlcNAc具有促进p38和JNK1/2/3蛋白磷酸化的作用,具体机制有待进一步研究。虽然部分结论同以往研究[18-19]有矛盾的地方,但可能是由于研究的细胞不同所致。NUNES等[20]研究发现ERK活性的抑制可以改善糖尿病导致的ED,而本实验表明ERK通路的活性受到了明显的抑制。这似乎证明GlcNAc能通过抑制ERK通路的活性而改善糖尿病ED,然而,由于糖尿病过程中也会导致O-糖基化的大量产生,并且MUSICKI等[5]研究认为糖尿病引起eNOS的过度O-糖基化使NO产量下降,进而导致ED,这是互相矛盾的。在糖尿病状态下,HBP途径过度激活,O-糖基化作用处于不可控状态。另外,糖尿病还可能通过血管或神经损伤导致ED,因而有必要继续研究糖尿病ED与生理条件下O-糖基化的差异,以证明O-糖基化对勃起功能的影响是有利还是负面的。虽然我们暂时不能明确MAPKs通路的改变对阴茎的勃起的影响,但种种迹象表明,MAPKs通路和O-糖基化确实参与了勃起的调控。对于O-糖基化究竟采用那种机制调节蛋白残基的磷酸化仍需进一步研究。另外,关于CSMC中MAPKs通路如何在糖基化作用影响下改变细胞的舒缩功能仍不甚明了,更好地理解这些点,可以对开发此靶点作为治疗ED的药物提供新的思路。
总之,GlcNAc可以显著抑制ERK和p38 MAPK通路的磷酸化水平,且该作用是通过糖基化依赖性途径完成。机制可能为UDP-GlcNAc基团竞争性或非竞争性结合可被磷酸化修饰的MAPKs通路相关蛋白的丝氨酸或苏氨酸残基,从而导致蛋白活性受到影响,进而影响平滑肌细胞的舒缩功能。
| [1] | SHAMLOUL R, GHANEM H. Erectile dysfunction[J]. Lancet, 2013, 381(9861): 153–165. DOI:10.1016/S0140-6736(12)60520-0 |
| [2] | WINGARD C J, MOUKDAR F, PRASAD R Y, et al. Reversal of voltage-dependent erectile responses in the Zucker obese-diabetic rat by rosuvastatin-altered RhoA/Rho-kinase signaling[J]. J Sex Med, 2009, 6(Suppl 3): 269–278. DOI:10.1111/j.1743-6109.2008.01184.x |
| [3] | S-NCHEZ A, MART-NEZ P, MU-OZ M, et al. Endothelin-1 contributes to endothelial dysfunction and enhanced vasoconstriction through augmented superoxide production in penile arteries from insulin-resistant obese rats: role of ET(A) and ET(B) receptors[J]. Br J Pharmacol, 2014, 171(24): 5682–5695. DOI:10.1111/bph.12870 |
| [4] | JANG H, BAE W J, KIM S J, et al. The herbal formula KH-204 is protective against erectile dysfunction by minimizing oxidative stress and improving lipid profiles in a rat model of erectile dysfunction induced by hypercholesterolaemia[J]. BMC Complement Altern Med, 2017, 17(1): 129. DOI:10.1186/s12906-017-1588-4 |
| [5] | MUSICKI B, KRAMER M F, BECKER R E, et al. Inacti-vation of phosphorylated endothelial nitric oxide synthase (Ser-1177) by O-GlcNAc in diabetes-associated erectile dysfunction[J]. Proc Natl Acad Sci U S A, 2005, 102(33): 11870–11875. DOI:10.1073/pnas.0502488102 |
| [6] | SLAWSON C, COPELAND R J, HART G W. O-GlcNAc signaling: a metabolic link between diabetes and cancer?[J]. Trends Biochem Sci, 2010, 35(10): 547–555. DOI:10.1016/j.tibs.2010.04.005 |
| [7] | PETI W, PAGE R. Molecular basis of MAP kinase regulation[J]. Protein Sci, 2013, 22(12): 1698–1710. DOI:10.1002/pro.2374 |
| [8] | MUNIZ J J, LEITE L N, LACCHINI R, et al. Dysregulated mitogen-activated protein kinase and matrix metalloproteinase in ethanol-induced cavernosal dysfunction[J]. Can J Physiol Pharmacol, 2018, 96(3): 266–274. DOI:10.1139/cjpp-2017-0082 |
| [9] | XU Y, GUAN R, LEI H, et al. Implications for differentiation of endogenous stem cells: therapeutic effect from icariside Ⅱ on a rat model of postprostatectomy erectile dysfunction[J]. Stem Cells Dev, 2015, 24(6): 747–755. DOI:10.1089/scd.2014.0380 |
| [10] | MATSUI H, SOPKO N A, HANNAN J L, et al. Pathophysiology of erectile dysfunction[J]. Curr Drug Targets, 2015, 16(5): 411–419. DOI:10.2174/138945011605150504114041 |
| [11] | SHEN Y, ZHU X, YANG X, et al. Cardamonin inhibits angiotensin Ⅱ-induced vascular smooth muscle cell proliferation and migration by downregulating p38 MAPK, Akt, and ERK phosphorylation[J]. J Nat Med, 2014, 68(3): 623–629. DOI:10.1007/s11418-014-0825-0 |
| [12] | LIMA V V, LOBATO N S, FILGUEIRA F P, et al. Vascular O-GlcNAcylation augments reactivity to constrictor stimuli by prolonging phosphorylated levels of the myosin light chain[J]. Braz J Med Biol Res, 2014, 47(10): 826–833. DOI:10.1590/1414-431X20144001 |
| [13] | DASSANAYAKA S, JONES S P. O-GlcNAc and the cardiovascular system[J]. Pharmacol Ther, 2014, 142(1): 62–71. DOI:10.1016/j.pharmthera.2013.11.005 |
| [14] | ZEIDAN Q, HART G W. The intersections between O-GlcNAcylation and phosphorylation: implications for multiple signaling pathways[J]. J Cell Sci, 2010, 123(1): 13–22. DOI:10.1242/jcs.053678 |
| [15] | JOHNSON G L, DOHLMAN H G, GRAVES L M. MAPK kinase kinases (MKKKs) as a target class for small-molecule inhibition to modulate signaling networks and gene expression[J]. Curr Opin Chem Biol, 2005, 9(3): 325–331. DOI:10.1016/j.cbpa.2005.04.004 |
| [16] | NIKOLAIENKO O, ERIKSEN M S, PATIL S, et al. Stimulus-evoked ERK-dependent phosphorylation of activity-regulated cytoskeleton-associated protein (Arc) regulates its neuronal subcellular localization[J]. Neuroscience, 2017, 360: 68–80. DOI:10.1016/j.neuroscience.2017.07.026 |
| [17] | HOTAMISLIGIL G S, DAVIS R J. Cell signaling and stress responses[J]. Cold Spring Harb Perspect Biol, 2016, 8(10): a006072. DOI:10.1101/cshperspect.a006072 |
| [18] | GOLDBERG H, WHITESIDE C, FANTUS I G. O-linked beta-N-acetylglucosamine supports p38 MAPK activation by high glucose in glomerular mesangial cells[J]. Am J Physiol Endocrinol Metab, 2011, 301(4): E713–E726. DOI:10.1152/ajpendo.00108.2011 |
| [19] | KNEASS Z T, MARCHASE R B. Protein O-GlcNAc modulates motility-associated signaling intermediates in neutrophils[J]. J Biol Chem, 2005, 280(15): 14579–14585. DOI:10.1074/jbc.M414066200 |
| [20] | NUNES K P, TOQUE H A, CALDWELL R B, et al. Extracellular signal-regulated kinase (ERK) inhibition decreases arginase activity and improves corpora cavernosal relaxation in streptozotocin (STZ)-induced diabetic mice[J]. J Sex Med, 2011, 8(12): 3335–3344. DOI:10.1111/j.1743-6109.2011.02499.x |



