2. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:全军高原医学重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:病理生理学教研室
2. Key Laboratory of High Altitude Medicine, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Pathophysiology, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
缺氧的本质是细胞对低氧状态的一种反应和适应性改变。缺氧时细胞可出现一系列功能、代谢和结构的变化。由于不同组织来源的细胞,其细胞功能、能量代谢状况等存在显著差异。因此,机体不同来源细胞对缺氧的敏感性或耐受性也存在差异。例如,在机体的所有器官中,脑是对缺氧较为敏感的器官,严重缺氧能造成脑不可逆损伤和认知、语言、行动等能力的损害,甚至危及生命。大脑虽然占体质量的2%~3%,但是它的血流量却占总血量的13%左右,而耗氧量占人体总耗氧量的25%左右。血管内皮细胞是分泌和合成血管活性物质场所,也是直接接触血液的细胞,其代谢旺盛,对缺氧也较为敏感。肠道固有层有丰富的血液供应,但肠腔内却是相对缺氧环境[1],因此,肠道上皮细胞可能对缺氧具有较好的耐受性。总之,不同组织来源的细胞对缺氧的耐受性可能存在显著差异。
因此,本研究选择了不同组织来源的细胞,包括人源正常结肠上皮细胞CCD 841 CoN、人胃黏膜上皮细胞GES-1、人脐静脉内皮细胞HUVEC、人脑胶质细胞HEB、人胚肾细胞HEK-293、人支气管上皮细胞HBE和人肝细胞L02。给予不同氧浓度不同时间处理,并采用CCK-8(Cell Counting Kit)和乳酸脱氢酶(lactic dehydrogenase,LDH)方法检测细胞增殖及细胞膜损伤情况,由此筛选出稳定的对缺氧敏感的细胞模型,为缺氧损伤机制的研究和药物作用的评估提供基础。
1 材料与方法 1.1 材料和试剂HUVEC、HEK-293和CCD 841 CoN PRMI1640培养基购自美国GIBCO公司,青链霉素购自碧云天生物有限公司,优等胎牛血清购自美国HyClone公司,细胞冻存液购自广州赛业生物科技有限公司,PBS购自北京中杉金桥生物技术有限公司,胰蛋白酶EDTA消化液购自美国HyClone公司,无水乙醇购自重庆川东化工集团有限公司,DMSO购自美国Sigma公司。
1.2 实验方法利用高原军事医学系实验室低氧工作站模拟低氧环境作为细胞缺氧模型,采用比较成熟的增殖检测方法CCK-8和缺氧损伤检测方法LDH酶活力[2-4]为基础进行实验。
1.2.1 细胞培养HUVEC、CCD 841 CoN、HEB、HEK-293和L02细胞采用含10%胎牛血清的高糖DMEM培养液于37 ℃、5%CO2饱和湿度培养箱中培养。GES-1、HBE细胞采用含10%胎牛血清的PRMI1640培养液常规培养,细胞置于37 ℃、5%CO2饱和湿度培养箱中培养。每2~3天换液传代,取对数生长期细胞用于实验。
1.2.2 实验分组正常对照组:21%O2、5%CO2、74%N2的混合气体,细胞培养时间6、12、24 h;缺氧实验组:1%O2、5%CO2、94%N2的混合气体和5%O2、5%CO2、90%N2的混合气体。细胞缺氧培养时间6、12、24 h;分别在缺氧相应时间后收集细胞上清和细胞进行指标测定。筛选出缺氧损伤敏感细胞,采用红景天和丁苯酞(butyl phthalide, NBP)来验证实验模型。加药组:红景天0.625 μmol/L和2.5 mmol/L作用于HEB细胞;丁苯酞1 μmol/L和2 μmol/L作用于HEB细胞,分别在加药1%缺氧浓度24 h后收集细胞上清和细胞进行指标测定。
1.2.3 细胞存活率和活力测定细胞接种于96孔板常规培养,施加处理因素,测定450 nm波长处各组各孔的光密度值[D(450)]。采用CCK-8试剂盒,反映出细胞活力及增殖情况。
1.2.4 细胞乳酸脱氢酶(LDH)漏出量测定收集各组细胞培养上清液,经测定,计算出各组细胞上清中所含LDH漏出量。反映出缺氧处理之后各组细胞损伤的变化。
1.3 统计学分析采用Excel进行统计学分析。计量资料以x±s表示。缺氧损伤评价用双因素方差分析,药物干预采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 不同缺氧条件对7种不同来源细胞增殖的影响低氧环境使HEB细胞增殖受到抑制,与常氧对照组相比,1%氧浓度缺氧处理24 h时,HEB细胞增殖能力显著降低(P < 0.05),如图 1A。但与常氧对照组相比,1%和5%氧浓度缺氧处理12~24 h时对L02、CCD 841 CoN、HBE、HUVEC、HEK-293、GES-1细胞增殖能力影响不大,细胞活力没有显著性变化,如图 1B~G。
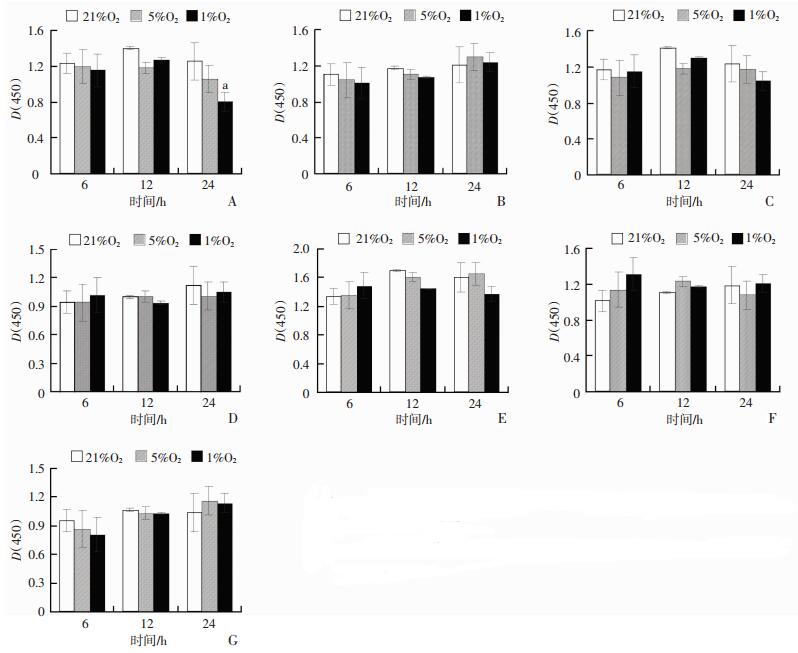
|
| A~G:HEB、L02、CCD 8441 CoN、HBE、HUVEC、HEK-293和GES-1细胞增殖; a:P < 0.05, 与21%O2比较 图 1 7种不同来源细胞在不同氧浓度及不同时间处理后细胞活力的变化(x±s, n=3) |
2.2 不同缺氧条件对7种不同来源细胞乳酸脱氢酶的影响
与常氧对照组相比,1%氧浓度缺氧处理12 h和24 h,HUVEC细胞LDH酶活力显著升高(P < 0.05),如图 2A。与常氧对照组相比,1%和5%氧浓度缺氧处理6、12 h和24 h,L02细胞上清中LDH酶活力没有明显的变化,如图 2B。与常氧对照组相比,1%氧浓度缺氧处理6、12 h和24 h,HEB细胞LDH酶活力显著升高(P < 0.01),5%氧浓度缺氧处理6 h和24 h,HEB细胞LDH酶活力显著升高(P < 0.01),如图 2C。与常氧对照组相比,5%和1%氧浓度缺氧处理6 h,GES-1细胞上清中LDH酶活力显著升高(P < 0.05);与常氧对照组相比,5%氧浓度缺氧处理24 h,GES-1细胞上清中LDH酶活力显著升高(P < 0.01),如图 2D。与常氧对照组相比,5%和1%氧浓度缺氧处理24 h,HEK-293细胞LDH酶活力显著升高(P < 0.01),如图 2E。与常氧对照组相比,5%和1%氧浓度缺氧处理24 h,HBE细胞LDH酶活力显著升高(P < 0.01),如图 2F。与常氧对照组相比,5%和1%氧浓度缺氧处理24 h,CCD 841 CoN细胞上清中LDH酶活力显著升高(P < 0.01),如图 2G。
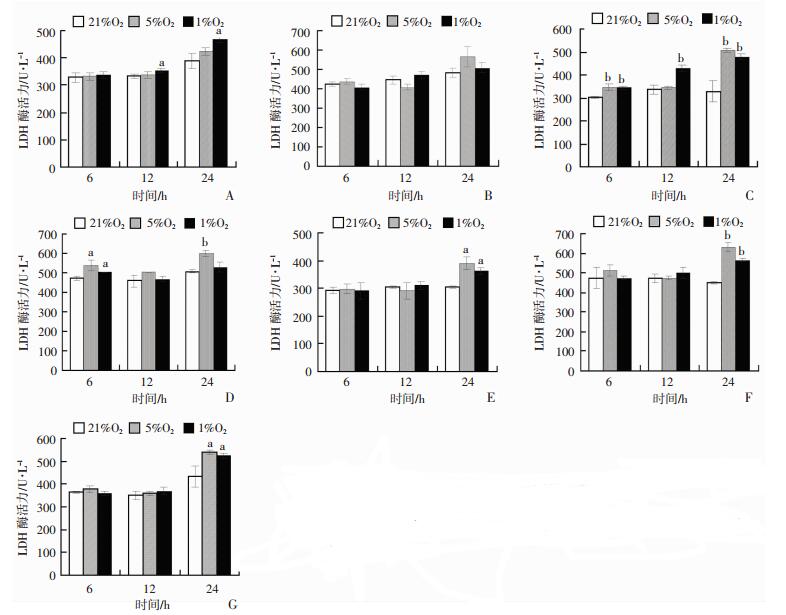
|
| A~G:HUVEC、L02、HEB、GES-1、HEK-293、CCD 8441 CoN细胞上清中LDH酶活力; a:P < 0.05, b: < 0.01, 与21%O2比较 图 2 7种不同来源细胞在不同氧浓度及不同时间处理后LDH漏出量的变化(x±s, n=3) |
2.3 丁苯酞与红景天对HEB细胞缺氧状态下增殖能力的影响
HEB细胞在1%氧浓度条件下培养,上清中加入1 μmol/L丁苯酞或2.5 mmol/L红景天处理24 h时可以使光密度值显著上升(P < 0.05,图 3),提示丁苯酞和红景天处理可以促进缺氧HEB细胞的增殖。
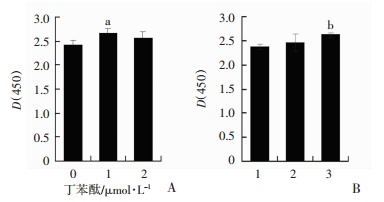
|
| A:丁苯酞处理24 h后细胞增殖;a:P < 0.05,与0 μmol/L比较;B:红景天处理24 h后细胞增殖1:0 μmol/L; 2: 0.625 μmol/L; 3: 2.5 mmol/L;b:P < 0.01,与0 μmol/L比较 图 3 丁苯酞和红景天对1%氧浓度处理24 h细胞活力的影响(n=3) |
2.4 丁苯酞与红景天对HEB细胞LDH漏出量的影响
HEB细胞在1%氧浓度条件下培养,上清中加入1 μmol/L和2 μmol/L丁苯酞或2.5 mmol/L红景天处理24 h时可以使LDH值显著下降(P < 0.05,图 4),提示丁苯酞和红景天处理可以减轻缺氧对HEB细胞的损伤。
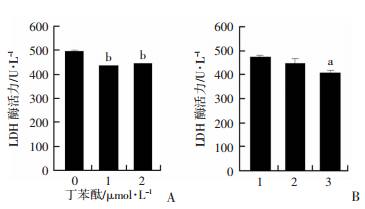
|
| A:丁苯酞处理24 h后细胞上清中LDH酶活力;b:P < 0.01,与0 μmol/L比较;B:红景天处理24 h后细胞上清中LDH酶活力1:0 μmol/L; 2: 0.625 μmol/L; 3: 2.5 mmol/L;a:P < 0.05,与0 μmol/L比较 图 4 丁苯酞和红景天对1%氧浓度处理24 h LDH酶漏出量的影响(n=3) |
3 讨论
低氧是指可利用氧的减少或氧分压降至临界值以下的状态,限制甚至终止器官、组织和细胞的生理功能[5]。细胞增殖是生物体的重要生命特征,细胞以分裂的方式进行增殖。在缺氧条件下,细胞为应对缺氧环境,可通过一系列调整机制,使细胞耗能过程减弱,如蛋白合成等,以减少氧消耗,维持氧供需平衡。细胞增殖是一个耗能过程,所以缺氧达到一定程度后便会抑制细胞增殖。在1%氧浓度缺氧24 h时,HEB细胞光密度值显著降低,HEB细胞增殖受到显著抑制。而缺氧对CCD 841 CoN、HEK-293、GES-1、L02、HBE和HUVEC等细胞的增殖无显著影响。这些结果表明缺氧条件下,研究的7种细胞中,HEB细胞增殖最易受到抑制,推测HEB细胞本身能耗较高,可能与缺氧时氨基酸代谢和糖代谢增强显著有关[6],为维持细胞较高的能耗,细胞增殖最先受到抑制。
缺氧时细胞可出现一系列功能、代谢和结构的变化,包括损伤性变化和代偿性变化。损伤性变化可表现为细胞膜损伤、线粒体损伤和溶酶体损伤等。LDH是稳定的胞浆酶,当细胞膜损伤时可快速释放到细胞培养液中。因此,检测细胞上清中的LDH酶活性,可反映细胞膜损伤程度。因此LDH常作为一个衡量细胞是否完整的重要指标,从而也间接反映细胞缺氧后损伤情况。HEB细胞缺氧后细胞上清中LDH酶活力与21%氧浓度相比,变化最为明显,HEB细胞5%氧浓度缺氧6 h时细胞上清LDH显著升高,随着缺氧浓度和缺氧时间的降低和延长,LDH酶活力也有显著变化,说明机体组织中脑组织对缺氧较为敏感,在较短时间内脑细胞即可表现出细胞损伤。从上述结果来看,CCD 841 CoN、HEK-293、GES-1、L02、HBE和HUVEC细胞上清中LDH酶活力均有升高,有统计学差异,但每种细胞LDH升高程度均不相同,说明每种细胞对缺氧敏感性不同。同时也说明LDH酶活力检测对于缺氧损伤的评估较细胞增殖更为敏感,更能较早表现出细胞缺氧损伤。综上所述,LDH酶活力检测法较CCK-8检测法更敏感,能较早表现出细胞缺氧损伤;HEB是较好的细胞缺氧损伤模型。
丁苯酞对线粒体具有保护作用,能逆转缺血期线粒体膜流动性降低,使线粒体膜电位和线粒体总ATPase活性恢复至正常水平。电镜结果显示丁苯酞能明显改善脑缺血再灌注引起的线粒体肿胀和空泡化[7]。丁苯酞作为一种多功能的靶向治疗药物,能够预防神经细胞凋亡,减少梗死面积[8]。本研究中使用丁苯酞(1 μmol/L和2 μmol/L)作用1%氧浓度缺氧24 h的HEB细胞,增殖水平显著性升高;HEB细胞LDH酶活力水平显著降低,与丁苯酞对神经细胞有保护作用的观点一致。红景天广泛分布于高海拔的极地和高原区域,具有抗衰老、抗疲劳、耐缺氧、调节免疫、调节中枢神经系统、提高脑力、增强体力等功效。尤其对提高低氧运动的耐力有明显效果,能在整体水平上提高机体缺氧时的有氧代谢过程。相关文献报道红景天苷可加速氧自由基清除和抑制细胞内钙超载,对脑缺血/再灌注损伤大鼠大脑有一定保护作用[9]。本研究中使用红景天苷(0.625 μmol/L和2.5 mmol/L)作用于1%缺氧24 h的HEB细胞,增殖水平显著升高;HEB细胞LDH酶活力水平显著降低,红景天可以减轻缺氧导致HEB细胞的损伤,红景天对神经细胞起到保护作用。
综上所述,本实验结果表明:HEB细胞对缺氧比较敏感,因此可作为反映缺氧损伤的最佳细胞模型,也为抗缺氧损伤药物研究提供了最佳的细胞模型。
| [1] | ZHENG L, KELLY C J, COLGAN S P. Physiologic hypoxia and oxygen homeostasis in the healthy intestine. A review in the theme: cellular responses to hypoxia[J]. Am J Physiol Cell Physiol, 2015, 309(6): C350–C360. DOI:10.1152/ajpcell.00191.2015 |
| [2] | LI H, YIN A, CHENG Z, et al. Attenuation of Na/K-ATPase/Src/ROS amplification signal pathway with pNaktide ameliorates myocardial ischemia-reperfusion injury[J]. Int J Biol Macromol, 2018, 118. DOI:10.1016/j.ijbiomac.2018.07.001 |
| [3] | CHEN C Y, YI L, JIN X, et al. Delphinidin attenuates stress injury induced by oxidized low-densitylipoprotein in human umbilical vein endothelial cells[J]. Chem Biol Interact, 2010, 183(1): 105–112. DOI:10.1016/j.cbi.2009.09.024 |
| [4] | LI Y, QIU L, LIU X, et al. PINK1 alleviates myocardial hypoxia-reoxygenation injury by ameliorating mitochondrial dysfunction[J]. Biochem Biophys Res Commun, 2017, 484(1): 118–124. DOI:10.1016/j.bbrc.2017.01.061 |
| [5] | BURTSCHER M, GATTERER H, BURTSCHER J, et al. Extreme terrestrial environments: life in thermal stress and hypoxia. A narrative review[J]. Front Physiol, 2018, 9: 572. DOI:10.3389/fphys.2018.00572 |
| [6] |
高伊星.胶质瘤缺氧转录与代谢表征的生物意义和肺癌IF1表达的临床意义[D].重庆: 第三军医大学, 2016.
GAO Y X. The biological significance of transcriptive and metabolic features in hypoxic glioblastoma cells and clinical value of IF1 expression in lung cancer[D]. Chongqing: Third Military Medical University, 2016. |
| [7] |
王伟.丁苯酞预处理对脑缺血再灌注海马神经元的保护作用[D].承德: 承德医学院, 2013.
WANG W. Protective effects of 3-n-butylphthalide pretreatment on hippocampal neurons of cerebral ischemia reperfusion in rats[D]. Chengde: Chengde Medical College, 2013. |
| [8] |
黄秀景.丁苯酞后处理对局灶性脑缺血再灌注损伤大鼠内质网应激的影响[D].天津: 天津医科大学, 2013.
HUANG X J. Effect of butylphthalide after treatment on the endoplasmic reticulum stress in focal cerebral ischemia reperfusion injury in rats[D]. Tianjin: Tianjin Medical University, 2013. |
| [9] |
刘沛, 王延晓, 葛朝明. 红景天苷对急性脑梗死患者的相关性研究[J].
中国医学创新, 2013, 10(8): 148–150.
LIU P, WANG Y X, GE C M. Correlative study of salidroside in patients with acute cerebral infarction[J]. Med Innovation China, 2013, 10(8): 148–150. DOI:10.3969/j.issn.1674-4985.2013.08.092 |



