棘球蚴病,俗称包虫病,是细粒棘球绦虫的幼虫棘球蚴寄生在动物及人的肝、肺等脏器引起的人畜共患寄生虫病[1-4],主要分布于世界上畜牧业发达但卫生条件相对较差的地区[5-9]。中国是受包虫病危害最严重国家之一[10-11],囊型与泡型包虫病都有流行[12],但主要是囊型包虫病[13],防治研究有待加强。
为了进行包虫病研究,多数实验室是在牧区羊群屠宰季节采集感染包虫的羊肝,分离棘球蚴标本进行相关研究。有些实验室则建立棘球蚴病动物模型,包括棘球蚴原发感染模型[14-15]、棘球蚴继发感染模型[16],以保证足量标本满足研究所需。目前国内外学者已成功建立了大鼠、小鼠、沙鼠等棘球蚴感染动物模型,为研究棘球蚴在宿主体内的病程进展及相关机制提供了条件。但是,建立棘球蚴病动物模型耗费时间周期长,还不能直接观察棘球蚴的发育过程。
棘球蚴的体外培养模型具有周期短、可直接观察棘球蚴的发育过程、可用于直接评价药物疗效等优点,常用于棘球蚴病致病机制、免疫诊断、抗棘球蚴新药筛选及棘球蚴细胞生物学研究等实验研究中。但是,棘球蚴体外培养较困难,棘球蚴成囊时间长,存活率低,成囊率低,耗费大。目前的关于棘球蚴体外培养的报告中,包括采用RPMI1640单相培养液体外培养棘球蚴[17],探索棘球蚴体外长期培养的最佳虫体密度及培养体系[18],以及观察体外培养的原头蚴成囊率变化[19-20]。除了研究补充剂和培养密度[18]、培养基[19-20]、不同温度对培养棘球蚴的影响作用外,还研究了不同饲养细胞与多房棘球蚴共培养的效果[21-25],如利用肝癌细胞(Bel-7404)[21]、鼠肝细胞[23-25]作为饲养细胞来促进多房棘球蚴的生长。
本文对有关文献[17, 19-20, 26]方法进行修改,采用单相液体为培养基、血清为营养、人肝细胞株L02为饲养细胞,试图建立经济高效的可长期培养棘球蚴的体外培养体系,观察不同培养体系下原头蚴发育为棘球蚴过程中成囊变化,为相关研究提供棘球蚴材料。
1 材料与方法 1.1 材料 1.1.1 实验材料及仪器材料:感染细粒棘球蚴的羊肝采自新疆乌鲁木齐某屠宰场,正常人肝细胞株L02系本实验室保种细胞。仪器:不锈钢滤网(200 μm),CO2恒温培养箱(Thermo,美国),超净工作台(上海博迅实业有限公司),光学显微镜(Olympus,日本),电热恒温水浴锅(北京长源实验设备厂),微量移液器(北京鼎国生物科技公司),台式高速离心机(Sigma,美国)。
1.1.2 主要试剂分别为DMEM高糖培养基(HyClone,美国),RPMI1640高糖培养基(HyClone,美国),胎牛血清(四季青,浙江),绵羊血清(Solarbio,北京),青/链霉素(HyClone,美国),胃蛋白酶(Sigma,美国),台盼蓝(鼎国,北京),0.25% EDTA(Genview,美国),PBS(鼎国,北京)。
1.2 实验方法 1.2.1 细胞系及培养条件 1.2.1.1 正常人肝细胞株L02的复苏从液氨罐中取出肝细胞株L02,放入37℃温水中尽快融化;无菌条件下吸出细胞悬液,加入10倍培养液混匀;置于高速离心机中,1 000 r/min离心5 min;弃上清,加入培养液重悬细胞;计数后,调整细胞密度,接种于细胞培养瓶;在37℃,5% CO2培养箱中培养;次日更换1次培养液,继续培养。
1.2.1.2 正常人肝细胞株L02的传代无菌条件下,吸除旧培养基,加入3 mL PBS清洗细胞表面3次;加入2 mL 0.25% EDTA消化液,置于37 ℃,5% CO2培养箱中消化1 min,待细胞间质回缩,细胞间隙清晰;加入含有10%胎牛血清或绵羊血清的培养液3 mL,重悬细胞,置于高速机中,1 000 r/min离心5 min;弃上清加入3 mL含胎牛血清或绵羊血清的培养基重悬细胞,分装至新的培养瓶。
1.2.2 配置不同体系的培养基根据培养基、血清的种类(杭州四季青优级胎牛血清、北京Solarbio绵羊血清)、正常人肝细胞株L02,将培养体系分为2大类(6个组)。培养基的配置参照LIU[18]的研究方法,配伍均为89%基础培养基,10%血清,1%青-链霉素,具体分组见表 1。
| 组别 | RPMI1640体系 | 组别 | DMEM体系 |
| A | RPMI1640+胎牛血清 | D | DMEM+胎牛血清 |
| B | RPMI1640+胎牛血清+肝细胞株L02 | E | DMEM+胎牛血清+肝细胞株L02 |
| C | RPMI1640+绵羊血清+肝细胞株L02 | F | DMEM+绵羊血清+肝细胞株L02 |
1.2.3 原头蚴的收集与处理
将感染细粒棘球蚴的羊肝在流水及三蒸水中各洗3次,浸入75%乙醇中10 s后迅速取出;无菌条件下收集原头蚴囊液沉淀和内囊壁上的原头蚴;用200 μm的不锈钢滤网过滤2次,收集沉淀于50 mL离心管中;用1%胃蛋白酶消化液(pH=2.1)37℃水浴,消化30 min(每隔5 min上下颠倒混匀,使棘球蚴充分消化);用含1%青-链霉的PBS清洗15次,细粒棘球蚴自然沉淀后待用。
1.2.4 原头蚴的单相培养取0.5 mL原头蚴混悬液用0.4%台盼蓝染色,在倒置显微镜下计数(计数3张玻片取平均值),活力>95%可用于体外培养,计算总数。以每个培养瓶(50 mL)/20 000个原头蚴的密度体外培养,分别加入25 mL不同体系的培养液。置于37℃,5% CO2培养箱中培养,每2~3天更换1次培养液体(每组更换时间保持一致),若培养基颜色变黄及时更换新培养基。
1.2.5 观察原头蚴状况观察不同培养体系中各时间点的原头蚴头节外翻数量、成囊数量及囊泡大小情况。在0、5、10、15、20、25、30、35、40、45 d各时间点,取0.5 mL培养物经0.4%台盼蓝染色,在光学显微镜下拍照,倒置显微镜下计数头节外翻数、成囊数、总数,测量囊大小(囊大小为100 μL悬液中每张玻片20个棘球蚴囊直径的平均值,重复3次,计算3张玻片平均值);计算头节外翻率(头节外翻率为100 μL悬液中每张玻片所有头节外翻棘球蚴数量/100 μL悬液中每张玻片原头蚴总数×100%,重复3次,计算平均值);计算棘球蚴成囊率(成囊率为100 μL悬液中每张玻片所有成囊棘球蚴数量/100 μL悬液中每张玻片原头蚴总数×100%,重复3次,计算平均值)。
1.2.6 观察在优化的培养体系中棘球蚴成囊状况在37 ℃,5%CO2培养箱中继续培养棘球蚴,每2~3天更换1次培养基,若培养基颜色变黄及时更换新培养基。在45~180 d中,每隔10天取0.5 mL棘球蚴混悬液经0.4%台盼蓝染色,在光学显微镜下观察囊的形态学变化并拍照,在倒置显微镜下测量囊大小(囊大小为100 μL悬液中每张玻片20个棘球蚴囊直径的平均值,重复3次,计算3张玻片平均值)。
1.3 统计学方法实验数据采用SPSS 19.0软件进行分析,计量资料采用x±s表示,多组间组内各时间点比较采用重复测量的多因素方差分析,均数间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果 2.1 不同培养体系中各时间点原头蚴形态学观察 2.1.1 培养45 d的原头蚴形态学观察原头蚴在光学显微镜的形态学观察见图 1所示,刚从羊肝分离出来的原头蚴呈椭圆或者冬瓜状,大小均匀、头节未翻出,伸缩蠕动明显,部分原头蚴头节外翻,50倍下可见虫体内钙颗粒,未见原头蚴成囊;第10天时,不同培养体系下均可见部分原头蚴顶突和吸盘翻出,体节变大,成囊状,外形呈比较规整的圆形,头节小钩向虫体中间移动,以原头蚴直径为标准进行比较,DMEM培养体系培养的原头蚴直径大于RPMI1640培养体系培养的原头蚴;第20天时,原头蚴成囊数较之前明显增加,头部变大,体内钙颗粒减少,头节外翻及成囊前期原头蚴较多,原头蚴头节小钩向虫体中央移动,顶突消失;第30天时,成囊的原头蚴可见角质层边缘,肥大且透明,体内钙颗粒逐渐消失;第40天时,原头蚴体积增大明显,外形呈透明气球状,微囊开始形成;第45天时,DMEM体系的E组(DMEM+胎牛血清1+肝细胞株L02)中原头蚴成囊率为100%,外形呈泡状结构,光镜下可见透明的角质层边缘,肉眼下可见透明微小囊,其余各组均可见未成囊原头蚴,大多原头蚴处于头节外翻和成囊前期,成囊前期的原头蚴呈囊状,但虫体内的顶突小钩或4个吸盘未完全退化或消失,见图 2。另外,在有肝细胞培养体系中的原头蚴成囊过程可见原头蚴尾部有透明的泡状结构,随着培养时间的增加而逐渐成囊,透明囊消失。
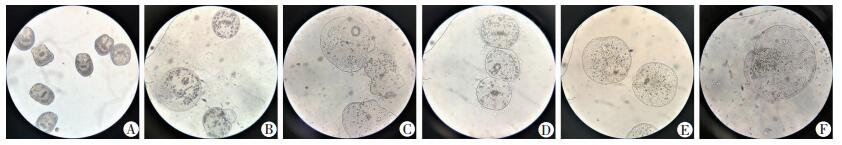
|
| A: 0 d; B: 10 d; C: 20 d; D: 30 d; E: 40 d; F: 45 d 图 1 各时间点的原头蚴成囊情况 (×50) |
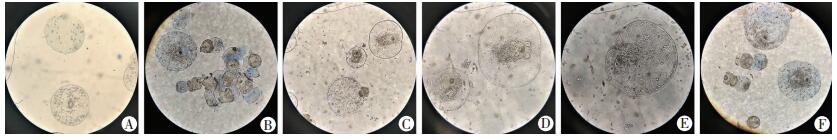
|
| A~F:分别为A~F组 图 2 各培养组第45天的原头蚴形态观察 (×50) |
2.1.2 45~180 d的原头蚴形态变化
根据0~45 d的培养基配伍实验筛选出E组(DMEM+胎牛血清+肝细胞株L02)为最佳培养体系,持续观察其后的46~180 d时间内原头蚴形态变化,发现随着培养时间的延长,成囊后原头蚴外形无明显变化,均成囊状,囊逐渐增大,肉眼可见透明囊逐渐增大,囊液不断增多。体外培养80 d后,光镜下可见囊内无钙颗粒、头节、小钩等,边缘可见透明的角质层,囊内无原头蚴产生,肉眼可见透明微小囊,见图 3。
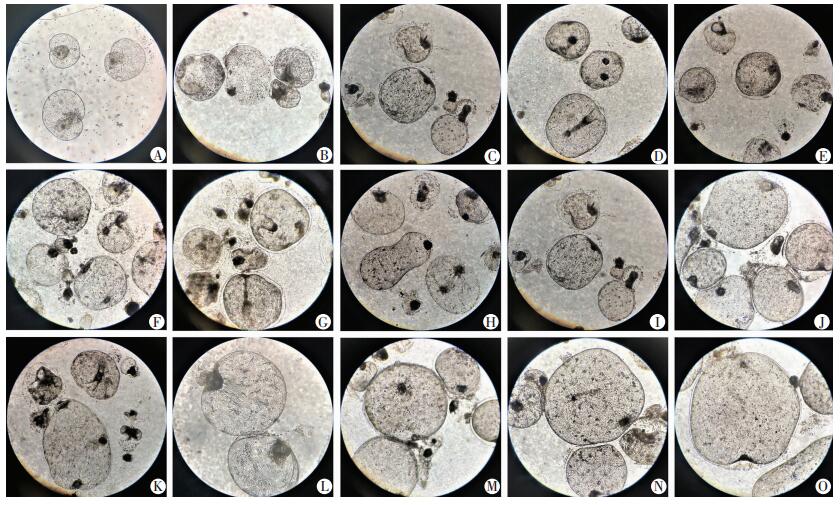
|
| A:46 d;B: 50 d; C:60 d;D:70 d;E:80 d;F:90 d;G:100 d;H:110 d;I:120 d;J:130 d;K:140 d;L:150 d;M:160 d;N:170 d;O:180 d 图 3 E组原头蚴46~180 d的成囊动态观察 (×20) |
2.2 各培养组的原头蚴成囊率
各培养组的原头蚴成囊率统计结果见表 2。结果表明,在DMEM体系E组中,第45天时原头蚴成囊率达到100%,其次是D组、F组。其余培养组的成囊率为(32.83±2.70)%~(44.16±2.32)%。自第20天以后,E组的原头蚴成囊率高于其他组。在6个组的原头蚴成囊率比较中,E组成囊率明显高于其他组,采用重复测量的多因素方差分析,各组差别有统计学意义(F=196.984,P < 0.01),培养不同时间有统计学差异(F=615.934,P < 0.01),不同时间各培养体系存在交互效应(F=23.769,P < 0.01),说明E组是最优方案。
| 组别 | 5 d | 10 d | 15 d | 20 d | 25 d | 30 d | 35 d | 40 d | 45 d |
| A组 | 3.17±0.68 | 3.74±0.78 | 4.03±1.83 | 9.43±4.78a | 18.27±4.44a | 23.50±5.01 | 32.52±1.80a | 38.06±0.96a | 43.48±3.53a |
| B组 | 1.53±0.36 | 1.53±1.37a | 6.31±3.38a | 9.88±0.11a | 11.48±0.13 | 17.17±0.23a | 23.17±0.11a | 27.70±0.44a | 32.83±2.70a |
| C组 | 0.78±0.50 | 2.25±0.89a | 10.02±1.87a | 13.89±3.09 | 18.71±3.19 | 23.81±11.96 | 30.58±1.82 | 37.03±0.60 | 44.16±2.32 |
| D组 | 1.04±0.83ab | 4.51±0.56 | 8.85±2.31 | 16.74±5.28a | 28.37±4.68a | 31.82±4.21 | 31.75±4.30 | 39.05±0.25a | 56.45±0.85ab |
| E组 | 1.06±0.67 | 3.99±1.45a | 11.37±0.79a | 34.72±3.88ac | 38.98±3.37c | 40.40±2.04ac | 56.37±1.30ac | 81.33±5.55ac | 100.00±0.00ac |
| F组 | 0.94±0.24 | 1.39±0.38 | 3.37±1.31ad | 8.89±3.47a | 17.40±6.55a | 19.83±0.52 | 22.81±2.79d | 25.63±1.83a | 44.70±3.13a |
| a:P < 0.05,同培养组内各时间点两两比较;b:P < 0.05,与A组比较;c:P < 0.05,与B组比较;d:P < 0.05,与C组比较 | |||||||||
2.3 各培养组的棘球蚴囊泡大小比较
各培养组内原头蚴形成的棘球蚴囊泡大小统计结果见表 3。结果表明,在E组中,至第45天时囊泡达到最大;其次是D组以及A组的囊泡直径。其余组的囊泡直径为(0.255±0.010)~(0.315±0.014)mm。自第25天以后,E组的囊泡直径大于其他组。比较6组培养组的囊泡大小,E组囊泡大小明显高于其他组,采用重复测量的多因素方差分析,各组差别有统计学意义(F=16.608,P < 0.01),培养不同时间有统计学差异(F=107.018,P < 0.01),培养不同时间与各培养体系存在交互效应(F=7.739,P < 0.01),说明E组是最优方案。
| 组别 | 5 d | 10 d | 15 d | 20 d | 25 d | 30 d | 35 d | 40 d | 45 d |
| A组 | 0.204±0.008a | 0.220±0.008 | 0.200±0.025 | 0.240±0.017 | 0.240±0.023 | 0.255±0.060 | 0.294±0.010a | 0.305±0.021 | 0.319±0.004 |
| B组 | 0.192±0.010a | 0.195±0.025 | 0.231±0.009 | 0.221±0.017 | 0.221±0.010 | 0.245±0.010a | 0.242±0.035 | 0.246±0.017 | 0.255±0.010 |
| C组 | 0.174±0.041a | 0.189±0.016 | 0.227±0.006 | 0.267±0.013a | 0.276±0.040 | 0.293±0.034a | 0.294±0.023 | 0.308±0.014 | 0.315±0.014 |
| D组 | 0.160±0.017ab | 0.193±0.005ab | 0.201±0.018 | 0.218±0.008 | 0.226±0.012 | 0.290±0.039a | 0.256±0.010ab | 0.309±0.022 | 0.337±0.008ab |
| E组 | 0.175±0.005a | 0.191±0.002 | 0.192±0.003c | 0.261±0.028a | 0.295±0.020c | 0.330±0.037ac | 0.376±0.029ac | 0.397±0.022c | 0.470±0.038ac |
| F组 | 0.208±0.013 | 0.179±0.013a | 0.230±0.034 | 0.228±0.020ad | 0.262±0.024 | 0.252±0.021 | 0.259±0.017 | 0.247±0.008d | 0.286±0.006ad |
| a:P < 0.05,同培养组内各时间点两两比较;b:P < 0.05,与A组比较;c:P < 0.05,与B组比较;d:P < 0.05,与C组比较 | |||||||||
2.4 各培养组的原头蚴头节外翻率
各培养组的原头蚴头节外翻的数量见表 4。结果表明,DMEM体系中E组在第45天时原头蚴头节外翻率为0,说明原头蚴全部成囊,其次是F组及A组,其余组原头蚴头节外翻率为(7.00±1.75)%~(15.73± 2.61)%,随着培养时间的增加,各组的头节外翻数量均在下降。在未成囊的原头蚴中,头节小钩均向虫体中央移动,未见明显的成囊结构,仍可见4个吸盘的轮廓。因此,该形状的原头蚴不计入成囊数或头节外翻数中。
| 组别 | 5 d | 10 d | 15 d | 20 d | 25 d | 30 d | 35 d | 40 d | 45 d |
| A组 | 73.78±0.64a | 34.03±1.63a | 20.48±1.06 | 18.52±1.32 | 20.80±2.25a | 16.15±3.66a | 11.24±2.07 | 10.75±1.55a | 6.63±1.48a |
| B组 | 52.30±0.60a | 30.55±1.09 | 29.31±2.17 | 30.84±1.80 | 26.26±1.68a | 26.60±2.59 | 19.59±9.26 | 16.71±2.15 | 15.73±2.61a |
| C组 | 73.42±4.58a | 35.71±1.31 | 32.90±2.63a | 22.36±2.19a | 14.75±1.67a | 9.05±0.82 | 9.09±0.72 | 8.55±1.00 | 7.00±1.75a |
| D组 | 53.75±3.07ab | 47.97±1.83ab | 41.14±0.90ab | 36.01±2.49ab | 31.57±1.55b | 29.65±0.61b | 29.31±1.13ab | 23.41±1.60ab | 13.67±0.63ab |
| E组 | 45.13±2.76ac | 27.12±0.17ac | 21.43±0.73c | 19.39±2.16ac | 19.61±1.65c | 7.89±0.67ac | 4.77±1.60a | 1.34±0.42c | 0.00±0.00ac |
| F组 | 64.55±5.11a | 45.79±6.01ad | 19.44±2.55ad | 11.01±1.15ad | 8.93±1.30d | 6.34±1.54 | 3.71±0.99d | 2.95±0.43d | 2.76±0.46ad |
| a:P < 0.05,同培养组内各时间点两两比较;b:P < 0.05,与A组比较;c:P < 0.05,与B组比较;d:P < 0.05,与C组比较 | |||||||||
6组培养体系得到的头节外翻率,E组明显低于其他组,采用重复测量的多因素方差分析,各组差别有统计学意义(F=196.894,P < 0.01),培养不同时间有统计学差异(F=615.934,P < 0.01),培养不同时间与各培养体系存在交互效应(F=23.769,P < 0.01),说明E组是最优方案。可以确定DMEM培养体系中的E组(DMEM+胎牛血清+肝细胞株L02)为筛选的原头蚴成囊的最佳培养体系。
2.5 DMEM+胎牛血清+肝细胞株L02组原头蚴囊大小生长曲线以筛选出的DMEM培养体系中的E组(DMEM+胎牛血清+肝细胞株L02)的原头蚴在180 d内的生长情况绘制原头蚴囊泡生长曲线,见图 4。0~50 d期间,成囊数逐渐增加,头节外翻数减少,囊泡逐渐增大;51~150 d,原头蚴增长缓慢;在150 d后,囊泡持续增大,增长速度较快。所得囊泡大小数据采用单因素方差分析,差异具有统计学意义(F=121.636,P < 0.01)。
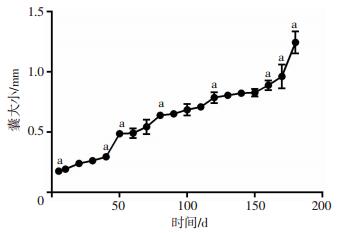
|
| a:P < 0.05,组内各时间点两两比较 图 4 DMEM+胎牛血清+肝细胞株L02组的原头蚴生长曲线 |
3 讨论
棘球绦虫的生活史复杂,需要犬科动物作终宿主,牛羊等食草动物为中间宿主。棘球绦虫成虫寄生在犬科动物小肠,带有虫卵的犬粪污染牧草,虫卵随牧草被牛羊等食草动物食入,从卵内释放的六钩蚴随血流到达牛羊肝肺等内脏则发育为棘球蚴;带有棘球蚴的牛羊肝肺等内脏若被犬吞食后,棘球蚴含有的大量原头蚴在犬小肠释放出来,原头蚴发育为成虫。人因为误食虫卵而患棘球蚴病,俗称包虫病。在棘球蚴病实验室研究中,可将原头蚴接种小鼠等实验动物建立棘球蚴感染动物模型[16, 27]得到棘球蚴囊泡标本,但该方法存在实验周期长的问题。以原头蚴体外培养棘球蚴获取囊泡的方法则具有生长周期短、生长条件可控等优点,通过体外培养,可以最大限度地模拟棘球蚴在宿主体内的生存环境完成生活史中的部分生长发育阶段[28],用于棘球蚴病的研究。
棘球绦虫的幼虫原头蚴具有双向发育的特征,幼虫经犬食入后,在犬肠道中发育为成虫。但是,中间宿主体内棘球蚴若是破裂,或者是在手术过程中破裂漏液,其中的原头蚴散落出来则在中间宿主体内发育为继发棘球蚴[29]。犬胆汁是原头蚴分化为成虫的一个重要培养条件,其主要成分为胆汁酸,在原头蚴向成虫的发育过程中,胆汁酸具有重要作用[30],且细粒棘球绦虫可表达胆汁酸受体及转运蛋白来激发相关的信号通路[10]。在ZHENG等[31]的研究中也预测到了细粒棘球绦虫专门运输胆汁酸盐的蛋白基因和与胆汁酸盐基因作用的靶蛋白基因。加入犬胆汁的原头蚴向成虫发育,无犬胆汁的原头蚴则发育为棘球蚴囊泡。在对华支睾吸虫研究中发现胆汁能够激活胃肠道寄生虫的代谢通路并增加肝吸虫的运动性,是重要激活剂之一,但其具体的作用机制尚不清楚,目前认为是诱导了非特异性刺激而导致的肌肉运动[32]。
在棘球蚴体外培养模型的建立中,ZHANG等[17]采用RPMI1640单相培养液体外培养细粒棘球蚴,在第56天仅有10%的原头蚴发育成囊。在本研究的棘球蚴培养过程中,RPMI1640体系培养基中酚红指示剂变黄较快,相同培养天数相比,RPMI1640体系培养基较黄。培养至45 d时,结果显示除了RPMI1640体系中的C组平均囊大小比DMEM体系中F组大0.029 mm (P < 0.05),其余各组培养体系下,基础培养基为DMEM体系的原头蚴均比RPMI体系的成囊大且成囊率高(P < 0.05),说明DMEM培养基是最优培养基。推测可能是DMEM培养基的培养环境更为稳定,DMEM比RPMI1640更适合棘球蚴的生长。
血清是体外培养的棘球蚴囊泡生长发育所需的主要营养来源,血清的添加可以促进棘球蚴向成囊方向发育。王慧等[33]对棘球蚴囊泡中囊液进行的蛋白质组学研究结果显示,共鉴定出39个牛血清相关蛋白,表明这些牛血清相关蛋白可能是棘球蚴生长发育所必需的营养物质。这与袁丽英等[19-20]的结果相一致,其采用含10%小牛血清的RPMI1640单相培养液体外培养细粒棘球蚴最优,在35~40 d成囊率为90%,成囊率远高于ZHANG等[17]的报告。我们推测含胎牛血清的培养基可能是提供了虫体生长发育所需的某些必需营养成分或促生长因子,也与本研究结果一致,添加胎牛血清的原头蚴成囊率更高,且囊泡大小更大。说明在囊液中鉴定到的牛血清相关蛋白,对于维持虫体正常的生长发育具有重要意义,但具体机制仍需进一步研究。
孙萃萍[22]使用HepG2细胞株与泡球蚴共培养,并对比了小鼠血清、马血清与胎牛血清的成囊发育变化,发现小鼠血清培养的囊泡虽然体积偏小,但在发育程度更优,为含有角皮层和生发层的成熟囊泡,而其他均未成囊,作者推测其原因可能是因为有蹄类动物更适合于细粒棘球蚴的寄生,而啮齿类动物更适合泡球蚴寄生。由于绵羊是棘球蚴的主要中间宿主,本研究专门设计了添加绵羊血清组,观察主要中间宿主绵羊血清是否能促进棘球蚴的生长。但是,本研究结果显示用胎牛血清来培养棘球蚴的效果更好,在体外培养前45 d,DMEM体系中E组(DMEM+胎牛血清+肝细胞株L02)成囊率最高(P < 0.01),且囊大小最大,远远高于其他培养体系(P < 0.01)。与已有研究[13-14]结果相比,含胎牛血清的培养体系至少能将棘球蚴培养至180 d,成囊率为100%,且生长状态良好,随着培养时间的延长,囊外形特征无明显变化,囊逐渐增大,囊液增多,体内无继发原头节产生,能达到有关文献报道的结果[16-18]。
对比原头蚴在添加2种血清的基础培养基中45 d生长发育情况,发现在DMEM基础培养基中,原头蚴在均添加正常人肝细胞株L02作为饲养细胞的条件下,E组和F组的成囊率分别为100%,44.70%(P < 0.01),囊泡大小平均值分别为0.470、0.286 mm(P < 0.01),说明在DMEM基础培养基中,在均加入肝细胞株L02的情况下,胎牛血清能促进棘球蚴成囊发育,与SMYTH等[26]结果有一致之处;在不同种属中(胎牛血清和绵羊血清)绵羊血清的成囊数和囊大小最低,虽然棘球蚴主要感染绵羊,是棘球蚴的重要中间宿主,但绵羊血清未显示出有助于成囊发育优势。本研究所用的胎牛血清采自健康母牛的出生前胎牛,绵羊血清系成年绵羊血清;2种血清在质检报告中显示,均为经过无菌采集,去内毒素,无支原体处理,各项检测指标均达标,但两者仍有很大差异。
在原头蚴形成棘球蚴的体外培养180 d过程中,发现棘球蚴生长的速度与换液时间有一定关系,每次更换培养基后,棘球蚴的生长更优。因此,为保持实验的一致性,固定更换培养基上清时间间隔为2~3 d/次。在起初的45 d,原头蚴迅速向囊泡发育,在第50天时最小囊直径为0.16 mm,最大囊直径为0.78 mm,囊平均直径增长0.311 mm。形态学上,由椭圆或冬瓜状向微小囊发育,成囊过程中原头蚴头节外翻伸缩蠕动明显,活力好,台盼蓝拒染,高倍镜下可见明显钙颗粒,随着培养时间延长,头节外翻数量由增多到慢慢降低,头节、小钩、吸盘逐渐退化消失,呈透明囊状;在50~150 d,原头蚴生长发育增长缓慢;在100 d时,最小囊直径为0.16 mm;最大囊直径为1.52 mm,囊平均直径增长0.199 mm,说明囊的生长发育在体外培养50 d后比较稳定,其外形无明显变化,微小囊泡逐渐增大;约在80 d时,肉眼可看到透明微小囊泡,随着培养时间增加,囊泡增大,囊液增多。在150 d以后,囊持续增大,且增长速度较快,最小囊直径为0.60 mm,最大囊直径为2.2 mm,到180 d时,囊平均直径平均增长0.416 mm,说明在体外培养150 d后囊泡生长发育较好,且在筛选出来的培养基中可继续培养长大。
泡球蚴的体外培养研究报告显示可以利用鼠肝细胞与泡球蚴共培养能促进泡球蚴的生长发育[21-23]。马海龙[21]采用了肝癌细胞(Bel-7404)及其上清液,与泡球蚴共培养,发现细胞上清液建立的体外培养模型具有一定的可行性,而非依赖于细胞本身。由于棘球蚴与泡球蚴均具有亲器官性,寄生部位主要在中间宿主的肝脏,因此一般选用肝细胞或肝癌细胞作为饲养细胞[19-23]。本研究在细粒棘球蚴的体外培养中添加正常人肝细胞株L02,尝试其是否具有促进细粒棘球蚴生长发育的作用。在添加饲养细胞(正常人肝细胞株L02)的培养体系中,DMEM体系中的原头蚴成囊率及囊大小均高于未加饲养细胞的培养体系,成囊率上E组较D组高43.55%,平均囊大小大0.133 mm。RPMI1640体系中,成囊率A组较B组高10.65%,囊大0.064 mm。各组的成囊率及囊泡大小,差别具有统计学意义(P < 0.05),说明加入正常人肝细胞株L02的培养液具有促进棘球蚴发育成囊的作用。究其原因,除了DMEM培养基可能更适合棘球蚴的生长外,肝细胞可能分泌了促进囊泡生长发育的因子,协同促进棘球蚴的生长发育及成囊生长。此外,还发现在添加肝细胞株L02的培养液中,原头蚴在向囊发育的过程中,其尾部有透明的泡状结构生长出,随着培养时间的延长,原头蚴向囊发育,尾部透明囊消失,显示肝细胞株L02在棘球蚴成囊的过程中可能分泌某些细胞因子促进棘球蚴的生长发育变化,具体机制需要再进一步研究。
总之,在本研究筛选的最优培养基配伍(DMEM基础培养基+胎牛血清+正常人肝细胞株L02)中细粒棘球绦虫原头蚴容易形成棘球蚴,而且棘球蚴可持续长大。本研究建立的相关培养方法在棘球蚴体外发育研究及抗包虫药物的体外筛选实验中将得到应用和验证。
| [1] |
温浩, 徐明谦. 实用包虫病学[M]. 北京: 科学出版社, 2007: 1.
WEN H, XU M Q. Practical hydatidiology[M]. Beijing: Science Press, 2007: 1. |
| [2] | OZDOL C, YILDIRIM A E, DAGLIOGLU E, et al. Alveolar hydatid cyst mimicking cerebellar metastatic tumor[J]. Surg Neurol Int, 2011, 2: 13. DOI:10.4103/2152-7806.76281 |
| [3] | ALGROS M P, MAJO F, BRESSON-HADNI S, et al. Intra cerebral alveolar echinococcosis[J]. Infection, 2003, 31(1): 63–65. DOI:10.1007/s15010-002-2178-y |
| [4] | MANDAL S, MANDAL M D. Human cystic echinococcosis: epidemiologic, zoonotic, clinical, diagnostic and therapeutic aspects[J]. Asian Pac J Trop Med, 2012, 5(4): 253–260. DOI:10.1016/S1995-7645(12)60035-2 |
| [5] |
张梦媛, 伍卫平, 官亚宜, 等. 我国棘球蚴病疾病负担分析[J].
中国寄生虫学与寄生虫病杂志, 2018, 36(1): 15–19.
ZHANG M Y, WU W P, GUAN Y Y, et al. Analysis on disease burden of hydatid disease in China[J]. Chin J Parasitol Parasit Dis, 2018, 36(1): 15–19. |
| [6] | BUDKE C M, DEPLAZES P, TORGERSON P R. Global socioeconomic impact of cystic echinococcosis[J]. Emerging Infect Dis, 2006, 12(2): 296–303. DOI:10.3201/eid1202.050499 |
| [7] |
尚婧晔, 张光葭, 何伟, 等. 细粒棘球蚴病病原分类学与分子流行病学研究进展[J].
中国寄生虫学与寄生虫病杂志, 2018, 36(2): 166–173.
SHANG J Y, ZHANG G J, HE W, et al. Taxonomy and molecular epidemiology of Echinococcus granulosus complex causing cystic echinococcosis[J]. Chin J Parasitol Parasit Dis, 2018, 36(2): 166–173. |
| [8] | GROSSO G, GRUTTADAURIA S, BIONDI A, et al. Worldwide epidemiology of liver hydatidosis including the Mediterranean area[J]. World J Gastroenterol, 2012, 18(13): 1425–1437. DOI:10.3748/wjg.v18.i13.1425 |
| [9] |
徐硕, 党志胜, 张皓冰, 等. 棘球蚴病药物治疗的研究进展[J].
中国寄生虫学与寄生虫病杂志, 2018, 36(3): 297–302.
XU S, DANG Z S, ZHANG H B, et al. Research progress on drug treatment for hydatidosis[J]. Chin J Parasitol Parasit Dis, 2018, 36(3): 297–302. |
| [10] |
温浩, 吐尔干艾力·阿吉, 邵英梅, 等. 棘球蚴病防治成就及面临的挑战[J].
中国寄生虫学与寄生虫病杂志, 2015, 33(6): 466–471.
WEN H, TUERGANAILI A J, SHAO Y M, et al. Research achievemets and challenges for echinococcosis control[J]. Chin J Parasitol Prasit Dis, 2015, 33(6): 466–471. |
| [11] |
周璇, 夏党荣, 赵新斐, 等. 棘球蚴病研究进展[J].
中国动物保健, 2014, 16(11): 7–10.
ZHOU X, XIA D R, ZHAO X F, et al. Study progress of echinococcosis[J]. China Ani Health, 2014, 16(11): 7–10. DOI:10.3969/j.issn.1008-4754.2014.11.004 |
| [12] |
伍卫平, 王虎, 王谦, 等. 2012-2016年中国棘球蚴病抽样调查分析[J].
中国寄生虫学与寄生虫病杂志, 2018, 36(1): 1–14.
WU W P, WANG H, WANG Q, et al. A nationwide sampling survey on echinococcosis in China during 2012-2016[J]. Chin J Parasitol Parasit Dis, 2018, 36(1): 1–14. |
| [13] |
孙艳红, 杨亚明. 包虫病的治疗研究进展[J].
热带病与寄生虫学, 2015, 13(1): 53–58.
SUN Y H, YANG Y M. Advances in the treatment of echinococcosis[J]. J Trop Dis Parasit, 2015, 13(1): 53–58. DOI:10.3969/j.issn.1672-2302.2015.01.017 |
| [14] | GOTTSTEIN B, FELLEISEN R. Protective immune mechanisms against the metacestode of Echinococcus multilocularis[J]. Parasitol Today(Regul Ed), 1995, 11(9): 320–326. DOI:10.1016/0169-4758(95)80184-7 |
| [15] | ELISSONDO M C, DOPCHIZ M C, BRASESCO M, et al. Echinococcus granulosus: first report of microcysts formation from protoscoleces of cattle origin using the in vitro vesicular culture technique[J]. Parasite, 2004, 11(4): 415–418. DOI:10.1051/parasite/2004114415 |
| [16] |
王慧, 李军, 郭宝平, 等. 微囊法棘球蚴继发感染小鼠动物模型的建立[J].
中国人兽共患病学报, 2016, 32(9): 784–788.
WANG H, LI J, GUO B P, et al. Establishment of secondary hydatid disease infection in mice with cystic and alveolar Echinococcus cysts cultured in vitro[J]. Chin J Zoonoses, 2016, 32(9): 784–788. DOI:10.3969/j.issn.1002-2694.2016.09.004 |
| [17] | ZHANG W B, JONES M K, LI J, et al. Echinococcus granulosus: pre-culture of protoscoleces in vitro significantly increases development and viability of secondary hydatid cysts in mice[J]. Exp Parasitol, 2005, 110(1): 88–90. DOI:10.1016/j.exppara.2005.02.003 |
| [18] | LIU C S, ZHANG H B, YIN J H, et al. Echinococcus granulosus: suitable in vitro protoscolices culture density[J]. Biomed Environ Sci, 2013, 26(11): 912–915. DOI:10.3967/bes2013.020 |
| [19] |
袁丽英, 张壮志, 石保新, 等. 细粒棘球绦虫-原头蚴在两种细胞培养液中体外培养的初步观察[J].
畜牧兽医杂志, 2008, 27(5): 16–18.
YUAN L Y, ZHANG Z Z, SHI B X, et al. In vitro cultivation protoscoleces of the protoslices of Echinococcus granulosus in medium RPMI-1640 and MEM[J]. J Ani Sci Vet Med, 2008, 27(5): 16–18. |
| [20] |
袁丽英, 张壮志, 石保新, 等. 细粒棘球蚴-原头蚴体外培养成囊模型的建立[J].
畜牧与兽医, 2009, 41(7): 29–31.
YUAN L Y, Zhang Z Z, Shi B X, et al. Establishment of the in vitro cultivation model of protoscolex of Echinococcus cyst[J]. Ani Husbandry Veter Med, 2009, 41(7): 29–31. |
| [21] |
马海龙, 李兆勇, 孙世安, 等. 肝癌细胞及其上清液体外培养多房棘球蚴的实验研究[J].
武警后勤学院学报(医学版), 2012, 21(11): 864–867.
MA H L, LI Z Y, SUN S A, et al. Experimental studies on the in vitro culture of Echinococcus multilocularis metacestodes with Bel-7404 cells and its supematant fluid[J]. J Logist Univ CAPF(Med Sci), 2012, 21(11): 864–867. DOI:10.3969/jissn.2095-3720.2012.11.008 |
| [22] |
孙萃萍.多房棘球绦虫HSP20蛋白的生物信息学分析、重组表达及泡球蚴的体外培养[D].兰州: 兰州大学, 2015.
SUN C P. Bioinformatic analysis, recombination and expression of HSP20 from Echinococcus multilocularis as well as the culture of alveolar hydatid in vitro[D]. Lanzhou: Lanzhou Univ, 2015. |
| [23] | SPILIOTIS M, TAPPE D, SESTERHENN L, et al. Long-term in vitro cultivation of Echinococcus multilocularis metacestodes under axenic conditions[J]. Parasitol Res, 2004, 92(5): 430–432. DOI:10.1007/s00436-003-1046-8 |
| [24] | HEMPHILL A, GOTTSTEIN B. Immunology and morphology studies on the proliferation of in vitro cultivated Echinococcus multilocularis metacestodes[J]. Parasitol Res, 1995, 81(7): 605–614. DOI:10.1007/BF00932028 |
| [25] | JURA H, BADER A, HARTMANN M, et al. Hepatic tissue culture model for study of host-parasite interactions in alveolar echinococcosis[J]. Infect Immun, 1996, 64(9): 3484–3490. |
| [26] | SMYTH J D, DAVIES Z. In vitro culture of the strobilar state of Echinococcus granulosus (sheep strain): a review of basic problems and results[J]. Int J Parasitol, 1974, 4(6): 631–644. DOI:10.1016/0020-7519(74)90028-9 |
| [27] |
周启锋, 任利, 张灵强, 等. 肝泡型包虫病动物模型建立的研究进展[J].
临床肝胆病杂志, 2017, 33(11): 1–5.
ZHOU Q F, REN L, ZHANG L Q, et al. Research advance in animal models of hepatic alveolar echinococcosis[J]. J Clin Hepatol, 2017, 33(11): 1–5. |
| [28] |
倪兴维, 贾万忠, 者永辉, 等. 棘球蚴体外培养技术的应用[J].
中国寄生虫学与寄生虫病杂志, 2011, 29(4): 314–318.
NI X Y, JIA W Z, ZHE Y H, et al. Application of in vitro cultivation technique for metacestodes in study of Echinococcus spp.[J]. Chin J Parasitol Parasit Dis, 2011, 29(4): 314–318. |
| [29] |
杨梅, 梁小弟, 李军, 等. 细粒棘球绦虫新疆株胆汁酸钠协同转运蛋白基因的克隆及序列分析[J].
科技导报, 2016, 34(2): 215–220.
YANG M, LIANG X D, LI J, et al. Molecular cloning and sequence analysis of sodium-bile acid cotransporter from Echinococcus granulosus in Xinjiang, China[J]. Sci & Technol Rev, 2016, 34(2): 215–220. DOI:10.3981/j.issn.1000-7857.2016.2.036 |
| [30] | SMYTH J D. In vitro cultivation of parasitic helminths[M]. London: Macmillan Education UK, 1990: 77-154. |
| [31] | ZHENG H, ZHANG W, ZHANG L, et al. The genome of the hydatid tapeworm Echinococcus granulosus[J]. Nat Genet, 2013, 45(10): 1168–1175. DOI:10.1038/ng.2757 |
| [32] | LI S, KIM T I, YOO W G, et al. Bile components and amino acids affect survival of the newly excysted juvenile Clonorchis sinensis, in maintaining media[J]. Parasitol Res, 2008, 103(5): 1019–1024. DOI:10.1007/s00436-008-1084-3 |
| [33] |
王慧.棘球蚴囊液蛋白质组学及主要分泌蛋白对宿主免疫调节的影响[D].乌鲁木齐: 新疆医科大学, 2015.
WANG H. Proteomic analysis of hydatid cyst fluid and effect of mainly secreted protein on host immune regulation[D]. Urumchi: Xinjiang Med Univ, 2015. |



