肺炎克雷伯菌(Klebsiella pneumoniae)是一种肠杆菌科的革兰阴性杆菌,作为医院常见的条件致病菌之一,可以引起菌血症、发热、腹膜炎、尿道炎等多种相关性院内感染,严重者还可引起患者休克或者死亡[1]。头孢吡肟(cefepime,FEP)属于第四代头孢类抗生素,于1994年首次投入临床使用。它通过与青霉素结合蛋白(penicillin binding proteins,PBP)结合,抑制细菌细胞壁的合成,使菌体膨胀裂解,从而实现对该菌的抗菌能力[2-3]。厄他培南(ertapenem,ETP)是一种新型β-内酰胺类抗生素,被称作是治疗广泛耐药肠杆菌感染的最后一道防线,该药具有抗菌谱广、抗菌活性强、稳定程度高的特点,相比头孢吡肟,厄他培南对产AmpC酶和ESBL酶的肺炎克雷伯菌有更稳定的杀菌效果[4-5]。近年来,随着抗生素大量、广泛使用,肺炎克雷伯菌对多种抗生素产生耐药现象。根据2017年中国耐药监测网(CHINET)数据调查显示:肠杆菌科细菌中肺炎克雷伯菌检出率较2016年上升最明显,该菌对头孢吡肟和厄他培南的耐药率均高于肠杆菌科其他菌种,并且呈现逐年上升趋势[6],使得细菌耐药性问题日趋严重,所以,选择这两种抗生素进行相关研究非常必要。另一方面,作为耐药的一种特殊形式,异质性耐药菌株由于其亚群常常表现为假敏感,日常工作中不容易被及时发现,临床上没有采取相应的干预和防治措施,导致菌株在长期抗生素压力下逐步发展为耐药,从而降低临床抗感染治疗效果甚至导致失败[7]。目前,国内关于肺炎克雷伯菌的异质性耐药的研究尚未引起足够重视,因此,在异质性耐药日趋严峻的背景下,分析该菌对头孢吡肟和厄他培南的异质性耐药现象是很有价值的。
本研究通过对患者无菌体液分离出的肺炎克雷伯菌进行回顾性分析,筛选对头孢吡肟和厄他培南异质性耐药的菌株,分析其临床特征与感染相关危险因素,为临床防治提供理论依据。
1 材料与方法 1.1 菌株来源收集2014-2015年重庆医科大学附属第一医院住院患者无菌体液标本(血液、腹腔积液、胸腔积液、胆汁、脑脊液等)中非重复肺炎克雷伯菌临床分离株(去除了同一患者不同时间和相同部位的重复菌株),共计108株。筛选对头孢吡肟异质性耐药肺炎克雷伯菌(cefepime-heteroresistant Klebsiella pneumoniae, FEP-HR-KP)和对厄他培南异质性耐药肺炎克雷伯菌(ertapenem-heteroresistant Klebsiella pneumoniae, ETP-HR-KP)菌株作为病例组, 剩余的非异质性耐药菌株分别作为其对照组。以上菌株均经Vitek2 Compact全自动细菌鉴定系统鉴定, 肺炎克雷伯菌的质控菌株为ATCC700603, 来自本院检验科临床微生物实验室。
1.2 试剂与仪器MH平板购自重庆庞通医疗器械公司,血平板和E-Test试纸条(FEP)购自郑州安图生物公司,E-Test试纸条(ETP)、药敏纸片(FEP、ETP,10 μg/片)、胰蛋白胨、氯化钠、酵母均购自英国Oxiod公司,抗生素粉末(FEP、ETP)购自美国Sigma公司,Vitek2 Compact型全自动细菌分析仪购自法国梅里埃生物公司。
1.3 异质性耐药表型初筛异质性耐药表型初筛主要通过K-B法和E-test法,操作方法按照临床和实验室标准协会(CLSI)2015版[8]进行实验操作与结果判读。异质性耐药(HR):抑菌圈内有菌落生长,非异质性耐药[分为敏感(S)、中介(I)、耐药(R)]:抑菌圈内没有菌落生长。
1.4 菌谱分析(population analysis profile, PAP)实验PAP实验是异质性耐药菌株判断的金标准[9]。本研究选取对象为K-B和E-test初筛为呈现异质性耐药的菌株。主要按以下步骤进行:先配制浓度0.25 ~512 mg/mL共12个梯度的抗生素溶液并制备相应浓度的MH平板,再将细菌涂布于平板上置于37 ℃孵箱培养48 h,随后进行菌落计数并绘制PAP曲线图。FEP和ETP都分别选择了5株异质性耐药菌(HR),同时选择了1株完全敏感菌(S)和1株完全耐药菌(R)作为对照来进行作图。
1.5 危险因素调查患者的资料均从检验科LIS系统和电子病历系统收集得到,且经过再次核对。收集的资料包括:①患者基本情况(年龄、性别、是否转院、是否入住ICU等);②基础疾病及并发症(高血压、胃肠疾病、尿路感染、低蛋白血症等);③侵入性操作(内置引流管、导尿管、感染前手术史、机械通气等);④抗生素使用情况(青霉素类、头孢菌素类、碳青霉烯类、喹诺酮类等);⑤临床转归(院内死亡、总住院时间等)。
1.6 统计学分析采用SPSS 21.0统计软件。先采用χ2检验或者Fisher精确概率法对计数资料进行单因素分析,并将相关统计量用百分率(%)表示。用两独立样本t检验或非参数秩和检验对计量资料进行单因素分析,结果用平均值或者中位数(四分位数)表示。再将单因素分析中P≤0.10的变量纳入Logistic回归模型中用逐步前进法(条件)进行多因素分析。在病例组与对照组的相关危险因素分析中,P < 0.05的变量可认为差异有统计学意义。
2 结果 2.1 临床特征2014-2015年一共收集到108株肺炎克雷伯菌,其中有41(40.0%)株对头孢吡肟异质性耐药,63(58.3%)株对厄他培南异质性耐药,38(35.2%)株同时对头孢吡肟和厄他培南异质性耐药。从每年的异质性耐药率来看,FEP-HR-KP从2014年的41.7%(20/48)增长到2015年的51.7%(31/60),ETP-HR-KP从2014年的54.1%(26/48)增长到2015年的61.7%(37/60);从分离的标本类型来看,菌株主要集中在血液(25/66, 37.9%)、胆汁(17/66, 25.8%)、引流液(12/66, 18.2%)、胸腔积液(8/66, 12.1%),另外,还分布在脑脊液(2/66,3.0%)、穿刺液(1/66,1.5%)、腹腔积液(1/66,1.5%);从科室送检情况来看,肝胆外科20株,重症监护室13株,骨科10株,胃肠外科9株,泌尿外科4株,血管外科3株,消化内科和老年病科各2株,神经内科、肾内科、心血管内科各1株。
2.2 异质性耐药表型初筛K-B药敏纸片法结果显示:肺炎克雷伯菌在头孢吡肟和厄他培南形成的抑菌圈内均有菌落生长,说明它对这两种药都存在异质性耐药的现象,然后通过E-test试纸条进一步也观察到了抑菌圈内有散在的菌落生长,说明各细菌亚群对头孢吡肟与厄他培南敏感程度不一(图 1)。
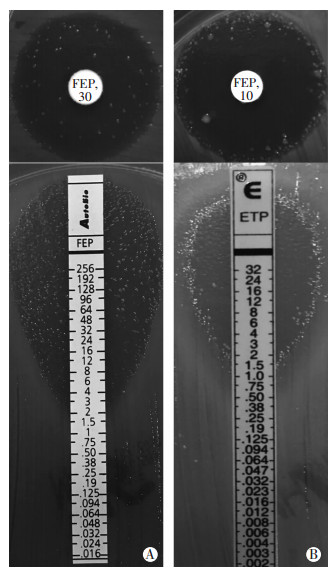
|
| 图 1 K-B法(上图)和E-test法(下图)显示肺炎克雷伯菌对头孢吡肟(A)和厄他培南(B)的异质性耐药现象 |
2.3 PAP验证
头孢吡肟、厄他培南的PAP曲线特点基本相似(图 2),以头孢吡肟为例:完全敏感菌8010在最低抑菌浓度2 μg/mL附近迅速被杀灭,无菌落生长;完全耐药菌8007在药物浓度为128 μg/mL之前都保持比较稳定的状态,在最低抑菌浓度曲线突然下降,无菌落生长;而8023、8027、8038、8039、8014这5株异质性耐药菌株的曲线则缓慢下降,且最高非抑菌抗生素浓度与最低完全抑菌抗生素浓度差异大于8倍。
2.4 FEP-HR-KP与ETP-HR-KP感染的单因素分析单因素分析结果显示:实体肿瘤、软组织感染、机械通气、内置导尿管、头孢菌素类抗生素的使用是FEP-HR-KP感染的主要危险因素(P < 0.05),转院、低蛋白血症、手术史、内置引流管、头孢菌素类抗生素使用、碳青霉烯类抗生素使用是ETP-HR-KP感染的主要危险因素(P < 0.05,表 1)。
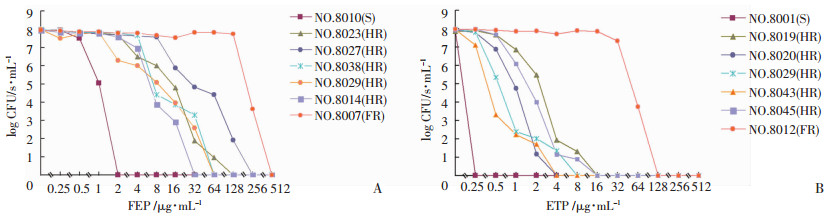
|
| 图 2 肺炎克雷伯菌对头孢吡肟(A)和厄他培南(B)异质性耐药PAP曲线 |
| 组别 | n | 年龄(≥60岁) | 男性 | 转院患者 | 入住ICU | 高血压 | 胃肠疾病 |
| 头孢吡肟 | |||||||
| 对照组 | 67 | 26(38.8%) | 48(71.6%) | 12(17.9%) | 29(43.3%) | 14(20.9%) | 11(16.4%) |
| 病例组 | 41 | 20(48.8%) | 26(63.4%) | 9(22.0%) | 12(29.3%) | 9(22.0%) | 8(19.5%) |
| OR(95%CI) | 1.50(0.69~3.29) | 0.69(0.30~1.57) | 1.29(0.49~3.39) | 0.54(0.24~1.24) | 1.07(0.41~2.74) | 1.23(0.45~3.38) | |
| P值 | 0.309 | 0.372 | 0.607 | 0.145 | 0.897 | 0.682 | |
| 厄他培南 | |||||||
| 对照组 | 45 | 19(42.2%) | 34(75.8%) | 14(31.1%) | 16(35.6%) | 7(15.6%) | 9(20.0%) |
| 病例组 | 63 | 27(42.9%) | 40(83.5%) | 7(11.1%) | 25(39.7%) | 16(25.4%) | 10(15.9%) |
| OR(95%CI) | 1.03(0.47~2.23) | 0.56(0.24~1.32) | 0.28(0.10~0.76) | 1.20(0.54~2.63) | 1.85(0.89~4.95) | 0.76(0.28~2.04) | |
| P值 | 0.948 | 0.183 | 0.010 | 0.663 | 0.218 | 0.579 | |
| 组别 | 冠心病 | 肾脏疾病 | 肝胆疾病 | 呼吸疾病 | 内分泌疾病 | 实体肿瘤 | |
| 头孢吡肟 | |||||||
| 对照组 | 4(6.0%) | 19(28.4%) | 28(41.8%) | 10(14.9%) | 8(11.9%) | 19(28.4%) | |
| 病例组 | 1(2.4%) | 7(17.1%) | 16(39.0%) | 6(14.6%) | 4(9.8%) | 4(9.8%) | |
| OR(95%CI) | 0.39(0.04~3.65) | 0.52(0.20~1.37) | 0.89(0.40~1.97) | 0.98(0.33~2.92) | 0.80(0.22~2.84) | 0.27(0.09~0.87) | |
| P值 | 0.397 | 0.183 | 0.776 | 0.967 | 0.726 | 0.022 | |
| 厄他培南 | |||||||
| 对照组 | 4(8.9%) | 15(33.3%) | 17(37.8%) | 7(15.6%) | 6(13.3%) | 13(28.9%) | |
| 病例组 | 1(1.6%) | 11(17.5%) | 27(42.9%) | 9(14.3%) | 6(9.5%) | 10(15.9%) | |
| OR(95%CI) | 1.25(0.36~3.07) | 0.42(0.17~1.04) | 1.24(0.57~2.70) | 0.91(0.31~2.64) | 0.68(0.21~2.28) | 0.46(0.18~1.18) | |
| P值 | 0.075 | 0.057 | 0.596 | 0.855 | 0.535 | 0.103 | |
| 组别 | 血液疾病 | 低蛋白血症 | 中性粒细胞减少 | 软组织感染 | 尿路感染 | 腹腔内感染 | |
| 头孢吡肟 | |||||||
| 对照组 | 5(7.5%) | 48(71.6%) | 4(6.0%) | 6(9.0%) | 6(9.0%) | 12(17.9%) | |
| 病例组 | 2(4.9%) | 35(85.4%) | 5(12.2%) | 12(29.3%) | 5(12.2%) | 9(22.0%) | |
| OR(95%CI) | 0.63(0.12~3.44) | 2.31(0.84-6.38) | 2.19(0.56~4.67) | 4.21(1.44~5.33) | 1.41(0.40~4.96) | 1.29(0.49~3.39) | |
| P值 | 0.596 | 0.101 | 0.256 | 0.006 | 0.589 | 0.607 | |
| 厄他培南 | |||||||
| 对照组 | 7(15.6%) | 26(57.8%) | 3(6.7%) | 5(11.1%) | 4(8.9%) | 7(15.6%) | |
| 病例组 | 9(14.3%) | 57(90.5%) | 6(9.5%) | 13(20.6%) | 7(11.1%) | 14(22.2%) | |
| OR(95%CI) | 0.91(0.31~2.64) | 3.01(1.08~4.86) | 1.47(0.35~3.23) | 2.08(0.68~6.32) | 1.28(0.35~4.67) | 1.55(0.57~4.22) | |
| P值 | 0.855 | <0.001 | 0.596 | 0.190 | 0.707 | 0.388 | |
| 组别 | 肺部感染 | 手术史(细菌检 出前6个月) |
肠外营养给予 | 内置引流管 | 膀胱冲洗 | 机械通气 | |
| 头孢吡肟 | |||||||
| 对照组 | 11(16.4%) | 48(71.6%) | 9(13.4%) | 23(34.3%) | 6(9.0%) | 11(16.4%) | |
| 病例组 | 8(19.5%) | 35(85.4%) | 10(24.4%) | 22(53.7%) | 1(2.4%) | 17(41.5%) | |
| OR(95%CI) | 1.23(0.45~3.38) | 2.31(0.84~5.38) | 2.08(0.76~5.65) | 2.22(1.01~4.90) | 0.25(0.03~2.19) | 3.61(1.47~8.84) | |
| P值 | 0.682 | 0.101 | 0.147 | 0.048 | 0.182 | 0.004 | |
| 厄他培南 | |||||||
| 对照组 | 8(17.8%) | 28(62.2%) | 8(17.8%) | 12(26.7%) | 4(8.9%) | 10(22.2%) | |
| 病例组 | 11(17.5%) | 55(87.3%) | 11(17.5%) | 33(52.4%) | 3(4.8%) | 18(28.6%) | |
| OR(95%CI) | 0.98(0.36~2.67) | 4.17(1.61~5.23) | 0.98(0.36~2.67) | 3.03(1.33~4.90) | 0.51(0.10~2.41) | 1.40(0.58~3.41) | |
| P值 | 0.966 | 0.002 | 0.966 | 0.008 | 0.390 | 0.458 | |
| 组别 | 导尿管 | 气管插管 | 鼻管 | 中心静脉置管 | 青霉素类 | 头孢菌素类 | |
| 头孢吡肟 | |||||||
| 对照组 | 34(50.7%) | 20(29.9%) | 4(6.0%) | 17(25.4%) | 32(47.8%) | 26(38.8%) | |
| 病例组 | 31(75.6%) | 6(14.6%) | 3(7.3%) | 13(31.7%) | 22(53.7%) | 28(68.3%) | |
| OR(95%CI) | 3.01(1.28~7.10) | 0.40(0.15~1.11) | 1.24(0.26~5.86) | 1.37(0.58~3.22) | 1.27(0.58~2.76) | 3.40(1.49~7.72) | |
| P值 | 0.010 | 0.073 | 0.783 | 0.476 | 0.552 | 0.003 | |
| 厄他培南 | |||||||
| 对照组 | 23(51.1%) | 12(26.7%) | 1(2.2%) | 10(22.2%) | 21(46.7%) | 14(31.1%) | |
| 病例组 | 42(66.7%) | 14(22.2%) | 6(9.5%) | 20(31.7%) | 33(52.4%) | 40(63.5%) | |
| OR(95%CI) | 1.91(0.87~4.19) | 0.79(0.32~1.91) | 2.21(0.53~3.87) | 1.63(0.68~3.93) | 1.26(0.58~2.71) | 3.85(1.71~5.69) | |
| P值 | 0.104 | 0.594 | 0.129 | 0.276 | 0.558 | 0.001 | |
| 组别 | 碳青霉烯类 | 喹诺酮类 | 氨基糖苷类 | 糖肽类 | 院内死亡 | 细菌检出前 住院时间/d |
总住院 时间/d |
| 头孢吡肟 | |||||||
| 对照组 | 8(11.9%) | 9(13.4%) | 8(11.9%) | 11(16.4%) | 1(1.5%) | 9(4.0,15.0) | 25(15,46) |
| 病例组 | 10(24.4%) | 8(19.5%) | 4(9.8%) | 6(14.6%) | 1(2.4%) | 10(4.5,15.0) | 34(19,45) |
| OR(95%CI) | 2.38(0.85~6.64) | 1.56(0.55~4.44) | 0.80(0.22~2.84) | 0.87(0.30~2.57) | 1.65(0.59~5.48) | ||
| P值 | 0.092 | 0.400 | 0.726 | 0.805 | 0.723 | 0.798 | 0.712 |
| 厄他培南 | |||||||
| 对照组 | 4(8.9%) | 6(13.3%) | 4(8.9%) | 5(11.1%) | 1(2.2%) | 10(4.0,13.5) | 25(15,43) |
| 病例组 | 20(31.7%) | 11(17.5%) | 8(12.7%) | 12(19.0%) | 1(1.6%) | 9(3.0,15.0) | 31(17,47) |
| OR(95%CI) | 2.78(1.50~5.18) | 1.38(0.47~4.04) | 1.49(0.42~5.29) | 1.88(0.61~5.78) | 0.71(0.34~1.58) | ||
| P值 | 0.005 | 0.562 | 0.535 | 0.264 | 0.809 | 0.878 | 0.110 |
| 低蛋白血症:血清总蛋白< 60 g/L或白蛋白 < 25 g/L;中性粒细胞减少:白细胞计数< 4.0×109/L | |||||||
2.5 FEP-HR-KP与ETP-HR-KP感染的多因素分析
将上述单因素分析中P < 0.10的变量纳入到二元Logistic回归模型中进行多因素分析,分析结果显示软组织感染、机械通气、头孢菌素类抗生素使用是引起FEP-HR-KP相关感染的独立危险因素(P < 0.05),头孢类抗生素使用、碳青霉烯类抗生素使用、内置引流管是引起ETP-HR-KP相关感染的独立危险因素(P < 0.05,表 2)。
| 危险因素 | FEP-HR-KP | ETP-HR-KP | |||||
| OR值 | 95%CI | P值 | OR值 | 95%CI | P值 | ||
| 软组织感染 | 1.92 | 0.91~3.91 | 0.049 | ||||
| 机械通气 | 2.45 | 1.31~4.47 | 0.013 | ||||
| 头孢菌素类抗生素使用 | 2.10 | 1.18~3.13 | 0.020 | 2.08 | 0.96~4.20 | 0.033 | |
| 内置引流管 | 2.76 | 1.49~4.90 | 0.018 | ||||
| 碳青霉烯类抗生素使用 | 2.52 | 1.08~3.86 | 0.023 | ||||
3 讨论
肺炎克雷伯菌是院内感染常见的条件病原菌之一,可以引起多器官相关感染。随着抗生素大量、广泛地使用,肺炎克雷伯菌对多种抗生素耐药的问题不容乐观,这给临床抗感染治疗带来很大的困难。作为耐药的一种特殊形式,异质性耐药是指同一遗传背景下不同克隆亚群对抗生素敏感性各不相同的现象,被认为是敏感到耐药的中间阶段[4, 10],最直观的表现就是抑菌圈内有菌落生长,然而临床的传统药敏试验往往不能检出耐药亚群,临床上根据不准确的药敏结果用药,使得耐药亚群的比例不断增加,最终导致患者反复感染和治疗失败,异质性耐药现象存在于各类细菌对各类抗生素的耐药之中。近年来,国内对异质性耐药的相关研究较少,主要报道了金黄色葡萄球菌以及结核分枝杆菌的异质性耐药现象,国外相继报道了肺炎克雷伯菌对多粘菌素、美罗培南的异质性耐药现象[11-12],但肺炎克雷伯菌的异质性耐药现象尚待探明。
本研究对2014-2015年本院头孢吡肟和厄他培南异质性耐药的肺炎克雷伯菌进行了回顾性分析,调查其临床特征与相关危险因素。结果显示:头孢吡肟异质性耐药率为40.0%,厄他培南异质性耐药率为58.3%,头孢吡肟与厄他培南双异质性耐药率为35.2%,且年异质性耐药率均呈现一个增长趋势,形势不容乐观。这可能跟长期大量使用各类抗生素有关,应当引起足够重视并做好相应的防治措施。从科室分布来看,超过一半的标本都来自于外科(47/66,71.2%),说明有创性操作和手术前预防性抗感染治疗可能会加大感染的风险。从标本类型来看,肺炎克雷伯菌主要分离自血液标本(25/66, 37.9%),可能与该菌主要引起血流感染有关。
通过分析FEP-HR-KP和ETP-HR-KP的危险因素,本研究发现实体肿瘤、软组织感染、内置引流管、机械通气、内置导尿管、头孢菌素类的使用与FEP-HR-KP感染有关,转院、低蛋白血症、手术史、内置引流管、头孢菌素类抗生素和碳青霉烯类抗生素的使用与ETP-HR-KP感染相关。从统计的病例资料来看,机械通气和内置引流管分别是FEP-HR-KP和ETP-HR-KP感染的独立危险因素,在FEP-HR-KP感染中,病例组机械通气比例(41.5%)明显高于对照组(16.4%),在ETP-HR-KP感染中,病例组内置引流管使用比例(52.4%)明显高于对照组(26.7%),说明侵入性操作可以增加异质性耐药菌株感染的机会,这与国内外报道是一致的[13-14]。相关研究表明:接受过机械通气、留置导尿管、引流管的患者往往病情都是比较重的,自身免疫力低下,有多种基础疾病,大多数曾经转入过ICU,且侵入性操作对患者的机体都存在不同程度的损伤,破坏人体正常屏障,导致这部分患者更容易感染上异质性耐药菌株[15]。此外,有文献报道发现有创性操作的插管管子(气管插管、导尿管、引流管、中心静脉置管等)的内壁上有细菌的生物膜形成,这也是造成患者感染概率更大的原因[16]。因此,临床上应视患者的病情决定是否实施相关侵入性操作,严格实行无菌操作流程,并在实施操作以后定期送检标本进行培养,密切监视患者情况,减少异质性耐药菌株的感染机会。
从抗生素使用情况来看,头孢菌素类抗生素的使用和碳青霉烯类抗生素的使用是FEP-HR-KP和ETP-HR-KP感染的独立危险因素。本研究中,FEP病例组头孢菌素类的使用率(68.3%)明显高于对照组(38.8%),ETP病例组头孢菌素类和碳青霉烯类的使用率(63.5%、31.7%)均高于对照组(31.1%、8.9%)。临床医师在治疗病情危重的患者时,往往会根据经验首选第四代头孢抗生素或者效果更好的碳青霉烯类抗生素,患者的病情也许会暂时控制,出现好转,但长期的经验性用药,将会导致细菌群体进行个体优化,耐药亚群比例逐渐增加,最终进展为耐药。另外,与其他报道不同的是,本研究还发现了软组织感染是导致FEP-HR-KP感染的一个独立危险因素,在临床治疗中,严重的软组织感染一般都会直接选择广谱类抗生素,相关报道显示第四代头孢类抗生素头孢吡肟是治疗软组织感染的一线药物,长此以往,患者体内的异质性耐药菌株会在抗生素压力下逐步发展为耐药,导致反复感染和治疗失败[17-18]。
本研究中所有的标本均来自住院患者的无菌体液标本,排除了正常定值菌的干扰,因此数量有限,研究可能较为局限。从以上分析可以看出,本院肺炎克雷伯菌对头孢吡肟和厄他培南的异质性耐药率都较高,应当引起重视。异质性耐药菌株由于耐药亚群的存在,在临床常规药敏试验中常常表现为“假敏感”,不能被及时检出发现。如果没有任何防治手段和治疗措施,异质性耐药将逐步发展为耐药,延长患者的住院时间,加重经济负担。因此,积极采用有效的防治措施是预防异质性耐药进展为耐药的关键。首先,临床应当结合培养结果及药敏试验合理地使用抗生素,根据患者病情不断调整用药,采用多种抗生素短期结合治疗,避免长期单一用药;其次,减少不必要的侵入性操作,定期消毒,及时送检,以减少异质性耐药菌株的传播流行。
| [1] | BIALEK-DAVENET S, CRISCUOLO A, AILLOUD F, et al. Genomic definition of hypervirulent and multidrug-resistant Klebsiella pneumoniae clonal groups[J]. Emerging Infect Dis, 2014, 20(11): 1812–1820. DOI:10.3201/eid2011.140206 |
| [2] | ENDIMIANI A, PEREZ F, BONOMO R A. Cefepime:a reappraisal in an era of increasing antimicrobial resistance[J]. Expert Rev Anti Infect Ther, 2008, 6(6): 805–824. DOI:10.1586/14787210.6.6.805 |
| [3] | PATEL H B, LUSK K A, COTA J M. The role of cefepime in the treatment of extended-spectrum beta-lactamase infections[J]. J Pharm Pract, 2017: 897190017743134. DOI:10.1177/0897190017743134 |
| [4] | EL-HALFAWY O M, VALVANO M A. Chemical communication of antibiotic resistance by a highly resistant subpopulation of bacterial cells[J]. PLoS ONE, 2013, 8(7): e68874. DOI:10.1371/journal.pone.0068874 |
| [5] | LEE C H, CHEN I L, LI C C, et al. Clinical benefit of ertapenem compared to flomoxef for the treatment of cefotaxime-resistant Enterobacteriaceae bacteremia[J]. Infect Drug Resist, 2018, 11: 257–266. DOI:10.2147/IDR.S146923 |
| [6] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J].
中国感染与化疗杂志, 2018, 18(3): 241–251.
HU F P, GUO Y, ZHU D M, et al. Antimicrobial resistance profile of clinical isolates in hospitals across China:report from the CHINET Surveillance Program, 2017[J]. Chin J Infect Chemother, 2018, 18(3): 241–251. DOI:10.16718/j.1009-7708.2018.03.001 |
| [7] | FALAGAS M E, MAKRIS G C, DIMOPOULOS G, et al. Heteroresistance:a concern of increasing clinical significance[J]. Clin Microbiol Infect, 2008, 14(2): 101–104. DOI:10.1111/j.1469-0691.2007.01912.x |
| [8] | WEINSTEIN M P. Performance standards for antimicrobial susceptibility testing[S/OL]. [2018-12-27]. |
| [9] | EL-HALFAWY O M, VALVANO M A. Antimicrobial heteroresistance:an emerging field in need of clarity[J]. Clin Microbiol Rev, 2015, 28(1): 191–207. DOI:10.1128/CMR.00058-14 |
| [10] | ANDERSON S E, SHERMAN E X, WEISS D S, et al. Aminoglycoside heteroresistance in Acinetobacter baumannii AB5075[J]. mSphere, 2018, 3(4): e00271–18. DOI:10.1128/msphere.00271-18 |
| [11] | MELETIS G, TZAMPAZ E, SIANOU E, et al. Colistin heteroresistance in carbapenemase-producing Klebsiella pneumoniae[J]. J Antimicrob Chemother, 2011, 66(4): 946–947. DOI:10.1093/jac/dkr007 |
| [12] | POURNARAS S, KRISTO I, VRIONI G, et al. Characteristics of meropenem heteroresistance in Klebsiella pneumoniae carbapenemase (KPC)-producing clinical isolates of K.pneumoniae[J]. J Clin Microbiol, 2010, 48(7): 2601–2604. DOI:10.1128/JCM.02134-09 |
| [13] | HE J, JIA X, YANG S, et al. Heteroresistance to carbapenems in invasive Pseudomonas aeruginosa infections[J]. Int J Antimicrob Agents, 2018, 51(3): 413–421. DOI:10.1016/j.ijantimicag.2017.10.014 |
| [14] | MA W, SUN J, YANG S, et al. Epidemiological and clinical features for cefepime heteroresistant Escherichia coli infections in Southwest China[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(4): 571–578. DOI:10.1007/s10096-015-2572-x |
| [15] | SULTAN A M, SELIEM W A. Identifying risk factors for healthcare-associated infections caused by carbapenem-resistant acinetobacter baumannii in a neonatal intensive care unit[J]. Sultan Qaboos Univ Med J, 2018, 18(1): e75–e80. DOI:10.18295/squmj.2018.18.01.012 |
| [16] | GIL-PEROTIN S, RAMIREZ P, MARTI V, et al. Implications of endotracheal tube biofilm in ventilator-associated pneumonia response:a state of concept[J]. Crit Care, 2012, 16(3): R93. DOI:10.1186/cc11357 |
| [17] | CARDONA A F, WILSON S E. Skin and soft-tissue infections:a critical review and the role of telavancin in their treatment[J]. Clin Infect Dis, 2015, 61(Suppl 2)): S69–S78. DOI:10.1093/cid/civ528 |
| [18] | BURNHAM J P, KOLLEF M H. Treatment of severe skin and soft tissue infections:a review[J]. Curr Opin Infect Dis, 2018, 31(2): 113–119. DOI:10.1097/QCO.0000000000000431 |



