2. 400038 重庆,陆军军医大学(第三军医大学):军事预防医学系全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学):校办公室
2. State Kay Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury, Faculty of Military Preventive Medicine, Army Medical University(Third Military Medical University), Chongqing, 400038, China;
3. Administration office, Army Medical University(Third Military Medical University), Chongqing, 400038, China
肺癌的早期症状并不明显,很多患者就诊时已处于手术和药物无法救治的病理晚期,因而病死率极高[1]。肺癌的高病死率与其高转移能力密切相关,在以往肺腺癌体内转移研究中主要使用裸鼠或者正常野生小鼠,但由于裸鼠存在胸腺发育障碍使其不能完全等同于正常小鼠,而使用正常野生小鼠进行体内成瘤实验时,存在成瘤率和转移率较低的问题。另外,由于肺癌原位荷瘤造模难度大、病死率高,而皮下荷瘤模型相对简单易行,造模成功率高,肿瘤生长较快、易测量,通过测量瘤径、瘤体质量等指标即可动态观察受试物的抗肿瘤效应,是目前肺癌造模最常用的方法[2-4]。众多研究表明皮下荷瘤模型鲜能出现转移[5],所以本研究拟尝试通过骨髓移植建立骨髓嵌合小鼠,观察该模型下Lewis肺腺癌细胞的成瘤和转移效率,为在体研究肺腺癌生长和转移提供一个新的动物模型。
在预实验中,我们发现对骨髓嵌合后的小鼠皮下注射小鼠肺腺癌细胞,其肺部可见肿瘤转移。为研究骨髓嵌合对于小鼠肺癌模型造模的影响,本研究选用C57鼠及鼠源Lewis肺癌细胞(Lewis lung cancer cells,LLC),比较皮下荷瘤后骨髓嵌合小鼠与野生小鼠皮下LLC细胞成瘤及转移的异同。
1 材料与方法 1.1 材料 1.1.1 细胞株LLC细胞由重庆巴尔斯公司提供,用含10%胎牛血清(Biological Industries公司,以色列)及双抗(青霉素100 U/mL, 链霉素100 μL/mL)的高糖培养基(Hyclone公司,美国)培养,置于37 ℃含5% CO2的细胞培养箱中孵育,2~3 d更换1次培养液,当细胞密度约达到95%,用含有EDTA(0.02%)的胰酶(0.25%)消化(消化时间不超过40 s)并分瓶传代培养。
1.1.2 实验动物C57小鼠(5周龄、雄性)50只,由本校实验动物中心提供[许可证号syxk(军)2012-0031],所有小鼠饲养于SPF级环境。
1.2 方法 1.2.1 骨髓嵌合小鼠制备采用随机数字表法抽取C57小鼠10只,在无菌操作台上处死并分离股骨、胫骨,用灭菌的PBS缓冲液冲洗骨髓细胞,配成浓度为106 /mL细胞悬浮液加入EP管并放于冰盒待用。再随机取20只C57小鼠,全部进行8 Gy全身照射(辐照时间:10 min)后将上一步获得的骨髓细胞悬浮液经尾静脉注入小鼠体内,每只小鼠注射细胞悬液体积为0.2 mL。最后将骨髓移植后的小鼠和剩余20只C57野生小鼠均放入SPF动物房中分开饲养1个月备用。
1.2.2 LLC细胞荷瘤小鼠模型制备将上述野生小鼠随机分为对照组和皮下荷瘤组(每组10只),分别标记为对照A组、野生小鼠组;将1.2.1的骨髓嵌合小鼠随机分为对照组和皮下荷瘤组(每组10只),分别标记为对照B组、骨髓嵌合小鼠组。收集处于对数生长期的LLC细胞,彻底去除血清后,用无血清的高糖培养基重悬,调整细胞浓度为2×107~2.5×107 /mL,置于冰上待用。取野生小鼠组及骨髓嵌合小鼠组的小鼠共20只进行皮下肿瘤细胞接种,接种时将小鼠背部皮肤经酒精消毒后,用1 mL一次性注射器在小鼠背部皮下注射LLC细胞(100 μL/只)或等体积生理盐水。接种后,所有小鼠置于SPF动物房中饲养,培养20 d后解剖小鼠,观察肿瘤生长情况。
1.2.3 观察各组肿瘤转移情况各实验组小鼠颈椎脱臼法处死后,经解剖观察肝脏和肺脏等器官的转移情况;用4%多聚甲醛固定24 h后,梯度酒精浓度脱水,石蜡包埋并制成切片,HE染色后,用显微镜拍照观察。
1.3 统计学分析采用SPSS 20.0统计软件,计量资料采用x±s形式表示,两组间数值比较采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 野生小鼠和骨髓嵌合小鼠皮下荷瘤体积及离体瘤质量比较骨髓嵌合小鼠在其背部皮下注射LLC细胞5~7 d后,可在该组小鼠背部检测到约40.41 mm3的肿瘤包块(成瘤率100%),而野生小鼠此时未明显检测到肿瘤包块,但到接种第8~10天,野生小鼠亦能触及约38.15 mm3的肿瘤突起(成瘤率100%)。野生小鼠和骨髓嵌合小鼠背部皮下肿瘤体积随时间变化如图 1A所示:与正常小鼠比较,骨髓嵌合小鼠皮下注射LLC后,不仅起瘤较早,并且其体积增长较快。实验结束后,如图 1B、C所示:相同体积的LLC细胞皮下注射后,骨髓嵌合组小鼠离体瘤较正常小鼠离体瘤显著增大[(0.773±0.148) vs(0.518±0.108)g, P<0.01],经测量其质量增加49.27%。

|
| A:野生小鼠与骨髓嵌合小鼠皮下肿瘤体积随时间变化(n=10,x±s) a:P<0.01,与野生小鼠荷瘤组比较;B、C:荷瘤小鼠及其离体肿瘤大体观察 图 1 野生小鼠和骨髓嵌合小鼠皮下荷瘤体积及离体瘤质量比较 |
2.2 野生小鼠和骨髓嵌合小鼠LLC细胞肺转移情况
将上述各组小鼠于注射第20天处死(注射当天为第0天),收集肺脏观察各组小鼠的肺转移情况。由图 2肺部的形态图可见:未接种LLC细胞的对照A和对照B小鼠,其肺表面光滑,质地均匀,而接种LLC细胞后,野生小鼠的肺部与对照A比较未见明显差异;骨髓嵌合小鼠则可观察到其肺部组织出现明显的深红色赘生物及亮泡(图 2箭头所示)。后经病理切片检查,接种LLC细胞后,在野生小鼠的肺部也检测到了少量的异质性转移癌细胞,但在骨髓嵌合小鼠的肺切片上可检测到多处转移且其面积远大于野生小鼠皮下荷瘤组。说明骨髓移植相对正常野生小鼠更利于LLC细胞皮下荷瘤向肺脏转移。
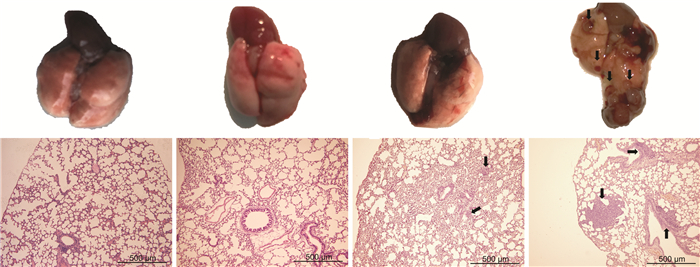
|
| 箭头示转移的癌灶 图 2 各组小鼠接种肿瘤细胞后第20天皮下荷瘤模型及对照小鼠的肺部大体及病理观察 |
2.3 野生小鼠和骨髓嵌合小鼠LLC细胞肝转移情况
未接种LLC细胞的正常野生小鼠肝脏较骨髓嵌合小鼠肝脏并无明显区别。同时接种LLC细胞后,野生小鼠及骨髓嵌合小鼠的肝脏与其对照组相比亦均未发现明显异质性差异,后经病理切片进一步检查发现:皮下接种LLC细胞后,在骨髓嵌合小鼠的肝切片上可检测少量转移的肿瘤细胞,而其他几组并无明显差异(图 3)。说明骨髓嵌合相对正常小鼠有利于LLC细胞皮下荷瘤向肝脏转移,但相对肺脏其肝转移促进作用较小。

|
| 箭头示转移的癌灶 图 3 各组小鼠接种肿瘤细胞后第20天皮下荷瘤模型及对照小鼠的肝脏大体及病理观察 |
3 讨论
肿瘤动物模型应用于多方面的研究领域,特别是在研究肿瘤的发生、发展等方面发挥着巨大作用,是实现体内研究的重要途径[6]。LLC细胞是来源于C57小鼠的肺腺癌细胞,由于共具有生长快、侵袭性强、易发生转移等特征,是为数不多可用于研究人肺癌的理想细胞模型[7]。本研究首先制得了C57骨髓嵌合小鼠,并通过对C57野生小鼠及骨髓嵌合小鼠皮下注射LLC细胞成功建立了肺癌体内增殖和转移小鼠模型,该过程操作简单、实验周期短。本研究观察到野生C57小鼠在接受骨髓移植后,其皮下肿瘤生长速度及平均离体瘤质量较野生小鼠大大提升;从解剖后小鼠的肺转移情况来看,骨髓移植后小鼠可观察到明显的肺转移肿瘤亮泡,说明骨髓移植对LLC荷瘤小鼠的肿瘤生长及转移有促进作用。肿瘤的增殖速率及侵袭转移能力与机体的免疫能力密切相关[8],前期研究报道表明:骨髓移植后,尽管机体获得免疫重建能力,但这个过程漫长而复杂,将有一个长达数月的免疫缺陷时期,易发生机会性感染,移植后1个月,造血功能完全恢复,各主要脏器组织形态正常,但免疫系统可能尚未完全恢复[9]。因此,本研究中骨髓嵌合小鼠具有的肿瘤快速增殖及高转移能力可能与其免疫系统尚未完全恢复有关,但具体原因还有待进一步研究阐明。此外,观察解剖后各组小鼠的肝脏,骨髓嵌合小鼠与野生C57小鼠荷瘤后肝脏外观虽未有明显差异,但其HE切片仍可检测到少量转移的癌细胞,说明骨髓嵌合对LLC细胞皮下荷瘤向肝转移也是有促进作用的。
综上所述,通过研究骨髓嵌合对C57小鼠皮下接种LLC细胞后成瘤能力及转移能力的影响,本研究发现骨髓嵌合有利于肿瘤造模及转移的发生,为肺癌及其他肿瘤的动物造模和机制研究提供了实验参考。
| [1] | KEITH R L, MILLER Y E. Lung cancer chemoprevention: current status and future prospects[J]. Nat Rev Clin Oncol, 2013, 10(6): 334–343. DOI:10.1038/nrclinonc.2013.64 |
| [2] | LI N, ZHANG X Y, JIANG Z X, et al. Establishment of a mouse model of orthotopic Lewis lung cancer[J]. Acta Lab Animalis Sci Sinica, 2014(5): 79–83. DOI:10.3969/j.issn.1005-4847.2014.05.018 |
| [3] | DUTT A, WONG K K. Mouse models of lung cancer[J]. Clin Cancer Res, 2006, 12(2): 4396s. DOI:10.1158/1078-0432.CCR-06-0414 |
| [4] | MA X M, WANG X M, YU M X, et al. Comparative study of imagable lewis lung carcinoma between orthotopic and ectopic murine models[J]. J Pract Oncol, 2018, 33(4): 523–526. DOI:10.3969/j.issn.1001-5930.2018.04.001 |
| [5] | HIROSHIMA Y, MAAWY A, ZHANG Y, et al. Patient-derived mouse models of cancer need to be orthotopic in order to evaluate targeted anti-metastatic therapy[J]. Oncotarget, 2016, 7(44): 71696–71702. DOI:10.18632/oncotarget.12322 |
| [6] | KELLAR A, EGAN C, MORRIS D. Preclinical murine models for lung cancer: clinical trial applications[J]. Biomed Res Int, 2015, 2015: 621234. DOI:10.1155/2015/621324 |
| [7] | RASHIDI B, YANG M, JIANG P, et al. A highly metastatic Lewis lung carcinoma orthotopic green fluorescent protein model[J]. Clin Exp Metastas, 2000, 18(1): 57–60. DOI:10.1023/A:1026596131504 |
| [8] | JANSSEN L M E, RAMSAY E E, LOGSDON C D, et al. The immune system in cancer metastasis: friend or foe[J]. J Immunother Cancer, 2017, 5(1): 79. DOI:10.1186/s40425-017-0283-9 |
| [9] | LIU D Q, WANG F, ZOU Z, et al. Long-term repopulation effects of donor BMDCs on intestinal epithelium[J]. Dig Dis Sci, 2010, 55(8): 2182–2193. DOI:10.1007/s10620-009-0991-1 |



