阿尔茨海默病(Alzheimer’s disease,AD)是常见的中枢神经系统疾病,发病率和致残率高,严重影响中老年人的生活质量。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族中的一员,具有促进细胞增殖、分化和存活,促进长时程增强,促进突触生长、突触传递以及可塑性等作用[1-2]。而脑源性神经营养因子前体(brain-derived neurotrophic factor precursor,proBDNF)的作用与BDNF的作用截然相反[3-5]。研究表明proBDNF和BDNF广泛分布于中枢神经系统,老龄以及AD前期脑内BDNF水平降低,proBDNF含量明显升高,推测BDNF/proBDNF比例失调参与了AD发病[4],然而其具体作用及机制尚未完全阐明。为此,本实验采用AD鼠右侧侧脑室定向注射携带有proBDNF基因的腺相关病毒基因整合载体(AAV-proBDNF),观察AAV-proBDNF在AD鼠脑内表达情况及其对AD鼠海马齿状回神经元前体细胞微管相关蛋白(doublecortin,DCX)阳性细胞数和突触后致密物-95(postsynaptic density-95,PSD-95)表达的影响。
1 材料与方法 1.1 动物及分组采用转基因阿尔茨海默病模型小鼠(AD鼠,APPswePS1dE9,雌性,5月龄,体质量28~32 g)15只,采用抛硬币法随机分为3组,每组5只。①正常对照组:右侧侧脑室注射生理盐水;②空载体对照组:右侧侧脑室注射空病毒载体量;③AAV-proBDNF组:右侧侧脑室注射AAV-proBDNF。AAV-proBDNF由本科王延江教授提供。
1.2 AAV-proBDNF右侧侧脑室注射腹腔注射6%水合氯醛麻醉小鼠,置于立体定位仪(Stoelting公司,美国)平台上,将小鼠头部固定于水平位,头顶剪去毛发,用碘伏消毒头部皮肤,沿正中线纵向切开皮肤约1.5 cm暴露囟门周围颅骨。以囟门为中心,定位坐标点:前后0.6 mm,右侧旁开1.2 mm。使用牙科钻钻颅。再次定位后以深度2.3 mm进行穿刺,注射位置即为右侧侧脑室。AAV-proBDNF组微量注射AAV-proBDNF(4 μL, 2×1013v.g./mL),空载体对照组微量注射AAV 4 μL,正常对照组采用同法注射生理盐水4 μL,微量注射速度为0.5 μL/min,注射结束后缓慢拔出注射针,完成微量注射后进行缝合。术后继续观察30 min,动物无异常后按1只/笼继续饲养。
1.3 海马组织取材各组AD鼠侧脑室注射后4周取材。过量麻醉处死动物(10%水合氯醛按0.01 mL/g腹腔注射),并常规灌注、海马取材,其中左侧海马用于免疫组化检测DCX阳性细胞,右侧海马于液氮中研磨后等份分装分别用于proBDNF含量测定和PSD-95测定。
1.4 ELISA法测定海马区proBDNF含量取分装后的右侧海马组织,超声破碎和匀浆,12 000 r/min离心10 min,取上清待测。根据proBDNF Rapid ELISA Kit(Biosensis公司,澳大利亚)说明书进行proBDNF浓度测定:梯度稀释proBDNF标准品,按100 μL/孔分别加入梯度标准品和待测样品,封板膜封板后置于摇床上(140 r/min,45 min)。甩去板孔内液体,200 μL/孔洗涤液清洗5次,100 μL/孔加入生物素化检测抗体,封板膜封板置于摇床上(140 r/min,30 min)。洗涤液洗板(200 μL/孔,5次),加入链霉亲和素-HRP复合物(100 μL/孔),摇床上摇匀(140 r/min,30 min)。再次使用洗涤液清洗板孔(200 μL/孔,共5次),加入100 μL TMB至每孔,4~8 min后加入终止液(100 μL/孔)。酶标仪检测波长450 nm处光密度值[D(450)]。计算浓度以及脑组织质量比浓度。
1.5 免疫组化检测海马DCX阳性细胞取左侧海马组织,福尔马林固定、蔗糖脱水后行冠状冰冻切片,每张切片厚度40 μm,每隔6张取1张切片,取其中1套(约8张含海马结构)进行免疫组化染色并计数,累加后乘6即为一侧海马齿回总的DCX阳性细胞数。3%H2O2室温孵育5~10 min;血清封闭30 min,兔DCX抗体(1:200,Abcam公司,英国)4 ℃孵育过夜;抗兔IgG生物素标记二抗溶液(1:500,Abcam公司,英国)室温孵育2 h;加入ABC(1:200),室温孵育1 h,二氨基联苯胺(DAB)显色,镜下观察并及时终止显色。梯度酒精脱水,二甲苯透明,封片阴干后镜下观察拍照、细胞计数。
1.6 Western blot检测海马PSD-95表达水平取分装右侧海马组织,加入蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂,冰上裂解30 min。4 ℃,12 000 r/min,离心10 min,取上清,采用BCA蛋白测定试剂盒(Thermo Fisher Scientific公司,美国)测定其蛋白浓度,加入Loading Buffer,100 ℃煮3~5 min,制成样品4 ℃保存待用。采用SDS-PAGE电泳,NC膜(MilliPore公司,美国)转膜。5%脱脂牛奶封闭1 h,一抗4 ℃过夜,一抗为兔多克隆PSD-95抗体(1:500,Santa Cruz公司,美国)及鼠β-actin(1:1 000,Sigma公司,美国)。二抗为IRDye 800CW荧光抗体(1:1 000,Licor公司,美国)。采用Odyssey Imaging System进行扫膜显影,利用Image J软件计算PSD-95和β-actin灰度值,用PSD-95/β-actin比值代表PSD-95的相对含量。
1.7 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 AAV-proBDNF在AD鼠海马的表达侧脑室注射后4周,AAV-proBDNF组AD鼠海马proBDNF在4周时表达水平达到高峰,明显高于正常对照组(P < 0.01)。而空载体对照组AD鼠海马proBDNF表达水平与正常对照组比较差异无统计学意义,但显著低于AAV-proBDNF组(P < 0.05,图 1)。
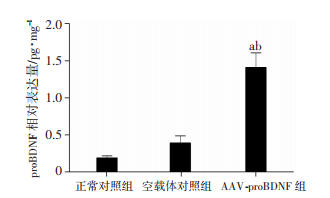
|
| a:P < 0.01,与正常对照组比较;b:P < 0.05,与空载体对照组比较 图 1 AAV-proBDNF侧脑室注射前后海马proBDNF的含量 |
2.2 AAV-proBDNF对AD鼠海马齿回DCX阳性细胞的影响
采用DCX标记海马区齿状回新生的神经元。结果显示(图 2):DCX阳性细胞大部分位于颗粒细胞层与门区之间,即海马下颗粒层区,细胞紧密排列、成簇出现,位置越偏向颗粒细胞层,胞体形态越接近颗粒细胞。AAV-proBDNF组海马DCX阳性细胞数为(202.46±24.27),明显低于正常对照组(382.26±37.58,P < 0.05)和空载体对照组(365.48±32.68,P < 0.05)。
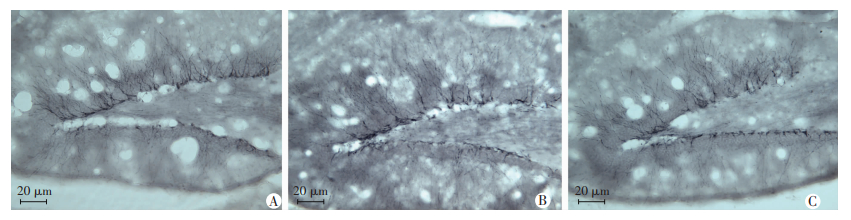
|
| A:正常对照组;B:空载体对照组;C:AAV-proBDNF组 图 2 AAV-proBDNF对AD鼠海马齿状回DCX阳性细胞数的影响(SABC) |
2.3 AAV-proBDNF对AD鼠海马区PSD-95表达的影响
Western blot检测正常对照组、空载体对照组与AAV-proBDNF组AD鼠脑内海马区PSD-95的表达情况,结果显示:AAV-proBDNF组海马PSD-95相对含量明显低于正常对照组和空载体对照组(P < 0.05,图 3)。
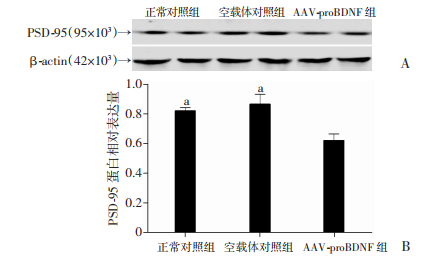
|
| A:Western blot检测;B:半定量分析a:P < 0.05,与AAV-proBDNF组比较 图 3 AAV-proBDNF对AD鼠海马PSD-95表达的影响 |
3 讨论
BDNF是神经营养因子家族中重要的一员,它广泛分布于中枢神经系统。BDNF首先是以前体蛋白proBDNF的形式由细胞合成和分泌,proBDNF再进一步被细胞内弗林酶、前体蛋白转化酶,或是细胞外血浆纤维溶酶和基质金属蛋白酶-9等裂解产生成熟BDNF和proBDNF前片段pro-domain[6-7]。近年研究表明proBDNF不只是BDNF的前体,本身具有与BDNF相反的作用。proBDNF对神经元的重塑、突触传递和突触可塑性具有负性调控作用[8],proBDNF通过与p75神经营养因子受体(p75 neurotrophin receptor,p75NTR)、sortilin结合形成功能三聚体,从而抑制新生小鼠小脑颗粒细胞的增殖、迁移[3, 9]。同时,proBDNF在多种神经精神类疾病,如精神分裂症、重度抑郁症、双相情感障碍、长期慢性压力等的发生与进展中发挥重要调控作用[10]。我们前期研究表明:proBDNF与p75NTR结合后降低海马神经发生、促进脑内β淀粉样蛋白(Aβ)沉积,进而引起小鼠学习与记忆缺陷[11-12],说明proBDNF可能参与AD的发生发展过程。
以往关于proBDNF功能的研究中,大多采用外源性抗裂解proBDNF进行干预研究,不能如实反映内源性proBDNF的功能。本实验将腺相关病毒(AAV)和点突变proBDNF进行基因整合形成重组基因载体AAV-proBDNF,采用侧脑室注射的方式将AAV-proBDNF转导神经细胞以表达抗裂解proBDNF。结果表明:给予AAV-proBDNF后,AD鼠脑内proBDNF表达明显上升,在注射后4周达高峰,高于空载体对照组,说明AAV-proBDNF在AD鼠脑内转染表达成功。为探讨proBDNF在AD发病中的作用,本实验进一步观察AAV-proBDNF侧脑室注射4周后,AD鼠海马神经元增殖以及突触可缩性的变化。
成年海马神经发生与学习、记忆等密切相关,齿状回颗粒下层(subgranular zone,SGZ)是神经发生的重要部位之一,而老龄以及AD患者海马神经发生能力明显下降[13]。DCX是一种微管结合蛋白,在中枢神经系统成长过程中高度表达,神经元前体细胞DCX的表达被视为成年神经发生的标志。因此,本实验选用DCX作为海马神经干细胞向神经元分化的标志,并通过向AD小鼠侧脑室注射AAV-proBDNF来观察海马神经发生的变化。结果表明:给予AAV-proBDNF后,AD鼠海马齿状回颗粒下层区中的DCX阳性细胞数明显减少。这可能是SGZ区神经元前体细胞减少所致,表明侧脑室注射AAV-proBDNF后AD鼠海马齿状回颗粒细胞增生受到一定抑制。
PSD-95属于突触后致密区核心构架蛋白,具有调节、聚合受体,稳定突触连接结构,传导膜受体信号的作用,是突触可塑性及皮质和海马神经元LTP的主要调控者,在学习和记忆的调控中起重要作用,敲除PSD-95基因可引起小鼠LTP的改变和学习记忆功能障碍[13]。PSD-95还通过不同结构域与其他蛋白相互作用,在介导和整合N-甲基-D-天冬氨酸受体(N-methyl- D-aspartate receptors,NMDARs)信号转导中具有关键作用,对记忆形成和信息传递起着重要作用[14]。而本实验结果表明:侧脑室注射AAV-proBDNF后AD鼠海马内PSD-95含量较对照组明显降低,提示其神经突触后兴奋性传递水平降低,proBDNF可能通过降低海马内PSD-95的表达,进而降低AD鼠学习记忆功能。
本实验采用立体定位的方法进行AD鼠侧脑室定向微量注射AAV-proBDNF,观察AAV-proBDNF在AD鼠海马的表达情况,以及对AD鼠海马区DCX阳性细胞数和PSD-95表达的影响,结果表明:AAV-proBDNF在AD鼠脑内成功转染并表达proBDNF,proBDNF不仅抑制海马齿状回新生神经元的产生,而且抑制海马PSD-95表达。表明proBDNF对海马神经发生和突触可塑性具有重要的负性调控作用,参与AD的发病机制。其机制可能与proBDNF促进脑内Aβ沉积有关[12],但其具体机制有待进一步研究。
| [1] | HARWARD S C, HEDRICK N G, HALL C E, et al. Autocrine BDNF-TrkB signalling within a single dendritic spine[J]. Nature, 2016, 538(7623): 99–103. DOI:10.1038/nature19766 |
| [2] | KUIPERS S D, TRENTANI A, TIRON A, et al. BDNF-induced LTP is associated with rapid Arc/Arg3.1-dependent enhancement in adult hippocampal neurogenesis[J]. Sci Rep, 2016, 6: 21222. DOI:10.1038/srep21222 |
| [3] |
陈甲, 张涛, 刘娟, 等. proBDNF对培养鼠小脑颗粒细胞增殖和凋亡的影响[J].
第三军医大学学报, 2014, 36(19): 1981–1986.
CHEN J, ZHANG T, LIU J, et al. proBDNF inhibits cell proliferation and apoptosis in cultured cerebellar granule cells[J]. J Third Mil Med Univ, 2014, 36(19): 1981–1986. DOI:10.16016/j.1000-5404.2014.19.003 |
| [4] | KAILAINATHAN S, PIERS T M, YI J H, et al. Activation of a synapse weakening pathway by human Val66 but not Met66 pro-brain-derived neurotrophic factor (proBDNF)[J]. Pharmacol Res, 2016, 104: 97–107. DOI:10.1016/j.phrs.2015.12.008 |
| [5] | DINIZ B S, TEIXEIRA A L. Brain-derived neurotrophic factor and Alzheimer's disease: physiopathology and beyond[J]. Neuromolecular Med, 2011, 13(4): 217–222. DOI:10.1007/s12017-011-8154-x |
| [6] | GUO J, JI Y, DING Y, et al. BDNF pro-peptide regulates dendritic spines via caspase-3[J]. Cell Death Dis, 2016, 7(6): e2264. DOI:10.1038/cddis.2016.166 |
| [7] | ROSA E, MAHENDRAM S, KE Y D, et al. Tau downregulates BDNF expression in animal and cellular models of Alzheimer's disease[J]. Neurobiol Aging, 2016, 48: 135–142. DOI:10.1016/j.neurobiolaging.2016.08.020 |
| [8] | YANG J, HARTE-HARGROVE L C, SIAO C J, et al. ProBDNF negatively regulates neuronal remodeling, synaptic transmission, and synaptic plasticity in hippocampus[J]. Cell Rep, 2014, 7(3): 796–806. DOI:10.1016/j.celrep.2014.03.040 |
| [9] | XU Z Q, SUN Y, LI H Y, et al. Endogenous proBDNF is a negative regulator of migration of cerebellar granule cells in neonatal mice[J]. Eur J Neurosci, 2011, 33(8): 1376–1384. DOI:10.1111/j.1460-9568.2011.07635.x |
| [10] | DINIZ C, CASAROTTO P C, RESSTEL L, et al. Beyond good and evil: a putative continuum-sorting hypothesis for the functional role of proBDNF/BDNF-propeptide/mBDNF in antidepressant treatment[J]. Neurosci Biobehav Rev, 2018, 90: 70–83. DOI:10.1016/j.neubiorev.2018.04.001 |
| [11] | CHEN J, LI C R, YANG H, et al. proBDNF attenuates hippocampal neurogenesis and induces learning and memory deficits in aged mice[J]. Neurotox Res, 2016, 29(1): 47–53. DOI:10.1007/s12640-015-9568-2 |
| [12] | CHEN J, ZHANG T, JIAO S, et al. ProBDNF accelerates brain amyloid-β deposition and learning and memory impairment in APPswePS1dE9 transgenic mice[J]. J Alzheimers Dis, 2017, 59(3): 941–949. DOI:10.3233/JAD-161191 |
| [13] | HORGUSLUOGLU-MOLOCH E, NHO K, RISACHER S L, et al. Targeted neurogenesis pathway-based gene analysis identifies ADORA2A associated with hippocampal volume in mild cognitive impairment and Alzheimer's disease[J]. Neurobiol Aging, 2017, 60: 92–103. DOI:10.1016/j.neurobiolaging.2017.08.010 |
| [14] | LISEK M, FERENC B, STUDZIAN M, et al. Glutamate deregulation in ketamine-induced psychosis-a potential role of PSD95, NMDA receptor and PMCA interaction[J]. Front Cell Neurosci, 2017, 11: 181. DOI:10.3389/fncel.2017.00181 |



