2. 400016 重庆,重庆医科大学基础医学院:分子医学与肿瘤研究中心
2. Molecular Medicine and Cancer Research Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
糖尿病是一种多病因的、因胰岛素绝对缺乏或者胰岛素利用障碍而引起的代谢疾病,会出现持续高血糖。糖尿病有多种并发症,在包括眼睛、肾脏和心脏在内的多种器官中产生长期损害和功能障碍。糖尿病肾病(diabetic nephropathy,DN)是糖尿病较为严重的一种并发症,其中肾纤维化和肌成纤维细胞的激活是导致终末期严重肾损害的主要原因[1]。持续性高血糖被认为是DN发展的驱动力,但实际上DN的发病机制繁多,涉及炎症、氧化应激等多种机制和因素。近年研究表明,肾脏炎症对促进DN发展至关重要,炎症可能是DN中刺激已知的生化和代谢紊乱的关键因素。尽管炎症已经被认为是DN发生、发展中的一个重要环节,但其具体机制仍无定论,目前的诊治手段仍不理想[2]。
长链非编码RNA(long non-coding RNA,lncRNA)缺乏编码蛋白质的能力,在许多生命过程中发挥着关键的作用,既能分布于细胞质,也能分布于细胞核,其长度大于200 nt。已有研究发现lncRNA影响多种疾病炎症的发生、发展,且与DN炎症相关[3]。但是lncRNA在DN炎症中的确切作用还不明确。本研究将DN小鼠肾脏组织和正常小鼠肾脏组织送检,通过二代测序技术,找出在组织中异常表达的lncRNA,发现了Rpph1这一lncRNA在DN小鼠肾脏组织中表达明显高于正常小鼠肾脏组织。因此,针对Rpph1做进一步研究,探讨Rpph1与DN炎症发生是否相关,以及其具体的潜在作用。接着在高低糖培养的系膜细胞中检测Rpph1的表达,构建Rpph1的过表达质粒和siRNA,转染于肾小球系膜细胞后用qRT-PCR验证其效率以及检测炎症相关因子MCP-1、TNF-α的表达,探讨Rpph1在DN炎症中可能的作用,为治疗DN提供一个新的思路。
1 材料与方法 1.1 材料与试剂小鼠肾小球系膜细胞株SV40-MES14为本实验室保存,DN模型小鼠B6.BKS(D)-Leprdb购自南京生物医药研究院,按SPF级饲养[4];细胞培养瓶、培养皿、玻璃瓶购自无锡耐思生物科技有限公司;Rpph1过表达质粒、转染试剂Lipofectamine 2000、Lipofectamine 3000购自Invitrogen公司;TRIzol、逆转录试剂盒和SYBR Green试剂购自TaKaRa公司;去内毒素质粒小提试剂盒购自Omega公司;胎牛血清购自上海生工生物工程股份有限公司;DMEM高糖和低糖培养基购自HyClone公司;Rpph1 FISH探针由广州锐博生物科技有限公司设计合成;SDS-PAGE相关试剂及细胞裂解液、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;PVDF膜购自美国Millipore公司;兔抗TNF-α购自BBI Life Science公司;兔抗MCP-1购自上海爱必信生物科技有限公司。
1.2 小鼠肾脏组织提取在糖尿病肾病小鼠和正常小鼠达到18周龄时,提取小鼠肾脏组织,将小鼠组织分为DN组(糖尿病肾病小鼠肾脏组织)和Nor组(正常小鼠肾脏组织),液氮保存备用。
1.3 细胞培养及转染肾小球系膜细胞分别用低糖(5 mmol/L)和DMEM高糖(25 mmol/L)培养基培养,胎牛血清含量为15%,将细胞分别命名为L-MC组和H-MC组。进一步将转染时仅加入脂质体Lipofectamine 2000的高糖培养的系膜细胞命名为H-MC mock组,转染siRNA阴性对照的高糖培养的系膜细胞命名为H-MC siNC组,转染Rpph1 siRNA的高糖培养的系膜细胞命名为H-MC siRpph1组;在低糖培养的系膜细胞中将转染时仅加入脂质体Lipofectamine 3000的命名为L-MC mock组,将转染空载质粒的命名为L-MC pcDNA3.1组以及将转染Rpph1过表达质粒的命名为L-MC Rpph1(+)组。用6孔板接种细胞,细胞增殖到75%~80%左右时进行转染,5 h后换为含15%血清的培养基,24 h后提细胞RNA,qRT-PCR检测过表达及干扰效率。
1.4 lncRNA-Rpph1编码蛋白能力分析运用在线软件ORF Finder (www.ncbi.nlm.nih.gov/orffinder/)以及CPC2(Coding Potential Calculator 2) (http://cpc2.cbi.pku.edu.cn/)分析lncRNA-Rpph1的蛋白编码能力。
1.5 pcDNA3.1(+)-Rpph1真核表达质粒构建运用Primer Premier 5.0软件设计Rpph1引物,Pubmed在线比对引物是否符合以及其特异性。质粒表达载体为pcDNA3.1(+),对Rpph1进行酶切位点扫描分析,对照质粒多克隆位点,分别在Rpph1的上游和下游引物加入BamHⅠ和EcoRⅠ位点,扩增Rpph1全长序列。其引物序列上游:5′-GGATCCAGTGGGCGGAGGAAGCTCATC-3′,下游:5′-GATATCAGGGCGGG-GGAGAGTAGTCTGAA-3′。PCR扩增Rpph1,琼脂糖凝胶电泳和纯化,大约为343 bp,配置双酶切体系(BamHⅠ和EcoRⅠ),然后37 ℃孵育1 h,加入T4连接酶16 ℃过夜将Rpph1 PCR产物连接到真核表达载体上,然后按步骤转化E.coli DH5α感受态细胞,取150 μL接种到含氨苄青霉素(50 μg/mL)的平板上,平板划线法挑选阳性单克隆,培养过夜,观察结果。在50 mL塑料离心管中加入15 mL培养基,加入抗生素,250 r/min、37 ℃摇床摇菌13~16 h,按试剂盒步骤提质粒,测质粒浓度,取相应质粒进行双酶切,琼脂糖凝胶电泳和测序鉴定是否连接成功。Pubmed在线比对测序结果,若扩增的目的片段与小鼠Rpph1基因序列同源性一致说明质粒构建成功。空载质粒作为对照组。
1.6 设计合成Rpph1小干扰RNA参考小鼠Rpph1基因序列,通过DSIR (http://biodev.extra.cea.fr/DSIR/DSIR.html)和siDirect version 2.0(http://sidirect2.rnai.jp/)在线设计Rpph1的3条siRNAs序列。序列1:5′-CCAGCAGTGCGAGTTCAAT-3′;序列2:5′-CGAGTTCAATGGCTGAGGT-3′;序列3:5′-GGCCTCATAACCCAATTCA-3′。siRNA序列由广州锐博生物有限公司合成,qRT-PCR鉴定干扰效率。
1.7 qRT-PCR检测Rpph1的表达TRIzol提取组织和细胞总RNA,按照PrimerScriptTM说明书进行逆转录,-20 ℃保存cDNA。设计Rpph1和β-actin的引物然后比对其特异性并交公司合成。Rpph1上游:5′-CAGACTGGGCAGGAGAAGCC-3′,下游:5′-TCACCTCAGCCATTGAACTCG-3′;β-actin上游:5′-GCTCAGTAACAGTCCGCCTAG-3′,下游:5′-AGTGTGACGTTGACATCCG-3′。以cDNA为模版,用配置PCR反应体系,体系为10 μL,每个检测指标设置3个复孔。PCR程序如下所示:95 ℃预变性3 min,95 ℃ 5 s,58 ℃ 34 s,72 ℃ 60 s,共40个循环,选用2-ΔΔCt法分析Rpph1的相对定量数据。
1.8 FISH检测Rpph1亚细胞定位按照试剂盒说明书进行实验操作,在高糖培养的系膜细胞和低糖培养的系膜细胞中检测Rpph1的定位情况。细胞分组情况为H-MC、L-MC、Control(仅用DAPI,不加Rpph1探针处理细胞)3组,在放有载玻片的24孔板中接种细胞,细胞培养箱培养24 h。实验步骤如下:PBS清洗24孔板4次,吸掉PBS,然后每孔加入100 μL 4%多聚甲醛,常温静置10 min,配置0.5%的Triton X-100,每孔加入100 μL 0.5%Triton X-100,5 min,增加细胞通透性,PBS洗4次,每次5 min,预杂交液和杂交液使用前先在37 ℃烘箱预热30 min,杂交前先每孔加入100 μL预杂交液,37 ℃恒温箱中放置20 min。用枪头轻轻吸去预杂交液,将lncRNA-Rpph1 FISH探针与杂交液以1 :50比例稀释,向每孔加入100 μL混合液,避光,37 ℃恒温箱中杂交过夜。次日先将4×SSC、2×SSC、1×SSC 50 ℃预热,按高浓度到低浓度顺序清洗细胞3次。枪头吸掉SSC,每孔加入10 μL DAPI工作液,静置8 min,PBS洗3次,最后封片拍照获取图像。
1.9 Western blot检测TNF-α、MCP-1的表达在高糖和低糖培养的系膜细胞中分别转染Rpph1的siRNA和过表达质粒,2 d后PBS洗涤细胞,用细胞刮轻轻刮下细胞,低速离心后收集细胞,将PMSF和RIPA按1 :100混合,加入适量裂解液,4 ℃裂解细胞40 min,裂解过程中振荡细胞3次,15 000 r/min 4 ℃离心30 min,小心吸取上清,进行蛋白定量实验检测上清中蛋白浓度,将样品与5×的蛋白上样缓冲液按4 :1混匀,98 ℃煮8 min使蛋白变性,放于-20 ℃冰箱。SDS-PAGE凝胶电泳,切胶,转膜,封闭,分别加入兔抗TNF-α一抗(1 :800稀释)和兔抗MCP-1一抗(1 :800稀释),4 ℃过夜。TBST洗涤PVDF膜,TBST稀释HRP标记山羊抗兔IgG二抗(1 :7 000稀释),加入PVDF膜,常温放于摇床上,2 h后显影,Image J软件分析灰度值,GAPDH为内参。
1.10 统计学分析采用SPSS 19.0统计软件分析实验数据,两组数据比较采用t检验,多组间数据的比较采用单因素方差分析,检验水准α=0.05。
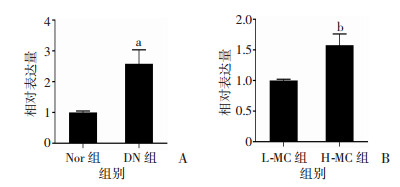
2 结果 2.1 Rpph1在DN小鼠肾脏组织和高糖培养的系膜细胞中高表达通过二代测序分析差异表达的基因,与正常对照小鼠肾脏组织相比,在DN小鼠肾脏组织中Rpph1水平显著上调。进一步通过qRT-PCR检测在DN小鼠肾脏组织和正常小鼠肾脏组织,以及高糖培养的系膜细胞和低糖培养的系膜细胞中Rpph1的表达。在DN小鼠肾脏组织Rpph1的表达较正常小鼠肾脏组织明显上调;同样,高糖环境下的系膜细胞中Rpph1表达水平明显高于低糖培养的系膜细胞(P < 0.01,图 1)。
|
| A:糖尿病肾病小鼠和正常小鼠肾脏组织中Rpph1水平a:P < 0.01,与Nor组比较;B:高糖和低糖培养的系膜细胞中Rpph1水平b:P < 0.01,与L-MC组比较 图 1 qRT-PCR检测Rpph1在DN小鼠肾脏组织和系膜细胞中的表达水平 |
2.2 生物信息学分析Rpph1的非编码性
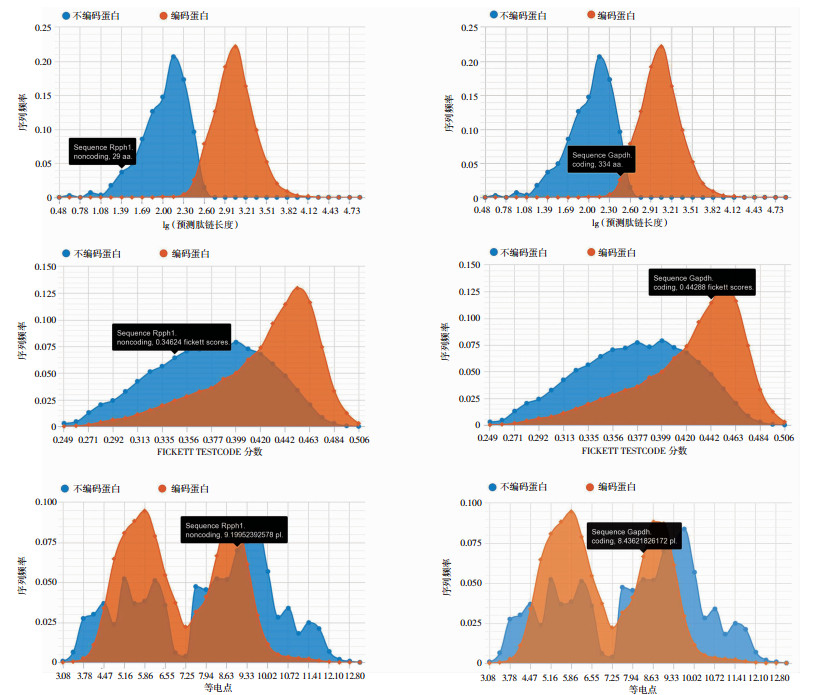
通过CPC2和ORF Finder在线软件分析Rpph1的蛋白编码能力,结果显示Rpph1无蛋白编码能力,以GAPDH为对照(图 2);将ORF Finder预测的氨基酸序列(表 1)在NCBI中比对,结果显示没有相匹配的蛋白,提示Rpph1确实是无蛋白编码能力的lncRNA。
|
| 左侧:Rpph1;右侧:GAPDH 图 2 CPC2分析Rpph1编码蛋白能力 |
| 名称 | 链方向 | 阅读框 | 起始位置 | 终止位置 | 长度(nt|aa) |
| ORF1 | + | 1 | 61 | 276 | 216|71 |
| ORF5 | - | 1 | 307 | 95 | 213|70 |
| ORF2 | + | 2 | 71 | 271 | 201|66 |
| ORF7 | - | 3 | 167 | 3 | 165|54 |
| ORF4 | + | 3 | 264 | 323 | 60|19 |
| ORF6 | - | 3 | 302 | 261 | 42|13 |
| ORF3 | + | 3 | 36 | 74 | 39|12 |
2.3 Rpph1主要定位于系膜细胞胞质
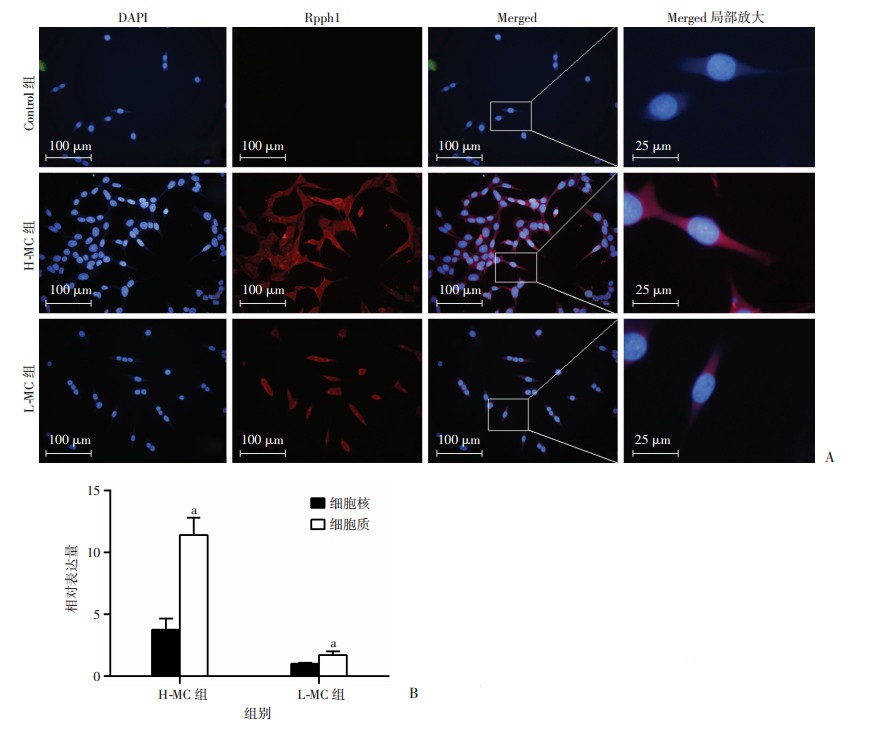
FISH结果显示,Rpph1在系膜细胞的细胞质与细胞核均有分布,但主要定位在细胞质;同时,高糖环境下的系膜细胞中,其水平高于低糖培养的系膜细胞(图 3A)。此外,qRT-PCR结果提示Rpph1主要存在于系膜细胞的胞质部分(P < 0.01,图 3B),与FISH实验结果相一致。
|
| A:FISH检测Rpph1主要分布在系膜细胞的胞质;B:qRT-PCR检测Rpph1主要存在于系膜细胞的细胞部分a:P<0.01与细胞核比较 图 3 Rpph1的亚细胞定位及分布 |
2.4 Rpph1过表达质粒转染效率检测和Rpph1 siRNAs的筛选
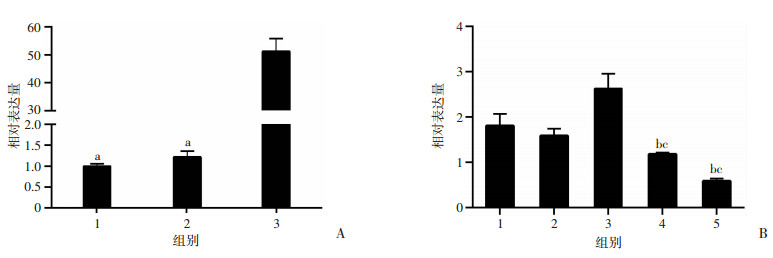
qRT-PCR检测3条Rpph1 siRNAs的敲低效率见图 4。在高糖培养的系膜细胞中siRNA-3的敲低效率最佳,其干扰效率超过60%。因此,后续实验将选择该条siRNA进行。同时,qRT-PCR验证在低糖培养的系膜细胞中转染了Rpph1过表达质粒后Rpph1的表达,其表达水平显著提高(P < 0.01)。
|
| A:低糖培养的系膜细胞中检测Rpph1过表达效率;1:L-MC mock组;2:L-MC pcDNA3.1组;3:L-MC Rpph1(+)组;a:P < 0.01, 与L-MC Rpph1(+)组比较;B:高糖培养的系膜细胞中检测Rpph1-siRNAs敲低效率;1:H-MC mock组;2:H-MC siNC组;3:H-MC siRpph1组;4:H-MC siRpph2组;5:H-MC siRpph3组;b:P < 0.01;与H-MC mock组比较;c:P < 0.01, 与H-MC siNC组比较 图 4 qRT-PCR检测转染过表达质粒和siRNAs后系膜细胞Rpph1的表达水平 |
2.5 高糖条件下Rpph1促进系膜细胞炎症因子的表达
Western blot检测转染Rpph1过表达质粒和siRNA后对炎症相关因子TNF-α和MCP-1表达的影响。结果显示,在低糖细胞中转染Rpph1过表达质粒后,TNF-α和MCP-1的蛋白表达水平明显上调(P < 0.01);而在高糖培养的系膜细胞中转染Rpph1 siRNA后,TNF-α和MCP-1的蛋白表达水平均明显降低(P < 0.01,图 5)。表明Rpph1对系膜细胞中炎症因子的表达具有调控作用,参与了DN炎症。
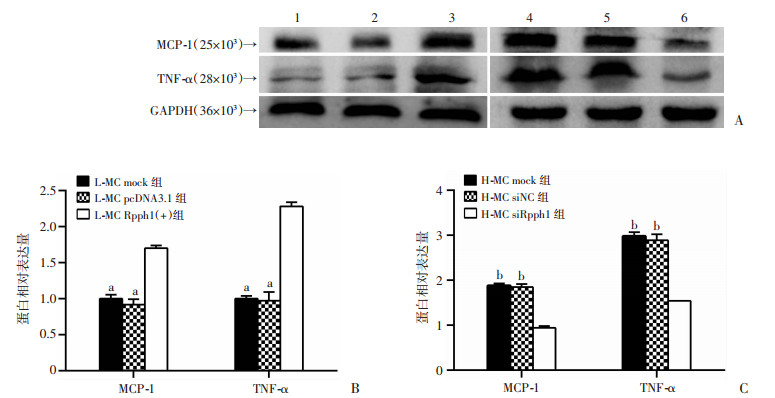
|
| A:Western blot检测结果;1:L-MC mock组;2:L-MC pcDNA3.1组;3:L-MC Rpph1(+)组;4:H-MC mock组;5:H-MC siNC组;6:H-MC siRpph1组;B、C:半定量分析结果;a:P < 0.01, 与L-MC Rpph1(+)组比较;b:P < 0.01, 与H-MC siRpph1组比较 图 5 过表达和敲低Rpph1对系膜细胞TNF-α和MCP-1表达的影响 |
3 讨论
近年来,越来越多的研究发现炎症参与了DN,许多学者提出了微炎症学说,是指患者机体在一些化学物质、内毒素、微生物、受体、脂肪因子、趋化因子等刺激后,激活单核/巨噬细胞系统,炎症相关因子分泌增多的一个缓慢而持续的微炎症反应,该学说认为DN是低度炎症和先天性免疫的一种疾病,炎症能导致肾脏损害,对DN的进展发挥了至关重要的作用[5-6]。炎症反应在DN的进展过程中发挥了重要作用,炎症因子的异常表达是DN炎症反应的典型特征。然而,由于众多复杂因素参与DN的发生发展,DN炎症因子的表达调控至今尚无定论。
lncRNA在最近几年成为科研热点,参与了许多复杂的调控网络。lncRNA功能繁多,广泛参与到组蛋白修饰、DNA甲基化和染色质重塑等生物学过程,能直接与一些RNA分子、蛋白质作用,在转录水平和转录后水平调控靶基因的表达[7]。lncRNA的异常表达参与了多种疾病的发生发展,包括心血管疾病、神经病变、癌症以及代谢性疾病[8]。此外,lncRNA的表达异常,在DN的发展中亦起到至关重要的作用。有报道称lncRNA参与调节肾脏对高血糖的反应,促进DN进展[9]。WANG等[10]报道lncRNA CYP4B1-PS1-001在早期糖尿病体内体外明显下调,而CYP4B1-PS1-001的过表达抑制了系膜细胞的增殖和纤维化。不仅如此,lncRNA也参与炎症过程。CARPENTER等[11]报道lncRNA-Cox2被鉴定为TLR配体诱导的动态调控基因,进而发挥促进和抑制炎症因子表达的作用;一些lncRNAs包括THRIL[12]、lnc13[13]被报道可调节髓系细胞的炎性基因表达。提示lncRNA可能参与DN炎症,尤其是本课题组在前期发现lncRNA-Gm4419在高糖培养的系膜细胞中高表达,并通过NF-κB信号通路调节DN炎症[14]。因此,lncRNA在糖尿病肾病炎症中可能扮演了重要的角色,是DN潜在新型分子标志物和治疗靶点,然而其确切机制目前还不清楚。
为了确定lncRNA与DN的内在关系,通过RNA-seq找出在DN小鼠肾脏组织中表达异常的lncRNAs,分析并验证相关lncRNA。本研究运用qRT-PCR验证DN小鼠肾脏组织内lncRNAs的表达,Ribonuclease P RNA component H1(Rpph1)在DN小鼠肾脏组织中较正常对照小鼠肾脏组织明显高表达。结果还显示Rpph1在高低糖培养的系膜细胞中的表达趋势与DN及正常肾脏组织一致。以上均提示lncRNA Rpph1可能是一个参与DN发生、发展的因子。Rpph1是核糖核酸酶P(RNase P)核糖核蛋白的RNA组分,位于小鼠14号染色体(chr14:50807447-50807771),长度为325 bp。最近有研究表明,核糖核酸酶P参与了lncRNA MALAT1的成熟[15];Rpph1在人类胃癌组织[16]和癫痫患者的新皮质[17]中上调;ZHANG等[18]研究证明Rpph1敲低后抑制了乳腺癌细胞的增殖和肿瘤的发生,但迄今为止未见任何Rpph1与糖尿病肾病的相关报道。本实验通过编码蛋白能力分析软件检测发现Rpph1不具有蛋白编码能力,再次证实其为非编码RNA。然而,Rpph1在DN中具体作用如何,还需更深入的研究。
为了探索lncRNA-Rpph1在DN中扮演的具体角色,应用高糖模拟糖尿病状态培养系膜细胞[19],利用荧光原位杂交技术和实时荧光定量PCR检测Rpph1在细胞中的分布。结果提示Rpph1在系膜细胞胞核与胞质均有分布,但主要分布在细胞质。而lncRNA在细胞中的分布不同,其发挥的功能也不相同。如果分布在细胞质,lncRNA主要是通过竞争性结合miRNA,抑制miRNA与靶基因结合以此调节基因表达,或者与特定蛋白质结合形成复合物来参与基因调控;如果分布于细胞核,可通过顺式和反式两种方式发挥作用,影响染色质重塑或者转录调控等过程[20]。结合本研究结果提示,Rpph1发挥作用的方式可能与其主要分布于细胞质相关,即竞争性结合miRNA或者与蛋白质相互作用从而调控基因的表达。这两种作用方式可能是Rpph1的重要机制,为我们后续深入研究Rpph1提供了方向。
此外,我们成功构建了Rpph1过表达质粒以及合成Rpph1 siRNA,在高糖和低糖培养的系膜细胞中分别转染siRNA和过表达质粒,qRT-PCR检测Rpph1的过表达和敲低效率,结果显示过表达和沉默效率较好,为后面实验研究Rpph1在系膜细胞中的功能提供了良好的基础。
为研究Rpph1在DN炎症中的作用,我们将目光投向TNF-α和MCP-1这两个重要的炎症相关因子。研究发现,TNF-α是一种主要由巨噬细胞、T细胞以及单核细胞产生,同时在树突细胞、肾小球系膜细胞、内皮细胞和肾小管细胞等肾脏固有细胞中也能被分泌合成的多效性炎症相关因子[21];TNF-α参与单核-巨噬细胞的招募,并通过启动一系列细胞因子和增加血管通透性诱发局部炎症,且TNF-α对肾脏细胞有细胞毒性,可直接诱发肾损伤,是引起糖尿病肾病炎症的重要因素[22];CHOW等[23]证明了MCP-1在糖尿病肾病中的致病作用,在糖尿病模型小鼠中敲除MCP-1后,其肾损害得到了减轻。在糖尿病肾病中MCP-1为表达上调,MCP-1能促进单核巨噬细胞的迁移、活化,以及调节其他炎症因子和粘附因子的表达,从而促进了糖尿病肾病炎症的发展[24]。本研究同时在低糖培养的系膜细胞中过表达Rpph1和在高糖培养的系膜细胞中沉默Rpph1,运用Western blot检测TNF-α和MCP-1的表达。结果显示,过表达Rpph1后TNF-α和MCP-1的蛋白表达水平显著增高,反之,下调Rpph1之后TNF-α和MCP-1的蛋白表达明显降低(P < 0.01)。以上结果提示,Rpph1可能通过促进炎症因子TNF-α和MCP-1的表达,参与了DN炎症的发生、发展。
综上所述,本研究发现了在DN小鼠肾脏组织和高糖培养的系膜细胞中异常高表达的lncRNA Rpph1,且高低表达Rpph1可调节系膜细胞炎症因子TNF-α和MCP-1的表达,从而参与DN炎症发生、发展过程。因此,针对Rpph1在DN中的作用,可为DN的预防和治疗提供一个新的方向。但lncRNA对DN的影响是一个极其复杂的过程,Rpph1在DN炎症中的具体机制如何,还需进一步研究。
| [1] | ZEISBERG M, NEILSON E G. Mechanisms of tubulointerstitial fibrosis[J]. J Am Soc Nephrol, 2010, 21(11): 1819–1834. DOI:10.1681/ASN.2010080793 |
| [2] | OLATUNJI O J, CHEN H, ZHOU Y. Lycium chinense leaves extract ameliorates diabetic nephropathy by suppressing hyperglycemia mediated renal oxidative stress and inflammation[J]. Biomed Pharmacother, 2018, 102: 1145–1151. DOI:10.1016/j.biopha.2018.03.037 |
| [3] | TANG P M, TANG P C, CHUNG J Y, et al. TGF-β1 signaling in kidney disease: From Smads to long non-coding RNAs[J]. Noncoding RNA Res, 2017, 2(1): 68–73. DOI:10.1016/j.ncrna.2017.04.001 |
| [4] | SUN Y, PENG R, PENG H, et al. miR-451 suppresses the NF-kappaB-mediated proinflammatory molecules expression through inhibiting LMP7 in diabetic nephropathy[J]. Mol Cell Endocrinol, 2016, 433: 75–86. DOI:10.1016/j.mce.2016.06.004 |
| [5] | HOJS R, EKART R, BEVC S, et al. Markers of inflammation and oxidative stress in the development and progression of renal disease in diabetic patient[J]. Nephron, 2016, 133(3): 159–162. DOI:10.1159/000447434 |
| [6] | WADA J, MAKINO H. Inflammation and the pathogenesis of diabetic nephropathy[J]. Clin Sci, 2013, 124(3): 139–152. DOI:10.1042/CS20120198 |
| [7] | WIERZBICKI A T. The role of long non-coding RNA in transcriptional gene silencing[J]. Curr Opin Plant Biol, 2012, 15(5): 517–522. DOI:10.1016/j.pbi.2012.08.008 |
| [8] | UCHIDA S, DIMMELER S. Long noncoding RNAs in cardiovascular diseases[J]. Circ Res, 2015, 116(4): 737–750. DOI:10.1161/CIRCRESAHA.116.302521 |
| [9] | ALVAREZ M L, DISTEFANO J K. The role of non-coding RNAs in diabetic nephropathy: potential applications as biomarkers for disease development and progression[J]. Diabetes Res Clin Pract, 2013, 99(1): 1–11. DOI:10.1016/j.diabres.2012.10.010 |
| [10] | WANG M, WANG S, YAO D, et al. A novel long non-coding RNA CYP4B1-PS1-001 regulates proliferation and fibrosis in diabetic nephropathy[J]. Mol Cell Endocrinol, 2016, 426: 136–145. DOI:10.1016/j.mce.2016.02.020 |
| [11] | CARPENTER S, AIELLO D, ATIANAND M K, et al. A long noncoding RNA mediates both activation and repression of immune response genes[J]. Science, 2013, 341(6147): 789–792. DOI:10.1126/science.1240925 |
| [12] | CASTELLANOS-RUBIO A, FERNANDEZ-JIMENEZ N, KRATCHMAROV R, et al. A long noncodingRNA associated with susceptibility to celiac disease[J]. Science, 2016, 352(6281): 91–95. DOI:10.1126/science.aad0467 |
| [13] | CHAN J, ATIANAND M, JIANG Z, et al. Cutting edge: a natural antisense transcript, AS-IL1α, controls inducible transcription of the proinflammatory cytokine IL-1α[J]. J Immunol, 2015, 195(4): 1359–1363. DOI:10.4049/jimmunol.1500264 |
| [14] | YI H, PENG R, ZHANG L Y, et al. LincRNA-Gm4419 knockdown ameliorates NF-κB/NLRP3 inflammasome-mediated inflammation in diabetic nephropathy[J]. Cell Death Dis, 2017, 8(2): e2583. DOI:10.1038/cddis.2016.451 |
| [15] | TRIPATHI V, ELLIS J D, SHEN Z, et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J]. Mol Cell, 2010, 39(6): 925–938. DOI:10.1016/j.molcel.2010.08.011 |
| [16] | XIA T, LIAO Q, JIANG X, et al. Long noncoding RNA associated-competing endogenous RNAs in gastric cancer[J]. Sci Rep, 2014, 4: 6088. DOI:10.1038/srep06088 |
| [17] | LIPOVICH L, DACHET F, CAI J, et al. Activity-dependent human brain coding/noncoding gene regulatory networks[J]. Genetics, 2012, 192(3): 1133–1148. DOI:10.1534/genetics.112.145128 |
| [18] | ZHANG Y, TANG L. Inhibition of breast cancer cell proliferation and tumorigenesis by long non-coding RNA RPPH1, down-regulation of miR-122 expression[J]. Cancer Cell Int, 2017, 17(1): 109. DOI:10.1186/s12935-017-0480-0 |
| [19] | QIN T, ZHAN H, CUI P, et al. A nucleus-localized long non-coding RNA enhances drought and salt stress tolerance[J]. Plant Physiol, 2017, 175(3): 1321–1336. DOI:10.1104/pp.17.00574 |
| [20] | SUN X, HAIDER ALI M S S, MORAN M. The role of interactions of long non-coding RNAs and heterogeneous nuclear ribonucleoproteins in regulating cellular functions[J]. Biochem J, 2017, 474(17): 2925–2935. DOI:10.1042/BCJ20170280 |
| [21] | DONG X, SWAMINATHAN S, BACHMAN L A, et al. Resident dendritic cells are the predominant TNF-secreting cell in early renal ischemia-reperfusion injury[J]. Kidney Int, 2007, 71(7): 619–628. DOI:10.1038/sj.ki.5002132 |
| [22] | ELMARAKBY A A, SULLIVAN J C. Relationship between oxidative stress and inflammatory cytokines in diabetic nephropathy[J]. Cardiovasc Ther, 2012, 30(1): 49–59. DOI:10.1111/j.1755-5922.2010.00218.x |
| [23] | CHOW F Y, NIKOLIC-PATERSON D J, MA F Y, et al. Monocyte chemoattractant protein-1-induced tissue inflammation is critical for the development of renal injury but not type 2 diabetes in obese db/db mice[J]. Diabetologia, 2007, 50(2): 471–480. DOI:10.1007/s00125-006-0497-8 |
| [24] | VIEDT C, ORTH S R. Monocyte chemoattractant protein-1 (MCP-1) in the kidney: does it more than simply attract monocytes?[J]. Nephrol Dial Transplant, 2002, 17(12): 2043–2047. DOI:10.1093/ndt/17.12.2043 |



