胃癌(gastric cancer,GC)是全球第四常见癌症,癌症相关死亡率排在全部恶性肿瘤的第二位[1]。新的生物标志物的发现及其应用将有助于改善对GC的早期诊断和预测靶向药物治疗效果[2]。然而,迄今为止,除了HER2之外,还没有广泛认可的生物标志物来早期诊断胃癌和预测其对靶向药物的反应[3]。因此,寻求新的GC诊治的靶点,进一步提高综合疗效,对胃癌的早期诊断和治疗具有重要意义。
干扰素调节因子4结合蛋白(IRF-4 binding protein,IBP)是2002年Pernis研究小组通过酵母双杂交技术,从人淋巴结cDNA文库中筛选出的一个可以与IRF-4结合的蛋白,主要表达于T淋巴细胞并发挥重要作用。之前对IBP功能的研究主要集中在免疫系统:参与TCR信号刺激下T细胞免疫突触的形成[4];对维持免疫内环境的稳定发挥重要作用,IBP敲除小鼠表现出自身免疫性疾病症状[5]。近年来对IBP在肿瘤中的研究越来越深入:LI等[6]研究确认IBP促进乳腺癌的增殖与侵袭,ZHANG等[7]研究认为IBP与直肠癌的发生、发展相关。p53有野生型和突变型两种基因型,其产物也有突变型和野生型p53蛋白两种,野生型p53基因可以调节细胞生长和凋亡,是一种肿瘤抑制基因,产物p53蛋白是一种抗癌因子,其适度表达可以调节细胞的正常生长发育,但其编码基因的缺失和突变产生的突变型p53蛋白却与许多肿瘤的发生、发展呈正相关[8]。由于野生型p53蛋白半衰期短,不易检测,而突变型p53蛋白因功能丧失而具有不易水解的特性,常常在细胞内积累。因此,免疫组化方法检测p53蛋白一般是突变类型。据报道,p53基因突变与多达50%的恶性肿瘤患者有关[9]。在胃癌中,p53基因是突变率较高的肿瘤抑制基因之一,其基因突变和产物过表达可发生在肿瘤发展的各个阶段[10]。LI等[6]发现在乳腺癌标本中IBP与突变型p53蛋白的表达呈负相关,进一步核酸水平研究发现IBP是一个新的野生型p53蛋白的靶基因,p53表达增加可以抑制IBP的表达,而IBP的诱导则与p53的抑制相关。在乳腺癌细胞株中,野生型p53可以与IBP启动子结合[11]。但IBP在GC中的表达尚不清楚,而胃腺癌中IBP和p53蛋白是否存在着类似的关系也不清楚。因此,本研究通过免疫荧光、Real-time PCR和Western blot检测IBP在胃腺癌细胞株中的表达情况,初步分析IBP在胃腺癌细胞中的表达情况。然后通过免疫组织化学染色检测IBP、p53蛋白在人胃腺癌组织标本中的表达情况,探究GC中IBP与p53蛋白表达之间的相互关系及其与临床病理特征之间的关系。
1 材料与方法 1.1 细胞及标本SGC-7901细胞株购自南京凯基生物科技公司,MKN-45细胞株购自上海中科院细胞库,Jurkat细胞株为本实验室传代保存。
标本来自本科2015-2016年确诊的胃腺癌HE切片对应存档蜡块,包括同期胃镜室活检的胃黏膜标本以及外科手术切除标本共150例,均通过病理明确诊断,入选患者临床病理资料齐全。150例标本中,高分化19例,中低分化131例。109例胃腺癌组织标本来自于外科手术切除(男性87例,女性22例),年龄24~79岁,平均54.74岁;根据国际抗癌联盟(UICC)中胃癌TNM分期标准进行临床病理分期,其中Ⅰ期14人,Ⅱ期45人,Ⅲ期49人,Ⅳ期1人。来自同期胃镜室活检胃腺癌病变标本41例(男性29例,女性12例),年龄37~81岁,平均61.04岁。另外50例癌旁正常胃黏膜标本为非胃腺癌组。本研究经过本院伦理委员会审查(2018-研第060-01),并获得患者知情同意。
1.2 主要试剂小鼠抗人IBP单克隆抗体由陆军军医大学医学检验系胡川闽教授馈赠,小鼠抗人p53蛋白单克隆抗体购自福州迈新生物技术开发有限公司,GAPDH抗体购自美国CST公司,DMEM高糖培养基、0.25%胰蛋白酶和青/链霉素购自美国HyClone公司,胎牛血清购自以色列BI公司,RNA提取试剂盒和RT-PCR试剂盒购自日本TaKaRa公司,Western blot配胶试剂盒购自上海碧云天生物技术公司,免疫组织化学试剂盒、DAB显色试剂盒、EDTA均购自北京中杉金桥生物技术有限公司,中性树胶购自Solarbio公司。
1.3 细胞培养人胃腺癌细胞系MKN-45、SGC-7901、人急性T淋巴细胞Jurkat均采用含10%胎牛血清的DMEM/H培养基,置于37 ℃、5%CO2、95%湿度的恒温培养箱中培养,隔夜换液,3~5 d传代。
1.4 免疫荧光检测取生长良好的MKN-45细胞,制备为1×105个细胞/mL完全DMEM/F12培养液的细胞悬液,接种于1 cm×1 cm的盖玻片,48 h后中止培养,以冰冷的PBS洗涤细胞爬片,4%多聚甲醛固定30 min,PBS洗涤3×5 min,含0.5%Triton X-100的PBS浸泡盖玻片15 min(打孔),PBS洗涤3×5 min。取出经PBS洗涤的细胞爬片,以PBS洗涤2×5 min,3%H2O2室温孵育15 min,封闭内源性过氧化物酶活性,免疫染色封闭液(碧云天)37℃孵育1 h,加入含1%BSA PBS 1:200稀释的抗IBP单克隆抗体,37 ℃湿盒中孵育2 h,PBST洗涤3×5 min,PBS洗涤2×5 min,加入以含1%BSA PBS 1:1 000稀释的Cy3标记山羊抗兔IgG二抗(红色荧光),37 ℃湿盒中孵育1 h,PBST洗涤3×5 min,DAPI染核5~10 min,PBS洗涤2×5 min,抗荧光淬灭封片剂封片后以激光共聚焦显微镜观察拍照。
1.5 RT-PCR检测用RNAiso Plus试剂提取细胞总RNA,按两步法将RNA反转录为cDNA,参照SYBR Premix Ex TaqTMⅡ试剂盒说明书配制反应体系,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 50 s ×40个循环。引物序列由上海英骏生物技术有限公司提供,GAPDH上游:5′-CTTTGGTATCGTGGAAGGACTC-3′,下游:5′-GTAGAGGCAGGGATGATGTTCT-3′;IBP上游:5′-GAAAGCTCGGCGAGA-TGAAG-3′,下游:5′-GATGATGCGCTCCTGCTCCT-3′。Step One Plus RT-PCR系统软件进行结果分析。
1.6 Western blot检测收集胃腺癌细胞,加入适量RIPA裂解液,并按100:1加入蛋白酶抑制剂,枪头吹打5 min,冰上放置裂解30 min,然后4 ℃、14 000 r/min离心10 min,提取总蛋白。根据BCA蛋白浓度测定试剂盒说明测定蛋白浓度。加入适量蛋白上样缓冲液(×5),混匀后金属浴加热至100 ℃,10 min变性。配置凝胶电泳,蛋白上样量为50 μg/孔。恒压电泳80 V、30 min,之后120 V、90 min。PVDF转膜150 mA、90 min。转膜结束后,将膜放入含5%脱脂奶粉的PBST中封闭1 h。剪膜后孵育一抗,GADPH兔抗人单克隆抗体(1:1 000)、IBP鼠抗人单克隆抗体(1:2 000),4 ℃过夜。PBST洗膜15 min×3次,然后加入3%BSA TBS配制的辣根过氧化物酶标记的抗小鼠IgG二抗工作液(1:10 000)15 mL,摇床缓慢摇动室温孵育1 h。PBST洗膜15 min×3次,ECL Plus显色,Bio-Rad凝胶成像仪显影。
1.7 临床病理组织免疫组织化学检测采用免疫组化EnVision两步法,石蜡组织切片于60 ℃烤箱烤片,二甲苯脱蜡、酒精浓度梯度降序复水,磷酸盐缓冲液PBS洗涤3次,每次3 min;3%过氧化氢室温孵育10 min,PBS洗涤3次,每次3 min;高温水浴条件下用EDTA缓冲液行抗原修复15 min,于室温待其自然冷却;PBS洗涤3次,每次5 min,用山羊血清封闭20 min,37 ℃;滴加一抗小鼠抗人IBP单克隆抗体(1:500)、小鼠抗人p53蛋白单克隆抗体(即用型),37 ℃孵育1 h,4 ℃孵育过夜(总时间>18 h)。室温下复温1 h;PBS洗涤3次,每次5 min,滴加生物素标记山羊抗兔二抗于37 ℃孵育20~30 min;PBS洗涤3次,每次5 min,滴加辣根酶链霉卵白素于37 ℃孵育20 min;PBS洗涤3次,每次5 min,1:1新鲜配制的DAB显色液显色;自来水冲洗10 min;苏木精复染22 s,自来水冲洗10 min;放入60 ℃双蒸水10 min;酒精浓度梯度升序、二甲苯脱水,风干后用盖玻片、中性树胶封片。
1.8 结果判定免疫组织化学结果参照半定量积分法进行结果判读,每个切片随机选择10个区域,用高倍镜(400倍)显微镜评估1 000个肿瘤细胞(100个细胞/区域)中的表达,每例标本由两位病理科医师医师判断,若有异议由第三位医师共同探讨决断。每张组织切片的阳性细胞染色程度计分:阳性着色细胞<5%为0分,5%~25%为1分、26%~50%为2分、51%~75%为3分、>75%为4分;染色强度计分:无着色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分。最终结果根据染色程度、染色强度得分相加来判定,0~1分为(-),2~3分为弱阳性(+),4~5分为阳性(++),6~7分为强阳性(+++),其中(+~+++)均判读为阳性[12]。
1.9 统计学分析采用SPSS 21.0统计软件。计数资料以率(%)表示,组间比较采用χ2检验,等级资料的相关分析采用Spearman等级相关性分析,P < 0.05为差异有统计学意义。
2 结果 2.1 免疫荧光检测IBP在胃腺癌细胞中的表达激光共聚焦显示IBP在胃腺癌细胞株MKN-45的胞膜和胞质中均有表达(图 1)。
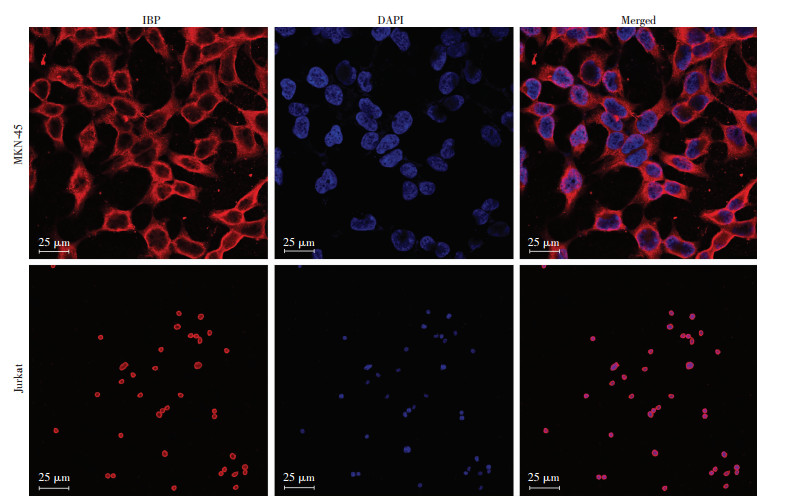
|
| 图 1 IBP在Jurkat细胞、胃腺癌细胞MKN-45中定位分析 |
2.2 Real-time PCR检测胃腺癌细胞株中IBP mRNA的表达
结果显示,IBP在两种胃腺癌细胞株SGC-7901、MKN-45中均有表达,且在恶性程度较高的MKN-45细胞中IBP表达明显高于恶性程度较低的SGC-7901细胞(P < 0.05,图 2)。
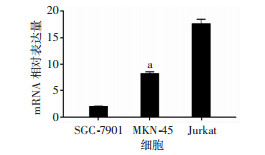
|
| a:P<0.05,与SGC-7901比较 图 2 Real-time PCR检测不同细胞株中IBP mRNA的表达 |
2.3 Western blot检测胃腺癌细胞株中IBP的表达
结果显示,在人胃腺癌细胞株MKN45和SGC7901中IBP蛋白表达水平与RT-PCR检测结果一致,IBP在胃腺癌细胞株MKN-45中的表达明显高于SGC-7901细胞(图 3)。

|
| 图 3 Western blot检测IBP在不同细胞株中的表达 |
2.4 IBP在胃腺癌组织中的表达
胃腺癌组患者IBP在胞膜及胞质中均有表达,为黄色或棕黄色颗粒,且其阳性率显著高于非胃腺癌组(P < 0.01,表 1、图 4)。
| 组别 | n | + | ++ | +++ | 阳性率(%) | χ2值 | P值 |
| 胃腺癌组 | 150 | 30 | 26 | 15 | 47.33 | 30.381 | < 0.01 |
| 非胃腺癌组 | 50 | 1 | 1 | 0 | 4.00 |
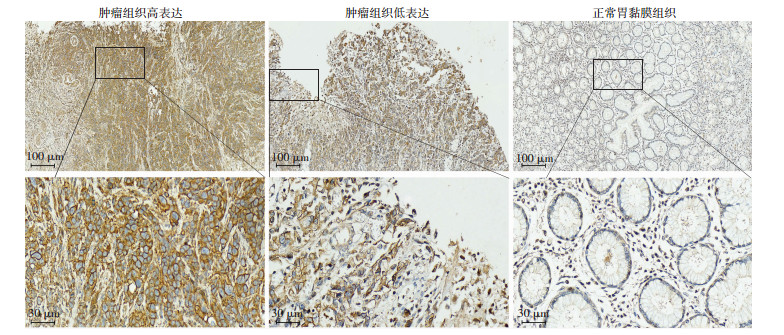
|
| 图 4 免疫组化染色观察IBP在胃腺癌组织和癌旁组织中的表达 |
2.5 p53蛋白在胃腺癌组织和癌旁组织中的表达
胃腺癌组患者的p53蛋白主要在细胞核中有表达,其阳性表达在镜下显示为棕黄色或棕褐色颗粒,与非胃腺癌组患者相比,其阳性表达较高,差异有统计意义(P < 0.01,表 2、图 5)。
| 组别 | n | + | - | 阳性率(%) | χ2值 | P值 |
| 胃腺癌组 | 150 | 58 | 92 | 38.67 | 27.23 | < 0.01 |
| 非胃腺癌组 | 50 | 0 | 50 | 0.00 |
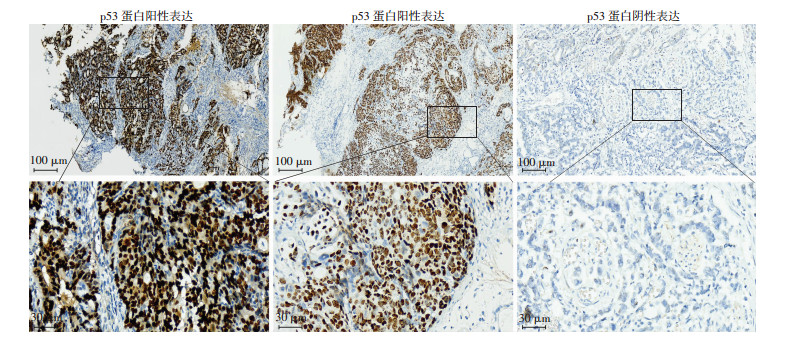
|
| 图 5 免疫组化染色观察p53蛋白在胃腺癌组织中的表达 |
2.6 胃腺癌组IBP、p53蛋白阳性表达与胃腺癌临床病理特征之间的关系
IBP与胃腺癌患者的病理分级呈正相关(P < 0.05,表 3),与年龄、性别、胃壁浸润深度、TMN分期、Lauren分型、肿瘤部位等相关性不明显(P>0.05,表 3);p53蛋白与患者年龄、性别、病理分级、Lauren分型具有相关性(P < 0.05,表 3)。p53蛋白有年龄越大表达越高的趋势;p53蛋白在男性患者中的表达率明显比女性患者高;病理分级越高的患者其p53蛋白的表达具有升高的趋势;p53蛋白还有在肠型胃腺癌中表达增高的趋势,而与胃壁浸润深度、TMN分期、肿瘤部位无相关性(P>0.05,表 3)。
| 临床特征 | n | IBP | p53蛋白 | ||||
| 阳性[例(%)] | χ2值 | P值 | 阳性[例(%)] | χ2值 | P值 | ||
| 年龄/岁 | |||||||
| > 60 | 71 | 33(46.48) | 0.039 | 0.842 | 34(47.89) | 4.833 | 0.028 |
| ≤60 | 79 | 38(48.10) | 24(30.38) | ||||
| 性别 | |||||||
| 男 | 116 | 59(50.86) | 2.556 | 0.110 | 50(43.10) | 4.248 | 0.039 |
| 女 | 34 | 12(35.29) | 8(23.53) | ||||
| 分化程度 | |||||||
| 高分化 | 19 | 1(5.26) | 15.446 | <0.001 | 1(5.26) | 17.417 | <0.001 |
| 中-低分化 | 131 | 70(53.44) | 57(43.51) | ||||
| 胃壁浸润深度 | |||||||
| T1、T2 | 18 | 8(44.44) | 0.814 | 0.367 | 7(38.89) | 0.015 | 0.903 |
| T3、T4 | 91 | 51(56.04) | 34(37.36) | ||||
| TMN分期 | |||||||
| Ⅰ、Ⅱ期 | 59 | 28(47.46) | 2.305 | 0.129 | 24(40.68) | 0.514 | 0.473 |
| Ⅲ、Ⅳ期 | 50 | 31(62.00) | 17(34.00) | ||||
| Lauren分型 | |||||||
| 肠型 | 114 | 51(44.74) | 1.641 | 0.440 | 51(44.74) | 8.528 | 0.014 |
| 弥漫型 | 30 | 16(53.33) | 7(23.33) | ||||
| 混合型 | 6 | 4(66.67) | 0(0.00) | ||||
| 肿瘤部位 | |||||||
| 贲门 | 24 | 12(50.00) | 2.809 | 0.422 | 12(50.00) | 5.971 | 0.113 |
| 胃底体 | 45 | 17(37.78) | 11(24.44) | ||||
| 胃窦 | 78 | 41(52.56) | 34(43.59) | ||||
| 其他 | 3 | 1(33.33) | 1(33.33) | ||||
2.7 胃腺癌组织标本中IBP、p53蛋白表达的关系
采用Spearman等级相关性分析结果显示,胃腺癌组织中IBP的表达与p53蛋白的表达无相关性(r=0.013,P>0.05,表 4)。
| p53蛋白 | IBP | 合计 | |||
| - | + | ++ | +++ | ||
| - | 49 | 18 | 16 | 9 | 92 |
| + | 30 | 12 | 10 | 6 | 58 |
| 合计 | 79 | 30 | 26 | 15 | 150 |
3 讨论
近年来,胃癌已成为我国发病率居第二位的恶性肿瘤,且发病率仍在增长。由于早期症状不明显以及早期诊断较为困难,很多患者在确诊时已属于中晚期,多已出现远程转移病灶。因此,寻求新的分子标志物对胃癌的诊断和治疗具有重要意义。
IBP是脊椎动物中高度保守的蛋白质,相对分子量约75×103,编码基因位于染色体6p21.31,与SWAP-70高度同源。SWAP-70在B细胞激活和Ig亚类转换中具有重要作用[13]。IBP被称为一种新型的鸟嘌呤核苷酸交换因子(GEF)[7],GEFs代表主要Rho GTPases活化状态的调节因子,Rho GTPases在许多生物过程中发挥着重要的作用。它们也被证明有助于病理过程:如癌细胞迁移、侵袭和转移。此外,Rho GTPases具有致癌活性,与多种癌症中的表达和活性增加相关[14]。相关报道还指出IBP显示出对Rho家族GTP酶(包括Rac1、Cdc42和RhoA)的GEF活性[15]。之前对IBP的研究主要集中在免疫系统[16],有报道IBP可以和激活Rac1一起调节细胞形态,IBP还可以同整合素一起影响细胞的分化[17]。IBP主要表达于T淋巴细胞,IBP缺陷鼠模型的研究结果证明,IBP的缺失导致小鼠免疫自稳失衡,出现SLE样系统性自身免疫疾病反应。IBP缺陷T细胞显示出凋亡异常,呈抵抗凋亡状态[18],异常的细胞凋亡、免疫自稳与肿瘤发生发展关系密切。近年来,胡川闽教授课题组发现IBP在结肠癌和乳腺癌中高表达并起着重要的作用[7, 19],并发现在乳腺癌标本中IBP与突变型p53蛋白的表达呈负相关[6],进而研究发现IBP是一个新的p53蛋白(野生型)的靶基因,p53表达增加可以抑制IBP的表达,而IBP的诱导则与p53的抑制相关,在乳腺癌细胞株中,野生型p53可以与IBP启动子结合[10]。近年研究还发现,IBP在口腔鳞癌组织中的表达显著上调,进一步研究发现其通过影响cyclinD1的表达,导致细胞周期不能及时停止,进而基因组稳定性丧失,加快口腔鳞癌细胞增殖[20]。而在人涎腺腺样囊性癌中,IBP低表达甚至不表达,在正常的涎腺样组织中高表达,细胞实验也证实了IBP能在一定程度上抑制涎腺腺样囊性癌细胞的增殖,这与IBP在乳腺癌、结肠癌等其他肿瘤中的表达情况完全相反,猜测可能与肿瘤组织起源类型不同有关[21]。但IBP在GC中是否起着作用,IBP和p53表达在GC中是否具有相关性,都有待探讨。
本研究首先通过免疫荧光检测显示IBP主要表达在胃腺癌细胞株MKN-45的胞质和胞膜中,主要以胞膜表达为主。该结果与IBP在乳腺癌细胞株中的表达情况相符合[9]。IBP的蛋白质序列N端具有豆蔻酰基序列,其通常是蛋白质锚定在脂质膜中的作用,我们认为IBP可能与许多其他细胞间信息转导分子相似,可定位于膜内部发挥作用,IBP可能参与了细胞外信息向细胞内的传导。免疫印迹及Real-time PCR均证实IBP在胃腺癌细胞株MKN-45、SGC-7901中有表达,在MKN-45中的表达高于SGC-7901细胞。联系到细胞恶性度的差异,IBP可能具有在恶性度较高的胃腺癌细胞中表达更高的趋势,但由于本实验只做了两个细胞系,这个结论并不明确,下一步研究中需要引入更多胃腺癌细胞系。IBP在造血祖细胞中高表达,但在分化为红细胞、粒细胞和巨噬细胞的过程中表达下调[22],显示IBP在低分化组织中表达高于高分化组织,表明IBP在组织分化和发展中具有一定的作用,与本实验高分化胃腺癌中表达升高的结果相吻合。本研究通过免疫组化方法检测了150例胃腺癌临床病理标本,同样发现IBP在胃腺癌组织中的表达明显高于正常胃组织,与细胞实验结果一致,提示其可能成为对GC治疗和诊断有积极作用的一种生物标志物;同时,IBP过表达与患者病理分级呈正相关,也与本研究细胞学实验结果吻合,提示IBP在GC的发生、发展中起了重要作用。IBP的过度表达促进了肿瘤的发生和发展,使肿瘤向高度恶性、低分化的方向发展,IBP的过表达提示患者的预后不良;本研究检测突变型p53蛋白在150例胃腺癌组织中的表达,发现p53蛋白的过表达与患者年龄、性别、肿瘤分化程度及胃腺癌的Lauren分型有关,与WARAYA等[23]研究中突变型p53蛋白在胃癌中的临床病理学特征类似;统计学分析显示,p53蛋白与IBP在胃组织中的表达上调没有明显的相关性,由于本研究免疫组化检测的p53蛋白为突变型,二者无相关性似乎与IBP和肿瘤临床病理相关相矛盾。但是,胃癌的发生、发展是多种癌基因进行网络式相互作用的结果,不同基因间的信号调节复杂。本研究的IBP既可以依赖于p53基因通路,也可以通过独立于p53基因途径影响细胞凋亡过程,在其他一些肿瘤中的表达情况也说明了该问题,如乳腺癌临床病理标本中IBP和突变型p53蛋白的表达呈负相关[6]。这也充分说明了肿瘤的发生、发展绝不是单一基因、单一因子的作用,而是多基因、多因子交联相互作用影响的过程;再次,由于p53蛋白的突变更多是点突变和少量插入、缺失或蛋白质融合,难以制备一种能够识别各种突变的p53蛋白,且不与正常的p53交叉反应的抗体。因此,仅采用免疫组化方法难以判断突变型p53蛋白表达的真实情况,应进一步采用核酸检测方法用于验证。本实验结果显示IBP在胃腺癌细胞株及临床病理标本中高表达,而且可能具有在恶性程度较高细胞中表达逐渐升高的趋势。IBP是一种新型的GEF,具有GEF活性[7, 15],而GEF对细胞骨架的调节、细胞周期进程及转导来自于细胞外的信号具有重要的作用,GEF和绝大多数的肿瘤发生、发展息息相关。联系到IBP在免疫系统中的作用及已报道的其在几种肿瘤中异常表达情况,我们猜测IBP的异常表达是肿瘤发生、发展中的一个普遍现象,当然,尚需进一步的研究来证明。
本研究结果表明,IBP、p53蛋白在胃腺癌细胞和组织中过度表达,IBP主要表达于胞膜、胞质,p53蛋白主要表达于胞核,IBP的表达与患者病理分级呈正相关,IBP与p53蛋白的表达并没有明显的相关性。尽管还需进一步实验,但我们认为IBP作为GC的一种新的肿瘤标志物及预后指标有着广阔的研究前景,进一步研究IBP在GC发生、发展中的作用将为其发生机制及综合治疗提供新的思路。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [2] | DUR-ES C, ALMEIDA G M, SERUCA R, et al. Biomarkers for gastric cancer: prognostic, predictive or targets of therapy?[J]. Virchows Arch, 2014, 464(3): 367–378. DOI:10.1007/s00428-013-1533-y |
| [3] | BANIAK N, SENGER J L, AHMED S, et al. Gastric biomarkers: a global review[J]. World J Surg Oncol, 2016, 14(1): 212. DOI:10.1186/s12957-016-0969-3 |
| [4] | BÉCART S, CHARVET C, CANONIGO BALANCIO A J, et al. SLAT regulates Th1 and Th2 inflammatory responses by controlling Ca2+/NFAT signaling[J]. J Clin Invest, 2007, 117(8): 2164–2175. DOI:10.1172/JCI31640 |
| [5] | FANZO J C, YANG W, JANG S Y, et al. Loss of IRF-4-binding protein leads to the spontaneous development of systemic autoimmunity[J]. J Clin Invest, 2006, 116(3): 703–714. DOI:10.1172/JCI24096 |
| [6] | LI P, ZHANG Z, WANG Q, et al. The ectopic expression of IFN regulatory factor 4-binding protein is correlated with the malignant behavior of human breast cancer cells[J]. Int Immunopharmacol, 2009, 9(7/8): 1002–1009. DOI:10.1016/j.intimp.2009.04.008 |
| [7] | ZHANG Z, WANG Q, LI P, et al. Overexpression of the Interferon regulatory factor 4-binding protein in human colorectal cancer and its clinical significance[J]. Cancer Epidemiol, 2009, 33(2): 130–136. DOI:10.1016/j.canep.2009.05.004 |
| [8] | MULLER P A, VOUSDEN K H. p53 mutations in cancer[J]. Nat Cell Biol, 2013, 15(1): 2–8. DOI:10.1038/ncb2641 |
| [9] | FANG L, GAO H, ZHANG W, et al. Resveratrol alleviates nerve injury after cerebral ischemia and reperfusion in mice by inhibiting inflammation and apoptosis[J]. Int J Clin Exp Med, 2015, 8(3): 3219–3226. |
| [10] | PRASS K, SCHARFF A, RUSCHER K, et al. Hypoxia-induced stroke tolerance in the mouse is mediated by erythropoietin[J]. Stroke, 2003, 34(8): 1981–1986. DOI:10.1161/01.STR.0000080381.76409.B2 |
| [11] | YANG M, YUAN F, LI P, et al. Interferon regulatory factor 4 binding protein is a novel p53 target gene and suppresses cisplatin-induced apoptosis of breast cancer cells[J]. Mol Cancer, 2012, 11: 54. DOI:10.1186/1476-4598-11-54 |
| [12] |
赵志华, 田研, 陈奎生. 多发性骨髓瘤中c-myc和MDM2蛋白的表达及其临床意义[J].
临床与实验病理学杂志, 2017, 33(2): 165–168.
ZHAO Z H, TIAN Y, CHEN K S. Expression of c-myc and MDM2 protein in multiple myeloma and their clinical significance[J]. Chin J Clin Exp Pathol, 2017, 33(2): 165–168. DOI:10.13315/j.cnki.cjcep.2017.02.011 |
| [13] | GUPTA S, LEE A, HU C, et al. Molecular cloning of IBP, a SWAP-70 homologous GEF, which is highly expressed in the immune system[J]. Hum Immunol, 2003, 64(4): 389–401. DOI:10.1016/S0198-8859(03)00024-7 |
| [14] | VEGA F M, RIDLEY A J. Rho GTPases in cancer cell biology[J]. FEBS Lett, 2008, 582(14): 2093–2101. DOI:10.1016/j.febslet.2008.04.039 |
| [15] | MAVRAKIS K J, MCKINLAY K J, JONES P, et al. DEF6, a novel PH-DH-like domain protein, is an upstream activator of the Rho GTPases Rac1, Cdc42, and RhoA[J]. Exp Cell Res, 2004, 294(2): 335–344. DOI:10.1016/j.yexcr.2003.12.004 |
| [16] | JAFFE A B, HALL A. Rho GTPases: Biochemistry and biology[J]. Annu Rev Cell Dev Biol, 2005, 21: 247–269. DOI:10.1146/annurev.cellbio.21.020604.150721 |
| [17] | BOS J L, REHMANN H, WITTINGHOFER A. GEFs and GAPs: Critical elements in the control of small G proteins[J]. Cell, 2007, 129(5): 865–877. DOI:10.1016/j.cell.2007.05.018 |
| [18] | CHARDIN P. Function and regulation of Rnd proteins[J]. Nat Rev Mol Cell Biol, 2006, 7(1): 54–62. DOI:10.1038/nrm1788 |
| [19] | ZHANG Z, YANG M, CHEN R, et al. IBP regulates epithelial-to-mesenchymal transition and the motility of breast cancer cells via Rac1, RhoA and Cdc42 signaling pathways[J]. Oncogene, 2014, 33(26): 3374–3382. DOI:10.1038/onc.2013.337 |
| [20] |
简从相, 李晨军, 黄晓山. IRF-4结合蛋白对人口腔鳞癌细胞生长作用的研究[J].
西南国防医药, 2012, 22(5): 470–472.
JIAN C X, LI C J, HUANG X S. Effects of IRF-4 binding protein on cell growth of oral squamous cell carcinoma[J]. Med J Nat Defending Forces Southwest China, 2012, 22(5): 470–472. DOI:10.3969/j.issn.1004-0188.2012.05.002 |
| [21] |
熊剑, 简从相, 李鹏, 等. IRF-4结合蛋白对人涎腺腺样囊性癌细胞增殖的抑制作用[J].
第三军医大学学报, 2011, 33(6): 554–557.
XIONG J, JIAN C X, LI P, et al. Inhibitory effect of IRF-4 binding protein on proliferation of human salivary adenoid cystic carcinoma cells[J]. J Third Mil Med Univ, 2011, 33(6): 554–557. DOI:10.16016/j.1000-5404.2011.06.006 |
| [22] | HOTFILDER M, BAXENDALE S, CROSS M A, et al. Def-2, -3, -6 and -8, novel mouse genes differentially expressed in the haemopoietic system[J]. Br J Haematol, 1999, 106: 335–344. DOI:10.1046/j.1365-2141.1999.01551.x |
| [23] | WARAYA M, YAMASHITA K, EMA A, et al. Exclusive association of p53 mutation with super-high methylation of tumor suppressor genes in the p53 pathway in a unique gastric cancer phenotype[J]. PLoS ONE, 2015, 10(10): e0139902. DOI:10.1371/journal.pone.0139902 |



