肺癌是一种发病率和死亡率都很高的恶性肿瘤,其中小细胞肺癌(small cell lung cancer,SLCL)占肺癌总发病率的10%~15%[1]。根据病变范围是否局限于一侧胸腔内,将小细胞肺癌分为局限期和广泛期[2]。在新诊断的小细胞肺癌患者中,约60%~70%的患者已经发展成为广泛期[3],小细胞肺癌对化疗及放疗敏感,但易发生继发性耐药[4],目前广泛期小细胞肺癌的治疗主要以化疗为主[5]。根据美国国立综合癌症网络(national comprehensive cancer network, NCCN)指南,依托泊苷联合铂类化疗(etoposide plus platinum, EP)及伊立替康联合铂类化疗(irinotecan plus platinum, IP)是小细胞肺癌的标准一线化疗方式[4]。Meta分析结果提示:在广泛期SLCL中IP方案化疗总生存期(overallsurvival, OS)及1年生存率优于EP方案[6],而近期来自韩国[7]、北美[8]的研究及国内的多中心、随机对照三期临床实验[9]均证实:在广泛期小细胞肺癌治疗中,EP方案与IP方案化疗OS、无进展生存期(progressionfreesurvival, PFS)无明显差异。因此,目前EP方案与IP方案化疗孰优孰劣依然存在争议,而且上述研究均未考虑到化疗联合放疗对小细胞肺癌疗效的影响。因此,我们对陆军军医大学第三附属医院诊断为SLCL的病例进行回顾性研究,对比使用EP方案与IP方案两组的客观缓解率(objective response rate, ORR)、疾病控制率(disease control rate, DCR)、中位无进展生存期(median progression-free survival, mPFS)、中位生存时间(median overall survival, mOS)及3/4级以上的毒副反应,根据是否接受联合胸部放疗进行分层分析,研究淋巴细胞亚群中T4、T8总数降低与否对PFS、OS的影响。
1 资料与方法 1.1 研究对象收集陆军军医大学第三附属医院2013-2017年收治的SLCL病例。纳入标准:①经我院病理科病理诊断为SLCL,且临床分期为广泛期;②经标准EP方案或IP方案化疗≥2周期,可评估疗效;③年龄为18~80岁;④具有1个及1个以上可测量病灶;⑤一线化疗出现疾病进展后接受或未接受二线化疗;⑥美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0~1分。排除标准:①化疗后或化疗前接受手术治疗;②无可测量病灶大小;③肝功能异常(转氨酶升高2倍以上);④脑转移未经治疗;⑤未经标准方案化疗的或化疗不规律。
1.2 观察指标主要观察指标为:最佳疗效、mPFS、mOS,3/4级以上毒副反应,次要观察指标为:DCR、ORR、总化疗次数及接受二线化疗比例,对患者是否进行放疗进行分层分析。此外,还对淋巴细胞亚群中T4、T8总数降低与否对PFS、OS的影响进行分析(图 1)。
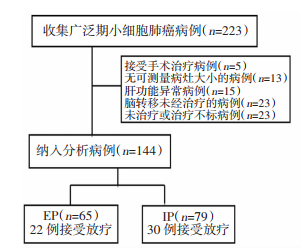
|
| 图 1 病例筛选流程图 |
1.3 化疗方法
EP组采用依托泊苷80~100 mg/m2 D1~D3+顺铂80~ 100 mg/m2 D1,IP组采用伊立替康60~80 mg/m2 D1, D8+顺铂80~100 mg/m2 D1。每21天为1个化疗周期,化疗2个周期进行1次疗效评估。收集病例影像学资料、血常规、尿常规、心电图和肝肾功能等检查及检验结果。
1.4 疗效评定标准疗效评定根据RECIST 1.1标准分为:完全缓解(CR),临床症状全部消失,病灶完全消失;部分缓解(PR),临床症状明显改善,肿瘤最长径之和缩小超过30%;稳定(SD),临床症状有所改善,肿瘤最长径之和缩小不超过30%或增大不超过20%;进展(PD),临床症状无改善或加重,肿瘤最长径之和增大超过20%或出现新发病灶;ORR,CR+PR;DCR: CR+PR+SD。毒副作用根据NCI-CTC 2.0标准评定。
1.5 统计学分析采用SPSS 22.0统计软件。生存分析采用Kaplan-Meier法,组间生存比较采用Log-rank检验;生存预后因素分析采用Cox回归模型;P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料收集SLCL病例223例,根据纳入、排除标准筛选后,排除79例,符合条件的共计144例,其中一线接受EP方案化疗65例,一线接受IP方案化疗79例。EP组中男性57例(87.7%),吸烟者49例(75.4%),65岁以下43例(66.2%),24例(36.9%)患者存在淋巴细胞亚群中T4、T8细胞总数低下,22例(33.8%)患者接受了化疗联合放疗。IP组中男性68例(86.1%),吸烟者52例(65.8%),65岁以下患者60例(75.9%),24例(30.4%)患者存在淋巴细胞亚群中T4、T8细胞总数低下,30例(30.8%)患者接受了化疗联合放疗。两组病例临床资料差异无统计学意义,具有可比性。
2.2 治疗效果 2.2.1 DCR与ORREP组ORR、DCR优于IP组,但差异无统计学意义(P=0.243、0.328,表 1)。
| 组别 | n | CR | PR | SD | PD | ORR | DCR |
| EP组 | 65 | 5(7.7) | 39(60.0) | 17(26.2) | 4(6.2) | 44(67.7) | 61(93.8) |
| IP组 | 79 | 4(5.1) | 41(51.9) | 28(35.4) | 6(7.6) | 45(57.0) | 73(92.4) |
2.2.2 mPFS、mOS
EP组mPFS为5.05个月,mOS为13.95个月;IP方案化疗组mPFS为4.30个月,mOS为14.10个月。EP组mPFS略长于IP组,IP组mOS略长于EP组,但两组mPFS、mOS比较差异无统计学意义(P=0.650、0.120,图 2)。

|
| A:PFS;B:OS 图 2 EP组与IP组患者的生存情况分析 |
2.2.3 是否接受化疗联合放疗的分层分析
EP方案:化疗联合放疗组mPFS为5.55个月(n=21),mOS为15.10个月(n=20);未接受放疗组mPFS为4.85个月(n=30),mOS为12.68个月(n=32),两组比较差异具有统计学意义(P=0.040)。IP方案:化疗联合放疗组mPFS为4.95个月(n=30),mOS为15.40个月(n=32);未接受放疗组mPFS为3.50个月(n=49),mOS为11.80个月(n=43),两组比较差异具有统计学意义(P=0.001,图 3)。
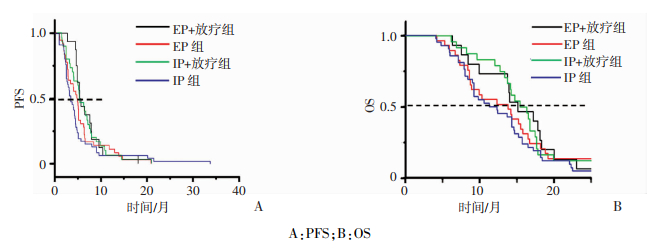
|
| A:PFS;B:OS 图 3 EP方案与IP方案患者是否接受放疗的生存情况分析 |
144名接受化疗的患者中,根据患者是否接受放疗,进行单因素生存分析。共52例患者接受放疗,化疗联合放疗组PFS和95%可信区间为5.4个月(4.104~ 6.696),未联合放疗组PFS和95%可信区间为3.8个月(2.876~4.724),两组差异具有统计学意义(χ2= 5.817,P=0.016)。化疗联合放疗组OS和95%可信区间为16.3个月(14.133~18.467),未联合放疗组OS和95%可信区间为10.6个月(7.274~13.926),两组差异具有统计学意义(χ2=8.649,P=0.003,图 4)。表明接受化疗联合放疗患者mPFS、mOS优于单纯化疗患者,EP方案+放疗与IP方案+放疗疗效相当。
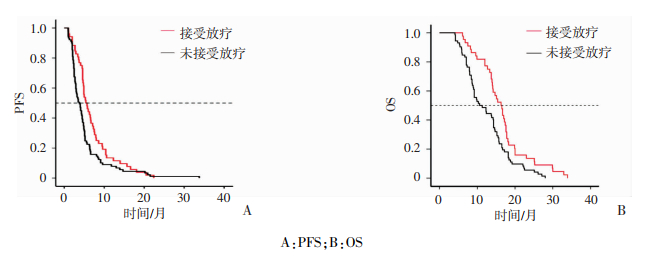
|
| A:PFS;B:OS 图 4 化疗联合放疗组与只接受化疗组患者的生存情况分析 |
2.2.4 接受总化疗周期数及接受二线及以上化疗比例
EP组化疗总周期数及二线化疗比例高于IP组,但差异无统计学意义(6.34 vs 4.77次, P=0.250;43.08% vs 34.18%,P=0.120)。
2.2.5 淋巴细胞亚群对PFS、OS的影响根据患者淋巴细胞亚群T4、T8状态,进行单因素生存分析。144例患者中96例T4、T8细胞总数正常,48例T4、T8细胞总数低下。淋巴细胞亚群正常组PFS和95%可信区间为5.0个月(4.486~5.514),淋巴细胞亚群低下组PFS和95%可信区间为3.4个月(1.932~4.868),差异具有统计学意义(χ2=6.452,P=0.011)。淋巴细胞亚群正常组OS和95%可信区间为15.2个月(7.875~10.125),淋巴细胞亚群低下组OS和95%可信区间为9.0个月(13.889~6.511),差异具有统计学意义(χ2=11.351,P=0.001,图 5)。
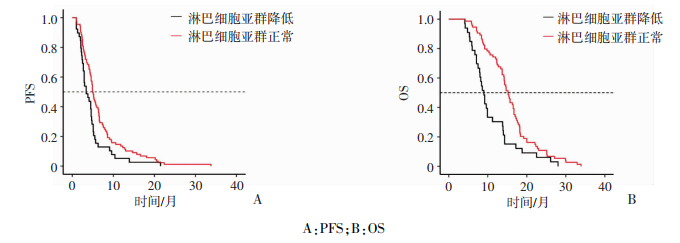
|
| A:PFS;B:OS 图 5 淋巴细胞亚群对两组患者生存情况的影响 |
2.3 3/4级以上化疗毒副作用
EP组5例(7.7%)患者发生腹泻,34例(52.3%)发生中性粒细胞减少,48例(73.8%)发生贫血;IP组37例(46.8%)患者发生腹泻,18例(22.8%)发生中性粒细胞减少,32例(40.5%)发生贫血。IP组化疗腹泻发生率高于EP组,EP组发生中性粒细胞减少及贫血高于IP组,差异具有统计学意义(P值分别为0.020、0.001、0.013)。
3 讨论目前EP方案与IP方案化疗已经成为SCLC的标准治疗方式。但究竟哪一种方案用于一线治疗,尚无定论。早期来自日本的纳入154例患者的三期临床研究(JCOG9511)报道:IP方案相较于EP方案可显著提高OS及PFS[10]。但是随后北美地区、中国[11]及韩国的研究均未能重复该结论,这可能与JCOG9511过早关闭了研究、样本量偏小相关。大多数研究表明IP方案与EP方案疗效相当。本研究同样证实EP方案化疗的ORR(67.7%)略优于IP方案化疗的ORR(57.0%),但差异无统计学意义,两组OS无明显差异,这与大多数的报道相符。而且,本研究发现无论一线接受EP方案或者IP方案化疗,其二线治疗比例同样无显著差异,提示一线治疗方式的选择对后续治疗无显著影响。
本研究结果提示化疗联合放疗可显著延长PFS及OS。EP方案+放疗较单纯EP化疗可使mPFS提高0.7个月,OS提高2.42个月,IP+放疗较单纯IP化疗可使mPFS提高1.45个月,OS提高3.6个月,与文献[12]结果相同。目前同步放化疗已经成为局限期SCLC的标准治疗方式[13],并得到了NCCN等指南的推荐。在既往的观点中,对于广泛期的SCLC进行放疗的主要目的是改善患者临床症状,控制局部肿瘤的发展。2015年SLOTMAN等[14]发表在柳叶刀杂志的多中心三期临床研究证实:对于广泛期的SCLC在全身化疗的同时联合放疗可显著改善2年OS率(化疗联合放疗2年OS率为13%,化疗2年OS率为3%)及部分改善1年OS率,这与我们的研究结果一致。无论EP或IP化疗联合放疗都可使患者获益,改善OS及PFS。因此,无论一线选择EP或者IP,在病情许可的情况下进行放疗可显著延长患者生命,对于广泛期的SCLC进行化疗联合胸部放疗不仅仅只是改善局部症状,且改善生存预后。
淋巴细胞亚群中T4、T8总数降低患者mPFS、mOS明显低于淋巴细胞亚群T4、T8总数正常患者。T4、T8细胞总数降低患者存在免疫力低下,可能减弱了机体自身对肿瘤细胞的杀伤作用,从而影响化疗疗效[15-16]。因此,在SCLC患者化疗过程中可使用免疫应答增强剂改善患者T4、T8低下,提高机体免疫力。
EP方案化疗的毒副作用主要是贫血及中性粒细胞减少,IP方案化疗的腹泻发生率较高,在临床中可根据患者的身体状态,个体化选择一线治疗方案,患者如患有消化系统基础疾病,存在腹泻风险,应谨慎选择IP方案;患者贫血、白细胞降低,应谨慎选择EP方案。
综上所述,SCLC无论采用EP方案还是IP方案化疗,较非SCLC化疗有较高的总反应率,但是SCLC化疗耐药时间发生早,发生耐药后进展快,目前需进一步探索化疗联合放疗、手术及免疫治疗等方案。本研究为回顾性研究,尚需前瞻性研究进一步验证。
| [1] | VAN MEERBEECK J P, FENNELL D A, DE RUYSSCHER D K. Small-cell lung cancer[J]. Lancet, 2011, 378(9804): 1741–1755. DOI:10.1016/S0140-6736(11)60165-7 |
| [2] |
周小昀, 李龙芸. 小细胞肺癌的治疗进展与现状[J].
癌症进展, 2007, 5(5): 475–488.
ZHOU X Y, LI L Y. Management of small cell lung caner[J]. Oncol Prog, 2007, 5(5): 475–488. DOI:10.3969/j.issn.1672-1535.2007.05.014 |
| [3] | HADDADIN S, PERRY M C. History of small-cell lung cancer[J]. Clin Lung Cancer, 2011, 12(2): 87–93. DOI:10.1016/j.cllc.2011.03.002 |
| [4] | FRVH M, DE RUYSSCHER D, POPAT S, et al. Small-cell lung cancer (SCLC): ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-up[J]. Ann Oncol, 2013, 24(Suppl 6): ⅵ99–105. DOI:10.1093/annonc/mdt178 |
| [5] | SANT M, ALLEMANI C, SANTAQUILANI M, et al. EUROCARE-4. Survival of cancer patients diagnosed in 1995-1999. results and commentary[J]. Eur J Cancer, 2009, 45(6): 931–991. DOI:10.1016/j.ejca.2008.11.018 |
| [6] | HAN D, WANG G, SUN L, et al. Comparison of irinotecan/platinum versus etoposide/platinum chemotherapy for extensive-stage small cell lung cancer: A meta-analysis[J]. European J Cancer Care, 2017, 26(6): e12723. DOI:10.1111/ecc.12723 |
| [7] | KIM D W, KIM H G, KIM J H, et al. Randomized phase Ⅲ trial of irinotecan plus cisplatin versus etoposide plus cisplatin in chemotherapy-naïve korean patients with extensive-disease small cell lung cancer[J]. Cancer Res Treat, 2018. DOI:10.4143/crt.2018.019 |
| [8] | HANNA N, BUNN PA J R, LANGER C, et al. Randomized phase Ⅲ trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J]. J Clin Oncol, 2006, 24(13): 2038–2043. DOI:10.1200/JCO.2005.04.8595 |
| [9] | SHI Y, HU Y, HU X, et al. Cisplatin combined with irino-tecan or etoposide for untreated extensive-stage small cell lung cancer: a multicenter randomized controlled clinical trial[J]. Thoracic Cancer, 2015, 6(6): 785–791. DOI:10.1111/1759-7714.12303 |
| [10] | FISHER M D, D'ORAZIO A. Irinotecan and cisplatin versus eto-oside and cisplatin in small-cell lung cancer: JCOG 9511[J]. Clin Lung Cancer, 2000, 2(1): 23–24. DOI:10.1016/S1525-7304(11)70610-6 |
| [11] |
曾筱怡. IP和EP两种方案治疗广泛期小细胞癌疗效观察及安全性分析[J].
当代医学, 2016, 22(10): 151–152.
ZENG X Y. Observation on the efficacy and safety of IP and EP in the treatment of extensive small cell cancer[J]. Contemp Med, 2016, 22(10): 151–152. DOI:10.3969/j.issn.1009-4393.2016.10.103 |
| [12] | LI-MING X, ZHAO L J, SIMONE C B 2ND, et al. Receipt of thoracic radiation therapy and radiotherapy dose are correlated with outcomes in a retrospective study of three hundred and six patients with extensive stage small-cell lung cancer[J]. Radiother Oncol, 2017, 125(2): 331–337. DOI:10.1016/j.radonc.2017.10.005 |
| [13] | PATRICE G I, LESTER-COLL N H, YU J B, et al. Cost-effectiveness of thoracic radiation therapy for extensive-stage small cell lung cancer using evidence from the chest radiotherapy extensive-stage small cell lung cancer trial (CREST)[J]. Int J Radiat Oncol Biol Phys, 2018, 100(1): 97–106. DOI:10.1016/j.ijrobp.2017.08.041 |
| [14] | SLOTMAN B J, VAN TINTEREN H, PRAAG J O, et al. Use of thoracic radiotherapy for extensive stage small-cell lung cancer: a phase 3 randomised controlled trial[J]. Lancet, 2015, 385(9962): 36–42. DOI:10.1016/s0140-6736(14)61085-0 |
| [15] |
董丽华.外周血T细胞亚群在小细胞肺癌治疗中的应用价值[D].西宁: 青海大学, 2017.
DONG L H. Value of peripheral blood T cell subsets in the treatment of small cell lung cancer[D]. Xining: Qinghai University, 2017. |
| [16] |
钱晓琴, 林建潮, 王社梁. T细胞亚群检测在恶性肿瘤患者辅助诊断中的价值研究[J].
浙江实用医学, 2016, 21(3): 170–171.
QIAN X Q, LIN J C, WANG S L. Value of T cell subgroup detection in assisted diagnosis of malignant tumors[J]. Zhejiang Prac Med, 2016, 21(3): 170–171. |



