脑血管疾病发病率逐年上升, 已经成为人类三大死亡原因之一和首位致残原因[1-2]。脑血管疾病以缺血性脑血管疾病为主, 其血管再通恢复血流后, 呈现缺血组织病理损害进一步加重的现象, 称为脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)[3]。研究表明, 引起脑缺血再灌注损伤的重要原因之一为再灌注后组织发生的炎症反应[4-5]。缺血再灌注后, 小胶质细胞迅速活化并大量分泌TNF-α等促炎因子, 导致损伤加重[6], 抑制小胶质细胞活化有利于减轻缺血再灌注损伤。右美托咪定(dexmedetomidine, Dex)为临床常用的镇静药物之一, 它对脑、肾脏、心脏等多种器官的缺血再灌注损伤具有保护作用[7-9], 其机制并未明确。
有研究表明[10], Dex对脊髓保护作用与抑制小胶质细胞的活化相关。那么, Dex是否可能通过抑制小胶质细胞活化发挥脑保护作用?本实验通过建立大鼠大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型和小鼠小胶质细胞株BV2细胞氧糖剥夺/复氧(oxygen-glucose deprivation and reperfusion, OGD/R)模型, 在动物和细胞水平模拟缺血再灌注损伤, 从小胶质细胞活化角度, 探讨Dex的脑保护作用以及其可能的机制, 为临床应用提供一定的理论依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物选取60只SD雄性大鼠, 体质量200~220 g, 由陆军军医大学(第三军医大学)第三附属医院(野战外科研究所)实验动物中心提供, 自由饮水, 普通饲料喂养。
1.1.2 细胞培养小鼠小胶质细胞株BV2购自武汉大学中国典型培养物保藏中心细胞库, 用含10%胎牛血清高糖DMEM培养基, 置于37 ℃、5%CO2培养箱中培养。细胞长至约80%融合时, 用0.05%胰蛋白酶消化传代。
1.1.3 试剂与耗材主要有:A5级硅胶包被大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型栓线(北京西浓科技公司), 盐酸右美托咪定注射液(江苏恒瑞公司), 高糖DMEM培养基、无糖DMEM培养基、胎牛血清(美国Gibco公司), TUNEL荧光试剂盒(碧云天公司), 大鼠组织匀浆ELISA试剂盒、小鼠细胞上清ELISA试剂盒(南京建成公司), 羊抗Iba-1抗体(美国Abcam公司), 驴抗羊荧光二抗(美国Abcam公司), 鼠抗CD68抗体(美国Abcam公司), 兔抗NF-κBp65抗体(武汉三鹰公司), 兔抗p-NF-κB p65抗体(美国CST公司), 驴抗兔荧光二抗、驴抗鼠荧光二抗(美国Abcam公司)。
1.1.4 实验器材主要有:手术显微镜(六六视觉科技公司), 红外荧光成像系统(美国LICOR公司), 三气细胞培养箱、全自动酶标仪(美国赛默飞公司), 倒置显微镜、共聚焦显微镜(日本奥林巴斯公司)。
1.2 方法 1.2.1 动物模型制备和分组参照LONGA等[11]的方法制备大鼠MCAO模型。栓塞90 min后, 拔出栓线, 恢复灌注。60只SD大鼠按随机数字表法分成3组, 假手术组(Sham组)、模型组(I/R组)和右美托咪定处理模型组(Dex+I/R组), 每组20只。Sham组除不置入栓线外, 其他同I/R组操作。Dex+I/R组分别于栓塞开始前30 min和再灌注前30 min经腹腔注射50 μg/kg Dex, 其他两组给予等体积生理盐水。I/R组和Dex+I/R组再灌注24 h后检测各指标, Sham组同时检测。
1.2.2 神经功能评分根据LONGA评分法[11]对各组大鼠进行评分, 0分:自主运动, 无神经功能障碍; 1分:左前肢伸展障碍, 轻度神经功能障碍; 2分:向前运动时, 向左侧倾倒, 中度神经功能障碍; 3分:不能向前运动, 原地做转圈运动, 重度神经功能障碍; 4分:不能自主运动, 并有意识障碍。MCAO模型大鼠评分为0分和4分视为建模失败, 予以剔除, 增补MCAO模型大鼠, 保证实验分组n=20。
1.2.3 HE染色观察脑组织切片的病理改变制作石蜡切片:再灌注24 h后, 大鼠麻醉, 经左心室快速灌入生理盐水, 待右心耳流出较清亮液体后, 灌入4%多聚甲醛, 随后完整取出大鼠脑组织, 冠状位切取距前囟点-1~-3 mm范围约2 mm厚脑片, 置入4%多聚甲醛中继续固定24 h。经脱水、石蜡包埋后切成5 μm薄片, 贴片备用。HE染色观察:石蜡切片经二甲苯脱蜡、梯度乙醇水化后, 依次置入苏木精、伊红液中进行染色, 而后经梯度乙醇、二甲苯处理后, 中性树胶进行封片, 倒置显微镜下观察梗侧大脑皮层病理改变并拍照。
1.2.4 TUNEL染色检测神经细胞凋亡率脑组织石蜡切片经脱蜡、水化后, 置入柠檬酸钠抗原修复液中微波炉加热修复20 min, 冷却后加入20 μg/mL不含DNA酶的蛋白酶K, 20~37 ℃作用15~30 min。加入现配的TUNEL检测液避光孵育60 min, DAPI染核, 最后滴加防淬灭剂封片。在共聚焦荧光显微镜下观察, 选取大脑皮层半暗带区5个独立400倍视野分别计数TUNEL阳性、DAPI阳性细胞数, 神经细胞凋亡率= TUNEL阳性细胞数/DAPI阳性细胞数×100%, 取5个视野平均值作为该标本神经细胞凋亡率。
1.2.5 组织免疫荧光染色检测小胶质细胞活化率采用Iba-1抗体标记小胶质细胞。脑组织石蜡切片经脱蜡、水化、抗原修复、打孔通透、封闭后, 加入一抗Iba1(1 :250)4℃孵育过夜, 经荧光二抗避光孵育1 h后, DAPI染核, 封片。在共聚焦荧光显微镜下观察, 选取大脑皮层半暗带区5个独立400倍视野, 分别计数活化的小胶质细胞和视野内总的小胶质细胞。小胶质细胞活化率=小胶质细胞活化数/总小胶质细胞数×100%, 5个视野小胶质细胞活化率取平均值作为该标本小胶质细胞活化率。
1.2.6 ELISA法检测大脑皮层匀浆中TNF-α浓度大脑皮层匀浆制备:大鼠麻醉, 立即取出完整脑组织, 切取距离前囟点-1~-3 mm范围的梗侧大脑皮层, 称质量, 按照质量比1 :10加入生理盐水进行匀浆, 匀浆液离心, 取上清。按照ELISA试剂盒步骤, 在样品孔中依次加入样品、生物素、酶标亲和素、底物孵育显色, 用酶标仪进行读数, 代入标准曲线计算得到TNF-α浓度。
1.2.7 建立氧糖剥夺/复氧模型及分组细胞氧糖剥夺/复氧模型:BV2细胞接种于6 cm培养皿中, 待细胞达到70%融合后建立模型。将细胞培养基更换为预缺氧的无糖DMEM培养基, 随后置于三气(1%O2、94%N2、5%CO2)培养箱中进行缺氧培养2 h, 而后换回正常含糖完全培养基, 放入普通细胞培养箱继续培养24 h后检测各指标。Control组细胞始终在正常含糖含氧条件下培养。1 μmol/L Dex+OGD/R组和10 μmol/L Dex+OGD/R组于缺氧前2 h开始加入终浓度分别为1、10 μmol/L Dex, 至缺氧培养结束, Control组和OGD/R组加入等体积PBS。
1.2.8 ELISA法检测细胞上清液中TNF-α浓度收取细胞培养上清液, 离心后取上清。按照试剂盒步骤加入样品进行检测。
1.2.9 Western blot检测细胞内CD68、NF-κB p65、p-NF-κB p65蛋白表达情况吸除细胞上清, 加入裂解液, 冰上裂解40 min后离心, 取上清液即获得细胞总蛋白。检测蛋白浓度, 根据蛋白浓度调整上样量。蛋白样品按Western blot法经电泳、转膜、封闭后加入一抗, 4 ℃孵育过夜, 荧光二抗孵育后, 通过荧光扫描成像系统进行曝光成像, 采用Image J图像分析软件计算灰度值。抗体稀释浓度:鼠抗CD68(1 :500)、兔抗NF-κBp65(1 :500), 兔抗p-NF-κB p65(1 :1 000), 驴抗兔荧光二抗(1 :10 000)、驴抗鼠荧光二抗(1 :10 000)。
1.3 统计学分析计量资料以x±s表示, 采用SPSS 24.0统计软件, 方差齐时多组间比较采用单因素方差分析, 两两比较采用LSD-t检验, 方差不齐时行Kruskal-Wallis H检验。检验水准:α=0.05。
2 结果 2.1 右美托咪定改善脑缺血再灌注大鼠神经功能评分I/R组评分显著高于Sham组, 说明模型可靠, 与I/R组相比, Dex+I/R组评分降低(P < 0.05), 说明右美托咪定干预改善了神经功能, 见表 1。
| 组别 | 样本数 | Longa评分 |
| Sham组 | 10 | 0±0 |
| I/R组 | 10 | 2.60±0.52 |
| Dex+I/R组 | 10 | 1.90±0.57a |
| a:P < 0.05, 与I/R组比较 | ||
2.2 右美托咪定降低脑缺血再灌注大鼠脑组织细胞坏死程度
光镜下观察梗侧大脑皮层病理改变。Sham组:细胞排列有序, 细胞形态结构正常, 细胞核圆形, 核仁清晰, 胞质均匀淡染, 细胞周围间隙致密。I/R组:脑组织着色浅, 细胞数量减少, 排列紊乱, 大量细胞坏死, 细胞胞体缩小, 胞核固缩或碎裂, 细胞呈空泡样变性, 间质水肿疏松。Dex+I/R组:细胞坏死程度较I/R组减轻, 细胞核部分固缩, 少量细胞呈空泡样变性, 间质水肿减轻, 见图 1。
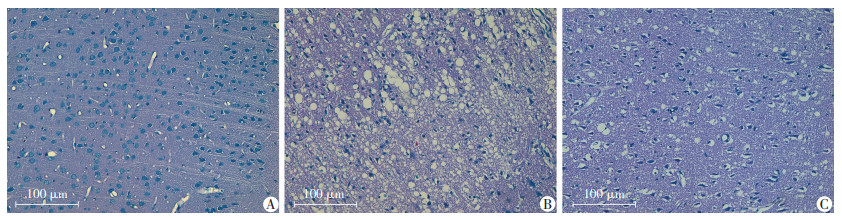
|
| A:Sham组; B:I/R组; C:Dex+I/R组 图 1 HE染色检测各组大鼠梗侧大脑皮层病理学变化 |
2.3 右美托咪定减少脑缺血再灌注大鼠皮层半暗带区神经细胞凋亡
I/R组凋亡率为(58.92±5.85)%, 与Sham组比较神经细胞凋亡明显增加(P < 0.01), Dex+I/R组凋亡率为(39.52±6.03)%, 与I/R组比较凋亡率下降(P < 0.05, 图 2)。
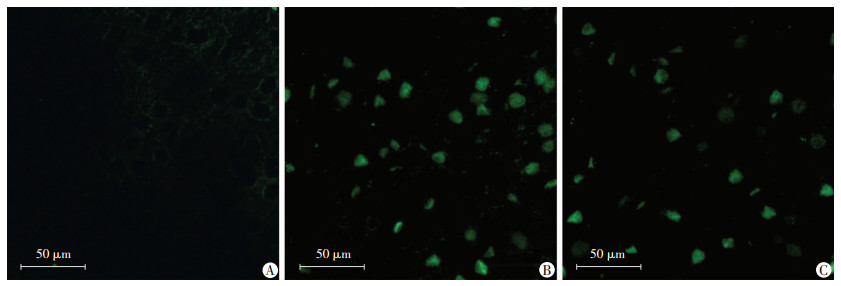
|
| A:Sham组; B:I/R组; C:Dex+I/R组 图 2 TUNEL法检测各组大鼠大脑皮层神经细胞凋亡情况 |
2.4 右美托咪定减少脑缺血再灌注大鼠半暗带区小胶质细胞活化
共聚焦显微镜下可见Sham组小胶质细胞均处于静息状态, 呈胞体较小, 突起较长的分支状。I/R组大量小胶质细胞处于活化状态, 呈胞体变大, 突起缩短的阿米巴状。Dex+I/R组部分小胶质细胞处于活化状态, 胞体略大, 有较短的突起, 活化程度较I/R组降低。I/R组小胶质细胞活化率为(69.36±6.59)%, 较Sham组显著增加(P < 0.01), Dex+I/R组小胶质细胞活化率为(49.71±8.37)%, 较I/R组显著降低(P < 0.05, 图 3)。
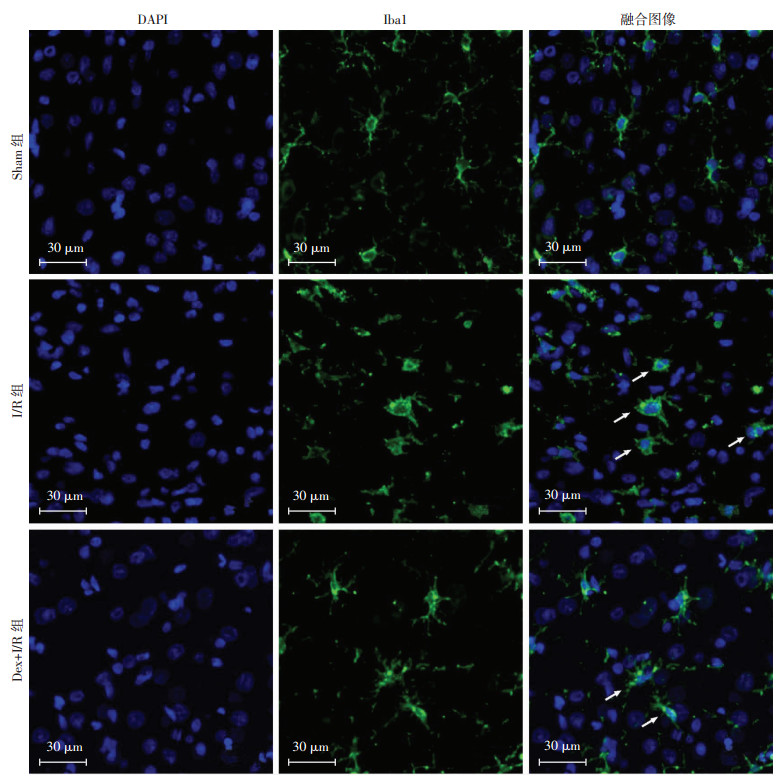
|
| ↑:示活化的小胶质细胞 图 3 组织免疫荧光检测各组大鼠小胶质细胞活化情况 |
2.5 右美托咪定降低缺血再灌注大鼠大脑皮层匀浆TNF-α浓度
ELISA检测结果显示, I/R组TNF-α浓度为(181.94± 20.24)ng/L, 较Sham组(82.42±6.27)ng/L明显增加(P < 0.01), 而Dex+I/R组(136.28±8.12)ng/L较I/R组显著降低(P < 0.05)。
2.6 右美托咪定减少BV2细胞氧糖剥夺/复氧后TNF-α分泌细胞培养上清检测结果显示, OGD/R组TNF-α浓度为(206.80±36.01)ng/L, 显著高于Control组(87.23± 4.44)ng/L(P < 0.01), 说明模型成功。1 μmol/L Dex+OGD/R组、10 μmol/L Dex+OGD/R组TNF-α浓度分别为(155.23±18.68)ng/L、(139.87±14.49)ng/L, 较OGD/R组均显著降低(P < 0.05)。
2.7 右美托咪定减少BV2细胞氧糖剥夺/复氧后CD68表达Western blot检测结果显示, BV2细胞经氧糖剥夺/复氧后, CD68表达明显增加(P < 0.01), 而经10 μmol/L Dex处理的BV2细胞CD68表达降低(P < 0.05, 图 4)。
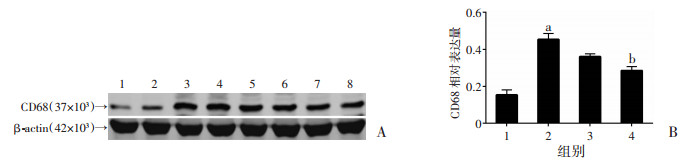
|
| A:Western blot检测结果1、2:Control组; 3、4:OGD/R组; 5、6:1 μmol/L Dex+OGD/R组; 7、8:10 μmol/L Dex+OGD/R组; B:半定量分析(n=8) 1:Control组; 2:OGD/R组; 3:1 μmol/L Dex+OGD/R组; 4:10 μmol/L Dex+OGD/R组; a:P < 0.01, 与Control组比较; b:P < 0.05, 与OGD/R组比较 图 4 Western blot检测各组细胞CD68表达情况 |
2.8 右美托咪定抑制BV2细胞氧糖剥夺/复氧后NF-κBp65磷酸化
Western blot检测结果显示, BV2细胞经氧糖剥夺/复氧后, NF-κB p65表达明显增加(P < 0.01), 经实验浓度的Dex处理的BV2细胞NF-κB p65表达差异无统计学意义(P>0.05)。BV2细胞经氧糖剥夺/复氧后, NF-κB p65磷酸化水平升高(P < 0.01), 经10 μmol/L Dex处理的BV2细胞NF-κB p65磷酸化水平降低(P < 0.05, 图 5)。
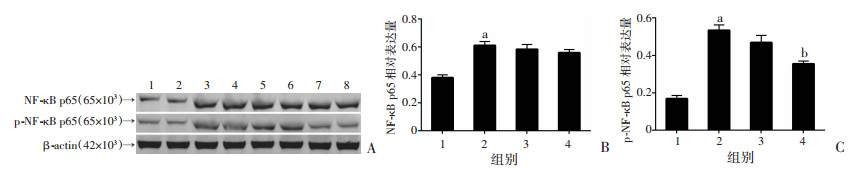
|
| A:Western blot检测结果1、2:Control组; 3、4:OGD/R组; 5、6:1 μmol/L Dex+OGD/R组; 7、8:10 μmol/L Dex+OGD/R组; B:NF-κB p65表达半定量分析(n=8);C:p-NF-κB p65表达半定量分析(n=8) 1:Control组; 2:OGD/R组; 3:1 μmol/L Dex+OGD/R组; 4:10 μmol/L Dex+OGD/R组; a:P < 0.01, 与Control组比较; b:P < 0.05, 与OGD/R组比较 图 5 Western blot检测各组细胞NF-κB p65和p-NF-κB p65蛋白表达情况 |
3 讨论
脑缺血再灌注损伤的病理机制主要涉及氧自由基、钙超载、炎症反应、细胞凋亡等[12]。小胶质细胞是脑内固有的免疫细胞, 起支持组织结构、营养神经、免疫监视等作用。当脑内发生炎症、感染、创伤或其他神经系统疾病时, 小胶质细胞迅速被激活[13]。活化小胶质细胞释放大量细胞毒性的炎症因子, 如TNF-α、IL-1β、IL-6等, 加重神经元损害[14]。抑制小胶质细胞激活, 可减轻其炎症反应, 发挥脑保护作用[15]。
已有证据显示右美托咪定对脑缺血再灌注损伤具有保护作用, 可能与抑制儿茶酚胺释放、抑制神经元凋亡、抗氧化等有关[16], 具体机制仍不清楚。本实验从调节小胶质细胞活化角度, 探讨右美托咪定对脑缺血再灌注损伤的影响。
动物实验结果显示, 用右美托咪定干预大鼠MCAO模型后, 与I/R组比较, 大鼠神经功能改善(P < 0.05), 病理损伤减轻, 神经细胞凋亡减少(P < 0.05), 说明右美托咪定对缺血再灌注损伤大鼠具有脑保护作用。在静息状态下, 小胶质细胞呈胞体较小, 突起较长的分支状; 激活的小胶质细胞呈胞体变大, 突起缩短的阿米巴状, 形态学变化是小胶质细胞活化的重要特征[17]。Iba1是在小胶质细胞中特异性表达的钙结合蛋白[18], 通过Iba1染色可观察小胶质细胞的形态学改变。TNF-α是一种促炎因子, 可引起过氧化损伤导致神经元变性坏死[19]。活化的小胶质细胞是缺血损伤后脑内TNF-α的主要来源[20], 因此TNF-α也可作为反映小胶质细胞活化的指标。提示Dex在大鼠MCAO模型中可抑制皮层小胶质细胞活化, 降低大脑皮层炎症水平。
为排除体内其他因素的影响, 本实验建立了OGD/R模型, 在细胞水平模拟体内缺血再灌注损伤, 观察右美托咪定对单独培养的小胶质细胞的影响。CD68是巨噬细胞的一种吞噬标志物, 小胶质细胞活化后大量表达, 可作为小胶质细胞活化标记物[21]。体外实验结果显示:Dex干预后BV2细胞CD68表达水平降低(P < 0.05), 也降低上清液TNF-α表达(P < 0.05), 进一步说明Dex可抑制小胶质细胞活化, 减少小胶质细胞炎症因子释放。那么, Dex通过何种途径发挥上述作用。已知NF-κB在炎性细胞因子诱导的基因表达中起关键性调控作用, 有研究表明, 激活NF-κB促进小胶质细胞活化, 同时增加小胶质细胞介导的TNF-α等炎症因子释放, 而抑制NF-κB后, 小胶质细胞活化减少, 小胶质细胞介导的炎症因子释放较少, 发挥保护作用[22-23]。我们发现Dex不影响BV2细胞NF-κB p65蛋白表达, 但降低磷酸化水平(P < 0.05), 提示Dex可能通过抑制NF-κB激活, 从而抑制小胶质细胞活化, 减少TNF-α等炎性细胞因子表达。
综上所述, 右美托咪定通过抑制小胶质细胞活化减轻脑缺血再灌注损伤发挥脑保护作用, 可能与其抑制小胶质细胞NF-κB通路有关。
本研究仍存在局限性, 在于无法区分Dex在缺血期和(或)再灌注期发挥上述作用。本实验观察到Dex可降低小胶质细胞NF-κB p65磷酸化水平, 但其具体分子机制尚需进一步研究。缺血再灌注(I/R)损伤导致的小胶质细胞活化机制可能涉及多途径, 多通路, 非常复杂, 我们仅据已做实验, 进行初步探讨。
| [1] | MORETTI A, FERRARI F, VILLA R F. Neuroprotection for ischaemic stroke: current status and challenges[J]. Pharmacol Ther, 2015, 146: 23–34. DOI:10.1016/j.pharmthera.2014.09.003 |
| [2] | FEIGIN V L, FOROUZANFAR M H, KRISHNAMURTHI R, et al. Global and regional burden of stroke during 1990-2010: findings from the global burden of disease study 2010[J]. Lancet, 2014, 383(9913): 245–254. DOI:10.1016/S0140-6736(13)61953-4 |
| [3] | ELTZSCHIG H K, ECKLE T. Ischemia and reperfusion—from mechanism to translation[J]. Nat Med, 2011, 17(11): 1391–1401. DOI:10.1038/nm.2507 |
| [4] | JIN R, YANG G, LI G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells[J]. J Leukoc Biol, 2010, 87(5): 779–789. DOI:10.1189/jlb.1109766 |
| [5] | IADECOLA C, ALEXANDER M. Cerebral ischemia and inflammation[J]. Curr Opin Neurol, 2001, 14(1): 89–94. DOI:10.1016/b978-1-4160-5478-8.10009-0 |
| [6] | WEINSTEIN J R, KOERNER I P, M LLER T. Microglia in ischemic brain injury[J]. Future Neurol, 2010, 5(2): 227–246. DOI:10.2217/fnl.10.1 |
| [7] | ZHU Y M, WANG C C, CHEN L, et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J]. Brain Res, 2013, 1494: 1–8. DOI:10.1016/j.brainres.2012.11.047 |
| [8] | LEMPI INEN J, FINCKENBERG P, MERVAALA E E, et al. Dexmedetomidine preconditioning ameliorates kidney ischemia- reperfusion injury[J]. Pharmacol Res Perspect, 2014, 2(3): e00045. DOI:10.1002/prp2.45 |
| [9] | RIQUELME J A, WESTERMEIER F, HALL A R, et al. Dexmedetomidine protects the heart against ischemia-reperfusion injury by an endothelial eNOS/NO dependent mechanism[J]. Pharmacol Res, 2016, 103: 318–327. DOI:10.1016/j.phrs.2015.11.004 |
| [10] | BELL M T, AGOSTON V A, FREEMAN K A, et al. Interruption of spinal cord microglial signaling by alpha-2 agonist dexmedetomidine in a murine model of delayed paraplegia[J]. J Vasc Surg, 2014, 59(4): 1090–1097. DOI:10.1016/j.jvs.2013.04.050 |
| [11] | LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84–91. DOI:10.1161/01.str.20.1.84 |
| [12] | SCHALLER B, GRAF R. Cerebral ischemia and reperfusion: the pathophysiologic concept as a basis for clinical therapy[J]. J Cereb Blood Flow Metab, 2004, 24(4): 351–371. DOI:10.1097/00004647-200404000-00001 |
| [13] | NAYAK D, ROTH T L, MCGAVERN D B. Microglia development and function[J]. Annu Rev Immunol, 2014, 32: 367–402. DOI:10.1146/annurev-immunol-032713-120240 |
| [14] | CEULEMANS A G, ZGAVC T, KOOIJMAN R, et al. The dual role of the neuroinflammatory response after ischemic stroke: modulatory effects of hypothermia[J]. J Neuroinflamm, 2010, 7: 74. DOI:10.1186/1742-2094-7-74 |
| [15] | D'AVILA J C, LAM T I, BINGHAM D, et al. Microglial activation induced by brain trauma is suppressed by post-injury treatment with a PARP inhibitor[J]. J Neuroinflamm, 2012, 9: 31. DOI:10.1186/1742-2094-9-31 |
| [16] |
陈丽娇, 薛庆生, 于布为. 右美托咪定的神经保护作用及其相关机制[J].
中国药理学通报, 2015, 31(11): 1493–1495.
CHEN L J, XUE Q S, YU B W. Neuroprotection and mechanisms of dexmedetomidine[J]. Chin Pharmacol Bull, 2015, 31(11): 1493–1495. DOI:10.3969/j.issn.1001-1978.2015.11.004 |
| [17] | MA Y, WANG J, WANG Y, et al. The biphasic function of microglia in ischemic stroke[J]. Prog Neurobiol, 2017, 157: 247–272. DOI:10.1016/j.pneurobio.2016.01.005 |
| [18] | BOK S, WANG T, LEE C J, et al. In vivo imaging of activated microglia in a mouse model of focal cerebral ischemia by two-photon microscopy[J]. Biomed Opt Express, 2015, 6(9): 3303–3312. DOI:10.1364/BOE.6.003303 |
| [19] | TAKEUCHI H, JIN S, WANG J, ZHANG G, et al. Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner[J]. J Biol Chem, 2006, 28;281(30): 21362–21368. DOI:10.1074/jbc.M600504200 |
| [20] | GREGERSEN R, LAMBERTSEN K, FINSEN B. Microglia and macrophages are the major source of tumor necrosis factor in permanent middle cerebral artery occlusion in mice[J]. J Cereb Blood Flow Metab, 2000, 20(1): 53–65. DOI:10.1097/00004647-200001000-00009 |
| [21] | AONO H, CHOUDHURY M E, HIGAKI H, et al. Microglia may compensate for dopaminergic neuron loss in experimental Parkinsonism through selective elimination of glutamatergic synapses from the subthalamic nucleus[J]. Glia, 2017, 65(11): 1833–1847. DOI:10.1002/glia.23199 |
| [22] | STAROSSOM S C, MASCANFRONI I D, IMITOLA J, et al. Galectin-1 deactivates classically activated microglia and protects from inflammation-induced neurodegeneration[J]. Immunity, 2012, 37(2): 249–263. DOI:10.1016/j.immuni.2012.05.023 |
| [23] | FRAKES A, FERRAIUOLO L, HAIDET-PHILLIPS A, et al. Microglia induce motor neuron death via the classical NF-κB pathway in amyotrophic lateral sclerosis[J]. Neuron, 2014, 81(5): 1009–1023. DOI:10.1016/j.neuron.2014.01.013 |



