2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院超声科
2. Department of Ultrasonography, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肾细胞癌(renal cell carcinoma, RCC)是肾脏最常见的恶性肿瘤,占肾脏肿瘤的70%~80% [1]。由于发病隐匿,很多肾癌发现时已是晚期[2],对于晚期肾癌的治疗,VEGF/PDGFR/mTOR途径的分子靶向治疗药物已取代免疫治疗成为晚期肾癌患者的一线用药,但很少有患者得到完全缓解,由于该类药物的靶点在全身分布广泛,且系全身用药,所以副反应比较多,有的甚至非常严重[3]。因此,肾癌的治疗仍需发展靶向性更好的药物或给药系统,达到高反应率、低副作用和持久的缓解。
靶向载药超声微泡联合超声靶向微泡破坏(ultrasound targeted microbubble destruction, UTMD)可以递送药物或治疗基因到各系统的肿瘤内部,证实能增加药物抗肿瘤疗效[4]。在我们前期研究中,我们制备了G250单克隆抗体靶向的纳米微泡,证实该靶向微泡能与表达肾癌相关抗原G250的肾癌细胞靶向结合,可显著增强肾癌移植瘤的超声显像,有助于肾癌的早期鉴别诊断,验证了G250是肾癌诊治的理想靶标[5]。由于单克隆抗体体积较大,不利于靶向微泡的小型化和穿出血管壁到达组织间隙,且免疫原性强,而纳米抗体分子量小(15~20×103),免疫原性低,具有高度稳定性和与抗原结合的高亲合力,是分子治疗的理想配体[6]。我们通过免疫骆驼,构建噬菌体展示纳米抗体库,淘选出了能与肾癌相关抗原G250胞外区特异性结合的纳米抗体,为我们制备纳米抗体靶向的纳米微泡奠定了基础[7]。
替西罗莫司(temsirolimus,TEM)是哺乳动物雷帕霉素靶点(mTOR)的抑制剂,可抑制肾癌增殖,显著提高晚期肾癌患者的总生存率,在肾癌治疗中应用广泛[8-9]。本研究拟将TEM制备成适合局部释放的纳米级超声微泡,再通过生物素-亲和素桥连法将G250纳米抗体连接到微泡表面实现靶向性,联合UTMD触发药物释放,以提高药物递送效率,减少毒副作用,增强治疗效果。
1 材料与方法 1.1 材料 1.1.1 纳米抗体与细胞株G250纳米抗体为本课题组成员前期制备[7],人肾癌系786-O细胞、ACHN细胞购于中科院上海细胞库。
1.1.2 主要试剂分别有:DPPC(1, 2-二棕榈酰-sn-甘油-3-磷酸胆碱),DPPE(1, 2-二棕榈酰基-sn-glycero-3-磷酸乙醇胺),DPPG(1, 2-dipalmitoyl-sn-glycero-3-磷酸甘油),DPPA(1, 2-二棕榈酰-sn-甘油-3-磷酸酯)(Corden Pharma, Switzerland),和DSPE-PEG2K-Biotin(生物素修饰的1, 2-二硬脂酰基-sn-甘油-3-磷酸)(NANOCS,Boston,MA,USA);替西罗莫司(纯度=99.14%)(Selleck Chemicals, Houston, USA);胎牛血清, 100 U/mL青霉素和100μg/mL链霉素, 细胞培养基RPMI1640、MEM, 胰酶EDTA购于荷兰BI公司;链霉亲和素购于北京索莱宝科技有限公司;荧光Alexa-488标记的二抗(Thermo Fisher, Rockford, USA),CCK-8试剂盒、一步法TUNEL细胞凋亡试剂盒购至碧云天生物技术公司(中国上海);八氟丙烷(C3F8;中国天津核工业理化工程研究所)。
1.1.3 主要仪器ST-B系列混合器(AT & M Biomaterials Co., Beijing, China);IX71光学显微镜(Olympus Corporation, Kyoto, Japan);Malvern Zetasizer nano ZS90检测器(Malvern Instruments Inc., Worces-tershire, UK);JEM-1400透射电子显微镜(JEOL, Tokyo, Japan);Agilent 1260高效液相色谱仪(Agilent Technologies, USA),WED-100超声治疗设备(中国深圳医疗电子有限公司)。
1.2 方法 1.2.1 靶向载药纳米微泡的制备采用薄膜水化和链霉素-亲和素桥连法制备靶向载药纳米微泡。将DDPC、DPPE、DPPG、DPPA、生物素化的DSPE-PEG(2000)共11 mg和替西罗莫司1mg融于甘油与PBS混合液中(体积比为1 :9),在55 ℃中水浴60 min后移至密闭的西林瓶中。用C3F8置换瓶中空气,将西林瓶置于ST-B系列混合器水平往复机械振动振荡90 s。将所得液体依次在300 g和300 r/min的条件下离心3 min,进一步纯化以除去未成泡的脂质成分和直径较大的微泡。最后,按3 μg/107 NB的比例加入亲和链霉素置4比孵育1 h,洗涤3次;按0.64 μg/107 NB的比例加入生物素化的G250纳米抗体4米孵育1 h,洗涤3次从而获得G250纳米抗体靶向的载替西罗莫司纳米微泡(G250-TEM-NBs)。
1.2.2 靶向载药纳米微泡表征通过马尔文粒径分析仪测量G250-TEM-NBs的平均粒度和ζ电位。使用光学显微镜观察G250-TEM-NBs的分布。使用透射电子显微镜观察NBs的形态特点。HPLC来测定G250-TEM-NBs的包封率(EE)和载药效率(LE),包封率(EE)=包封在纳米微泡内的TEM量/加入的TEM总量×100%,载药效率(LE)=包封在纳米微泡内的TEM量/制备纳米微泡的脂质总量×100%[10-11]。色谱条件:色谱柱:Zorbax Eclipse XDB-C18(150 mm×4.6 mm, 3 μm),柱温:30 ℃,流速:0.8 mL/min,进样量:10 μL,流动相:乙腈:0.5%冰乙酸(45 :55),检测波长:277 nm,每组重复3次。
将荧光Alexa-488标记的HA-tag抗小鼠IgG1单克隆抗体(Thermo Fisher Scientific, Rockford, US)100 μL(1 :500)加入到G250-TEM-NBs样品中4品孵育1 h,在荧光显微镜下观察,验证生物素化的G250纳米抗体是否连接到NB的表面。
1.2.3 细胞培养将人肾癌786-O细胞接种于含有10%(V/V)胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640培养基中,人肾癌细胞ACHN接种于含有10%(V/V)胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的MEM培养基中,在37 ℃含有5% CO2的孵箱中培养,取指数生长期的细胞用0.25%胰蛋白酶消化后传代或进行实验。
1.2.4 G250-TEM-NBs体外靶向能力将一定浓度786-O细胞、ACHN细胞分别接种于24孔板中,培养24 h,将细胞固定在4%多聚甲醛中并用含5%牛血清白蛋白(BSA-PBS)的PBS封闭。分别将细胞分成2组,一组加入50 μL浓度为108/mL的G250-TEM-NBs,另一组加入相同浓度的TEM-NBs,在4 ℃孵育2 h,PBS漂洗3次,3 min/次,在光学显微镜下观察与786-O细胞结合的纳米泡的数量。上述实验重复3次。
1.2.5 G250-TEM-NBs抗细胞增殖测定通过CCK-8测定来评估G250-TEM-NBs抗细胞增殖效率。将786-O细胞以5 000个细胞/孔的密度接种在96孔板中,5% CO2、37 ℃培养过夜。将细胞分成8组:对照组±US、游离TEM±US、TEM-NBs±US、G250-TEM-NBs±US,n=5。对照组未接受治疗。TEM组与载药NB组TEM的剂量均为2 μmol/L。给药1h后开始超声辐照,超声功率为1 W/cm2,照射时间为20 s[12]。处理24 h后,每孔加入10 μLCCK-8试剂并在培养箱中孵育1 h。用酶标仪在450 nm处读取光密度值D(450)并计算细胞存活率,所有实验进行3次。
1.2.6 细胞凋亡测定将浓度为5×104/mL处于指数生长期的786-O细胞接种在24孔板中,在37 ℃、5%CO2潮湿的培养箱中孵育。培养过夜后将细胞如上所述用于抗增殖测定分组,并进行相应处理24 h。PBS洗1次,4%多聚甲醛固定细胞30 min,加室温孵育5 min,加入按说明书配制的TUNEL检测液50 μL,37 ℃液避光孵育60 min。PBS洗涤3次,DAPI复染核5 min,PBS洗3次,用抗荧光淬灭封片液封片后激光共聚焦显微镜下观察。
1.3 统计学分析计量资料用x±s表示,使用SPSS 23.0统计软件进行分析;数据分析采用配对t检验和单因素方差分析。检验水准:α=0.05。
2 结果 2.1 靶向载药纳米微泡的特征G250-TEM-NBs在光学显微镜下分散性好(图 1A),荧光显微镜下G250-TEM-NBs呈均匀绿色(图 1B),表明G250纳米抗体均匀连接到NB的表面。电镜下呈圆形(图 1C),大小均匀。粒径为(399.67±99.67)nm(图 1D),Zeta电位为(-23.33±2.63)mV(图 1E),经IPP6.0软件灰度测量计算靶向纳米微泡浓度为(4.50±1.18)×109/mL,n=3。

|
| A:显微镜下G250-TEM-NBs;B:A488染色的G250-TEM-NBs;C:透射电镜观察G250-TEM-NBs形态;D:G250-TEM-NBs粒径分布;E:G250-TEM-NBs的电位分布 图 1 G250-TEM-NBs表征 |
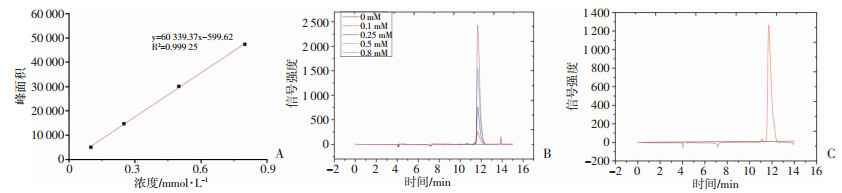
高效液相色谱法检测替西罗莫司并绘制标准工作曲线(图 2A),直线回归方程为y=60 339.37x-599.62,R2=0.999 25,在0~0.8 mmol/L范围内替西罗莫司线性关系良好。计算G250-TEM-NBs的包封率(EE,Encapsulation efficiency)和载药效率(LE,Drug-loading efficiency)分别为(87.73±5.44)%和(7.99±0.49)%,n=3。TEM标准品出峰时间为12 min出峰,峰型良好(图 2B);G250-TEM-NBs样品出峰时间与标准品一致,峰型良好(图 2C)。
|
| A:HPLC法测得不同浓度样品工作曲线(R2=0.999 25);B:TEM标准品色谱分析,出峰时间为12 min出峰,峰型良好;C:G250-TEM-NBs样品色谱分析,出峰时间与标准品一致 图 2 高效液相色谱法检测结果 |
2.2 G250-TEM-NBs体外靶向能力
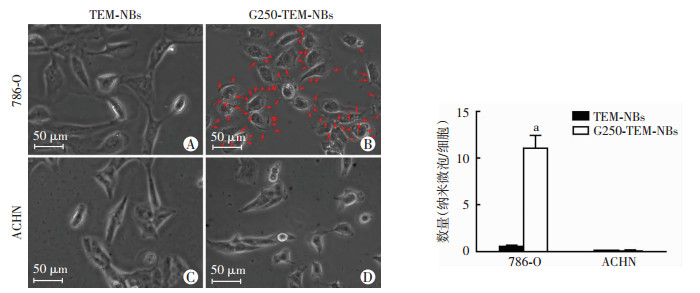
光学显微镜下观察表达G250抗原的786-O细胞与TEM-NBs几乎不结合(图 3A),而与G250-TEM-NBs大量结合(图 3B)。两种载药微泡与不表达G250抗原的ACHN细胞均不结合(图 3C、D),直方图显示(图 3E),每个细胞平均结合G250-TEM-NBs的数量与结合TEM-NBs的数量差异有统计学意义(P<0.05)。说明G250-TEM-NBs与表达G250抗原的786-O细胞可以特异性结合。
|
| A:TEM-NBs与786-O细胞几乎不结合;B:红色箭头表示与786-O细胞结合的G250-TEM-NBs;C、D:ACHN细胞与两种载药纳米微泡均不结合;E:两种载药纳米微泡与细胞结合能力分析a:P<0.05,与786-O细胞结合TEM-NBs数量比较 图 3 G250-TEM-NBs靶向结合786-O细胞的能力评估 |
2.3 G250-TEM-NBs对786-O细胞的抗增殖能力检测
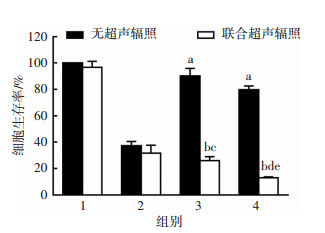
CCK-8法检测分析G250-TEM-NBs联合US的抗细胞增殖效率。如图 4所示,对照组和单纯超声辐照组细胞存活率差异无统计学意义(P>0.05),表明超声照射剂量对细胞是安全的。游离TEM组与TEM+US组的细胞存活率差异无统计学意义。在没有超声辐照的情况下,游离TEM的抗肿瘤细胞增殖能力高于G250-TEM-NBs和TEM-NBs组。两种载药微泡在超声辐照下,抗细胞增殖能力明显增大(P<0.05)。最重要的是,G250-TEM-NBs+US组的抗细胞增殖能力高于TEM-NBs+US组。G250-TEM-NBs+US组细胞的存活率是所有组中最低的。
|
| 1:对照组,2:TEM组,3:TEM-NBs组,4:G250-TEM-NBs组;a:P<0.05,与无超声辐照的TEM组比较;b:P<0.05,与联合超声TEM组比较;c:P<0.05,与无超声辐照的TEM-NBs组比较;d:P<0.05,与无超声辐照的G250-TEM-NBs组比较;e:P<0.05,与联合超声的TEM-NBs组比较 图 4 CCK-8法检测G250-TEM-NBs对786-O细胞抗增殖效率 |
2.4 G250-TEM-NBs诱导细胞凋亡
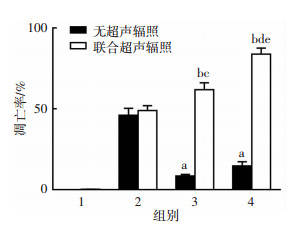
一步法TUNEL细胞凋亡检测结果显示未联合超声时游离TEM组诱导肿瘤细胞凋亡作用优于载药纳米微泡组(图 5、6);而联合超声辐照后,载药微泡组诱导肿瘤细胞凋亡作用明显优于直接给药组,G250-TEM- NBs+US组诱导786-O细胞凋亡效果最好。这一结果与抗增殖能力检测结果一致。
|
| 1:对照组,2:TEM组,3:TEM-NBs组,4:G250-TEM-NBs组;a:P<0.05,与无超声辐照的TEM组比较;b:P<0.05,与联合超声辐照的TEM组比较;c:P<0.05,与无超声辐照的TEM-NBs组比较;d:P<0.05,与无超声辐照的G250-TEM-NBs组比较;e:P<0.05,与联合超声的TEM-NBs组比较 图 5 统计分析各组诱导肿瘤细胞凋亡的比率变化 |
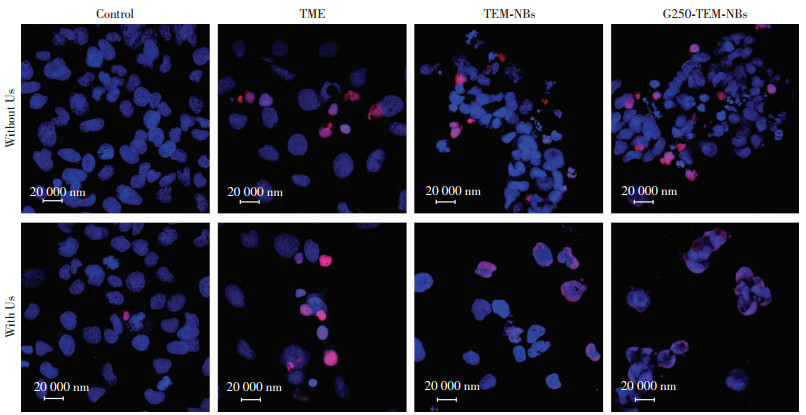
|
| 图 6 TUNEL检测G250-TEM-NBs诱导786-O细胞凋亡 |
3 讨论
由于肾癌临床症状隐匿,仅6%~10%出现典型的腰疼、血尿及腹部包块三联症,早期诊断困难,发现时很多已为中晚期,手术切除率低,并且术后复发率高[13]。药物治疗是肾癌综合治疗的重要手段之一,近年来对新型靶向治疗的不断探索有望改善患者的生存率[14]。肿瘤区域的药物有效浓度与持续时间是肿瘤化疗的两个重要因素,全身用药后,药物在体内吸收、分布、代谢,最终在肿瘤部位的药物有效浓度低、持续时间短,疗效差,并且毒副作用大[15]。因此需要积极探寻新型药物载体来满足临床需要,而超声微泡造影剂(ultrasonic microbubble contrast agent, UCA)既可以用于疾病的诊断/鉴别诊断,也可以作为载体携带抗癌药物或基因用于治疗,被认为是一种临床应用前景非常好的药物载体[16]。目前研究比较多的UCA是脂质纳米微泡(nanobubbles, NBs),其可以携载抗肿瘤药物,将药物输送到肿瘤组织,并且减少药物在血液循环系统中的降解。进一步用或抗体对NBs表面修饰促进其主动靶向作用,可增加药物在肿瘤部位的聚集[17]。疏水性药物可以包裹在脂质微泡的脂质层之间,而亲水性药物携载在脂质体结构的水性核中[18]。靶向载药纳米微泡在增强渗透和保留效应(enhanced permeability and retention,ERP)效应和主动靶向共同作用下有效增加局部有效药物浓度、延长药物作用时间而增强疗效,又减少全身毒副作用,在UTMD作用下释放药物杀死肿瘤细胞,从而有效地治疗肿瘤。靶向微泡携载药物联合UTMD在肿瘤治疗中有潜在的应用价值而被广泛研究,如携载阿霉素、紫杉醇、长春新碱脂、顺铂、10-羟基喜树碱、美罗华等[19],但多处于动物实验阶段,要进入临床,还需要深入研究。
本实验中制备的靶向载药纳米微泡G250-TEM-NBs大部分粒径小,电镜下呈圆形,大小均匀,分散性好,药物包封效率高。配体介导的主动靶向性是肿瘤靶向治疗的关键,本研究制备的G250纳米抗体具有分子量小、稳定性好、免疫原性低、特异性高、易于修饰、穿透组织能力强,是目前最小的功能性抗原结合片段。使用生物素-链霉素亲和素将生物素化的纳米抗体连接在微泡表面,并通过进行免疫荧光验证,在体外实验中进一步证实其对肾癌细胞系786-O细胞有很好的靶向性。在抗细胞增殖实验中发现,未经超声辐照时载药纳米微泡组的抗细胞增殖能力均明显低于直接给药组,是游离TEM比载药NBs更容易被动扩散、内化、穿透和进入细胞,而NB中的TEM随其破裂而逐渐释放,细胞毒性随时间增加[20]。载药纳米微泡在UTMD作用下抗细胞增殖能力明显增强,并且优于直接给药组。一方面,UTMD产生的空化效应使纳米微泡产生震荡、膨胀、压缩以及内爆等一系列的物理过程而破裂,所携载药物在超声辐照的部位迅速释放,药物在肿瘤局部聚集;另一方面,载药微泡作为空化核,在超声作用下稳定、持续地空化,产生“声孔效应”,引起邻近细胞的细胞膜破裂、穿孔,造成细胞及组织的损伤,增加了细胞膜的通透性,有利于药物通过毛细血管达到组织间隙,进一步增加肿瘤局部有效药物浓度,增强抗肿瘤效果[21]。最重要的是UTMD作用下靶向载药纳米微泡的抗增殖能力明显优于非靶向纳米微泡,说明靶向载药纳米微泡发挥了定向靶向作用。细胞凋亡对肿瘤的发生、发展起着负调控作用,TUNEL检测细胞凋亡,发现G250-TEM-NBs+US组诱导肿瘤凋亡作用最明显,进一步解释了超声爆破后靶向载药微泡中药物释放诱导细胞凋亡的机制。
目前尚未见有关靶向于肾癌的载药超声微泡的构建和靶向治疗的研究。我们首次将靶向治疗药物替西罗莫司溶解在脂质外壳中,采用生物素-亲和素桥连法将G250纳米抗体连接到微泡表面,制备了G250纳米抗体靶向的携载替西罗莫司的纳米微泡。TEM包封在脂质微泡的内部,包封率高,可以减少全身用药的毒副作用。通过G250纳米抗体实现主动靶向作用,并验证对肾癌细胞具有特异靶向作用,之所以选择靶点G250,是因为其本身是一种与肾癌生长和转移有关的酶,与靶向微泡结合可封闭其酶活性,从而也具有抑癌作用。在UTMD作用下载药纳米微泡破裂,药物在肿瘤局部释放,提高了局部的药物浓度,同时超声波的空化效应使细胞膜通透性增高,药物更易进入细胞内,极大高了药物的治疗作用,为肾癌的靶向治疗提供了新的思路。本研究尚存在不足之处,比如载药效率有待进一步提高,UTMD的参数(频率、时间、功率)需要进一步探索,尚未展开体内研究等。下一步,我们将继续深入研究上述问题,在动物体内继续研究G250纳米抗体靶向的载药纳米微泡的靶向性及其穿过肿瘤血管、与肾癌细胞特异性结合,在超声辐照下释放药物、抑制肾癌生长的过程和效果。
| [1] | LJUNGBERG B, BENSALAH K, CANFIELD S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J]. Eur Urol, 2015, 67(5): 913–924. DOI:10.1016/j.eururo.2015.01.005 |
| [2] | CAPITANIO U, MONTORSI F. Renal cancer[J]. Lancet, 2016, 387(10021): 894–906. DOI:10.1016/S0140-6736(15)00046-X |
| [3] | KIM S W, KIM S J, PARK S H, et al. Complete regression of metastatic renal cell carcinoma by multiple injections of engineered mesenchymal stem cells expressing dodecameric TRAIL and HSV-TK[J]. Clin Cancer Res, 2013, 19(2): 415–427. DOI:10.1158/1078-0432.CCR-12-1568 |
| [4] | JANG K W, SEOL D, DING L, et al. Ultrasound-triggered PLGA microparticle destruction and degradation for controlled delivery of local cytotoxicity and drug release[J]. Int J Biol Macromol, 2018, 106: 1211–1217. DOI:10.1016/j.ijbiomac.2017.08.125 |
| [5] |
阳孟君, 王洛夫, 郭燕丽, 等. 携载G250单克隆抗体的纳米微泡靶向于肾细胞癌的体内外实验研究[J].
第三军医大学学报, 2016, 38(2): 112–118.
YANG M J, WANG L F, GUO Y L, et al. In vivo and in vitro study of nanoscale microbubbles with G250 monoclonal antibodies targeting to renal cell carcinoma[J]. J Third Mil Med Univ, 2016, 38(2): 112–118. DOI:10.16016/j.1000-5404.201508106 |
| [6] | LIU L, YE Q, LU M, et al. A new approach to deliver anti-cancer nanodrugs with reduced off-target toxicities and improved efficiency by temporarily blunting the reticuloendothelial system with intralipid[J]. Sci Rep, 2017, 7(1): 16106. DOI:10.1038/s41598-017-16293-6 |
| [7] |
胡明, 王洛夫, 江军, 等. 骆驼抗G250蛋白胞外区纳米抗体的制备及鉴定[J].
第三军医大学学报, 2017, 39(06): 541–547.
HU M, WANG L F, JIANG J, et al. Preparation and inentification of camel nanobodies against human G250 ectodomain[J]. J Third Mil Med Univ, 2017, 39(06): 541–547. DOI:10.16016/j.1000-5404.201611198 |
| [8] | SCHULZE M, STOCK C, ZACCAGNINI M, et al. Temsirolimus[J]. Recent Results Cancer Res, 2014, 201: 393–403. DOI:10.1007/978-3-642-54490-3_24 |
| [9] | BERGMANN L, MAUTE L, GUSCHMANN M. Temsirolimus for advanced renal cell carcinoma[J]. Expert Rev Anticancer Ther, 2014, 14(1): 9–21. DOI:10.1586/14737140.2014.864562 |
| [10] | ZHAO H, WU M, ZHU L, et al. Cell-penetrating peptide-modified targeted drug-loaded phase-transformation lipid nanoparticles combined with low-intensity focused ultrasound for precision theranostics against hepatocellular carcinoma[J]. Theranostics, 2018, 8(7): 1892–1910. DOI:10.7150/thno.22386 |
| [11] | LUO W, WEN G, YANG L, et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment[J]. Theranostics, 2017, 7(2): 452–465. DOI:10.7150/thno.16677 |
| [12] | FAN X, WANG L, GUO Y, et al. Inhibition of prostate cancer growth using doxorubicin assisted by ultrasound-targeted nanobubble destruction[J]. Int J Nanomedicine, 2016, 11: 3585–3596. DOI:10.2147/IJN.S111808 |
| [13] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [14] | RYAN C W. Dosing strategies and optimization of targeted therapy in advanced renal cell carcinoma[J]. J Oncol Pharm Pract, 2017, 23(1): 43–55. DOI:10.1177/1078155215618769 |
| [15] | PY A G, ZEINADDEEN G, PERRIER Y, et al. Evaluation of the effectiveness of botulinum toxin injections in the lower limb muscles of children with cerebral palsy. Preliminary prospective study of the advantages of ultrasound guidance[J]. Ann Phys Rehabil Med, 2009, 52(3): 215–223. DOI:10.1016/j.rehab.2009.02.005 |
| [16] | G VENER N, APPOLD L, DE LORENZI F, et al. Recent advances in ultrasound-based diagnosis and therapy with micro- and nanometer-sized formulations[J]. Methods, 2017, 130: 4–13. DOI:10.1016/j.ymeth.2017.05.018 |
| [17] | BOISSENOT T, BORDAT A, FATTAL E, et al. Ultrasound-triggered drug delivery for cancer treatment using drug delivery systems: From theoretical considerations to practical applications[J]. J Control Release, 2016, 241: 144–163. DOI:10.1016/j.jconrel.2016.09.026 |
| [18] | MOUSSA H G, MARTINS A M, HUSSEINI G A. Review on triggered liposomal drug delivery with a focus on ultrasound[J]. Curr Cancer Drug Targets, 2015, 15(4): 282–313. DOI:10.2174/1568009615666150311100610 |
| [19] | P REZ-HERRERO E, FERN NDEZ-MEDARDE A. Advanced targeted therapies in cancer: drug nanocarriers, the future of chemotherapy[J]. Eur J Pharm Biopharm, 2015, 93: 52–79. DOI:10.1016/j.ejpb.2015.03.018 |
| [20] | XING L, SHI Q, ZHENG K, et al. Ultrasound-mediated microbubble destruction (UMMD) facilitates the delivery of CA19-9 targeted and paclitaxel loaded mPEG-PLGA-PLL nanoparticles in pancreatic cancer[J]. Theranostics, 2016, 6(10): 1573–1587. DOI:10.7150/thno.15164 |
| [21] | CAO Y, CHEN Y, YU T, et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound[J]. Theranostics, 2018, 8(5): 1327–1339. DOI:10.7150/thno.21492 |



