帕金森病(Parkinson’s disease, PD)是世界上最常见的神经退行性疾病。它是中枢神经系统(central nervous system, CNS)的第2常见病症, 平均发病年龄为60岁左右, 我国65岁以上人群PD的患病率大约是1.7%[1-2]。帕金森病最主要的病理改变是中脑黑质多巴胺(dopamine, DA)能神经元的变性死亡。PD的临床特征包括肌肉僵硬、静止性震颤、运动迟缓和姿势不稳定等[3]。药物治疗仍然是PD最主要的治疗手段。左旋多巴是治疗PD最有效的药物, 但其不能从根本上抑制PD的进程和DA能神经元的渐进性丢失, 且伴有一系列副作用, 因此寻找真正能够阻止疾病进程的神经保护药物非常必要[4-6]。关于PD的发病机制目前尚不明确, 可能与年龄、遗传、环境等风险因素及氧化应激、兴奋性毒素、自身免疫、线粒体功能障碍、细胞凋亡和异常蛋白的聚集等密切相关[7]。
研究表明, PD患者死亡后的脑组织中一些濒死的神经元可表现出凋亡的形态学特征, 且在黑质中可检测到Caspase 3, 8, 9的存在, 同时黑质存活的DA能神经元中抗凋亡蛋白Bcl-2表达下调, 表明细胞凋亡在PD患者的DA能神经细胞凋亡中发挥着重要作用[8]。因此对神经元的保护和抗细胞凋亡已成为PD治疗的主要思路。有研究也表明, 受损的线粒体功能与帕金森病密切相关[9]。线粒体在细胞死亡调控、能量代谢、钙离子贮存、传递电子等过程中发挥重要作用, 是细胞内氧化应激的源头和细胞凋亡的场所。研究还表明, PD患者黑质线粒体呼吸链中复合物Ⅰ活性下降30%~40%, 电子传递链功能出现异常, 使氧自由基生成增多。另一方面, PD患者黑质线粒体膜通透性增加, 促进了凋亡诱导因子和细胞色素c释放, 以及Caspase的激活从而诱导DA神经元凋亡[10]。
近年许多研究表明, 类黄酮具有多方面的生物活性, 如抗癌、抗氧化、抗炎和抗菌作用[11]。异鼠李素-3-O-葡萄糖苷(isorhamnetin-3-O-glucoside, IR3G)是一种黄酮醇化合物, 广泛存在于许多蔬菜、大米和药用植物中, 具有广泛的药理活性[12-13]。近年来研究表明, IR3G具有抗氧化应激和预防四氯化碳诱发小鼠肝损伤的作用[13-14], 然而尚少见其对PD保护作用的相关研究报道。在前期研究中, 我们发现IR3G对MPP+诱导的PC-12细胞凋亡具有明显的保护作用, 本实验旨在研究IR3G对MPP+诱导的帕金森细胞模型损伤的保护机制, 为帕金森病的预防和治疗提供了新的思路。
1 材料与方法 1.1 材料大鼠嗜铬细胞瘤细胞(PC-12细胞)购自ATCC; RPMI1640 medium培养基、胎牛血清(FBS)、胰蛋白酶、MitoTarker® Red CMXRos均购自美国Invitrogen公司; Western blot试剂购自Bio-Basic公司; cleaved-Caspase 9、cleaved-Caspase 3抗体购自Cell Signaling公司, PARP1抗体购自Epitomics公司; GAPDH抗体、线粒体分离提取试剂盒均购自碧云天公司; VDAC、Cytochrome c抗体购自Santa Cruz公司; 二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)均购自Sigma-Aldrich公司; Bcl-2、Bax、Bim抗体、Annexin V-FITC、碘化丙啶(PI)购自BD公司; JC-1购自Molecular Probes公司。
1.2 方法 1.2.1 细胞株与细胞培养PC-12细胞用1640完全培养基(含10%胎牛血清、青霉素1×10 U/L、链霉素100 mg/L), 在37 ℃、饱和湿度及5%CO2的恒温培养箱中培养, 每2天传代。
1.2.2 MTT法检测细胞活度处于对数期生长的PC-12细胞系按照每孔5 000个细胞90 μL完全培养基接种于96孔板, 恒温培养箱培养24 h。加药处理后放入培养箱反应24 h, 每孔加入0.5% MTT 20 μL, 培养箱反应4 h, 吸掉孔中液体, 每孔加入150 μL DMSO, 室温振摇10 min, 用酶标仪于490 nm波长处检测光密度值D(490)。
细胞活度=(处理组光密度-空白孔光密度)/(对照组光密度-空白孔光密度)×100%。
1.2.3 流式细胞仪检测细胞凋亡利用6孔板培养PC-12细胞, 24 h后加药处理, 作用24 h后收细胞, 按照凋亡检测试剂盒说明书加入AnnexinV-FITC 2 μL和PI(50 μg/mL)5 μL染色, 涡旋混匀后用流式细胞仪检测。
1.2.4 Western blot检测PC-12细胞处理后, 提取全细胞蛋白(碧云天P0013蛋白提取试剂盒)并测定蛋白浓度(碧云天BCA蛋白浓度测定试剂盒增强型), 蛋白液加入Loading buffer, 96 ℃, 金属浴10 min变性, 保存于-80 ℃。经聚丙烯酰胺凝胶(SDS-PAGE)电泳分离, 0.45A电流下转膜2~3 h, 5%脱脂奶粉封闭1 h, 于4 ℃摇床上孵育抗体过夜, TBST洗涤一抗3次, 每次10 min, 加入二抗于室温下孵育2 h, TBST洗涤3× 30 min后曝光显影。
1.2.5 线粒体膜电位的检测使用亲脂性阳离子探针荧光染料JC-1检测线粒体膜电位的变化。根据试剂盒说明书配制JC-1染色工作液, 药物处理24 h后收集细胞, 用配制的工作液孵育20 min, 再用JC-1染色缓冲液漂洗2次, 重悬后用流式细胞仪检测, JC-1单体的发射波长为530 nm, 聚合物发射波长为590 nm。通过红绿荧光的相对比例来衡量线粒体去极化的程度。
1.2.6 激光共聚焦显微镜观察线粒体形态对数期生长的PC-12细胞铺于预先植入爬片的24孔板内, 每孔1.5×104个细胞, 常规培养24 h, 加入药物处理24 h, 依照MitoTracker® Red CMXRos染色试剂盒说明书染线粒体, PBS洗涤并用碧云天免疫染色固定液固定细胞20 min, 封片后在激光共聚焦显微镜(Zeiss)下观察。
1.3 统计学分析共聚焦图像采用Image J统计处理, Western blot检测结果采用Quality One软件分析, 计量数据以x±s表示, 采用SPSS 19.0统计软件进行处理。两样本的组间比较采用t检验。检验水准:α=0.01。
2 结果 2.1 IR3G对MPP+降低PC-12细胞存活率的影响MTT法结果显示, 不同浓度MPP+(0、0.5、0.75、1、2、4、5 mmol/L)处理PC-12细胞后, 可引起细胞存活率显著降低, 呈明显的量效关系, 且0.75 mmol/L处理组的细胞存活率降低至60%左右(图 1A); 不同浓度的IR3G(0、5、10、15、20、30、40、50 μmol/L)作用于PC-12细胞后, 可引起细胞存活率适度增加(图 1B); 预处理不同浓度的IR3G (2 h)可显著逆转MPP+ (0.75 mmol/L)导致的细胞存活率下降(P < 0.01, 图 1C)。结果提示, IR3G对MPP+诱导的PC-12细胞损伤具有一定逆转作用。
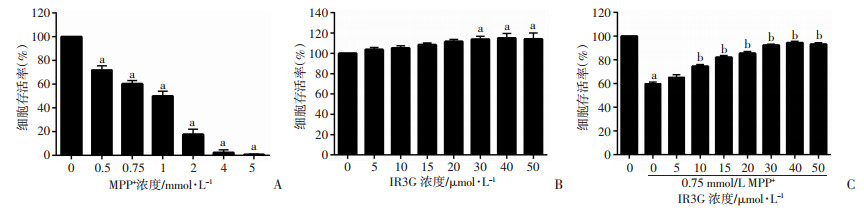
|
| A:不同浓度的MPP+对PC-12细胞存活率的影响; B:不同浓度的IR3G对PC-12细胞存活率的影响; C:预处理不同浓度的IR3G后MPP+对PC-12细胞存活率的影响a:P < 0.01, 与对照组(0)比较; b:P < 0.01, 与0 μmol/L IR3G+MPP+组比较 图 1 MPP+、IR3G及预处理IR3G后MPP+对PC-12细胞存活率的影响 |
2.2 IR3G对MPP+诱导PC-12细胞凋亡的影响
利用AnnexinV-FITC和PI双染流式检测方法检测IR3G对MPP+诱导PC-12细胞凋亡的影响。结果显示:对照组细胞凋亡率与IR3G组细胞凋亡率相比差异无统计学意义, MPP+组细胞凋亡率较对照组细胞凋亡率明显升高, 而IR3G+MPP+组细胞凋亡率较MPP+组细胞凋亡率明显下降(P < 0.01, 图 2)。结果提示IR3G可以抑制MPP+诱导PC-12细胞的凋亡。
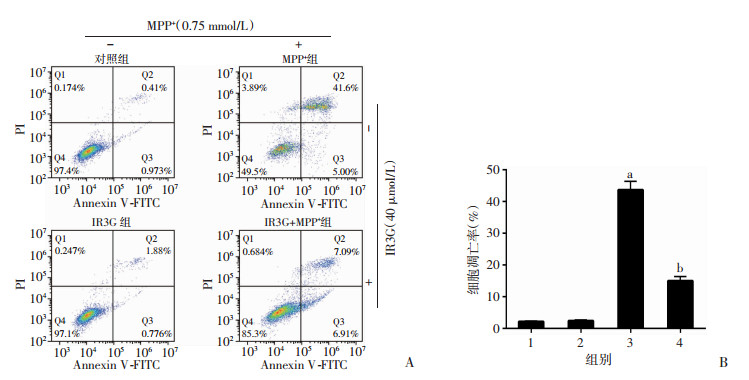
|
| A:流式细胞检测结果; B:统计分析1:对照组; 2:IR3G组; 3:MPP+组; 4:IR3G+MPP+组; a:P < 0.01, 与对照组比较; b:P < 0.01, 与MPP+组比较 图 2 IR3G对MPP+诱导PC-12细胞凋亡的影响 |
2.3 IR3G对MPP+诱导PC-12细胞凋亡相关蛋白变化的影响
Western blot检测蛋白PARP1、cleaved- Caspase3(c-Caspase3)、cleaved-Caspase9(c-Caspase9)的表达。结果显示IR3G可以逆转MPP+导致的PARP1降低和cleaved-Caspase3、cleaved-Caspase9升高(图 3A), 证实IR3G可以减弱MPP+诱导PC-12细胞发生的凋亡。
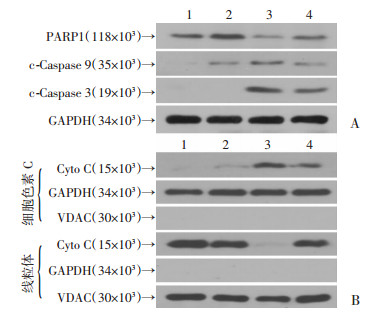
|
| 1:对照组; 2:IR3G组; 3:MPP+组; 4:IR3G+MPP+组A:全细胞凋亡相关蛋白; B:胞质与线粒体相关蛋白 图 3 预处理IR3G对MPP+诱导PC-12细胞凋亡相关蛋白表达的影响 |
正常情况下, Cyto C位于线粒体内, 胞质中的Cyto C一般是从线粒体释放出来的。提取线粒体及胞质蛋白Western blot检测发现, 与对照组相比, MPP+组中大量的Cyto C从线粒体释放至胞质, 而IR3G可以减少MPP+诱导的Cyto C从线粒体的释放(图 3B), 说明IR3G可以抑制MPP+诱导的PC-12细胞线粒体中Cyto C向胞质的释放。
2.4 IR3G对MPP+诱导的PC-12细胞线粒体膜电位的影响通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞线粒体膜电位的下降, 因此采用JC-1荧光探针检测PC-12细胞不同处理后的线粒体膜电位变化情况。结果显示, IR3G组与对照组相比JC-1红绿荧光比例差异无统计学意义; 而与对照组相比, MPP+组JC-1红绿荧光比例显著降低, 线粒体膜电位显著下降; 预处理IR3G后, 与MPP+组相比, JC-1红绿荧光比例明显上升(P < 0.01, 图 4)。说明IR3G可以逆转MPP+引起的线粒体膜电位下降。
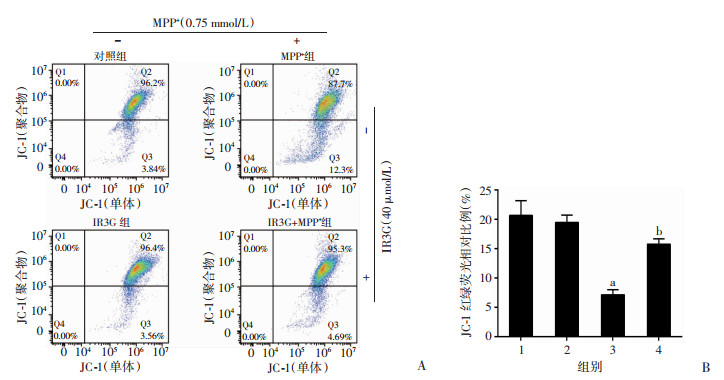
|
| A:流式细胞检测结果; B:统计分析1:对照组; 2:IR3G组; 3:MPP+组; 4:IR3G+MPP+组; a:P < 0.01, 与对照组比较; b:P < 0.01, 与MPP+组比较 图 4 IR3G对MPP+诱导PC-12细胞线粒体膜电位的影响 |
2.5 IR3G对MPP+导致的PC-12细胞线粒体分裂的影响
用MitoTracker对线粒体进行染色, 然后在激光共聚焦显微镜下观察线粒体形态, 结果显示Control组与IR3G组线粒体呈现长丝状, 平均长度约为4.5~4.8 μm; 而MPP+组线粒体断裂出现碎片化, 呈明显的点状分布, 长度缩短到0.5 μm; IR3G干预后, 与MPP+组相比, 线粒体平均长度显著增加至3.4 μm (P < 0.01, 图 5)。结果显示, IR3G可以阻断MPP+导致的线粒体分裂, 进一步证实IR3G可以抑制MPP+诱导的PC-12细胞线粒体损伤。

|
| A:激光共聚焦观察方框示局部放大结果; B:线粒体碎片比例统计分析结果; C:线粒体平均长度统计分析1:对照组; 2:IR3G组; 3:MPP+组; 4:IR3G+MPP+组; a:P < 0.01, 与对照组比较; b:P < 0.01, 与MPP+组比较 图 5 IR3G对MPP+导致的PC-12细胞线粒体分裂的影响 |
2.6 IR3G对MPP+诱导PC-12细胞Bcl-2家族相关蛋白表达的影响
Bcl-2家族位于线粒体膜上, 是调控凋亡的重要因子。为进一步确定凋亡的分子机制, Western blot检测Bcl-2家族相关蛋白Bcl-2、Bim、Bax的表达, 结果显示MPP+组抗凋亡蛋白Bcl-2的表达量下降, 促凋亡蛋白Bim的表达量升高, 促凋亡蛋白Bax发生线粒体转位。IR3G预处理后, 相比MPP+组Bcl-2的表达量则显著升高, Bim的表达量显著降低, Bax线粒体转位减弱(图 6)。说明IR3G正是通过对Bcl-2家族相关蛋白的调控来抑制MPP+引起的线粒体损伤。
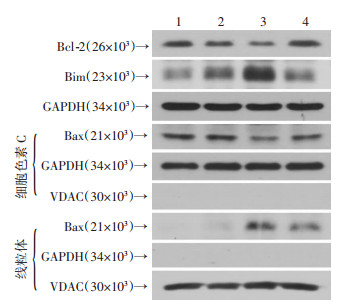
|
| 1:对照组; 2:IR3G组; 3:MPP+组; 4:IR3G+MPP+组 图 6 预处理IR3G对MPP+诱导PC-12细胞Bcl-2家族相关蛋白表达的影响 |
3 讨论
迄今为止, PD的早期诊断尚缺乏有效手段。当患者出现症状时, 黑质部位的DA神经元已有80%丢失[15]。临床与实验研究表明, 在初步诊断PD时, 大约50%的黑质纹状体通路中的多巴胺能神经元细胞都会出现凋亡[16]。鉴于凋亡是黑质DA神经元死亡的主要方式, 那么抑制细胞凋亡就有可能发挥神经细胞的保护作用。为此, 本研究开展了IR3G对抗凋亡作用的研究。PC-12细胞表面存在大量的神经生长因子受体, 神经生长因子可诱导PC-12细胞分化成交感神经元样细胞, 从而在形态、生理、生化及功能方面更接近于神经元。大量研究证实了PC-12细胞损伤模型是探索PD发病机制及筛选神经保护性药物的良好模型[17]。因此, 在体外实验中采取0.75 mmol/L的MPP+毒性浓度, 使PC-12细胞凋亡率大约为60%, 制作PD细胞模型[18]。为了了解IR3G的体外细胞毒性, 本实验观察了IR3G对正常PC-12细胞生长的影响, 结果显示其对细胞的增殖具有促进作用。进一步研究发现IR3G抑制MPP+诱导的PC-12细胞凋亡的作用呈剂量依赖性, 在40 μmol/L时达到最佳细胞活度94%, 因此选择这一剂量进行下一步的研究。
通过流式细胞仪、Western blot等技术进一步研究发现, IR3G可以明显降低MPP+引起的细胞凋亡率, 并且这一保护作用与Caspase 3的激活和Cyto C的释放有关。Bcl-2家族是抑制细胞程序性凋亡的主要成员之一, 根据功能和结构可将其分为抗凋亡蛋白和促凋亡基蛋白。多数促凋亡蛋白如Bax位于细胞质内, 当接收到诱导凋亡信号时, 即向线粒体转位, 使线粒体中的凋亡因子释放, 激活Caspase蛋白酶家族进而导致细胞凋亡。而抗凋亡蛋白如Bcl-2, 则可在上述机制中截断凋亡的诱导和执行[19]。Bcl-2家族成员定位于线粒体膜上, 可影响线粒体膜的通透性, 从而调控线粒体凋亡途径。检测线粒体膜电位与线粒体形态的变化, 发现MPP+组线粒体膜电位下降、线粒体出现分裂; 而预处理IR3G后, 可以逆转MPP+引起的线粒体膜电位下降和线粒体的分裂。进一步检测Bcl-2家族蛋白, 发现MPP+组Bax转位至线粒体, 且促凋亡蛋白Bim增加, 抗凋亡蛋白Bcl-2降低, 因此打开了线粒体表面的渗透性转换孔, 导致线粒体的膜电位下降。预处理IR3G后, 可以逆转MPP+诱导的Bcl-2家族蛋白的表达。本实验证实了IR3G通过Bcl-2家族蛋白影响了MPP+对细胞的线粒体膜通透性和线粒体形态的作用, 从而减少了Cyto C向胞质的释放, 并进一步抑制Caspase 9和Caspase 3的活化从而抑制细胞凋亡。IR3G可能正是通过调控线粒体凋亡途径从而抑制MPP+诱导的细胞凋亡, 因此对帕金森病的研究具有潜在的意义。
| [1] | BLESA J, PRZEDBORSKI S. Parkinson's disease: animal models and dopaminergic cell vulnerability[J]. Front Neuroanat, 2014, 8: 155. DOI:10.3389/fnana.2014.00155 |
| [2] | LOTHARIUS J, BRUNDIN P. Pathogenesis of Parkinson's disease: dopamine, vesicles and alpha-synuclein[J]. Nat Rev Neurosci, 2002, 3(12): 932–942. DOI:10.1038/nrn983 |
| [3] | LEWIS P A, COOKSON M R. Gene expression in the Parkinson's disease brain[J]. Brain Res Bull, 2012, 88(4): 302–312. DOI:10.1016/j.brainresbull.2011.11.016 |
| [4] |
杨卫东. 返朴归真回归自然——21世纪民族医药的展望[J].
中国民族医药杂志, 2008(2): 74–75.
YANG W D. Returning to the basics and returning to nature-the prospect of national medicine in the 21st century[J]. J Med Pharm Chin Minorities, 2008(2): 74–75. DOI:10.16041/j.cnki.cn15-1175.2008.02.020 |
| [5] |
阿丽塔, 刘晓婷, 王敏. 抗帕金森病新药的研发进展[J].
中国药事, 2016, 26(6): 629–633.
A L T, LIU X T, WANG M. Advances of the research and development of new anti-Parkinson's disease drugs[J]. Chin Pharm Affair, 2016, 26(6): 629–633. DOI:10.16153/j.1002-7777.2012.06.030 |
| [6] |
韦春英, 韩敏. 帕金森病治疗进展[J].
内科, 2014, 9(3): 360–362.
WEI C Y, HAN M. Advances of the treatment of Parkinson's disease[J]. Inter Med, 2014, 9(3): 360–362. DOI:10.16121/j.cnki.cn45-1347/r.2014.03.049 |
| [7] | WERSINGER C, SIDHU A. An inflammatory pathomechanism for Parkinson's disease[J]. Curr Med Chem, 2006, 13(5): 591–602. DOI:10.2174/092986706776055760 |
| [8] |
熊珮, 陈忻, 张楠, 等. 帕金森病病理机制及中药防治帕金森病实验研究进展[J].
中国中药杂志, 2012, 37(5): 686–691.
XIONG P, CHEN X, ZHANG N, et al. Advance in studies on pathological mechanism of Parkinson's disease and traditional Chinese medicine experiments in prevention and treatment of Parkinson's disease[J]. Chin J Chin Mater Med, 2012, 37(5): 686–691. |
| [9] | SUBRAMANIAM S R, CHESSELET M F. Mitochondrial dysfunction and oxidative stress in Parkinson's disease[J]. Prog Neurobiol, 2013: 17–32. DOI:10.1016/j.pneurobio.2013.04.004 |
| [10] |
唐涌, 肖成华. 细胞凋亡在帕金森病发病中的作用[J].
徐州医学学报, 2004, 24(1): 87–90.
TANG Y, XIAO C H. Role of apoptosis in the pathogenesis of Parkinson's disease[J]. Acta Acad Med Xuzhou, 2004, 24(1): 87–90. DOI:10.3969/j.issn.1000-2065.2004.01.039 |
| [11] | RAVISHANKAR D, RAJORA A K, GRECO F, et al. Flavonoids as prospective compounds for anti-cancer therapy[J]. Int J Biochem Cell Biol, 2013, 45(12): 2821–2831. DOI:10.1016/j.biocel.2013.10.004 |
| [12] | XIA X H, ZHANG Y, XI Y B, et al. Advances in studies on chemical constituents and bioactivities actions of ginkgo biloba L[J]. Chin J Exp Tradit Med Formulae, 2009, 15: 100–104. |
| [13] | IGARASHI K, MIKAMI T, TAKAHASHI Y, et al. Comparison of the preventive activity of isorhamnetin glycosides from atsumi-kabu (red turnip, brassica campestris l.) leaves on carbon tetrachloride-induced liver injury in mice[J]. Biosci Biotechnol Biochem, 2008, 72(3): 856–860. DOI:10.1271/bbb.70558 |
| [14] | DEVI V G, ROOBAN B N, SASIKALA V, et al. Isorhamnetin-3- glucoside alleviates oxidative stress and opacification in selenite cataract in vitro[J]. Toxicol In Vitro, 2010, 24(6): 1662–1669. DOI:10.1016/j.tiv.2010.05.021 |
| [15] |
卢芳, 刘树民, 杨婷婷. 帕金森病的最新国内外研究进展[J].
中国老年学杂志, 2009, 29(9): 1171–1174.
LU F, LIU S M, YANG T T. Latest research progress at home and abroad of Parkinson's disease[J]. Chin J Gerontol, 2009, 29(9): 1171–1174. DOI:10.3969/j.issn.1005-9202.2009.09.062 |
| [16] | HANCOCK D B, MARTIN E R, MAYHEW G M, et al. Pesticide exposure and risk of Parkinson's disease:a family-based case-control study[J]. BMC Neurol, 2008, 8: 6. DOI:10.1186/1471-2377-8-6 |
| [17] |
李婷婷, 梁迎春. 帕金森病体外细胞模型[J].
医学综述, 2013, 19(6): 1003–1006.
LI T T, LIANG Y C. In vitro models of Parkinson disease[J]. Med Recapitulate, 2013, 19(6): 1003–1006. DOI:10.3969/j.issn.1006-2084.2013.06.016 |
| [18] | TAMILSELVAM K, BRAIDY N, MANIVASAGAM T, et al. Neuroprotective effects of hesperidin, a plant flavanone, on rotenone-induced oxidative stress and apoptosis in a cellular model for Parkinson's disease[J]. Oxid Med Cell Longev, 2013, 2013: 102741. DOI:10.1155/2013/102741 |
| [19] |
李生华, 黄伟华. Bcl-xL在恶性肿瘤中应用的研究进展[J].
医学综述, 2007, 13(7): 501–503.
LI S H, HUANG W H. Bcl-xL and malignant tumor in human[J]. Med Recapitulate, 2007, 13(7): 501–503. DOI:10.3969/j.issn.1006-2084.2007.07.010 |



