甲状腺癌(thyroid cancer)是最为常见的内分泌恶性肿瘤,在过去的数十年里,发病率快速上升。乳头状甲状腺癌(papillary thyroid cancer,PTC)在甲状腺癌中占比超过80%。PTC具有相对好的预后,但仍有10%~30%的病例恶性发展程度快,预后极差[1]。因此,从分子层面深入探究PTC发生发展的作用机制,对PTC的诊断治疗有着重要的临床意义与价值。
遗传和表观遗传的改变与多种癌症的起始和进程相关,这其中也包括PTC。长链非编码RNA(long noncoding RNAs,lncRNAs)的调控就是表观遗传调控的一种重要类型。新近的研究表明多种lncRNAs在癌症中转录失调,发挥促癌或抑癌的功能[2-3]。例如,lncRNAs BANCR、MEG3和PTCSC3在PTC中转录下调而发挥肿瘤抑制的功能[4-6]。而lncRNAs ANRIL、HOTAIR和MALAT1在PTC中转录上调而发挥促癌作用[7-8]。但仍有大量的lncRNAs在PTC中的作用机制并不清楚。本实验室前期通过芯片的筛选发现lncRNA LSINCT5在PTC中表达显著上调,提示其可能参与了PTC的发生发展,而具体的分子生物学机制有待阐明。本研究旨在明确LSINCT5在PTC患者中癌组织和癌旁组织表达情况,探讨LSINCT5对PTC细胞增殖和转移能力的影响,并探究其促PTC发生和进程的可能作用机制。
1 材料与方法 1.1 标本来源选择2016年9月至2017年12月在陆军军医大学第一附属医院接受PTC切除手术的32例PTC患者,其中男性18例,女性14例,平均年龄57岁。所纳入的患者均签订了书面知情同意书。在PTC切除术中,取适量的PTC癌组织以及癌旁组织(距癌巢中心距离>3 cm)。PTC切除后的组织样本置于液氮中保存。人正常甲状腺细胞HT-ori3购自于中国科学院上海细胞生物研究所,PTC细胞系NPA87和KAT-5购自于ATCC,TPC-1由本科室实验室保存。
1.2 细胞株培养人正常甲状腺细胞株HT-ori3和PTC细胞株NPA87、KAT-5、TPC-1均使用含10%胎牛血清(HyClone)的DMEM(HyClone)培养基培养。孵箱培养条件温度设置为37 ℃,CO2含量为5%。
1.3 芯片筛选差异表达lncRNAs从液氮样品保存库中取出6例PTC患者配对的癌组织和癌旁组织。提取各样本的总RNA,采用随机引物合成正义链cDNA,后将DNA片段化并进行生物素标记。标记后的DNA片段与Affymetrix clariom D芯片(Affymetrix,USA)进行杂交反应,反应完全后,将芯片进行洗涤、染色、扫描和数据挖掘分析。
1.4 qRT-PCR检测lncRNA LSINCT5和ITGB1的相对表达采用Trizol法提取组织和细胞样本中的总RNA,并将总RNA使用随机引物法反转录为cDNA。按照qRT-PCR定量检测试剂盒(TaKaRa)步骤说明加入预混液、cDNA模板、lncRNA LSINCT5和ITGB1对应的上游引物和下游引物。lncRNA LSINCT5上游:5′-TAGTGGACAGAGCCTACCCC-3′,lncRNA LSINCT5下游:5′-CCAGCTACCACCCACAACAA-3′;ITGB1上游:5′-AGTAGTGCACTTTTCTCTCATGG-3′,ITGB1下游:5′-CCCGTCCACCCATTTCTACC-3′;内参GAPDH上游:5′-TGGCTATTGCCGAATCGCTG-3′,GAPDH下游:5′-CCTAGGCTTGAATCGGTCT-3′;反应条件:95 ℃ 3 min;40个循环于95 ℃变性15 s;60 ℃退火20 s;72 ℃延伸20 s,每个循环在72 ℃时采集荧光。qRT-PCR结果采用2-ΔΔCt方法对目的基因进行定量分析。
1.5 CCK-8法检测PTC细胞TPC-1和KAT-5转染后的增殖能力将PTC细胞TPC-1和KAT-5制备成单细胞悬液,细胞浓度调整为2×104/mL,以每孔100 μL的体积接种到96孔板中。待TPC-1和KAT-5细胞贴壁后,分别转染siNC、siLSINCT5-1、siLSINCT5-2、Control(空质粒组)、LSINCT5、LSINCT5-Mut、LSINCT5和miR-29c。在转染后的24、48、72 h,在每孔中加入10 μL的CCK-8试剂,并使其混匀。在37 ℃,5%CO2条件下继续培养1 h后,使用Bio-Rad iMark微板酶标仪,测量各孔450 nm处光密度值D(450)(仪器自动读数时自动扣除空白对照数值)。
1.6 QCMTM Laminin Migration转移试剂盒检测TPC-1和KAT-5转染后的迁移能力从4 ℃冰箱中取出QCMTM Laminin Migration试剂盒(Millipore, Germany),放置室温条件下平衡1 h。在Transwell下室的12孔板中加入0.5 mL完全培养基,并将已经制备好的200 μL单细胞悬液加入Transwell小室中。共培养24 h后,采用棉签擦去Transwell小室中上层未穿过细胞,采用95%乙醇固定20 min,将其放置超净工作台中晾干,随后使用0.1%结晶紫染色15 min,染色后放入PBS溶液中清洗数次。再次晾干后,在Transwell小室直径上,选取3~5个视野,在显微镜下拍照后计数穿膜细胞数量。
1.7 LSINCT5-Wt和LSINCT5-Mut荧光报告载体构建及荧光素酶活性检测PCR扩增LSINCT5-Wt序列片段,并使用Promega定点突变试剂盒(Promega, 上海)获取LSINCT5-Mut序列。双酶切后插入荧光素酶报告基因载体pmir-GLO。将miR-29c及阴性对照miR-NC与构建成功的LSINCT5-Wt和LSINCT5-Mut reporter质粒共转染于HEK293细胞。转染24 h以后,检测对应荧光强度并计算荧光素酶相对活性。
1.8 RIP检测LSINCT5结合的内源性miR-29c将LSINCT5-Wt序列片段和LSINCT5-Mut序列片段经双酶切后插入PcDNA3.1-MS2载体。将PcDNA3.1-MS2,PcDNA3.1-LSINCT5-MS2[PcDNA3.1-LSINCT5-MS2(mut)]和MS2-GFP质粒共转染于TPC-1细胞。转染24 h后RIP共沉淀LSINCT5结合的RNA,纯化后的RNA行定量PCR检测miR-29c的相对含量。
1.9 Western blot检测蛋白ITGB1和E-cadherin的表达采用RIPA裂解缓冲液裂解处理后的TPC-1细胞,12 000×g高速离心15 min后,收集上清并测定蛋白浓度。并按照4 :1的比例加入蛋白上样缓冲液(5×SDS),并在金属浴中充分加热煮沸备用。取适量样品经12%SDS-PAGE胶分离后,湿转印至PVDF膜上,经3%脱脂奶粉封闭后,分别用小鼠来源的anti-ITGB1的一抗抗体(Abcam, USA)(1 :1 000稀释),小鼠来源的anti-E-cadherin的一抗抗体(Abcam, USA)(1 :800稀释),小鼠来源的anti-GAPDH的一抗抗体(Abcam, USA)(1 :2 000稀释)孵育过夜,再与HRP标记山羊抗小鼠IgG孵育1 h,将洗膜后的PVDF膜置于暗室曝光成像仪器中,加入化学发光显色底物,检测目的蛋白条带的化学发光强弱。
1.10 统计学方法采用统计学软件SPSS 22.0进行数据处理。计量资料数据以x±s表示,采用t检验进行差异统计学分析。检验水准α=0.05。
2 结果 2.1 lncRNA LSINCT5在PTC组织和细胞系中的表达水平上升采用Affymetrix clariom D芯片对6例PTC癌组织和癌旁组织差异表达的lncRNAs进行了筛选。芯片筛选结果如图 1A所示,与癌旁组织相比较,LSINCT5在PTC癌组织中表达高于对应的癌旁组织,表达上调3.4倍。进一步检测验证32例PTC患者中的癌组织与癌旁组织LSINCT5的表达水平,结果显示癌组织中LSINCT5显著高表达于癌旁组织,差异有统计学意义(P < 0.05,图 1B)。同时检测了PTC细胞系和人正常甲状腺细胞HT-ori3中LSINCT5表达水平,结果显示LSINCT5在PTC细胞系TPC-1、NPA87和KAT-5的表达水平均显著高于人正常甲状腺细胞HT-ori3(P < 0.05,图 1C)。
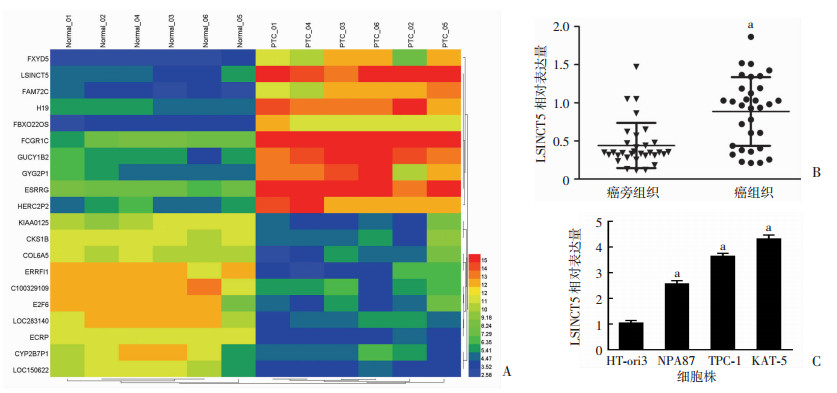
|
| A:芯片筛选PTC癌组织与癌旁组织差异表达的lncRNAs;B:LSINCT5在组织中的表达水平(n=32,x±s);a:P < 0.05,与癌旁组织比较;C:PTC细胞系与人正常甲状腺细胞HT-ori3中LSINCT5的表达水平(n=3,x±s);a:P < 0.05,与HT-ori3比较 图 1 LSINCT5在PTC组织及细胞系中的表达水平 |
2.2 敲低LSINCT5的表达抑制了PTC细胞系TPC-1和KAT-5细胞的增殖和转移
首先检测转染siLSINCT5后TPC-1和KAT-5细胞中LSINCT5的表达水平。结果显示转染siLSINCT5-1、siLSINCT5-2后,与转染siNC组相比,均显著降低了LSINCT5在TPC-1和KAT-5细胞中的表达水平(P < 0.05,图 2A、B)。为评价LSINCT5对TPC-1和KAT-5细胞增殖能力的影响,采用了CCK-8法检测各组细胞的增殖能力,如图 2C、D所示,与siNC组相比,siLSINCT5-1、siLSINCT5-2组在转染后的72 h均显著抑制了TPC-1和KAT-5细胞的增殖(P < 0.05)。如图 2E~H所示,Transwell迁移实验表明,siLSINCT5-1、siLSINCT5-2组与siNC组相比,TPC-1和KAT-5的侵袭能力受到显著的抑制(P < 0.05)。
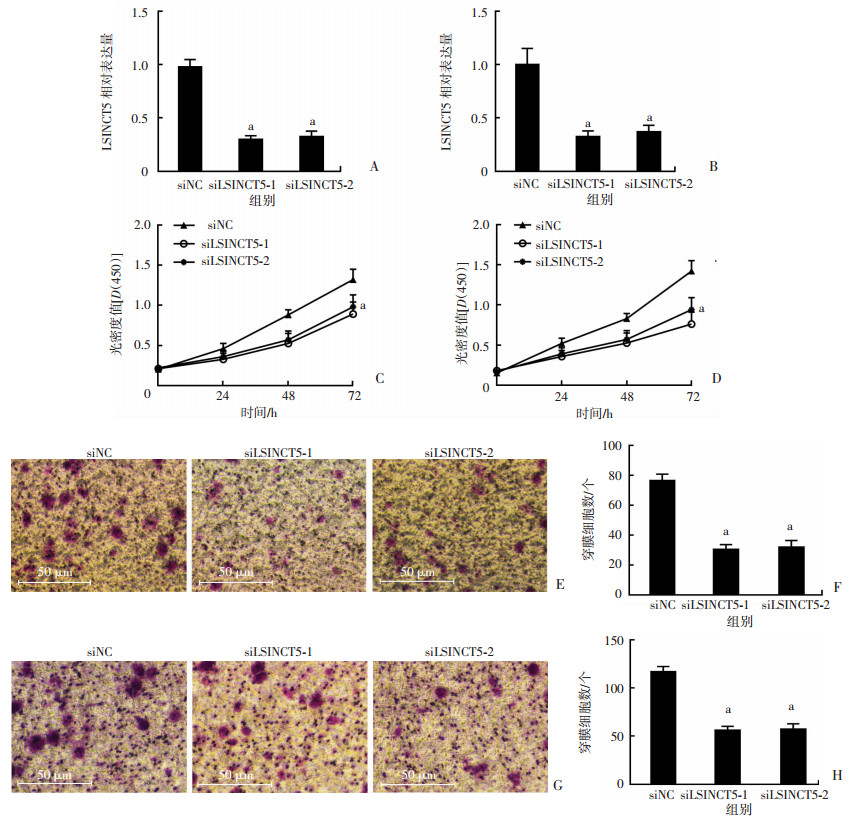
|
| A、B:qRT-PCR检测转染siLSINCT5后TPC-1和KAT-5中LSINCT5的表达水平(n=3,x±s);C、D:CCK-8检测转染siLSINCT5后TPC-1和KAT-5增殖能力的变化;E、F:Transwell迁移实验检测转染siLSINCT5后TPC-1转移能力变化(n=5,x±s);G、H:Transwell迁移实验检测转染siLSINCT5后KAT-5转移能力变化(n=5,x±s);a:P < 0.05,与siNC组比较 图 2 敲低LSINCT5表达抑制PTC细胞系TPC-1和KAT-5的增殖和转移 |
2.3 生物信息学预测,双荧光素酶报告基因和RIP检测lncRNA LSINCT5与miR-29c靶向结合
首先采用生物信息学软件Targetscan预测LSINCT5能够结合的miRNAs,预测结果如图 3A所示,LSINCT5序列上包含多个miRNAs的结合位点,其中包括miR-29c的结合位点。为了证实LSINCT5是否能够结合miR-29c,采用了双荧光素酶报告基因实验进行检测。结果如图 3B所示,共转染miR-NC和pmirGLO组的相对荧光素酶活性值与共转染miR-29c和pmirGLO组的相对荧光素酶活性值比较无统计学差异。共转染miR-NC和LSINCT5-Mut组的相对荧光素酶活性值与共转染miR-29c和LSINCT5-Mut组的相对荧光素酶活性值比较无统计学差异。而共转染miR-NC和LSINCT5组的相对荧光素酶活性值与共转染miR-29c和LSINCT5组的相对荧光素酶活性值比较,共转染miR-29c和LSINCT5组显著降低(P < 0.05)。进一步通过RIP下拉了能够与LSINCT5作用结合的内源性miRNAs,后进行定量PCR检测。结果显示MS2-LSINCT5在TPC-1细胞中,相比较空白对照MS2,以及MS2-LSINCT5(Mut),能够显著富集结合miR-29c,富集结合效率提高了5倍。以上结果均表明,LSINCT5含有miR-29c的结合位点,且能够靶向结合miR-29c。该结果提示LSINCT5可能通过发挥分子海绵吸附功能,结合miR-29c发挥转录后调控,而参与PTC的发生与进程。
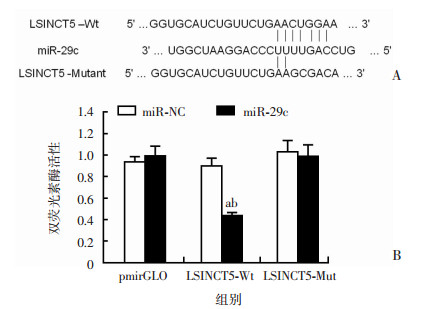
|
| A:Targetscan预测LSINCT5与miR-29c的结合位点;B:双荧光素酶报告基因验证LSINCT5与miR-29c靶向结合(n=3,x±s);a:P < 0.05,与miR-NC比较;b:P < 0.05,与LSINCT5-Mut组比较 图 3 生物信息学预测,双荧光素酶报告基因和RIP检测LSINCT5与miR-29c靶向结合 |
2.4 共转染miR-29c抑制LSINCT5对PTC促增殖和转移的作用
增殖实验结果如图 4A所示:与Control(空质粒)组相比,LSINCT5组在转染后72 h细胞增殖能力显著上升(P < 0.05);与LSINCT5组相比,LSINCT5+miR-29c组TPC-1细胞在转染后72 h细胞增殖能力显著下降(P < 0.05)。转移实验结果如图 4B所示:与Control组相比,LSINCT5组在转染后72 h细胞迁移能力显著上升(P < 0.05);与LSINCT5组相比,LSINCT5+miR-29c组TPC-1细胞在转染后72 h细胞迁移能力显著下降(P < 0.05)。该结果进一步提示LSINCT5与miR-29c的结合作用,而过表达miR-29c能够拮抗LSINCT5与内源性miR-29c结合后的促PTC增殖和转移的作用。
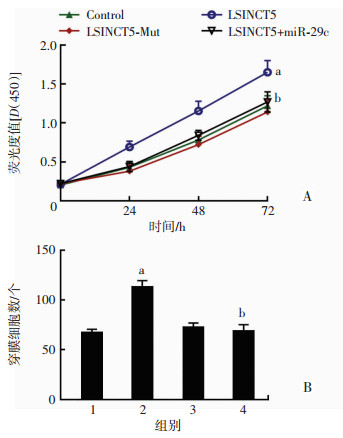
|
| A:共转染miR-29c抑制LSINCT5对PTC促增殖作用;B:共转染miR-29c抑制LSINCT5对PTC促转移作用1: Control组;2:LSINCT5组;3:LSINCT5-Mut组;4:LSINCT5+ miR-29c组;a:P < 0.05,与Control组比较;b:P < 0.05,与LSINCT5组比较 图 4 共转染miR-29c抑制LSINCT5对PTC促增殖和转移的作用(n=5,x±s) |
2.5 共转染miR-29c抑制LSINCT5对ITGB1的上调作用
qRT-PCR结果如图 5A所示:与Control组相比,LSINCT5组在转染后72 h,ITGB1的表达水平显著上升(P < 0.05);与LSINCT5组相比,LSINCT5+miR-29c组TPC-1细胞在转染后72 h,ITGB1的表达水平显著下降(P < 0.05)。Western blot结果如图 5B所示,ITGB1蛋白表达水平与qRT-PCR结果一致。同时,与Control组相比,LSINCT5组在转染后72 h,E-cadherin的表达水平下降;与LSINCT5组相比,LSINCT5+miR-29c组TPC-1细胞在转染后72 h,E-cadherin的表达水平上调。以上结果表明过表达LSINCT5后,共转染miR-29c可以逆转LSINCT5对ITGB1表达的上调,而促进E-cadherin的表达。该结果提示LSINCT5通过靶向结合miR-29c,抑制了miR-29c-ITGB1轴的抑癌作用,进一步发挥促进PTC的增殖和转移。
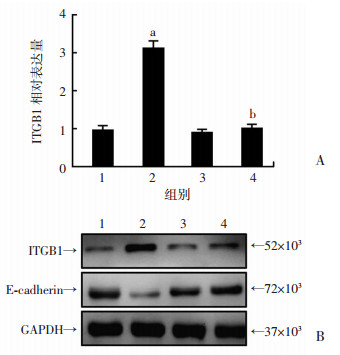
|
| A:qRT-PCR检测转染后各组细胞中ITGB1的表达水平(n=3,x±s);B:Western blot检测转染后各组细胞中ITGB1和E-cadherin的表达;1:Control组;2:LSINCT5组;3:LSINCT5-Mut组;4:LSINCT5+miR-29c组;a:P < 0.05,与Control组比较;b:P < 0.05,与LSINCT5组比较 图 5 共转染miR-29c抑制LSINCT5对ITGB1的上调作用 |
3 讨论
新近的研究表明表观遗传调控是机体内最为重要的调控方式之一。lncRNAs可以通过染色质重塑、转录调控以及转录后等方式参与机体的表观遗传调控。其参与了细胞分化、增殖、凋亡,神经发育,免疫稳态,肿瘤发生等生命过程。
本研究首先通过高通量lncRNAs芯片系统筛选PTC癌组织和癌旁组织差异表达的lncRNAs,LSINCT5是其中表达上调的lncRNAs之一。qRT-PCR进一步验证发现,LSINCT5在PTC癌组织中的表达显著高于癌旁组织。CCK-8细胞增殖实验和Transwell迁移实验表明敲低LSINCT5的表达可以显著抑制PTC细胞株TPC-1和KAT-5的增殖和转移能力。生物信息学预测,双荧光素酶报告基因和RIP检测证实了LSINCT5能够与miR-29c靶向竞争性结合。共转染实验进一步发现过表达LSINCT5后,miR-29c能够抑制LSINCT5对PTC促增殖和转移的作用,qRT-PCR和Western blot检测显示过表达LSINCT5后,miR-29c能够逆转LSINCT5对ITGB1表达的上调,而促进E-cadherin的表达。以上结果表明LSINCT5能够发挥miRNAs分子海绵的功能,而抑制了miR-29c-ITGB1轴的抑癌作用,促进PTC的增殖和转移。
在lncRNAs与PTC的相关研究中,也有其他的lncRNAs通过发挥分子海绵吸附结合miRNAs的作用,而参与了PTC的发生与进程[9-10]。如CHEN等[11]发现,长链非编码lncRNA CNALPTC1可以作为一种分子诱饵,其能够竞争结合miR-30家族(miR-30a/miR-30b/miR-30c),而促进了PTC的进程与发展。WANG等[12]研究表明lncRNA PTCSC3可通过调控miR-574-SCAI-wnt/catenin而促进PTC的增殖和侵袭转移。本研究阐明了LSINCT5-miR-29c-ITGB1轴调控PTC细胞的增殖与转移,为PTC的诊断和治疗提供了新的标志物和作用靶点。但由于PTC是一种分化类型较好的肿瘤,细胞增殖和侵袭转移实验容易受实验环境的影响,还需进一步扩大PTC细胞株类型验证LSINCT5对肿瘤表型的影响,同时在下一步的研究中将探究LSINCT5在动物模型中对PTC增殖、侵袭和转移的功能作用。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | LI Q, LI H, ZHANG L, et al. Identification of novel long non-coding RNA biomarkers for prognosis prediction of papillary thyroid cancer[J]. Oncotarge, 2017, 8(28): 46136–46144. DOI:10.18632/oncotarget.17556 |
| [3] | LIYANARACHCHI S, LI W, YAN P, et al. Genome-wide expression screening discloses long noncoding RNAs involved in thyroid carcinogenesis[J]. J Clin Endocrinol Metab, 2016, 101(11): 4005–4013. DOI:10.1210/jc.2016-1991 |
| [4] | JENDRZEJEWSKI J, THOMAS A, LIYANARACHCHI S, et al. PTCSC3 is involved in papillary thyroid carcinoma development by modulating S100A4 gene expression[J]. J Clin Endocrinol Metab, 2015, 100(10): E1370–E1377. DOI:10.1210/jc.2015-2247 |
| [5] | WANG C, YAN G, ZHANG Y, et al. Long non-coding RNA MEG3 suppresses migration and invasion of thyroid carcinoma by targeting of Rac1[J]. Neoplasma, 2015, 62(4): 541–549. DOI:10.4149/neo_2015_065 |
| [6] | WANG Y, GU J, LIN X, et al. lncRNA BANCR promotes EMT in PTC via the Raf/MEK/ERK signaling pathway[J]. Oncol Lett, 2018, 15(4): 5865–5870. DOI:10.3892/ol.2018.8017 |
| [7] | DING S, QU W, JIAO Y, et al. LncRNA SNHG12 promotes the proliferation and metastasis of papillary thyroid carcinoma cells through regulating wnt/beta-catenin signaling pathway[J]. Cancer Biomark, 2018, 22(2): 217–226. DOI:10.3233/CBM-170777 |
| [8] | ZHU H, LV Z, AN C, et al. Onco-lncRNA HOTAIR and its functional genetic variants in papillary thyroid carcinoma[J]. Sci Rep, 2016, 6: 31969. DOI:10.1038/srep31969 |
| [9] | JEONG S, LEE J, KIM D, et al. Relationship of focally amplified long noncoding on chromosome 1 (FAL1) lncRNA with E2F transcription factors in thyroid cancer[J]. Medicine, 2016, 95(4): e2592. DOI:10.1097/MD.0000000000002592 |
| [10] | ZHOU Q, CHEN J, FENG J, et al. Long noncoding RNA PVT1 modulates thyroid cancer cell proliferation by recruiting EZH2 and regulating thyroid-stimulating hormone receptor (TSHR)[J]. Tumour Biol, 2016, 37(3): 3105–3113. DOI:10.1007/s13277-015-4149-9 |
| [11] | CHEN C, ZHOU L, WANG H, et al. Long noncoding RNA CNALPTC1 promotes cell proliferation and migration of papillary thyroid cancer via sponging miR-30 family[J]. Am J Cancer Res, 2018, 8(1): 192–206. |
| [12] | WANG X, LU X, GENG Z, et al. LncRNA PTCSC3/miR-574-5p governs cell proliferation and migration of papillary thyroid carcinoma via Wnt/beta-catenin signaling[J]. J Cell Biochem, 2017, 118(12): 4745–4752. DOI:10.1002/jcb.26142 |



