2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院药剂科
2. Department of Pharmacy, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
高原地区占我国领土面积的四分之一,其特有的低压、低氧环境给急进高原的人们带来了许多危害与困扰,严重影响机体的体力和军事作业能力。在高原缺氧环境下从事一定的体力或脑力劳动后,极易造成血乳酸及其他代谢物堆积,并且可造成机体代谢性酸碱紊乱,从而引起肌肉张力降低、产生疲劳,最终表现出劳动能力普遍下降,严重者甚至丧失作业能力。随着海拔高度的提升,劳动能力明显降低。而线粒体作为细胞有氧代谢的主要场所,在肌肉收缩过程中,它通过氧化磷酸化,提供肌肉收缩所需能量。在高原环境中进行高强度的劳动作业,机体承受高原缺氧和运动双重刺激,从而产生强烈的应激反应,诱导机体产生大量氧自由基,引起组织的氧化损伤[1-3],而线粒体不仅是产生内源性自由基的主要场所,也是自由基攻击的靶部位。线粒体功能的损伤势必会影响细胞的能量代谢,从而降低骨骼肌细胞的供能效力,产生运动性疲劳。因此,积极探索高原环境下抗疲劳药物,减少线粒体的氧化损伤,对于提高高原环境下机体的体力劳动能力、工作效率和军事作业能力都有积极的意义。
人参是我国长期以来最常用的中药补品之一。人参皂苷是人参的主要活性成分,具有抗疲劳、抗氧化、神经保护、抗炎、抗糖尿病等多种药理作用[4-6]。有研究报道人参皂苷Rg3 (Rg3)在平原环境下具有显著的抗疲劳效应,然而Rg3是否具有高原抗疲劳效应以及对骨骼肌线粒体有何影响却知之甚少。本研究建立模拟高原缺氧大鼠模型,考察Rg3在模拟高原环境下对大鼠的抗疲劳作用,并研究Rg3对骨骼肌线粒体功能的影响,以期为Rg3的作用机制研究和临床应用提供参考依据。
1 材料与方法 1.1 实验动物雄性SD大鼠(18个月)由陆军军医大学实验动物中心提供[实验动物中心许可证号:SYXK (渝) 2012-0002]。室温(23±2)℃,每12小时交替照明(照明时间:6:00-18:00),自由摄食、饮水。
1.2 主要药品与试剂人参皂苷Rg3(含量98%)购于武汉Chem Faces公司。锰超氧化物歧化酶(Mn-superoxide dismutase,Mn-SOD)、丙二醛(malondialdehyde,MDA)、总胆固醇(total cholesterol,TC), 甘油三酯(triglyceride,TG)、血糖(glucose, GLU)、血氨(blood ammonia,BA)、血尿素氮(blood urea nitrogen,BUN)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒和考马斯亮蓝蛋白测定试剂盒购于南京建成生物工程研究所;组织线粒体分离试剂盒和苯甲基磺酰氟(PMSF)购于碧云天生物技术研究所;呼吸链复合物Ⅲ活性检测试剂盒和呼吸链复合物Ⅳ活性检测试剂盒购于上海杰美基因医药科技有限公司。
1.3 动物分组和与实验条件在实验开始前,所有大鼠进行适应性饲养1周。大鼠按随机数字表法分成4组,每组10只,分为正常对照组、Rg3+正常对照组(NG+Rg3)、缺氧模型组(model group, MG)、Rg3+缺氧模型组(MG+Rg3)。
MG组和MG+Rg3组在模拟海拔5 000 m高度的低压舱中喂养, 其中MG组和MG+Rg3组需每日从模拟高原环境(低压舱)中取出1 h灌胃。实验期间动物自由饮水和摄食,NG+Rg3组、MG +Rg3组大鼠造模后每日灌服20 mg/(kg·d)的Rg3,连续灌胃15 d后按照分组要求检测相应指标;对照组和MG组的大鼠给予等量的生理盐水。对照组和NG+Rg3组不进行模拟高原环境造模。
1.4 方法 1.4.1 力竭游泳实验模型组在低压舱模拟5 000 m海拔环境内完成。大鼠连续灌胃15 d,末次给予Rg3 30 min后,在大鼠尾根部负重5%体质量的铅皮,置于游泳箱中游泳。水深50 cm,水温(25.0±0.5)℃。记录大鼠自游泳至力竭的时间,以头部不能浮出水面10 s为准。
1.4.2 样品收集力竭游泳实验结束后休息30 min,所有大鼠立即用2%戊巴比妥钠(3.5 mL/kg)皮下注射麻醉,从腹主动脉采血用于生化指标检测,并迅速分离动物股四头肌中间部位提取线粒体,剩余组织-80 ℃保存。
1.4.3 生化指标的检测腹主动脉采血后,4 ℃下3 000 r/min离心20 min,取上清,并储存在-80 ℃超低温冰箱备用。TC、TG、BA、GLU、BUN、LDH等指标用试剂盒进行测定。
1.4.4 骨骼肌线粒体的提取迅速在动物股四头肌中间部位进行取材,在离心管内对新鲜组织进行称量90 mg,用PBS洗涤组织1次。按照组织线粒体分离试剂盒要求,把组织放在1个置于冰上的培养皿中,用剪刀把组织剪切成非常细小的组织碎片。依次加入体积预冷的PBS、胰酶消化液、线粒体分离试剂B,加入每种试剂后均需进行冰浴、离心、沉淀组织样品,弃上清。再加入预冷的临用前添加了PMSF的线粒体分离试剂B,在冰浴上进行匀浆并离心,小心将上清转移到另一离心管中,在11 000×g、4 ℃离心10 min。小心去除上清,沉淀即分离得到的骨骼肌细胞线粒体。由于用于完整线粒体酶活性研究,加入适量线粒体储存液,重悬线粒体,-20 ℃保存。
1.4.5 骨骼肌线粒体MDA和Mn-SOD的检测骨骼肌线粒体MDA和Mn-SOD检测按照试剂盒说明书操作:取-20 ℃保存的骨骼肌线粒体,分别用硫代巴比妥酸和黄嘌呤氧化酶的方法测定MDA含量和Mn-SOD活力。测量波长分别为532 nm和550 nm处光密度值。Mn-SOD活力=总SOD活力-CuZn-SOD活力。
1.4.6 骨骼肌线粒体呼吸链复合物Ⅲ、Ⅳ活性检测线粒体呼吸链复合物Ⅲ、Ⅳ活性检测按照试剂盒说明书操作:取-20 ℃保存的骨骼肌线粒体,采用考马斯亮蓝法测定骨骼肌线粒体蛋白浓度。设定分光光度计测量波长为550 nm,并设置背景为空白对照。测定样品总活性和非特异活性。骨骼肌线粒体呼吸链复合物Ⅲ(或Ⅳ)活性=样品总活性-样品非特异活性。
1.5 统计学分析采用SPSS 15.0统计软件,实验数据用x±s表示,样本采用双因素方差分析,组间两两比较采用Dunnett-t检验。检验水准:α=0.05。
2 结果 2.1 Rg3对大鼠力竭游泳时间的影响与对照组比较,NG+Rg3组负重游泳时间显著延长(P < 0.01)。与MG组比较,MG+Rg3组游泳时间显著延长(P < 0.01),对照组游泳时间显著延长(P < 0.05,图 1)。
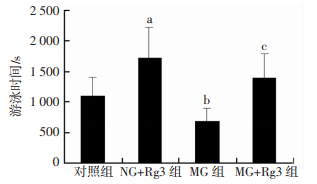
|
| a: P < 0.01,b: P < 0.05, 与对照组比较;c: P < 0.01, 与MG组比较 图 1 Rg3对大鼠力竭游泳时间的影响(n=10) |
2.2 Rg3对血液生化指标的影响
与对照组比较,NG+Rg3组TC、TG、LDH、GLU的浓度明显增高(P < 0.05,P < 0.01),MG组TC、LDH的浓度明显降低(P < 0.05,P < 0.01);与MG组比较,MG+Rg3组TC、TG、LDH、GLU的浓度明显增高(P < 0.05,P < 0.01),BUN明显降低(P < 0.05,表 1)。表明Rg3的抗疲劳作用可能与TC、TG、LDH、GLU和BUN有关。
| 组别 | TC/mmol·L-1 | TG /mmol·L-1 | LDH /IU·L-1 | GLU/mmol·L-1 | BA /μmmol·L-1 | BUN/mmol·L-1 |
| 对照组 | 1.45±0.41 | 0.75±0.34 | 363.0±53.2 | 5.22±1.06 | 129.21±18.21 | 8.25±2.23 |
| NG+Rg3组 | 4.89±0.70b | 1.74±0.43b | 573.0±58.2b | 7.49±1.53a | 132.16±19.32 | 7.86±1.94 |
| MG组 | 0.87±0.21a | 0.42±0.15 | 168.0±27.4b | 4.54±0.99 | 149.16±15.24 | 8.42±2.48 |
| MG+Rg3组 | 3.27±0.47d | 1.12±0.31d | 293.0±35.4d | 7.23±1.54c | 147.38±17.24 | 5.51±1.27c |
| a: P < 0.05, b: P < 0.01, 与对照组比较;c: P < 0.05, d:P < 0.01, 与MG组比较 | ||||||
2.3 Rg3对正常大鼠和模拟高原模型大鼠骨骼肌线粒体MDA和Mn-SOD的影响
与MG组比较,MG+Rg3组MDA含量明显降低(P < 0.01),Mn-SOD活性明显增高(P < 0.01)。与对照组比较,NG+Rg3组Mn-SOD活性明显增高(P < 0.01),MG组MDA含量明显增加(P < 0.01,图 2)。表明Rg3的抗疲劳作用可能与骨骼肌线粒体MDA和Mn-SOD有关。
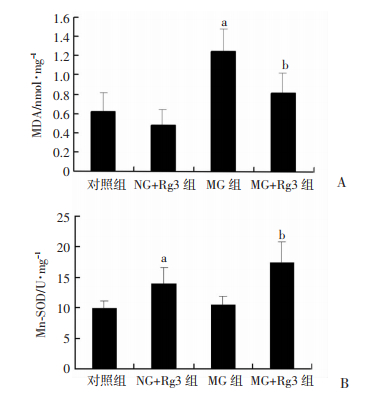
|
| a: P < 0.01, 与对照组比较;b: P < 0.01, 与MG组比较 图 2 Rg3对大鼠骨骼肌线粒体MDA(A)和Mn-SOD(B)的影响(n=10) |
2.4 Rg3对正常大鼠和模拟高原模型大鼠骨骼肌线粒体呼吸链复合物Ⅲ、Ⅳ活性的影响
与对照组比较,NG+Rg3组骨骼肌线粒体呼吸链复合物Ⅲ、Ⅳ活性明显增高(P < 0.01),MG组复合物Ⅲ、Ⅳ活性明显降低(P < 0.01);与MG组比较,MG+Rg3组复合物Ⅲ、Ⅳ活性明显增高(P < 0.01,图 3)。表明Rg3的抗疲劳作用可能与增加骨骼肌线粒体呼吸链复合物Ⅲ、Ⅳ活性有关。
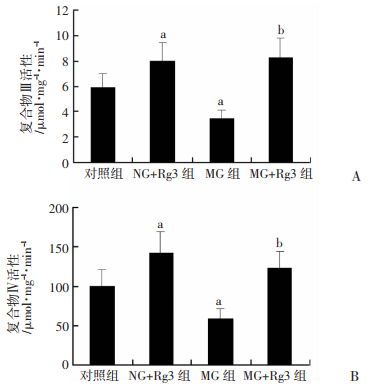
|
| a: P < 0.01, 与对照组比较;b: P < 0.01, 与MG组比较 图 3 Rg3对大鼠骨骼肌线粒体呼吸链复合物Ⅲ(A)、Ⅳ(B)活性的影响(n=10) |
3 讨论
疲劳是一种症状,包括精神或身体疲劳,是指缺乏能量,耐力下降,运动后需要延长恢复时间。在缺氧的高原环境下,可导致各种代谢产物在体内大量储存,影响机体生理功能,使得疲劳成为常见的生理反应之一[7-8]。研究显示缺乏高原预适应者如果进入高原,其劳动效率在3 500 m处较平原降低12.61%,4 500 m处可降低18.78%[7-8]。
本研究采用经典负重游泳实验评估Rg3在平原环境和高原缺氧环境下的抗疲劳作用。结果显示Rg3不仅能显著延长大鼠在平原环境下负重游泳时间,与XU等[9]的研究结果一致,而且还可显著延长模拟高原环境大鼠的负重游泳时间,提示Rg3具有作为抗高原疲劳药物的潜质。
血液中TC、TG和LDH的浓度可作为衡量疲劳的指标。TC和TG的合理利用可以减少糖原和葡萄糖的消耗,且TG分解的脂肪酸可为肌肉收缩提供能量,从而达到延缓疲劳效果[10-11]。此外,如果肌肉通过无氧糖酵解获得足够能量时,会产生大量乳酸。乳酸浓度的增加会引起一系列生化、生理相关的副作用,因此,快速消除乳酸有利于缓解疲劳。血清LDH作为衡量肌肉损伤的指标,可以催化乳酸转变为丙酮酸,从而减少肌肉中乳酸堆积[12-13]。本研究结果显示:相对于对照组和MG组,给予Rg3后TC、TG、和LDH浓度显著升高,提示Rg3在平原环境和模拟高原环境中均可以发挥抗疲劳作用。
众所周知,血糖可为各组织细胞的活动提供能量,剧烈运动后,肌糖原与肝糖原会出现耗竭,血糖浓度降低,引起疲劳的产生,因此血糖是抗疲劳评价的一个重要指标[14]。本研究结果显示:相对于对照组和MG组,给予Rg3后血糖浓度显著升高,提示Rg3在平原环境和模拟高原环境中可以减少血糖的大量消耗,维持运动后大鼠血糖水平,进而延缓疲劳的产生。尿素氮(BUN)和血氨(BA)是运动中蛋白质和氨基酸降解的产物,快速消除降解产物有助于疲劳的迅速恢复。本研究结果显示Rg3对对照组的BUN浓度无影响,但可显著降低MG组的BUN浓度,而各组间的BA差异无统计学意义。按照国家卫生部《保健食品功能学评价程序和检验方法》(1996年)规定,若1项或1项以上的耐力运动实验(负重游泳和爬杆)和2项或2项以上的生化指标(血乳酸、血清尿素氮、肝肌糖原等)为阳性,即可判定受试物具有抗疲劳活性。因此,本研究的负重游泳实验和一系列生化指标结果提示:Rg3在平原环境和模拟高原环境中均具有抗疲劳效应。
SOD催化超氧阴离子的歧化反应,是线粒体在氧化应激损伤过程中抗氧化防御的第一道屏障。同时,MDA作为重要的脂质过氧化产物,是评价氧化应激过程的有效指标[15-16]。Mn-SOD主要存在于线粒体中,与对照组相比,MG组大鼠骨骼肌线粒体中的Mn-SOD活性和MDA含量存在不同程度升高,Rg3能显著提高对照组和MG组Mn-SOD活性,显著降低MG组的MDA含量。这些研究结果表明Rg3在平原环境和高原环境中都具有明显的抗氧化活性,可以抑制脂质过氧化,并能保护体内的骨骼肌细胞,提高骨骼肌线粒体对自由基的消除作用,防止大鼠的氧化应激损伤。
线粒体是通过电子传递进行有氧呼吸,呼吸链酶体系位于线粒体内膜,复合物Ⅲ、Ⅳ是催化质子跨膜转运的质子泵,是呼吸链的重要能量偶联位点[17]。呼吸链复合物Ⅲ、Ⅳ的活性测定表明:Rg3能显著提高正常组和MG组的呼吸链复合物Ⅲ、Ⅳ的活性,提示Rg3在平原环境和高原环境中可通过增加呼吸链复合物Ⅲ和Ⅳ的活性提高线粒体的供能效力,从而维持线粒体的正常功能。因此,本研究结果提示:Rg3在平原环境和模拟高原环境中均可通过提高线粒体的供能效力而发挥抗疲劳作用。
综上所述,本研究结果表明Rg3在平原环境和模拟高原环境中均具有抗疲劳效应,同时可提高骨骼肌线粒体对自由基的消除作用和供能效力。但具体作用机制目前尚不清楚,有待进一步研究探明。
| [1] | DOSEK A, OHNO H, ACS Z, et al. High altitude and oxidative stress[J]. Respir Physiol Neurobiol, 2007, 158(2/3): 128–131. DOI:10.1016/j.resp.2007.03.013 |
| [2] | HINGHOFER-SZALKAY H. Intermittent hypoxic training: risks versus benefits[J]. Eur J Appl Physiol, 2010, 108(2): 417. DOI:10.1007/s00421-009-1274-4 |
| [3] | PIALOUX V, MOUNIER R, ROCK E, et al. Effects of the 'live high-train low' method on prooxidant/antioxidant balance on elite athletes[J]. Eur J Clin Nutr, 2009, 63(6): 756–762. DOI:10.1038/ejcn.2008.30 |
| [4] | SHISHTAR E, SIEVENPIPER J L, DJEDOVIC V, et al. The effect of ginseng (the genus panax) on glycemic control: a systematic review and meta-analysis of randomized controlled clinical trials[J]. PLoS ONE, 2014, 9(9): e107391. DOI:10.1371/journal.pone.0107391 |
| [5] | LEE C H, KIM J H. A review on the medicinal potentials of ginseng and ginsenosides on cardiovascular diseases[J]. J Ginseng Res, 2014, 38(3): 161–166. DOI:10.1016/j.jgr.2014.03.001 |
| [6] | KIM H J, KIM P, SHIN C Y. A comprehensive review of the therapeutic and pharmacological effects of ginseng and ginsenosides in central nervous system[J]. J Ginseng Res, 2013, 37(1): 8–29. DOI:10.5142/jgr.2013.37.8 |
| [7] |
周思敏, 张钢, 田怀军, 等. 银杏叶片对模拟高原暴露小鼠抗疲劳作用的实验研究[J].
西南国防医药, 2011, 21(1): 1–3.
ZHOU S M, ZHANG G, TIAN H J, et al. Empirical study of anti-fatigue effects of Ginkgo Tablet on mice exposed to a simulated altitude of 5 000 m[J]. Med J Nat Defend Forces Southwest China, 2011, 21(1): 1–3. DOI:10.3969/j.issn.1004-0188.2011.01.001 |
| [8] |
田怀军, 罗红. 高原军队卫生学[M]. 北京: 人民卫生出版社, 2006.
TIAN H J, LUO H. Altitude military hygiene[M]. Beijing: People's Medical Publishing House, 2006. |
| [9] | XU Y, ZHANG P, WANG C, et al. Effect of ginsenoside Rg3 on tyrosine hydroxylase and related mechanisms in the forced swimming-induced fatigue rats[J]. J Ethnopharmacol, 2013, 150(1): 138–147. DOI:10.1016/j.jep.2013.08.016 |
| [10] | JUNG K, KIM I H, HAN D. Effect of medicinal plant extracts on forced swimming capacity in mice[J]. J Ethnopharmacol, 2004, 93(1): 75–81. DOI:10.1016/j.jep.2004.03.022 |
| [11] | KANG K S, YAMABE N, KIM H Y, et al. Effects of heat-processed ginseng and its active component ginsenoside 20(S)-Rg3 on the progression of renal damage and dysfunction in type 2 diabetic Otsuka Long-Evans Tokushima Fatty rats[J]. Biol Pharm Bull, 2010, 33(6): 1077–1081. DOI:10.1248/bpb.33.1077 |
| [12] | HE B, CHEN P, XIE Y, et al. 20(R)-ginsenoside Rg3 protects SH-SY5Y cells against apoptosis induced by oxygen and glucose deprivation/reperfusion[J]. Bioorg Med Chem Lett, 2017, 27(16): 3867–3871. DOI:10.1016/j.bmcl.2017.06.045 |
| [13] | MANNAA F, ABDEL-WAHHAB M A, AHMED H H, et al. Protective role of Panax ginseng extract standardized with ginsenoside Rg3 against acrylamide-induced neurotoxicity in rats[J]. J Appl Toxicol, 2006, 26(3): 198–206. DOI:10.1002/jat.1128 |
| [14] |
韩培涛, 李晓莉, 钱平, 等. 中链甘油三酯抗疲劳作用及其机制研究[J].
中国油脂, 2018, 43(1): 56–60.
HAN P T, LI X L, QIAN P, et al. Anti-fatigue effect of medium chain triglycerides and its mechanism[J]. Chin Oils Fats, 2018, 43(1): 56–60. DOI:10.3969/j.issn.1003-7969.2018.01.015 |
| [15] | YANGI B, CENGIZ USTUNER M, DINCER M, et al. Propolis protects endotoxin induced acute lung and liver inflammation through attenuating inflammatory responses and oxidative stress[J]. J Med Food, 2018, 43(1): 56–60. DOI:10.1089/jmf.2017.0151 |
| [16] | GUTIERREZ E L, RAMOS W, SEMINARIO-VIDAL L, et al. Oxidative stress in patients with endemic pemphigus foliaceus and healthy subjects with anti-desmoglein 1 antibodies[J]. An Bras Dermatol, 2018, 93(2): 212–215. DOI:10.1590/abd1806-4841.20186211 |
| [17] | EUBEL H, J NSCH L, BRAUN H P. New insights into the respiratory chain of plant mitochondria. Supercomplexes and a unique composition of complexⅡ[J]. Plant Physiol, 2003, 133(1): 274–286. DOI:10.1104/pp.103.024620 |



