多药耐药MDR(multidrug resistance)是血液肿瘤疾病治疗的重要阻碍, 导致临床化疗失败的主要原因。多药耐药是指肿瘤细胞对一种或一类药物产生耐药性的同时, 对其他的抗肿瘤药物产生交叉耐药性[1]。目前针对耐药细胞株, 多采用更换治疗药物或者增敏原药物来暂时达到治疗的效果, 但是这种方法缺点在于耐药细胞会对新的治疗药物产生耐药性, 导致治疗失败。K562/ADR是人类髓性白血病细胞K562对临床用药多柔比星的耐药细胞[2]。寻找一种本身对耐药细胞无明显凋亡作用, 但是与多柔比星联合用药之后达到杀死耐药细胞的药物是当前治疗多药耐药的新思路。
细胞凋亡主要有内源性和外源性两条途径。内源性途径主要是指细胞色素C释放, 进而介导Caspase家族蛋白以及PARP的激活导致细胞的凋亡[3], 外源性途径主要是由肿瘤坏死因子及其受体介导, 最终导致Caspase的激活和细胞凋亡[4]。线粒体作为能量的调节器, 在发生凋亡的过程中具有重要的作用。凋亡发生时, 长丝状线粒体会片段化, 线粒体嵴重塑, 管状连接打开, 导致细胞色素C的释放, 进而激活Caspase家族蛋白, 导致凋亡[5]。研究表明, 动力相关蛋白1(Drp1或DNM1L)是调节线粒体分裂的重要因子, 在凋亡过程中, Drp1蛋白637位去磷酸化激活, Drp1蛋白从细胞质转位到线粒体, 在线粒体分裂位点聚集形成环状复合物, 通过Drp1的GTP水解收缩Drp环, 导致线粒体断裂, 凋亡发生[6]。
千金藤素(cepharanthine)是从中药千金藤中提取的异喹啉生物碱[7], 已经用于临床, 主要用于治疗白细胞减少症, 未见明显毒副作用[8]。研究表明千金藤素对多种肿瘤细胞具有抗肿瘤活性和抗多药耐药的作用, 与化疗药物联合作用, 通过逆转多药耐药性, 发挥化疗增效的作用[9]。但对千金藤素联合用药逆转多药耐药作用及其分子机制的研究较少。多柔比星(doxorubicin)临床上主要用于治疗白血病以及其他恶性肿瘤[10]。在研究中, 我们发现千金藤素对K562/ADR细胞增殖无明显抑制作用, 多柔比星对K562/ADR细胞的凋亡也无明显作用, 但是联用多柔比星和千金藤素会抑制K562/ADR细胞存活率, 诱导凋亡。本实验旨在研究千金藤素与多柔比星联合用药逆转K562/ADR耐药性的机制, 为千金藤素成为白血病治疗药物提供实验依据。
1 材料与方法 1.1 材料K562/ADR、K562细胞购自上海博谷生物科技有限公司; IMDM高糖培养基、RPMI1640培养基、胎牛血清(FBS)、Western blot试剂购自Bio-Basic公司; ROS清除剂NAC、免疫共沉淀试剂盒、GAPDH抗体购自碧云天公司; Cleavage-Caspase 3、Cleavage-Caspase 9、PARP(46D11)、Drp1、P-Drp1(Ser637)、COX Ⅳ均购自Cell Signaling Technology公司; TOMM20、Cytochrome c抗体购自Santa Cruz公司, 四甲基偶氮唑蓝(MTT)均购自Sigma-Aldrich公司; 流失细胞仪购自BD公司; 千金藤素(cepharanthine, Cep)对照品购自成都曼斯特生物科技有限公司; 多柔比星(doxorubicin, Dox)购自Santa Cruz Technology公司。
1.2 方法 1.2.1 细胞培养与分组K562/ADR细胞用IMDM完全培养基(含20%胎牛血清、1%谷氨酰胺), K562细胞用1640完全培养基(含10%胎牛血清、1%谷氨酰胺), 在37 ℃、饱和湿度及5% CO2的恒温培养箱中培养, 每2 d传代。耐药细胞的鉴定中细胞分为两组:K562组(多柔比星梯度浓度:0、0.3、0.6、0.9、1.2、1.5 μmol/L)、K562/ADR组(多柔比星梯度浓度:0、30、60、90、120、150 μmol/L)。MTT法测定多柔比星协同千金藤素对K562/ADR细胞存活率的影响; 固定多柔比星浓度为4 μmol/L, 千金藤素的浓度梯度为: 0、2、4、6、8、10 μmol/L, 固定千金藤素浓度为6 μmol/L, 多柔比星的浓度梯度为:0、2、4、6、8、10 μmol/L。根据实验需要分为对照组、多柔比星组(4 μmol/L)、千金藤素组(6 μmol/L)、多柔比星(4 μmol/L)与千金藤素(6 μmol/L)联合用药组、NAC组(5 mmol/L)、多柔比星(4 μmol/L)与千金藤素(6 μmol/L)加NAC(5 mmol/L)组。
1.2.2 Western blot检测K562/ADR、K562细胞处理后, 提取全细胞蛋白(碧云天P0013蛋白提取试剂盒)、线粒体以及胞质蛋白(碧云天细胞线粒体分离试剂盒)并测定蛋白浓度(碧云天BCA蛋白浓度测定试剂盒增强型), 蛋白液加入Loading buffer, 96 ℃, 金属浴10 min, 保存于-80 ℃。经聚丙烯酰胺凝胶电泳(SDS-PAGE), 电转3~4 h至PVDF膜, 5%脱脂奶粉封闭1 h, 于4 ℃摇床上孵育抗体过夜, TBST洗涤一抗, 加入二抗于室温下孵育2 h, TBST洗涤后显影。
1.2.3 MTT比色法对数期的细胞计数后, 分盘于96孔板中, 每孔90 μL, 培养24 h。加入完全培养基配制的梯度浓度多柔比星和千金藤素, 先加千金藤素预处理2 h后再加多柔比星。培养48 h。96孔板中每孔加入20 μL MTT工作液, 37 ℃孵育4 h后, 每孔加入三联液100 μL。37 ℃过夜。酶标仪595 nm处测其光密度, 计算细胞存活率。
1.2.4 细胞凋亡检测细胞计数后分盘于6孔板中, 37 ℃培养24 h。加药培养48 h。细胞收集于离心管内, 每管中加入200 μL 1×binding buffer, 再加入2 μL Annexin V-FITC, 5 μL PI, 混匀后避光染色15 min。加150 μL 1×binding buffer充分重悬细胞, 流式细胞仪检测。
1.2.5 ROS检测细胞计数后分盘于6孔板中, 37 ℃培养24 h。加药培养48 h。加入探针孵育2 h, 收集细胞, 用PBS混悬细胞, 流式细胞仪检测。
1.2.6 免疫共沉淀实验(IP)检测按1.2.2中收集细胞, 提蛋白的方法测蛋白浓度。蛋白样品分为2份, 200~ 400 μL, 浓度不低于3 μg/μL, 一份作为IP样品, 一份作为阴性对照(IgG), 各加入抗体约2 μg, 4 ℃缓慢振摇过夜。离心处理后加入20 μL琼脂糖珠子, 4 ℃缓慢振摇2~3 h, 清洗珠子, 制样, Western blot检测。
1.3 统计学分析Western blot检测结果采用Photoshop软件分析, 流式检测数据采用FlowJo软件进行分析, 量效关系、协同系数用Calcusyn软件分析, 采用SPSS 19.0统计软件进行统计学处理, 两样本的组间比较采用t检验。检验水准:α=0.01。
2 结果 2.1 耐药细胞的鉴定 2.1.1 多柔比星对K562/ADR细胞的IC50值显著高于K562细胞MTT实验检测多柔比星对K562、K562/ADR细胞的IC50值。结果显示, 梯度浓度多柔比星均会导致两种细胞存活率降低(图 1A、B)。多柔比星对K562、K562/ADR细胞的IC50为(0.75±0.11)、(75.97±2.17)μmol/L, K562/ADR细胞的IC50是正常K562细胞的100倍左右(P < 0.01)。
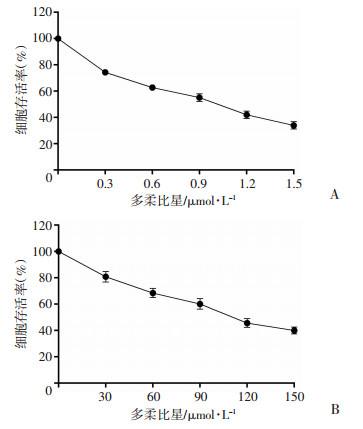
|
| A:多柔比星对K562细胞存活率的影响; B:多柔比星对K562/ADR细胞存活率的影响 图 1 多柔比星对K562、K562/ADR细胞IC50值的影响 |
2.1.2 多药耐药标志蛋白Mdr-1在K562/ADR中高表达
利用Western blot对K562、K562/ADR全细胞中多药耐药标志蛋白Mdr-1进行检测。结果显示(图 2), 在正常K562细胞中检测不到多药耐药标志蛋白, 而在K562/ADR细胞中Mdr-1高表达。通过上述实验, 确认实验所用K562/ADR细胞是耐药株, 且耐药性极强。
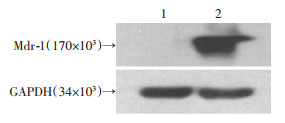
|
| 1:K562;2:K562/ADR 图 2 Western blot检测多药耐药蛋白的表达 |
2.2 千金藤素协同多柔比星对K562/ADR细胞凋亡的影响 2.2.1 千金藤素协同多柔比星显著降低K562/ADR细胞存活率
MTT实验检测千金藤素与多柔比星对K562/ADR细胞存活率的影响, 结果显示(图 3A、B)千金藤素与多柔比星联合作用于K562/ADR细胞后, 均在一定程度上减少K562/ADR细胞存活率, 并且在千金藤素6 μmol/L, 多柔比星4 μmol/L时联用效果最好, 而两种药物单独作用时对K562/ADR细胞存活率影响较小。利用Calcusyn软件求得量效关系和协同系数, 结果显示(图 3C、D)在一定剂量范围内, 药物效应与浓度呈正相关。协同系数均小于1, 表明两药联合作用效果为协同。
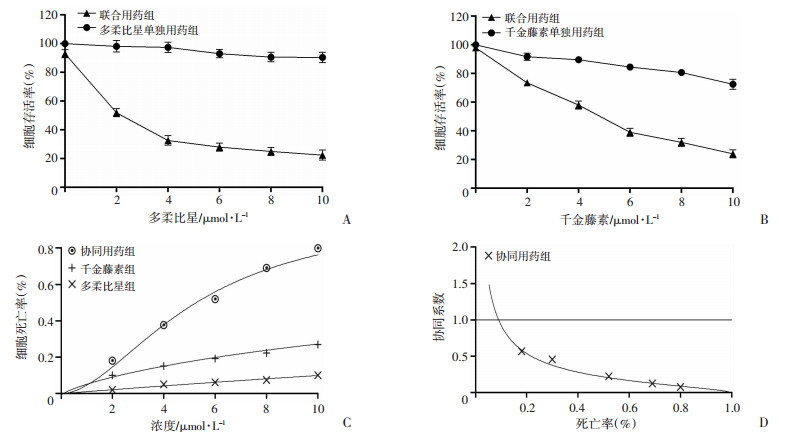
|
| A:梯度浓度多柔比星对K562/ADR细胞存活率的影响(千金藤素6 μmol/L); B:梯度浓度千金藤素对K562/ADR细胞存活率的影响(多柔比星4 μmol/L); C:药物浓度与细胞死亡率之间的量效关系; D:多柔比星联用千金藤素的协同系数 图 3 千金藤素和多柔比星联合用药对细胞存活率的影响 |
2.2.2 千金藤素协同多柔比星诱导K562/ADR细胞凋亡
Annexin V-FITC和PI双染色的方法处理K562/ADR细胞, 通过流式细胞仪检测凋亡, 并对3次重复数据通过统计学处理进行定量分析, 结果显示千金藤素协同多柔比星促进K562/ADR细胞发生凋亡(图 4A)。定量分析结果显示, 千金藤素协同多柔比星可显著升高K562/ADR细胞凋亡率约45%, 差异有统计意义(P < 0.01, 图 4B)。
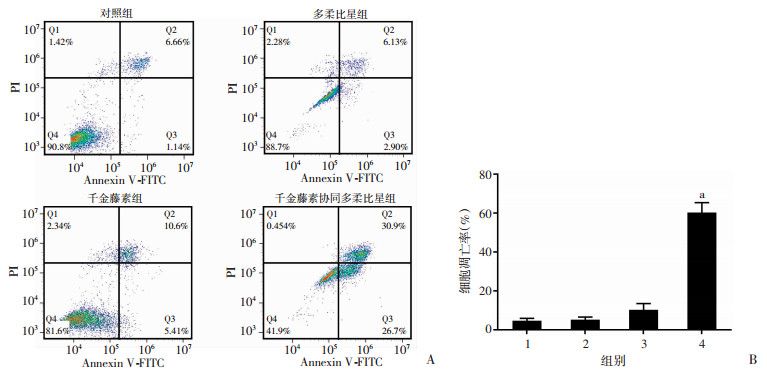
|
| A:流式细胞仪检测凋亡; B:半定量统计分析结果1:对照组; 2:多柔比星组; 3:千金藤素组; 4:千金藤素协同多柔比星组; a:P < 0.01, 与对照组比较 图 4 千金藤素协同多柔比星诱导K562/ADR细胞凋亡情况 |
2.2.3 千金藤素协同多柔比星激活凋亡信号通路逆转耐药
Western blot对凋亡相关蛋白、Mdr-1以及胞质蛋白中的细胞色素C[Cyto C(c)]进行检测。结果显示(图 5), 千金藤素协同多柔比星导致PARP-1和Cleavage-Caspase 3、Cleavage-Caspase 9蛋白表达升高, 细胞色素C释放到胞质, 提示有线粒体损伤, 并且显著减少Mdr-1蛋白的表达。
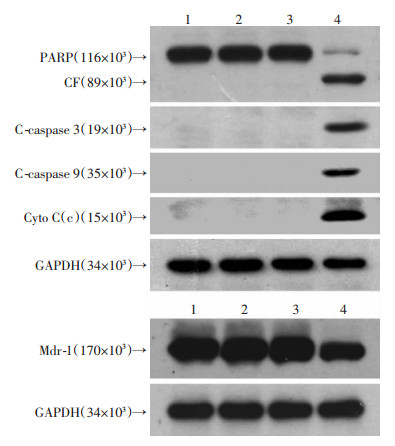
|
| 1:对照组; 2:多柔比星组; 3:千金藤素组; 4:千金藤素协同多柔比星组A:Western blot检测凋亡相关蛋白的表达; B:Western blot检测Mdr-1的表达 图 5 Western blot检测凋亡相关蛋白以及Mdr-1的表达 |
2.3 千金藤素协同多柔比星诱K562/ADR细胞凋亡的机制研究 2.3.1 千金藤素协同多柔比星诱导ROS的生成
流式细胞仪检测ROS水平, 结果显示联合用药组ROS水平明显升高(图 6A)。定量分析结果显示(图 6B), 千金藤素和多柔比星单独处理细胞ROS相对产生量无明显区别, 协同作用可显著升高K562/ADR细胞的ROS水平约70%, 差异有统计学意义(P < 0.01)。
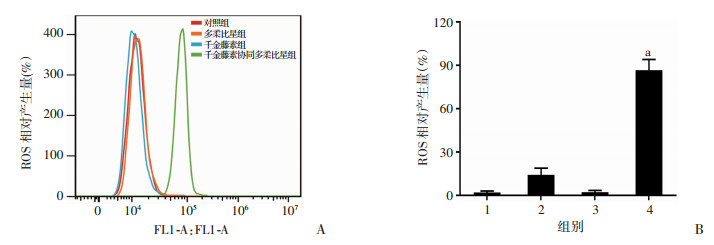
|
| A:流式细胞仪检测ROS的生成量; B:半定量统计分析结果1:对照组; 2:多柔比星组; 3:千金藤素组; 4:千金藤素协同多柔比星组; a:P < 0.01, 与对照组比较 图 6 千金藤素协同多柔比星诱导ROS的生成 |
2.3.2 千金藤素协同多柔比星导致Drp1转位, 诱导线粒体损伤
Western blot对线粒体分裂关键蛋白Drp1进行检测。结果显示(图 7A), 千金藤素协同多柔比星减少Drp1在Ser637位点磷酸化水平, Drp1蛋白总量无明显变化。联合用药组线粒体Drp1表达水平比两药单独作用时增多, 胞质中的Drp1表达减少。说明多柔比星协同千金藤素导致Drp1转位到线粒体, 诱导线粒体损伤。免疫共沉淀实验(IP)结果显示(图 7B), 联合用药组Drp1与线粒体外膜蛋白Tom20共沉淀明显增多。
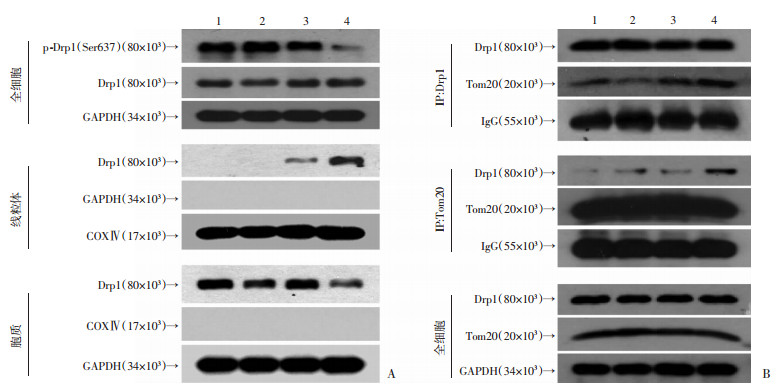
|
| A:Western blot检测结果; B:免疫共沉淀检测结果1:对照组; 2:多柔比星组; 3:千金藤素组; 4:千金藤素协同多柔比星组 图 7 Western blot检测线粒体分裂关键蛋白Drp1的表达 |
2.3.3 抑制ROS降低凋亡率
加入ROS抑制剂NAC, 流式细胞仪检测ROS以及凋亡水平, 结果显示:加入NAC后联合用药组ROS水平明显下降, 凋亡减少。定量分析结果显示:联合用药组加入NAC处理细胞后ROS相对产生量明显下降约45%, 凋亡率下降约35%, 差异有统计学意义(P < 0.01, 图 8)。

|
| A:流式细胞仪检测ROS生成量; B:半定量统计分析结果; C:流式细胞仪检测凋亡; D:半定量统计分析结果1:对照组; 2:千金藤素协同多柔比星组; 3:NAC组; 4:千金藤素+多柔比星+NAC联合用药组; a:P < 0.01, 与千金藤素协同多柔比星组比较 图 8 流式细胞仪检测ROS生成量与凋亡变化 |
2.3.4 抑制ROS阻断Drp1线粒体转位, 减少凋亡相关蛋白的表达
Western blot对线粒体分裂关键蛋白Drp1、凋亡相关蛋白进行检测。结果显示, NAC阻断了Drp1线粒体转位(图 9A), 显著降低千金藤素协同多柔比星导致的PARP、Caspase 3、Caspase 9的激活以及细胞色素C的线粒体释放(图 9B)。
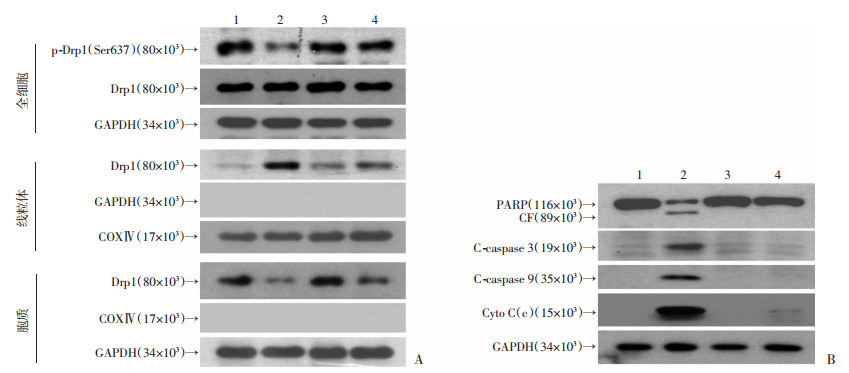
|
| A:Western blot检测Drp1的表达; B:Western blot检测凋亡相关蛋白的表达1:对照组; 2:千金藤素协同多柔比星组; 3:NAC组; 4:千金藤素+多柔比星+NAC联合用药组 图 9 Western blot检测凋亡相关蛋白以及线粒体分裂关键蛋白Drp1的表达 |
3 讨论
目前多药耐药已成为临床治疗的一个主要阻碍。造成多药耐药的机制主要有以下几个方面:ATP转运蛋白超家族、DNA甲基化、细胞凋亡、拓扑异构酶Ⅱ、谷胱甘肽解毒系统等[11]。针对耐药主要的措施有运用化疗增敏剂、中药逆转剂等[12]。而采用自噬抑制剂与自噬诱导剂联合用药的方法可以达到1+1>2的效果, 并且杀死耐药株, 关键在于两种药物在适当剂量对耐药株增殖凋亡无明显效果, 可防止对新的药物产生耐药。本研究发现在适当剂量多柔比星和千金藤素联用时会导致K562/ADR细胞存活率降低, 凋亡增多, 两种药物单独使用却无明显效果。
线粒体损伤会导致细胞能量调节失调, 引起一系列反应, 导致凋亡发生[13]。线粒体损伤的因素主要有药物或者外来刺激导致线粒体结构和功能的紊乱[14], 包括线粒体DNA的表达和复制受抑制, 内膜通透性的增加[15], 对电子传递体系和新陈代谢的抑制, 线粒体解剖结构上的破坏, 例如内膜稳定性的缺失[16], 也是导致线粒体损伤的一个重要因素。活性氧(ROS)是细胞代谢的产物, 也可以引起线粒体损伤, ROS导致线粒体损伤主要从破坏线粒体氧化磷酸化功能、改变线粒体膜通透性、影响线粒体DNA突变等方面[17]。实验发现联合用药组会导致明显的ROS升高和线粒体的损伤, 并且抑制ROS会减少凋亡。
动力相关蛋白1(dynamin-related protein 1, Drp1)也称为DNM1L, 是线粒体分裂所必需的关键蛋白[18], Drp1在线粒体转位会导致线粒体过度分裂和细胞色素C的释放[19], 进而产生一系列凋亡反应。在线粒体分裂的过程中, 外膜蛋白Fis会招募Drp1转位到线粒体外膜富集于潜在分裂位点, 当Drp1过度聚集时就会在分裂位点形成一个环状结构, 不断收缩, 导致线粒体缢裂[20]。有文献报道, 过度的自噬体堆积导致的自噬性应激会引起Drp1线粒体转位和线粒体的过度分裂。分裂后, Drp1蛋白会回到胞质循环利用。Drp1在Ser637位的磷酸化会抑制Drp1蛋白线粒体转位[21]。本研究发现联合用药组Drp1蛋白在Ser637位发生明显的去磷酸化导致Drp1蛋白线粒体转位。而抑制ROS可以明显阻断Drp1蛋白Ser637位的去磷酸化和线粒体转位。因此, 本研究认为多柔比星协同千金藤素导致ROS水平升高, 进而导致Drp1的Ser637位的去磷酸化和线粒体转位, 诱导线粒体过度分裂和细胞凋亡。具体分子机制有待进一步深入研究。
| [1] | WANG J, SEEBACHER N, SHI H, et al. Novel strategies to prevent the development of multidrug resistance (MDR) in cancer[J]. Oncotarget, 2017, 8(48): 84559–84571. DOI:10.18632/oncotarget.19187 |
| [2] | WANG Y J, ZHAO H D, ZHU C F, et al. Tuberostemonine reverses multidrug resistance in chronic myelogenous leukemia cells K562/ADR[J]. J Cancer, 2017, 8(6): 1103–1112. DOI:10.7150/jca.17688 |
| [3] | FOGARTY C E, BERGMANN A. Killers creating new life:caspases drive apoptosis-induced proliferation in tissue repair and disease[J]. Cell Death Differ, 2017, 24(8): 1390–1400. DOI:10.1038/cdd.2017.47 |
| [4] | GIAMPIETRI C, PETRUNGARO S, PADULA F, et al. Autophagy modulators sensitize prostate epithelial cancer cell lines to TNF-alpha-dependent apoptosis[J]. Apoptosis, 2012, 17(11): 1210–1222. DOI:10.1007/s10495-012-0752-z |
| [5] | LEE J, LEE D G. Melittin triggers apoptosis in Candida albicans through the reactive oxygen species-mediated mitochondria/caspase-dependent pathway[J]. FEMS Microbiol Lett, 2014, 355(1): 36–42. DOI:10.1111/1574-6968.12450 |
| [6] | PAGLIUSO A, THAM T N, STEVENS J K, et al. A role for septin 2 in Drp1-mediated mitochondrial fission[J]. EMBO Rep, 2016, 17(6): 858–873. DOI:10.15252/embr.201541612 |
| [7] | DESGROUAS C, CHAPUS C, DESPLANS J, et al. In vitro antiplasmodial activity of cepharanthine[J]. Malar J, 2014, 13: 327. DOI:10.1186/1475-2875-13-327 |
| [8] | WU J, SUZUKI H, ZHOU Y W, et al. Cepharanthine activates caspases and induces apoptosis in Jurkat and K562 human leukemia cell lines[J]. J Cell Biochem, 2001, 82(2): 200–214. |
| [9] | IKEDA R, CHE X, YAMAGUCHI T, et al. Cepharanthine potently enhances the sensitivity of anticancer agents in K562 cells[J]. Cancer Sci, 2005, 96(6): 372–376. DOI:10.1111/j.1349-7006.2005.00057.x |
| [10] | PUGAZHENDHI A, EDISON T N J I, VELMURUGAN B K, et al. Toxicity of Doxorubicin (Dox) to different experimental organ systems[J]. Life Sci, 2018, 200: 26–30. DOI:10.1016/j.lfs.2018.03.023 |
| [11] | FAN Y F, ZHANG W, ZENG L, et al. Dacomitinib antagonizes multidrug resistance (MDR) in cancer cells by inhibiting the efflux activity of ABCB1 and ABCG2 transporters[J]. Cancer Lett, 2018, 421: 186–198. DOI:10.1016/j.canlet.2018.01.021 |
| [12] | TSURUO T, IIDA H, TSUKAGOSHI S, et al. Overcoming of vincristine resistance in P388 leukemia in vivo and in vitro through enhanced cytotoxicity of vincristine and vinblastine by verapamil[J]. Cancer Res, 1981, 41(5): 1967–1972. |
| [13] | CZARNECKA A M, KUKWA W, KRAWCZYK T, et al. Mitochondrial DNA mutations in cancer-from bench to bedside[J]. Front Biosci (Landmark Ed), 2010, 15: 437–460. DOI:10.2741/3629 |
| [14] | JAESCHKE H, MCGILL M R, RAMACHANDRAN A. Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury: lessons learned from acetaminophen hepatotoxicity[J]. Drug Metab Rev, 2012, 44(1): 88–106. DOI:10.3109/03602532.2011.602688 |
| [15] | NADANACIVA S, DYKENS J A, BERNAL A, et al. Mitochondrial impairment by PPAR agonists and statins identified via immunocaptured OXPHOS complex activities and respiration[J]. Toxicol Appl Pharmacol, 2007, 223(3): 277–287. DOI:10.1016/j.taap.2007.06.003 |
| [16] | NEUSTADT J, PIECZENIK S R. Medication-induced mitochondrial damage and disease[J]. Mol Nutr Food Res, 2008, 52(7): 780–788. DOI:10.1002/mnfr.200700075 |
| [17] | ZHANG Z, LIU L, WU S, et al. Drp1, Mff, Fis1, and MiD51 are coordinated to mediate mitochondrial fission during UV irradiation-induced apoptosis[J]. FASEB J, 2016, 30(1): 466–476. DOI:10.1096/fj.15-274258 |
| [18] | ESTAQUIER J, ARNOULT D. Inhibiting Drp1-mediated mitochondrial fission selectively prevents the release of cytochrome c during apoptosis[J]. Cell Death Differ, 2007, 14(6): 1086–1094. DOI:10.1038/sj.cdd.4402107 |
| [19] | OTERA H, MIHARA K. Mitochondrial dynamics: functional link with apoptosis[J]. Int J Cell Biol, 2012, 2012: 821676. DOI:10.1155/2012/821676 |
| [20] | CEREGHETTI G M, STANGHERLIN A, MARTINS DE BRITO O, et al. Dephosphorylation by calcineurin regulates translocation of Drp1 to mitochondria[J]. Proc Natl Acad Sci U S A, 2008, 105(41): 15803–15808. DOI:10.1073/pnas.0808249105 |
| [21] | ZHOU J, LI G, ZHENG Y, et al. A novel autophagy/mitophagy inhibitor liensinine sensitizes breast cancer cells to chemotherapy through DNM1L-mediated mitochondrial fission[J]. Autophagy, 2015, 11(8): 1259–1279. DOI:10.1080/15548627.2015.1056970 |



