2. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系
2. Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
缺血性心脏病(ischemic heart disease,IHD)是冠状动脉的供血不足或中断,造成心脏能量不足,进而造成细胞凋亡、坏死,严重时将发展成心功能不全、心衰等,已成为全球死亡率较高的疾病之一[1-2]。由于心肌细胞属终末分化细胞,几乎无再生能力,如果能在心肌缺血早期进行干预,可逆性抑制心肌细胞凋亡,将会对缺血心肌细胞起保护作用[1]。Carabin是近年发现的TBC1蛋白家族的成员[3],可通过CaN和Ras信号通路防止心肌肥厚[4-6]。然而在心肌缺血的研究中,Carabin是否起着重要的作用尚无定论。我们前期实验结果显示人心室肌细胞AC16在氧糖剥夺(OGD)24 h后Carabin的蛋白表达显著下调。那么Carabin是否与心肌细胞氧糖剥夺后的损伤相关联呢?本研究拟建立氧糖剥夺诱导AC16细胞凋亡模型,通过Carabin过表达观察Carabin对氧糖剥夺诱导AC16细胞凋亡的影响,以期为缺血性心脏病的防治提供一些科学的理论依据。
1 材料与方法 1.1 细胞培养人心室肌细胞株AC16购自美国模式培养物集存库(American type culture collection, ATCC)[7],其培养于含10%胎牛血清的高糖培养基中,置于37 ℃、5%CO2培养箱中贴壁培养。当细胞长至约90%融合度时,用0.25%胰蛋白酶消化传代培养。
1.2 主要试剂DMEM基础培养基购自美国Gibco公司;胎牛血清购自美国HyClone公司;Caspase-3活性检测试剂盒、胰酶细胞消化液、Western及IP细胞裂解液和BCA蛋白检测试剂盒均购自碧云天公司;Annexin V-APC/7-AAD双染法细胞凋亡检测试剂盒购自美国BD公司;TUNEL凋亡试剂盒购自美国Roche公司;乳酸脱氢酶(LDH)测定试剂盒购自南京建成生物工程研究所;Carabin抗体购自Abcam公司;Caspase-3、β-actin抗体购自CST公司;Hanks液购自武汉博士德生物工程有限公司。
1.3 Carabin基因过表达慢病毒载体的构建提取阳性克隆质粒,并进行酶切反应及测序[8]。挑选鉴定正确的重组质粒进行病毒包装,将携带目的基因的重组质粒pLVX-hTBC1D10C-mCMV-ZsGreen-PGK-Puro,以及系统包装质粒导入293T细胞,产生携带目的基因的高滴度慢病毒,同时用重组质粒pLVX-mCMV-ZsGreen-PGK-Puro包装空载对照病毒(rLV-NC)。将成功包装的过表达慢病毒载体(rLV-hTBC1D10C)及阴性对照载体(rLV-NC)分别感染AC16细胞;用嘌呤霉素筛选得稳转的过表达细胞株及空载细胞株,qPCR和Western blot分别检测Carabin的mRNA和蛋白表达效果。选取稳定感染过表达慢病毒载体(rLV-hTBC1D10C)并有效过表达Carabin的AC16细胞作为过表达组;将稳定感染慢病毒空载体(rLV-NC)的AC16细胞作为空载对照组。用含有10%胎牛血清DMEM高糖培养基培养细胞,并置于37 ℃、5% CO2常氧培养箱中培养。待细胞融合度约90%时,消化传代。
1.4 心肌细胞的分组及处理将AC16细胞分为空载常氧组、过表达常氧组和空载OGD 24 h组、过表达OGD 24 h组。常氧组培养条件为37 ℃,21%O2-5%CO2-74%N2,10%FBS DMEM培养基,OGD组培养条件为37 ℃,1%O2-5%CO2-94%N2,Hanks平衡液。
1.5 指标检测 1.5.1 流式细胞术检测细胞凋亡将成功构建的空载组和过表达组AC16细胞分别消化传至六孔板中培养24 h后,将空载常氧组和过表达常氧组换液后继续常氧环境培养24 h;空载OGD 24 h组和过表达OGD 24 h组换为Hanks液后置于缺氧环境培养24 h。用不含EDTA的胰酶消化细胞,800 ×g离心5 min收集细胞,弃上清液,留细胞沉淀。用预冷PBS洗涤细胞2次(800 ×g离心5 min)收集细胞。将按照2 μL Annexin V-APC、2 μL 7-AAD和100 μL binding buffer比例的混合液200 μL重悬细胞,冰上避光孵育15 min后C6流式细胞仪检测。
1.5.2 TUNEL检测细胞凋亡将空载组和过表达组AC16细胞分别消化传至放有盖玻片的12孔板中培养24 h后,空载常氧组和过表达常氧组换液后继续常氧环境培养24 h;空载OGD 24 h组和过表达OGD 24 h组换为Hanks液后置于缺氧环境培养24 h。TUNEL染色的操作按说明书进行,简要如下:PBS洗2次,预冷的75%乙醇固定15 min,PBS洗2次,0.2%的Triton X-100通透5 min,PBS洗2次,加入TUNEL反应混合液(50 μL TdT+450 μL荧光素标记的dUTP),37 ℃避光反应1 h;加入DAPI染核7 min;取出盖玻片,加入抗摧灭剂,盖至载玻片上,在荧光显微镜下观察。
1.5.3 Caspase-3活性检测将空载组和过表达组AC16细胞分别接种至直径10 cm培养皿中,如前所述进行常氧及缺氧培养24 h。用胰酶消化并收集细胞,600×g 4 ℃离心5 min,PBS洗涤1次;加入100 μL裂解液,重悬沉淀,冰浴裂解15 min;4 ℃ 20 000×g离心15 min;收集上清至冰浴预冷的离心管中。按照以下反应体系依次加入检测缓冲液40 μL、样品50 μL、Ac-DEVD-pNA (2 mmol/L)10 μL共100 μL混匀,37 ℃孵育120 min,酶标仪检测波长405 nm处光密度值[D(405)]。Bradford法检测蛋白浓度校准。
1.5.4 乳酸脱氢酶(LDH)活性检测如前所述接种细胞分别进行常氧及缺氧培养24 h。收集培养上清进行LDH测量。简要如下:取20 μL样本加入96孔板中,每孔分别加入25 μL基质缓冲液和5 μL辅酶Ⅰ应用液,对照组加入5 μL双蒸水,混匀,37 ℃水浴15 min,再加入2,4-二硝基苯肼25 μL,混匀,37 ℃水浴15 min,最后加入0.4 mol/L NaOH溶液250 μL,混匀,室温静置5 min,在波长450 nm处酶标仪检测光密度值[D(450)]。
1.5.5 Western blot检测凋亡蛋白Caspase-3的表达如前所述接种细胞至直径10 cm皿中,分别进行常氧及缺氧培养24 h。加入细胞裂解液100 μL,并全部刮取细胞至1.5 mL预冷离心管中,10 000 ×g,4 ℃离心10 min后取上清,BCA法测定蛋白浓度。调平样品浓度为2.5 μg/μL。用10% SDS-PAGE电泳分离,电泳条件80 V电泳30 min,100 V电泳100 min。转膜,5%脱脂奶粉封闭1 h,TBST洗3次后一抗4 ℃孵育过夜。TBST洗3次后二抗室温孵育2 h。TBST洗3次后显影。
1.6 统计学分析采用SPSS 24.0统计软件分析,计量资料以x±s表示。多组间比较采用双因素方差分析。
2 结果 2.1 氧糖剥夺后AC16细胞Carabin的mRNA及蛋白表达随着OGD处理时间的延长,AC16细胞内Carabin的mRNA水平呈逐渐减低趋势(P < 0.01, 图 1A);Carabin的蛋白表达也呈逐渐减低趋势(图 1B)。
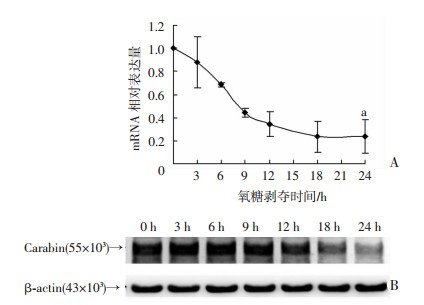
|
| A:实时荧光定量PCR检测Carabin mRNA相对表达量(x±s,n=3) a:P < 0.01,与0 h比较;B:蛋白质免疫印迹检测Carabin蛋白表达 图 1 AC16细胞在氧糖剥夺(OGD)后Carabin的mRNA及蛋白变化 |
2.2 Carabin过表达对AC16细胞氧糖剥夺条件下细胞形态的影响
AC16细胞在常氧或OGD 24 h后的细胞形态(图 2)。在倒置显微镜下观察:空载常氧组(图 2A)及过表达常氧组(图 2B)的细胞生长状态良好,形态完整,贴壁牢固,边界清楚,大小均匀,细胞均长满;空载OGD 24 h组(图 2C)细胞生长状态差,形态不完整,大多数呈圆形漂浮状,仅少数贴壁,大小不均匀;过表达OGD 24 h组(图 2D)细胞生长比空载OGD 24 h组(图 2C)较好,虽细胞融合度不及常氧组细胞,但比空载OGD 24 h组(图 2C)较高,细胞呈圆形漂浮状较少,大多数细胞仍贴壁。

|
| A:空载常氧组;B:过表达常氧组;C:空载OGD 24 h组;D:过表达OGD 24 h组 图 2 倒置显微镜下观察各组AC16细胞形态变化 |
2.3 Carabin过表达减轻AC16细胞氧糖剥夺条件下细胞凋亡
流式细胞术检测AC16细胞在常氧或OGD 24 h后细胞凋亡见图 3、表 1。空载OGD 24 h组和过表达OGD 24 h组与空载常氧组相比,凋亡率均升高(P < 0.01),存活率均降低(P < 0.01);然而,与空载OGD 24 h组比较,过表达OGD 24 h组凋亡率明显降低(P < 0.01),存活率明显升高(P < 0.01)。TUNEL染色检测AC16细胞在常氧或OGD 24 h后细胞凋亡见图 4。空载OGD 24 h组和过表达OGD 24 h组与空载常氧组相比,凋亡数目均增多;过表达OGD 24 h组与空载OGD 24 h相比,凋亡数目减少。
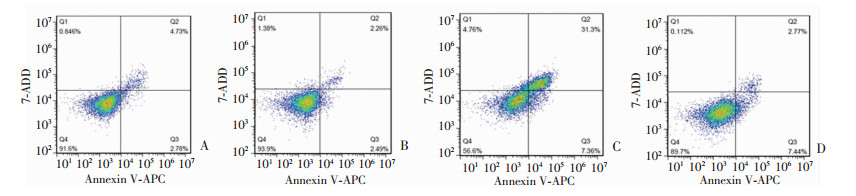
|
| A:空载常氧组;B:过表达常氧组; C:空载OGD 24 h组;D:过表达OGD 24 h组 图 3 流式细胞术检测各组AC16细胞的凋亡情况 |
| 组别 | 凋亡率/% | 存活率/% |
| 空载常氧组(0 h) | 6.50±2.35 | 92.43±2.08 |
| 过表达常氧组(0 h) | 5.80±1.51 | 93.07±1.19 |
| 空载OGD24 h组 | 34.37±3.72a | 62.17±4.83a |
| 过表达OGD24 h组 | 11.29±0.96ab | 88.57±1.00ab |
| a:P < 0.01,与空载常氧组比较;b:P < 0.01,与空载OGD 24 h组比较 | ||
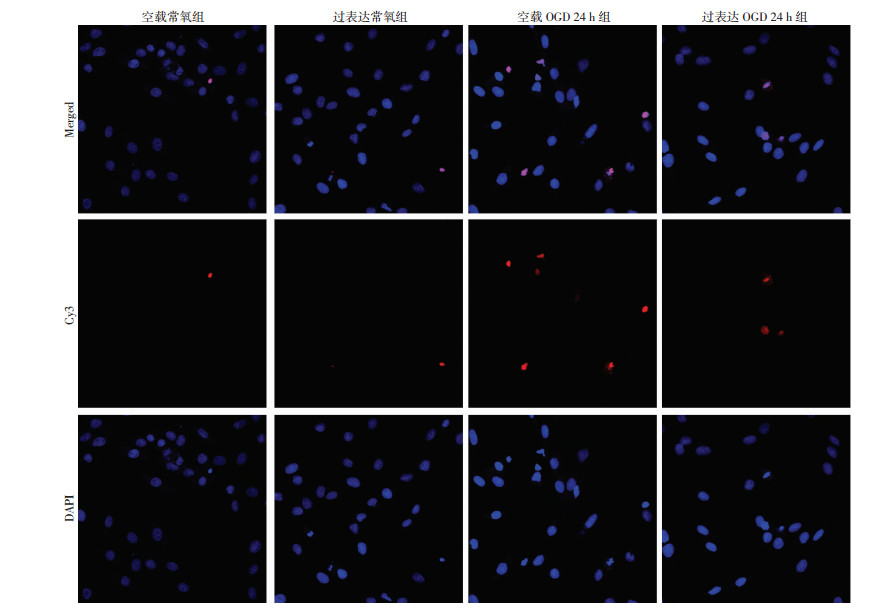
|
| 图 4 TUNEL法染色检测各组AC16细胞的凋亡情况 |
2.4 Carabin过表达降低AC16细胞氧糖剥夺条件下Caspase-3和乳酸脱氢酶的活性
AC16细胞在常氧或OGD 24 h后Caspase-3的活性检测结果显示,空载OGD 24 h组与空载常氧组相比,Caspase-3活性明显增高(P < 0.01,图 5);过表达OGD 24 h组与空载OGD 24 h相比,Caspase-3活性显著降低(P < 0.05,图 5)。乳酸脱氢酶(LDH)检测结果显示,AC16空载组细胞在OGD 24 h后LDH明显升高(P < 0.01);而AC16过表达组细胞在OGD 24 h后其LDH含量明显低于空载OGD 24 h组(P < 0.05,图 5)。表明Carabin过表达可降低AC16细胞在OGD环境中的损伤。

|
| 1:空载常氧组;2:过表达常氧组;3:空载OGD 24 h组;4:过表达OGD 24 h组; a:P < 0.01,与空载常氧组比较;b:P < 0.05,与空载OGD 24 h组比较 图 5 各组AC16细胞在OGD 24 h后Caspase-3和乳酸脱氢酶的活性(n=3) |
2.5 Carabin过表达减少AC16细胞氧糖剥夺条件下Caspase-3蛋白表达
AC16细胞在常氧或OGD 24 h培养后,蛋白质免疫印迹检测结果显示(图 6),空载OGD 24 h组中的Caspase-3蛋白表达明显高于空载常氧组[(1.274 8±0.063 6)vs (1.042 1±0.036 7),P < 0.05];过表达OGD 24 h组中的Caspase-3蛋白表达(1.157 2±0.016 2)明显低于空载OGD 24 h组(P < 0.05)。

|
| 1:空载常氧组;2:过表达常氧组;3:空载OGD 24 h组;4:过表达OGD 24 h组 图 6 蛋白质免疫印迹检测凋亡蛋白Caspase-3的表达 |
3 讨论
心肌与其他组织不同,受损后自我修复能力有限,最终导致心肌重塑或左心室功能障碍[9-11]。目前治疗心肌缺血或梗死的方法有:药物溶栓、介入治疗、冠脉搭桥手术,以及干细胞移植等[12-14]。因此,如果能在缺血性心脏病早期进行干预,可逆性地抑制心肌细胞凋亡,将会对心肌起非常重要的保护作用。
Carabin是钙调神经磷酸酶(CaN)的结合蛋白[2],也是CaN的内源性抑制因子,可特异性抑制Ras/ERK1/2信号通路[3]。Carabin可靶向抑制Rab35负性调控B细胞BCR信号通路,抑制Carabin可促进B细胞的早期应答[15];Carabin还可以相同机制使胞内囊泡积聚,进而影响外泌体的分泌[16]。Carabin通过脯氨酸羟化酶(P4HA2)发生羟基化而降解,从而激活Ras/胞外信号调节激酶途径,促进B细胞淋巴瘤增殖[17]。
BISSERIER等[4]研究发现,Carabin可通过CaN和Ras信号通路抑制心肌细胞肥大,防止心肌肥厚,起保护作用。然而ZHU等[5]研究发现,Carabin抑制心肌细胞肥大,防止心肌肥厚,主要是由于Carabin通过CaN通路实现的。VOLLAND等[6]的研究也得出同样结论,并且Carabin通过降低心率使小鼠心输出量降低,从而提高小鼠运动能力和存活率。总之,Carabin可抑制心肌细胞肥大,防止心肌肥厚,起着保护性作用,但目前尚未有Carabin在心肌缺血模型中的相关研究。
我们前期研究发现,Carabin在心肌细胞中表达相对较低,利用人心室肌细胞株AC16建立氧糖剥夺模型后发现Carabin的mRNA和蛋白表达量显著下调。为了进一步研究及明确Carabin在心肌缺血损伤中的作用,我们构建Carabin过表达慢病毒,并筛选到Carabin稳定过表达的AC16细胞株。研究结果显示, 过表达Carabin后,氧糖剥夺(OGD)导致的AC16细胞凋亡显著减轻,Caspase-3和LDH的活性均显著下降,同时Caspase-3的蛋白表达显著下降。
综上所述,Carabin过表达后能显著减轻氧糖剥夺诱导的人心室肌细胞AC16的凋亡,但其具体的作用机制目前尚不明确,可能与CaN、Ras等信号通路有关。我们实验室后续将对Carabin的具体作用机制进一步研究,并且行Carabin敲低后检测AC16在氧糖剥夺后的凋亡损伤变化,并在动物水平进一步验证Carabin的作用及相关机制。
| [1] | YONEZU K, SAKAKURA K, WATANABE Y, et al. Determinants of survival and favorable neurologic outcomes in ischemic heart disease treated by veno-arterial extracorporeal membrane oxygenation[J]. Heart Vessels, 2018, 33(1): 25–32. DOI:10.1007/s00380-017-1031-2 |
| [2] | ROMERO-CORRAL A, MONTORI V M, SOMERS V K, et al. Association of bodyweight with total mortality and with cardiovascular events in coronary artery disease: a systematic review of cohort studies[J]. Lancet, 2006, 368(9536): 666–678. DOI:10.1016/S0140-6736(06)69251-9 |
| [3] | PAN F, SUN L, KARDIAN D B, et al. Feedback inhibition of calcineurin and Ras by a dual inhibitory protein Carabin[J]. Nature, 2007, 445(7126): 433–436. DOI:10.1038/nature05476 |
| [4] | BISSERIER M, BERTHOUZE-DUQUESNES M, BRECKLER M, et al. Carabin protects against cardiac hypertrophy by blocking calcineurin, ras, and Ca2+/calmodulin-dependent protein kinase Ⅱ signaling[J]. Circulation, 2015, 131(4): 390–400. DOI:10.1161/CIRCULATIONAHA.114.010686 |
| [5] | ZHU X, FANG J, GONG J, et al. Cardiac-specific EPI64C blunts pressure overload-induced cardiac hypertrophy[J]. Hypertension, 2016, 67(5): 866–877. DOI:10.1161/HYPERTENSIONAHA.115.07042 |
| [6] | VOLLAND C, BREMER S, HELLENKAMP K, et al. Enhanced cardiac TBC1D10C expression lowers heart rate and enhances exercise capacity and survival[J]. Sci Rep, 2016, 6: 33853. DOI:10.1038/srep33853 |
| [7] | DAVIDSON M M, NESTI C, PALENZUELA L, et al. Novel cell lines derived from adult human ventricular cardiomyocytes[J]. J Mol Cell Cardiol, 2005, 39(1): 133–147. DOI:10.1016/j.yjmcc.2005.03.003 |
| [8] |
刘凯玉, 蒋维, 王瑞娜, 等. 人Carabin蛋白过表达慢病毒载体构建及其稳定表达细胞株的筛选[J].
生物学杂志, 2016, 33(3): 1–4.
LIU K Y, JIAN W, WANG R N, et al. Construction of lentivirus expression vector of human CARABIN and screening of cell line stably expressing CARABIN[J]. J Biol, 2016, 33(3): 1–4. DOI:10.3969/j.issn.2095-1736.2016.03.001 |
| [9] | ROTH G A, JOHNSON C, ABAJOBIR A, et al. Global, regional, and national burden of cardiovascular diseases for 10 causes, 1990 to 2015[J]. J Am Coll Cardiol, 2017, 70(1): 1–25. DOI:10.1016/j.jacc.2017.04.052 |
| [10] | DIAS L D, CASALI K R, GHEM C, et al. Mesenchymal stem cells from sternum: the type of heart disease, ischemic or valvular, does not influence the cell culture establishment and growth kinetics[J]. J Transl Med, 2017, 15(1): 161–170. DOI:10.1186/s12967-017-1262-0 |
| [11] | NI H, XU J. Recent trends in heart failure-related mortality: United States, 2000-2014[J]. NCHS Data Brief, 2015(231): 1–8. |
| [12] | LALIT P A, HEI D J, RAVAL A N, et al. Induced pluripotent stem cells for post-myocardial infarction repair: remarkable opportunities and challenges[J]. Circ Res, 2014, 114(8): 1328–1345. DOI:10.1161/CIRCRESAHA.114.300556 |
| [13] | MOON S H, KANG S W, PARK S J, et al. The use of aggregates of purified cardiomyocytes derived from human ESCs for functionalengraftment after myocardial infarction[J]. Biomaterials, 2013, 34(16): 4013–4026. DOI:10.1016/j.biomaterials.2013.02.022 |
| [14] | AILAWADI S, WANG X, GU H, et al. Pathologic function and therapeutic potential of exosomes in cardiovascular disease[J]. Biochim Biophys Acta, 2015, 1852(1): 1–11. DOI:10.1016/j.bbadis.2014.10.008 |
| [15] | SCHICKEL J N, PASQUALI J L, SOLEY A, et al. Carabin deficiency in B cells increases BCR-TLR9 costimulation-induced autoimmunity[J]. EMBO Mol Med, 2012, 4(12): 1261–1275. DOI:10.1002/emmm.201201595 |
| [16] | HSU C, MOROHASHI Y, YOSHIMURA S, et al. Regulation of exosome secretion by Rab35 and its GTPase-activating proteins TBC1D10C[J]. J Cell Biol, 2010, 189(2): 223–232. DOI:10.1083/jcb.200911018 |
| [17] | JIANG W, ZHOU X, LI Z, et al. Prolyl 4-hydroxylase 2 promotes B-cell lymphoma progression via hydroxylation of Carabin[J]. Blood, 2018, 131(12): 1325–1336. DOI:10.1182/blood-2017-07-794875 |



