弗劳地枸橼酸杆菌(Citrobacter freundii)不仅是肠道的正常菌群之一,而且是重要的条件致病菌,当机体抵抗力下降时,可引起呼吸道、消化道、泌尿系统感染及败血症等。有研究报道[1-3],其耐药性问题日趋严重,且呈现多重耐药现象。碳青霉烯类药物是对抗革兰阴性杆菌活性最为强大的一类抗菌药物,是肠杆菌科细菌引起感染的最后一道防线,但随着该类抗生素的大量使用,该防线已经被各种产碳青霉烯酶的肠杆菌科细菌突破,严重地限制了临床用药选择。据中国耐药监测网数据显示[4],目前国内CRCF临床分离率为8%左右,而近几年我院CRCF临床分离率高达23.2%,显著高于国内耐药监测水平。是什么原因引起了我院分离的CRCF异常升高?本研究通过对我院CRCF感染的临床病例进行危险因素分析,对不同菌进行基因同源性分析,期望从基础疾病的易感因素及菌株克隆起源方面来探寻CRCF高分离率的原因。本文对2013年1月-2018年3月我院临床分离CRCF感染相关危险因素及同源性特征进行分析,现将结果报道如下:
1 材料与方法 1.1 材料菌株来源 收集重庆医科大学附属第二医院2013年1月-2018年3月所有临床分离弗劳地枸橼酸杆菌138株,其中CRCF组32株,NCRCF组106株。治疗期间同一患者多次检出此菌不重复纳入本次研究。
临床资料 采用回顾性分析,对该院2013年1月-2018年3月临床分离出的所有138株弗劳地枸橼酸杆菌进行临床资料的收集及分析,治疗期间同一患者多次感染该菌,仅将第一次感染的资料纳入分析,排除临床资料不完整病例。对菌株的临床资料进行统计,包括:性别、年龄、感染类型、基础疾病、标本来源、标本种类、细菌药敏结果、标本科室分布、经验性使用抗生素等。
仪器与试剂 哥伦比亚血平板、麦康凯平板、巧克力平板、血培养瓶、药敏纸片(英国Oxoid公司)、药敏M-H平板(法国梅里埃公司);自动化鉴定仪VITEK2-Compact(法国梅里埃公司),PCR仪、脉冲场凝胶电泳仪器(美国Bio-Rad公司)、凝胶成像仪,脉冲场凝胶电泳相关试剂、PCR相关试剂(大连Takara生物有限公司)。
1.2 方法 1.2.1 细菌鉴定与药敏所有细菌严格按照VITEK 2-Compact全自动微生物分析系统试验步骤进行细菌鉴定和药敏试验,结果按照2018版美国临床和实验室标准化协会(CLSI)M100文件来判定。质控菌株:大肠埃希菌ATCC 25922,铜绿假单胞ATCC 27853,大肠埃希菌ATCC 35218,肺炎克雷伯菌ATCC 700603。
1.2.2 多位点序列分型(multilocus sequence typing, MLST)采用MLST对32株CRCF进行分型。煮沸法提取细菌DNA模板;①引物设计:网站上获得弗劳地枸橼酸杆菌的7个管家基因引物序列, 详见表 1(http://pubmlst.org/cfreundii/);②反应体系:总反应体积25 μl, DNA 2 μl, 引物各0.75 μl,TaKaRa rTaq DNA poly-merase 12.5 μl,灭菌纯水9.0 μl;③反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃ 1 min,30个循环,72 ℃延伸10 min; PCR扩增产物经琼脂糖电泳分离,凝胶成像观察结果。PCR扩增产物送由上海生工生物工程股份有限公司测序,测序结果在弗劳地枸橼酸杆菌MLST数据库进行比对得到每个管家基因的等位基因号,将七个管家基因按aspC-clpX-fadD-mdh-arcA-dnaG-lysP顺序排列形成等位基因谱,与数据库中已有等位基因谱进行比对,得到每株细菌的ST型(http://pubmlst.org/cfreundii/)。
| 管家 基因 |
引物 名称 |
引物序列(5′-3′) | 产物大小 |
| aspC | aspC-F | 5′-GTTTCGTGCCGATGAACGTC-3′ | 513 bp |
| aspC-R | 5′-AAACCCTGGTAAGCGAAGTC-3′ | ||
| clpX | clpX-F | 5′-CTGGCGGTCGCGGTATACAA-3′ | 567 bp |
| clpX-R | 5′-GACAACCGGCAGACGACCAA-3′ | ||
| fadD | fadD-F | 5′-GCTGCCGCTGTATCACATTT-3′ | 483 bp |
| fadD-R | 5′-GCGCAGGAATCCTTCTTCAT-3′ | ||
| mdh | mdh-F | 5′-GTCGATCTGAGCCATATCCCTAC-3′ | 549 bp |
| mdh-R | 5′-TACTGACCGTCGCCTTCAAC-3′ | ||
| arcA | arcA-F | 5′-GACAGATGGCGCGGAAATGC-3′ | 435 bp |
| arcA-R | 5′-TCCGGCGTAGATTCGAAATG-3′ | ||
| dnaG | dnaG-F | 5′-ACCGCCGATCACATACAACT-3′ | 444 bp |
| dnaG-R | 5′-TGCACCAGCAACCCTATAAG-3′ | ||
| lysP | lysP-F | 5′-GCTACGTCGTGAACTGAAGG-3′ | 477 bp |
| lysP-R | 5′-TGTCCCCTGGAAGGAGAAGC-3′ | ||
| 注:F-上游序列R-下游序列 | |||
1.2.3 脉冲场凝胶电泳(Pulsed Field Gel Electrophoresis, PFGE)
采用PFGE对耐碳青霉烯类弗劳地枸橼酸杆菌进行同源性分析。细菌经裂解液处理、凝胶包埋并用内切酶Xba Ⅰ酶切之后,进行脉冲场电泳;电泳参数:1%琼脂糖凝胶、电泳液为0.5×Tris-硼酸(TBE)缓冲液,电泳电压6 V/cm,脉冲时间1~20 s,脉冲角度120°,14 ℃电泳19 h。所获得的图像用BioNumerics software6.6分析并制成树状图。
1.2.4 数据分析药敏结果用软件WHONET 5.6进行数据分析;其他数据采用SPSS17.0进行统计学分析。计数资料及单因素危险因素分析采用χ2检验。多因素危险因素分析采用二分类Logistic回归分析。P<0.05为差异具有统计学意义。
2 结果 2.1 患者临床资料临床分离138株弗劳地枸橼酸杆菌细菌分为两组,CRCF组和NCRCF组。CRCF常检出于手术后,占40.6%;肿瘤和肝胆疾病是CRCF感染的最常见基础疾病,分别占40.6%、37.5%;CRCF最常见的经验性使用抗生素为头孢菌素类和碳青霉烯类分别占28.1%和25%,详见表 2。
| 分组 | n | 年龄(岁) | 男性 | 感染类型[例(%)] | 感染可能来源[例(%)] | 基础疾病[例(%)] | 经验性使用抗生素[例(%)] | |||||||||||||||||
| 手术 | 合并其他耐碳青霉烯类细菌感染 | 动静脉导管相关 | 泌尿生殖道 | 腹部感染 | 胸部感染 | 皮肤软组织 | 糖尿病 | 高血压 | 心脏病 | 肺部疾病 | 肝胆疾病 | 肾脏疾病 | 肿瘤 | β-内酰胺酶抑制剂 | 头孢菌素类 | 碳青霉烯类 | 联合用药 | |||||||
| CRCF组 | 32 | 62(9~89) | 22(68.7%) | 13(40.6%) | 4(12.5%) | 8(25%) | 6(18.8%) | 13(40.6%) | 2(6.2%) | 2(6.2%) | 5(15.6%) | 7(21.9%) | 5(15.6%) | 4(12.5%) | 12(37.5%) | 6(18.75%) | 13(40.6%) | 4(12.5%) | 9(28.1%) | 8(25%) | 7(21.9%) | |||
| NCRCF组 | 106 | 66(11~93) | 66(62.3%) | 21(19.8%) | 7(6.6%) | 0 | 49(46.2%) | 22(20.8%) | 11(10.4%) | 20(18.9%) | 28(26.4%) | 47(44.3%) | 31(29.2%) | 14(13.2%) | 18(17%) | 22(20.8%) | 16(15.1%) | 25(23.6%) | 28(26.4%) | 8(7.5%) | 10(9.4%) | |||
| P值 | 0.243 | 0.504 | 0.017 | 0.28 | - | 0.005 | 0.024 | 0.732 | 0.104 | 0.21 | 0.022 | 0.124 | 1 | 0.014 | 0.805 | 0.002 | 0.221 | 0.848 | 0.007 | 0.061 | ||||
2.2 标本来源分布情况
CRCF主要来源于肝胆外科;检出标本以血液多见,占62.5%,差异具有统计学意义,详见表 3。
| 分组 | 科室分布 | 标本类型 | ||||||||
| 血液内科 | 肝胆外科 | 泌尿外科 | 老年科 | 其他科室 | 血液 | 尿液 | 脓液+伤口分泌物 | 痰、气管导管 | ||
| CRCF组 | 3(9.4%) | 15(46.9%) | 4(12.5%) | 4(12.5%) | 6(18.8%) | 20(62.5%) | 6(18.8%) | 5(15.6%) | 1(3%) | |
| NCRCF组 | 0(0%) | 16(15.1%) | 16(15.1%) | 8(7.5%) | 66(62.3) | 2(1.8%) | 49(46.2) | 46(43.4%) | 9(8.5%) | |
| P值 | - | 0 | 1 | 0.473 | - | 0 | 0.005 | 0.004 | 0.453 | |
2.3 CRCF感染相关危险因素
CRCF组32例患者和NCRCF组106例患者单因素分析显示,经验性使用碳青霉烯类抗生素、肝胆疾病、腹部感染、手术和肿瘤等因素的存在与CRCF的感染相关;进一步进行多因素Logistic回归分析,结果显示手术和肿瘤是CRCF感染的独立危险因素。详见表 4、表 5。
| 因素 | OR(95%CI)值 | P值 |
| 年龄0~40(岁) | 2.090(0.471~9.269) | 0.387 |
| 年龄41~60(岁) | 1.514(0.669~3.425) | 0.318 |
| 年龄>=61(岁) | 0.493(0.222~1.097) | 0.080 |
| 性别 | 1.333(0.573~3.102) | 0.504 |
| 手术 | 2.769(1.181~6.492) | 0.017 |
| 合并其他耐碳青霉烯类细菌感染 | 2.020(0.552~7.400) | 0.280 |
| 高血压 | 0.351(0.140~0.883) | 0.022 |
| 糖尿病 | 0.516(0.181~1.470) | 0.210 |
| 心脏病 | 0.448(0.158~1.270) | 0.124 |
| 肺部疾病 | 0.939(0.286~3.083) | 1.000 |
| 肾脏疾病 | 0.881(0.323~2.405) | 0.805 |
| 肝胆疾病 | 2.933(1.220~7.051) | 0.014 |
| 肿瘤 | 3.849(1.591~9.311) | 0.002 |
| 泌尿生殖道来源 | 0.268(0.102~0.706) | 0.005 |
| 腹部感染来源 | 2.612(1.120~6.096) | 0.024 |
| 胸部感染来源 | 0.576(0.121~2.744) | 0.732 |
| 皮肤软组织感染来源 | 0.287(0.063~1.300) | 0.104 |
| 头孢菌素类 | 1.090(0.451~2.637) | 0.848 |
| 碳青霉烯类 | 4.083(1.391~11.986) | 0.007 |
| 联合用药 | 2.688(0.930~7.770) | 0.061 |
| 注:OR:优势比;CI:可信区间 | ||
| 因素 | B | SE | Wals | P值 | OR(95%CI)值 |
| 肝胆疾病 | 0.172 | 0.644 | 0.071 | 0.789 | 1.188(0.336~4.021) |
| 腹部感染 | 0.032 | 0.636 | 0.002 | 0.960 | 1.032(0.297~3.588) |
| 手术 | 1.078 | 0.474 | 5.167 | 0.023 | 2.938(1.160~7.441) |
| 肿瘤 | 1.400 | 0.483 | 8.399 | 0.004 | 4.057(1.574~10.458) |
| 碳青霉烯类 | 1.055 | 0.590 | 3.196 | 0.074 | 2.873(0.903~9.136) |
| B:相关系数; SE:标准误; Wals:统计量; OR:优势比;CI:可信区间; | |||||
2.4 CRCF组和NCRCF组的药敏试验结果
CRCF菌株以多重耐药为显著特点,对临床常用的抗生素高度耐药,耐药性均高于NCRCF组,详见表 6。
| 分组 | 亚胺 培南 |
美洛 培南 |
头孢 噻肟 |
头孢 他啶 |
氨曲南 | 哌拉西林/ 他唑巴坦 |
庆大 霉素 |
环丙 沙星 |
妥布 霉素 |
复方新 诺明 |
左旋氧 氟沙星 |
阿米 卡星 |
|
| CRCF组(n=32) | 耐药 | 100.0 | 100.0 | 100.0 | 100.0 | 68.8 | 65.4 | 81.2 | 75.0 | 62.5 | 55.2 | 43.8 | 31.2 |
| 敏感 | 0.0 | 0.0 | 0.0 | 0.0 | 31.2 | 23.1 | 18.8 | 15.6 | 28.1 | 24.1 | 25.0 | 68.8 | |
| NCRCF组(n=106) | 耐药 | 0.0 | 0.0 | 39.6 | 29.5 | 30.2 | 4.8 | 30.2 | 20.8 | 12.3 | 38.0 | 13.3 | 1.9 |
| 敏感 | 100.0 | 100.0 | 58.5 | 69.5 | 67.9 | 85.5 | 68.9 | 65.1 | 69.8 | 52.0 | 72.4 | 98.1 |
2.5 耐碳青霉烯类弗劳地枸橼酸杆菌MLST结果
结果显示CRCF菌株一共有7个克隆型,以ST22(n=9)和ST115(n=9)型多见,本研究发现ST115和ST116两种新的克隆型。详见表 7。
| MLST(STs) | MLST等位基因谱型 (aspC-clpX-fadD-mdh-arcA-dnaG-lysP) |
株数 | 构成比 (%) |
| ST22 | 15-12-20-15-5-11-17 | 9 | 34.6 |
| ST115(new) | 63-62-71-5-1-1-57 | 9 | 34.6 |
| ST116(new) | 16-12-7-10-5-55-5 | 3 | 11.5 |
| ST91 | 48-10-14-13-32-6-11 | 2 | 7.7 |
| ST118 | 64-63-33-6-5-22-14 | 1 | 3.8 |
| ST79 | 43-22-50-41-29-38-42 | 1 | 3.8 |
| ST63 | 56-50-57-47-33-45-16 | 1 | 3.8 |
2.6 耐碳青霉烯类弗劳地枸橼酸杆菌PFGE结果
PFGE一共分为6个型,结果显示部分科室同年同时间段相继检出相应同克隆群高度同源性菌株。结果详见图 1。
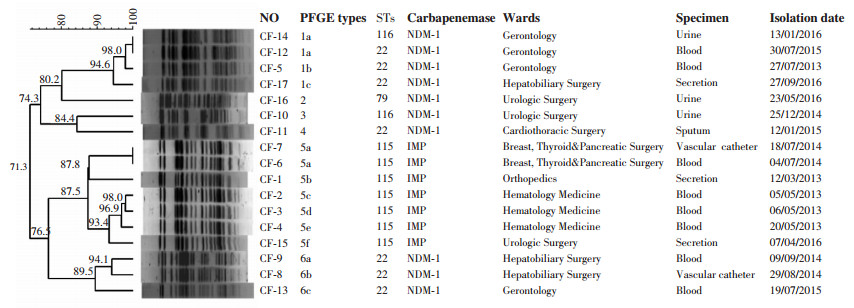
|
| 图 1 耐碳青霉烯类弗劳地枸橼酸杆菌PFGE结果 |
3 讨论
近年来,弗劳地枸橼酸杆菌检出率呈逐年增加趋势,且碳青霉烯类耐药菌株临床分离率不断增加,并呈现出多重耐药的特性[3, 5-6],这不得不引起临床医生的足够重视。近5年我院的CRCF临床分离率显著高于同期国内平均水平,为探讨导致CRCF在我院高流行的原因,本研究对我院临床分离的CRCF感染相关危险因素及同源性特征进行分析。
单因素危险因素分析结果显示,经验性使用碳青霉烯类抗生素、肝胆疾病、腹部感染、手术和肿瘤等因素的存在与CRCF的感染相关。本研究中几乎所有患者均接受了经验性抗生素治疗,CRCF感染患者以头孢菌素类和碳青霉烯类经验性抗生素治疗为主。研究报道[7-10],碳青霉烯类抗生素、喹诺酮类抗生素的使用是CRE感染的独立危险因素,在大剂量抗生素暴露情况下患者CRCF的感染风险增加。多因素Logistic回归分析结果显示手术和肿瘤是CRCF感染的独立危险因素,可能与肿瘤或手术后患者机体抵抗力下降相关,导致CRCF的感染风险增加。因此对于肿瘤患者及进行手术尤其是腹部手术后患者应加强CRCF感染的监测和控制,同时增强患者免疫功能,以改善患者预后及减轻患者经济负担。
本研究采用MLST和PFGE的方法对CRCF菌株进行分子流行病学分析。MLST结果显示CRCF菌株一共有7个克隆型,各型之间均无亲缘关系,其中以ST22(n=9)和ST115(n=9)型最为多见,为本院CRCF感染优势克隆型;本研究发现12株细菌的基因型与数据库中基因型不吻合,数据资料提交数据库(http://pubmlst.org/cfreundii/)后确定为新发现基因型,经分配后分别命名为ST115和ST116。
PFGE一共分为6个型,PFGE与MLST分型结果基本保持一致,PFGE与MLST分型结果均显示在部分科室中同年同时间段内相继检出相应同克隆群高度同源性菌株,且同科室检出菌株相隔时间较近,其余均为散发。查找病人资料对菌株进行溯源,发现这些病人大多是肿瘤患者或是手术后患者,且其中8例患者有长时间留置动静脉导管的记录,部分患者合并其他耐碳青霉烯类细菌感染。前期研究表明[11],其中17株菌株均产金属β-内酰胺酶,有8株菌产blaNDM-1,本研究结果显示这8株菌株均为散发,无爆发流行趋势,追溯其病史,均未发现有国外旅游史。分析CRCF感染和获得耐药基因的原因可能为:①肿瘤和手术是CRCF菌株感染的独立危险因素,患者机体抵抗力下降,加之长时间留置静脉导管,使得同科室同时期相邻病床患者感染同克隆群高度同源性菌株;②研究报道[12-14],耐药基因定位于质粒上,耐药基因可能通过质粒介导的传播方式进行水平传播。本研究中有12.5%患者合并感染其他耐碳青霉烯类鲍曼不动杆菌和铜绿假单胞菌,CRCF菌株的耐药基因可能由患者自身感染这些菌株传播而来。
本院为综合三甲医院,院内收住病人病情危重;手术患者、肿瘤患者多且基础情况较差;重症及高危患者大剂量使用抗生素及留置静脉导管现象较普遍;根据上述危险因素及分子流行病学结果显示肿瘤和手术是CRCF感染的独立危险因素,而大剂量使用抗生素、长期留置静脉导管增加了CRCF的易感性。可能由于这些原因导致我院CRCF临床分离率显著高于同期国内平均水平。
因此,各医院应加强耐药菌株尤其是优势菌株的预防、检测与监控工作,加强高危患者尤其是手术后患者、肿瘤患者及大剂量使用抗生素患者的检测与监测,并采取有效的防控措施,如加强医护人员的手卫生,对所使用的医疗器械如静脉导管等及时按要求严格消毒、更换等,从而减少耐药菌株的出现和播散流行。
| [1] | HAMMERUM A M, HANSEN F, NIELSEN H L, et al. Use of WGS data for investigation of a long-term NDM-1-producing Citrobacter freundii outbreak and secondary in vivo spread of blaNDM-1 to Escherichia coli, Klebsiella pneumoniae and Klebsiella oxytoca[J]. J Antimicrob Chemother, 2016, 71(11): 3117–3124. DOI:10.1093/jac/dkw289 |
| [2] | WANG J T, WU U I, LAUDERDALE T L, et al. Carbapenem-nonsusceptible Enterobacteriaceae in Taiwan[J]. PLoS ONE, 2015, 10(3): e0121668. DOI:10.1371/journal.pone.0121668 |
| [3] |
刘淑敏, 杜娜, 刘嘉欣, 等. 2012年至2014年耐碳青霉烯类弗氏柠檬酸杆菌的分布与耐药性[J].
昆明医科大学学报, 2016, 37(8): 35–38.
LIU S M, DU N, LIU J X, et al. Distribution and drug resistance of carbapenem-resistant citrobacter freundii from 2012 to 2014[J]. J Kunming Med Univ, 2016, 37(8): 35–38. DOI:10.3969/j.issn.1003-4706.2016.08.008 |
| [4] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J].
中国感染与化疗杂志, 2018, 18(3): 241–251.
HU F P, GUO Y, ZHU D M, et al. CHINET 2017 surveillance of bacterial resistance in China[J]. Chin J Infec Chemoth, 2018, 18(3): 241–251. DOI:10.16718/j.1009-7708.2018.03.001 |
| [5] | CHEN S, HU F, LIU Y, et al. Detection and spread of carbapenem-resistant Citrobacter freundii in a teaching hospital in China[J]. American Journal of Infection Control, 2011, 39(9): e55–e60. DOI:10.1016/j.ajic.2011.02.009 |
| [6] |
许建成, 周琪, 刘韶晖, 等. 连续5年临床分离弗劳地枸橼酸杆菌的耐药变迁[J].
现代预防医学, 2009, 36(9): 1741–1742.
XU J C, ZHOU Q, LIU S H, et al. Changes of drug resistance of citrobacter freundii isolated during past 5 years[J]. Modern Preventive Medicine, 2009, 36(9): 1741–1742. |
| [7] | WANG Z, QIN R R, HUANG L, et al. Risk factors for carbapenem-resistant klebsiella pneumoniae infection and mortality of klebsiella pneumoniae infection[J]. Chin Med J, 2018, 131(1): 56–62. DOI:10.4103/0366-6999.221267 |
| [8] | GAGLIOTTI C, GIORDANI S, CICCARESE V, et al. Risk factors for colonization with carbapenemase-producing Klebsiella pneumoniae in hospital: a matched case-control study[J]. Am J Infect Control, 2014, 42(9): 1006–1008. DOI:10.1016/j.ajic.2014.05.028 |
| [9] |
周静芳, 凌勇, 刘伟江, 等. 耐碳青霉烯类肠杆菌科细菌的感染特征和危险因素分析[J].
中华医院感染学杂志, 2017, 27(1): 16–19.
ZHOU J F, LING Y, LIU W J, et al. Characteristics and risk factors for carbapenem-resistant Enterobacteriaceae infection[J]. Chin J Nosocomiol, 2017, 27(1): 16–19. |
| [10] | SWAMINATHAN M, SHARMA S, POLIANSKY BLASH S, et al. Prevalence and risk factors for acquisition of carbapenem-resistant Enterobacteriaceae in the setting of endemicity[J]. Infect Control Hosp Epidemiol, 2013, 34(8): 809–817. DOI:10.1086/671270 |
| [11] |
向丹, 张利军, 周先玉, 等. 耐碳青霉烯类弗劳地枸橼酸杆菌耐药机制及治疗策略研究[J].
重庆医学, 2017, 46(26): 3635–3637+3640.
XIANG D, ZHANG L J, ZHOU X Y, et al. Study on drug resistance mechanism in carbapenem-resistant Citrobacter freundii and treatment strategies[J]. Chongqing Med, 2017, 46(26): 3635–3637+3640. DOI:10.3969/j.issn.1671-8348.2017.26.012 |
| [12] | WANG X, CHEN G, WU X, et al. Increased prevalence of carbapenem resistant Enterobacteriaceae in hospital setting due to cross-species transmission of the bla NDM-1 element and clonal spread of progenitor resistant strains[J]. Front Microbiol, 2015, 6: 595. DOI:10.3389/fmicb.2015.00595 |
| [13] | YANAT B, RODR GUEZ-MART NEZ J M, TOUATI A. Plasmid-mediated quinolone resistance in Enterobacteriaceae: a systematic review with a focus on Mediterranean countries[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(3): 421–435. DOI:10.1007/s10096-016-2847-x |
| [14] | HE S, CHANDLER M, VARANI A M, et al. Mechanisms of evolution in high-consequence drug resistance plasmids[J]. mBio, 2016, 7(6). DOI:10.1128/mbio.01987-16 |



