2. 610083 成都, 西部战区总医院检验科
2. Department of Clinical Laboratory, the General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China
HU Xiaobing, E-mail: 18981715872@189.cn
人55型腺病毒(human adenovirus type 55,HAdV-55)属于人腺病毒的一种亚型,主要引起呼吸道感染,部分重症者发展为肺炎。该病毒最早于2006年3-4月发生在我国陕西省岐山县的一所中学,从此次疫情中分离出了HAdV-55的第一个毒株QS-DLL毒株[1]。杨朝辉等[1]通过PCR测序获取了QS-DLL的全基因核酸序列,基于序列分析发现QS-DLL分离株是基于HAdV-B14型基因组骨架嵌合HAdV-B11型Hexon部分片段的重组病毒。近几年我国多次发生HAdV-55感染疫情,无论是社区还是人员相对聚集的场所如学校、部队等,HAdV-55都是引起呼吸道感染的主要病原体之一[2-5]。2016年1-3月,西藏某部发生HAdV-55感染疫情,这是55型腺病毒在高原上首次引起大规模感染病例。我们从这次感染者咽拭子标本中分离了腺病毒毒株LS89/Tibet/2016,并对其全基因序列进行了分析,发现该毒株与之前我国报道的毒株相比并未产生较大的变异[6]。目前GenBank数据库中公布的HAdV-55全基因序列已有十几条,其中3条是我们于2016年分离的毒株序列[7]。2017年冬季至2018年春季,成都周边部队营区内发生了多起HAdV-55感染疫情,我们从不同营区感染者分离了腺病毒毒株,并进行全基因测序,获取了多个HAdV-55毒株的全基因序列。通过构建系统发育进化树,分析其基因变异特点,阐明其分子流行病学特征,为病毒进化及溯源提供有价值的参考数据。
1 材料与方法 1.1 实验材料人喉癌上皮细胞HEp-2由中科院细胞库提供,由本实验室保存培养,培养于含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的DMEM培养液,37 ℃,5% CO2饱和湿度培养箱中。GIBCO胎牛血清、DMEM、青/链霉素、Invitrogen PureLinkTM Viral RNA/DNA Mini Kit购自赛默飞世尔科技(中国)有限公司;引物合成和测序由成都擎科梓熙生物技术有限公司完成;生化试剂购自上海生工生物工程有限公司;TransStart Taq DNA Polymerase购自北京全式金生物技术有限公司。
咽拭子标本采集自2017年12月-2018年3月西南地区部队55型腺病毒感染病例。
1.2 细胞培养与病原分离在BSL-2实验室接种HEp-2细胞于24孔板内,接种密度2.5×105个/孔,培养24 h,弃去原培养基,PBS洗细胞3次,每孔加入0.5 mL的2%的DMEM培养基,并加入确诊患者的咽拭子标本100 μL(对于病毒水平较低的咽拭子标本可加大接种剂量),37 ℃孵箱内培养并逐日观察细胞病变(cytopathogenic effect,CPE)情况,细胞密度达到100%之后按照1 :4的比例进行传代,持续培养,当75%以上的细胞出现典型CPE时,收集细胞上清,分装保存。采用荧光定量PCR方法对培养物上清进行检测,引物和探针序列如下,AdV-F:5′-TTTGAGGTYGAYCCCATGGA-3′,AdV-R:5′-AGAASGGTGTRCGCAGGTA-3′,AdV-probe:5′-FAM- ACCACGTCGAARACTTCGAA-BHQ1-3′。
1.3 病毒DNA提取采用Invitrogen PureLinkTM Viral RNA/DNA Mini Kit提取上述病毒分离液的腺病毒DNA,具体操作参照说明书进行。
1.4 病毒基因组序列的获取参照我们之前报道的腺病毒全基因序列获取方法[8],以提取的腺病毒DNA为模板,PCR反应扩增覆盖HAdV-55全基因的12个基因片段。反应体系如下:TransStart Taq 0.5 μL,10× buffer 5 μL,dNTP(2.5 mmol/L)4 μL,上游引物1 μL,下游引物1 μL,灭菌水36.5 μL,模板DNA 2 μL,混匀。PCR反应条件如下:98 ℃ 3 min,98 ℃ 10 s,55 ℃ 15 s,72 ℃ 1 min 20 s,30 cycles,72℃ 5 min。PCR产物利用1%琼脂糖凝胶电泳判断结果。PCR阳性产物交由成都擎科梓熙生物技术有限公司进行测序。
1.5 序列分析用生物信息学分析软件-MEGA6.06,对获得的腺病毒基因组序列进行分析和标注,分析完成后提交至GenBank数据库。从GenBank数据库下载已发布的HAdV-55全基因序列,与本研究获取的序列进行比对分析,采用邻位相连法(Neighbor-joining)构建系统发育进化树。
2 结果 2.1 HAdV-55病毒株的分离鉴定采用腺病毒敏感细胞系人喉癌细胞HEp-2分离腺病毒,设立HAdV-55阳性咽拭子标本接种组、HAdV-55阴性咽拭子标本接种组和未接种咽拭子标本细胞对照组。24-1和1806003接种组接种2 d后部分细胞开始出现膨大、变圆、脱落等,接种后3 d细胞出现明显CPE,40%的细胞出现CPE,接种后第4天80%的细胞出现CPE,收集细胞上清,暂存-80 ℃冰箱。24-2和1804001接种3天后细胞未见CPE,细胞密度达到100%,进行细胞传代,从24孔板传至6孔板中,传代后细胞生长2 d部分细胞开始出现病变,持续观察,当75%以上的细胞出现CPE收集细胞上清保存。DYN样本接种组接种后3天,未见CPE,由24孔传入6孔板,再生长3 d仍未见CPE,传至24T细胞培养瓶中,传代后2 d细胞出现大量死亡,第3天90%的细胞出现CPE,收集上清保存。HAdV-55阴性咽拭子标本接种组和未接种咽拭子标本细胞对照组按照正常方式传代培养,逐日观察细胞状态,细胞自始至终生长良好。图 1为咽拭子接种不同时间点HEp-2细胞生长状况。
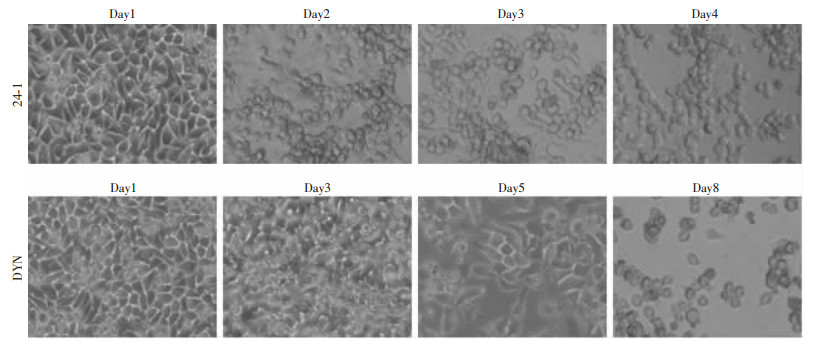
|
| 图 1 24-1和DYN咽拭子接种细胞生长状态观察(相差显微镜×100) |
取收集的5株1代病毒100 μL,分别感染新接种的24T瓶HEp-2细胞,感染第3天,各组80%以上的细胞均出现CPE,收集上清,分装保存,即获得2代病毒。取5 μL 2代病毒作为模板,荧光定量PCR检测,结果如图 2所示,5株2代病毒检测结果均为HAdV-55阳性。
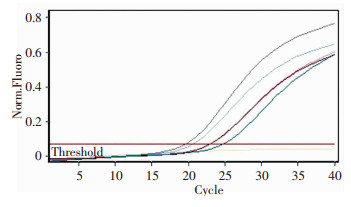
|
| 图 2 2代培养物上清荧光定量PCR检测结果 |
2.2 HAdV-55的全基因序列扩增
抽提24-1株、24-2株、1 804 001株、1 806 003株、DYN株病毒的DNA,对其进行分段PCR扩增,分段策略及对应的PCR扩增引物和测序引物见参考文献[8],PCR反应体系和反应条件如方法部分所述,24-1株PCR产物电泳如图 3所示,其他4株病毒PCR产物与24-1株类似。回收各片段进行测序,12段序列拼接即获得5株HAdV-55全基因序列,提交至GenBank数据库,基因登录号见表 1所示。
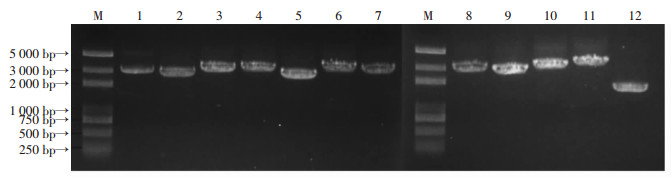
|
| M为DNA maker 2000,1-12为12个PCR产物 图 3 24-1株HAdV-55 PCR产物经1%琼脂糖凝胶电泳检测 |
| 病毒株 | 分离时间 | 地点 | 基因登录号 |
| SGN1222 | 2005 | 新加坡 | FJ597732 |
| QS-DLL | 2006 | 陕西岐山 | FJ643676 |
| CQ-814 | 2010 | 重庆 | JX123027 |
| CQ-1657 | 2011 | 重庆 | JX123028 |
| CQ-2903 | 2012 | 重庆 | JX123029 |
| P14 | 2011 | 北京 | JX491639 |
| Hebei/BD6728/2013 | 2013 | 河北保定 | KJ883520 |
| Shanxi/QZ01/2011 | 2011 | 陕西 | KJ883522 |
| Hebei/BD6729/2013 | 2013 | 河北保定 | KJ883521 |
| LS89/Tibet/2016 | 2016 | 西藏拉萨 | KY002683 |
| SF04/SC/2016 | 2016 | 四川什邡 | KY002684 |
| KM03/YN/2016 | 2016 | 云南昆明 | KY002685 |
| 24-1/Sichuan/2018 | 2018 | 四川成都 | MH256653 |
| 24-2/Sichuan/2018 | 2018 | 四川成都 | MH256654 |
| 1804001/Sichuan/2018 | 2018 | 四川成都 | MH256655 |
| 1806003/Sichuan/2018 | 2018 | 四川成都 | MH256656 |
| DYN/Sichuan/2018 | 2018 | 四川成都 | MH256657 |
2.3 序列比对
为进一步分析成都周边HAdV-55的遗传变异特点及分子进化关系,在GenBank数据库中检索HAdV-55基因组DNA序列,一共获得17条序列,其中3条序列为2016年我们分离的病毒序列[7],5条为本研究获取的序列。采用邻位相连法(Neighbor-joining)构建系统发育进化树,如图 4所示,这5株新分离株均与QS-DLL株及重庆的分离株CQ-2903株相近,与2016年分离的三株HAdV-55毒株(LS89/Tibet/2016、SF04/SC/2016和KM03/YN/2016)的遗传进化距离相对较远,说明2018年成都周边驻地部队流行的55型腺病毒为QS-DLL株或重庆分离株CQ-2903株的突变株。

|
| 序列名称后括号内依次为基因登录号,分离地区和分离时间 图 4 基于腺病毒基因组全长DNA序列的系统发育进化树 |
进一步对各病毒株基因突变位点进行分析,发现2018年新分离的5株病毒株之间序列差异较小,仅有16处碱基变异。与我国报道的第一株55型腺病毒QS-DLL株和重庆株(CQ-2903)序列相比,有30处碱基变异(见图 5)。
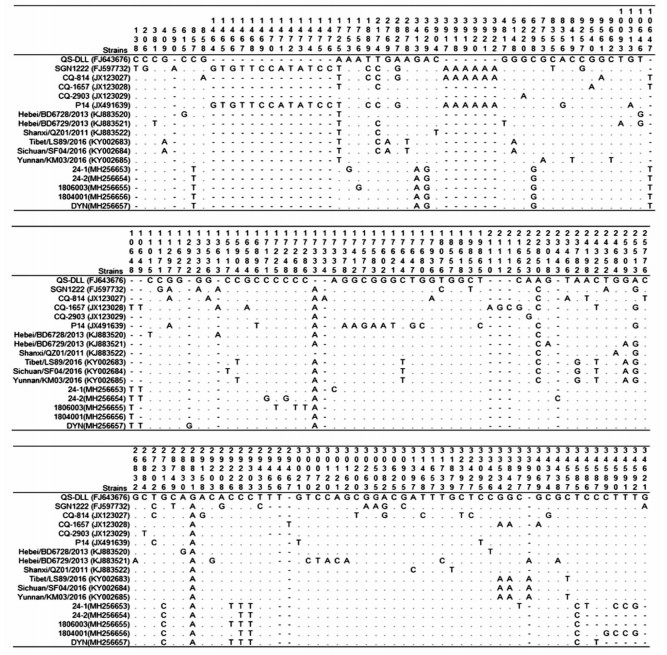
|
| 图 5 各毒株突变位点分析(与QS-DLL毒株相比) |
3 讨论
人55型腺病毒(human adenovirus type 55,HAdV-55)首次在我国报道,2006年3-4月中国陕西岐山县某中学发生聚集性呼吸道感染病例,当时认为此次暴发的病原体为HAdV-11a,杨朝辉在其2009年的硕士毕业论文中[1],分离了引起此次感染的病原体毒株,即QS-DLL株,对毒株全基因序列进行分析发现,QS-DLL分离株的核酸序列除了DNA多聚酶、pVI和pTP,其他片段与腺病毒14型毒株(AY803294)有很高的同源性(>98.3%)。随后,中外研究人员通过生物信息学对病毒进行重新鉴定,该毒株被命名为HAdV- B55型[9],这是我国第一次爆发55型腺病毒感染的疫情。
近几年,HAdV-55感染的疫情在我国时有发生,而且多发生在营区、学校等场所。2012年,河北保定某部发生55型腺病毒感染疫情,保定疫情的腺病毒毒株序列与2006年陕西岐山疫情同属一个分支,病毒基因序列碱基发生部分位点点突变,但总体变异不大。
2014年北京多家单位对成人腺病毒肺炎流行情况进行了调查研究,发现HAdV-55感染是成人社区获得性肺炎的重要病因之一。Lu等[2]收集了2009-2012年重庆地区急性呼吸道感染住院儿童鼻咽分泌物标本2 234例,其中191例检测为腺病毒,占比8.55%。阳性标本中,6例为HAdV-55,占3.1%(6/191)。提示无论是成人还是儿童,HAdV-55已成为社区急性呼吸道感染的主要病原体之一。
部队营区由于人员相对封闭密集,也是腺病毒的高发地。近几年我们也参与处置了多次部队HAdV-55感染疫情,2016年我们分别从西藏、四川以及云南等地的感染病例分离了HAdV-55毒株,其中西藏感染疫情是HAdV-55首次在高原地区引起聚集性感染的报道,西藏地区高原低压缺氧环境可能加重呼吸道感染症状,然而大部分感染者以轻症为主,少数发展为肺炎[10]。对其分离株LS89/Tibet/2016毒株全基因序列进行分析,与之前内地报道的毒株序列如QS-DLL等相比未出现片段重组和大规模基因变异,目前仍不清楚该毒株的最初起源,疫情驻地周边普通人群也没有感染HAdV-55的病例报道,HAdV-55在当地的流行现状尚不明确。
根据分子进化树分析结果,结合本研究获取的5株HAdV-55全基因序列分析结果,成都周边部队流行的HAdV-55毒株主要为QS-DLL类似株,发现虽然HAdV-55在我国出现了十余年,但其基因序列总体上没有产生大的变异。但由于HAdV-55毒株是由HAdV-11和HAdV-14型病毒重组而来,不能确定以后该毒株是否会再次发生新的重组,因此加强监测仍是最为有效的手段,另外腺病毒宿主广泛,HAdV-55毒株是否存在自然疫源地和自然疫源动物还没有人做过调查,这方面的研究也是今后需要加强的方向。
| [1] |
杨朝辉.人腺病毒11a型的全基因序列测定及分析研究[D].兰州: 兰州大学, 2009.
YANG Z H. The complete genome sequencing and relative analysis on the human adenovirus serotype 11a[D]. Lanzhou: Lanzhou University, 2009. |
| [2] | LU Q B, TONG Y G, WO Y, et al. Epidemiology of human adenovirus and molecular characterization of human adenovirus 55 in China, 2009-2012[J]. Influenza Other Respir Viruses, 2014, 8(3): 302–308. DOI:10.1111/irv.12232 |
| [3] | CAO B, HUANG GH, PU ZH, et al. Emergence of community-acquired adenovirus type 55 as a cause of community-onset pneumonia[J]. Chest, 2014, 145(1): 79–86. DOI:10.1378/chest.13-1186 |
| [4] | SUN B, HE H, WANG Z, et al. Emergent severe acute respiratory distress syndrome caused by adenovirus type 55 in immunocompetent adults in 2013: a prospective observational study[J]. Crit Care, 2014, 18(4): 456. DOI:10.1186/s13054-014-0456-6 |
| [5] | LI X, KONG M, SU X, et al. An outbreak of acute respiratory disease in China caused by human adenovirus type B55 in a physical training facility[J]. Int J Infect Dis, 2014, 28: 117–122. DOI:10.1016/j.ijid.2014.06.019 |
| [6] |
王文博, 刘媛, 周奕帆, 等. 高原地区55型腺病毒的病原分离及全基因序列分析[J].
军事医学, 2017, 41(6): 453–456.
WANG W B, LIU Y, ZHOU Y F, et al. Pathogen isolation and whole-genome sequence analysis of human adenovirus type 55 outbreak on plateaus[J]. Mil Med Sci, 2017, 41(6): 453–456. |
| [7] | WANG W B, LIU Y, ZHOU Y, et al. Whole-genome analyses of human adenovirus type 55 emerged in Tibet, Sichuan and Yunnan in China, in 2016[J]. PLoS ONE, 2017, 12(12): e0189625. DOI:10.1371/journal.pone.0189625 |
| [8] |
刘媛, 王文博, 邹自英, 等. 快速获取55型腺病毒基因组序列的方法[J].
微生物学通报, 2017, 44(11): 2708–2713.
LIU Y, WANG W B, ZOU Z Y, et al. Rapid acquisition of complete viral genome sequence of human adenovirus type 55[J]. Microbiology, 2017, 44(11): 2708–2713. |
| [9] | WALSH M P, SETO J, JONES M S, et al. Computational analysis identifies human adenovirus type 55 as a re-emergent acute respiratory disease pathogen: FIG. 1[J]. J Clin Microbiology, 2009, 48(3): 991–993. DOI:10.1128/jcm.01694-09 |
| [10] |
赵瑞臣, 高文文. 高原92例成人B组55型腺病毒感染治疗浅析[J].
华南国防医学杂志, 2016(7): 470–471.
ZHAO R C, GAO W W. Analysis of treatment of type 55 adenovirus infection in 92 adults with plateau[J]. Mil Med J South China, 2016(7): 470–471. |



