肝细胞癌是世界上发病率第6位和死亡率第2位的恶性肿瘤[1-2]。尽管有很多治疗手段可以用来治疗肝细胞癌,包括非手术治疗(射频消融,经肝动脉介入化疗栓塞)和手术治疗(肝切除和肝移植),但肝切除才是肝细胞性肝癌的一线治疗方法[3-4]。有研究证明早期彻底的解剖性肝切除能提高肝细胞癌患者的总体生存率和无病生存率[5-7]。在过去的20年,由于手术技术,麻醉技术及对肝癌患者围术期的管理方面的进步使得肝癌切除手术的安全性得到很大的提高,大大降低了手术的死亡率[8]。因此位于肝脏Ⅵ段的肝硬化肝细胞癌患者应该优先采用肝切除的治疗方式。对位于第Ⅵ段肝硬化肝细胞癌的患者,有多种肝切除的手术方式可以选择,包括局部肝切除(楔形切除和解剖性Ⅵ段切除)和扩大切除(右后叶切除和右半肝切除)。然而,有些文献报道和解剖性肝切除相比,由于没有解剖性的切除肿瘤可能侵犯的门脉系统,行楔形切除的肝癌患者通常表现出更短的生存时间和更高的复发率[9-10]。由于切除了大量的有功能的肝组织导致术后残余肝体积过小,行扩大肝切除的肝癌患者更容易发生术后肝功能衰竭,有研究报道行扩大肝切除肝癌患者术后肝功能衰竭的发生率为8%[11]。到目前为止,尚无研究比较了位于肝脏Ⅵ段肝硬化肝细胞癌患者采用不同肝切除方式的围术期结果及肿瘤总体生存率(OS)和无病生存率(DFS)结果。因此,对于肝脏Ⅵ段肝硬化肝细胞癌患者,一线肝切除方式仍不清楚,本研究就针对此问题展开了研究。同时,我们对影响肝癌患者的预后相关因素进行了分析。
1 资料和方法 1.1 纳入标准① 病理诊断为肝细胞癌和肝硬化。②肿瘤位于肝脏第Ⅵ段并通过术前影像学检查及术中确认。③采用楔形肝切除或者Ⅵ段肝切除或者右后叶切除或者右半肝切除。
1.2 排除标准① 病理诊断为胆管细胞癌,混合性肝癌,肝脏良性疾病和肝转移癌。②肝功能为Child-Pugh B/C级。③合并有其他系统严重的并发症。
1.3 纳入病例的诊断及手术方式回顾性分析了从2008年12月至2016年12月在中南大学湘雅二医院肝胆胰外科行肝切除治疗的2 450位肝硬化肝细胞癌患者,根据纳入及排除标准,最终有210位患者纳入了研究。210位患者由132位男性和78位女性组成。210位患者根据采用的手术方式分为局部切除组(包括楔形切除组和Ⅵ段切除组)和扩大切除组(右后叶切除组和右半肝切除)两个大组和楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除4个小组。所有患者术前都常规检查AFP, 肝功能,HBV及HCV血清学标志物,术前影像学检查包括腹部彩超,肝脏CT,其中行肝脏CT的目的是用来确认肿瘤的位置及肿瘤与邻近血管的关系,见图 1。当肝脏CT不能明确肝癌诊断时,通常加用肝脏MRI来明确诊断。
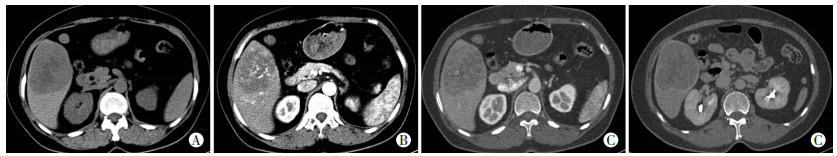
|
| A:平扫期,B:动脉期,C:门脉期,D:平衡期 图 1 第Ⅵ段肝硬化肝细胞癌患者CT影像学表现 |
1.4 随访
术后病人均进行了常规随访,每1-2个月复查AFP, 肝功能,HBV病毒载量。每3个月复查一次腹部彩超,每6个月或者考虑肿瘤复发时复查肝脏CT或MRI。术后肿瘤复发主要通过肝脏CT或MRI的影像学表现诊断,术后复发的病人无法行肝切除的则采用射频消融或经肝动脉介入化疗栓塞,能行肝切除的病人则采用肝切除[12]。如果经济负担的起,则建议服用索拉菲尼。
1.5 手术指征位于肝脏第Ⅵ段的肝硬化肝细胞癌患者肝切除方式的选择主要取决于肿瘤与周围血管的关系和残余肝功能。当肿瘤局限肝脏第Ⅵ段,且未侵犯周围血管时采用解剖性Ⅵ段肝切除。当肿瘤侵犯邻近肝段或者邻近肝叶的glissionean鞘时则采用右后叶切除或者是右半肝切除。对于残余肝功能的评价,采用了残余肝体积(%FLRV)及15分钟吲哚氰绿滞留试验(ICG15)。%FLRV的计算公式是%FLRV=残肝容量×100/(总肝体积-肿瘤体积)[13]。所有行肝切除的肝硬化肝细胞癌患者的%FLRV>40%。肝硬化肝癌患者可耐受的肝切除范围主要取决于ICG15的大小[14],当ICG15<10%时可行右半肝切除,当10%<ICG15<20%时可行右后叶切除,当20%<ICG15<30%时可行解剖性Ⅵ段肝切除,当30%<ICG15时只能行楔形切除[15]。
1.6 统计学方法统计分析软件包括spss 22,制图软件为Graph Pad Prism 7。分类变量采用卡方检验或Fisher确切概率法进行统计分析。连续性变量采用中位数(范围)来表示,采用student's t-test进行统计分析。OS及DFS采用Kaplan-Meier法和Log-Rank法进行统计分析,采用多变量Cox比例风险模型评估肝癌患者预后影响因素。P<0.05表示有统计学差异。
2 结果 2.1 患者基本临床特征楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除组所占的比例分别是22.4%(47), 44.3%(93), 19.5%(41), 13.8%(29)。在年龄(P=0.934),性别(P=0.889),肝功能Child-Pugh分级(P=1.341)方面,局部切除组(楔形切除组和Ⅵ段切除组)和扩大切除组(右后叶切除组和右半肝切除组)无明显统计学差异。和局部切除组相比,扩大切除组患者肿瘤直径更大(P=0.010),肿瘤数量更多(P<0.001),ICG15更低(P<0.001), HBV感染率更高(P=0.023),酒精肝数目更少(P<0.001),见表 1。
| 分组 | 例数 | 男性 /例(%) |
年龄 /岁 |
HBV阳性 /例(%) |
HCV阳性 /例(%) |
酒精肝 /例(%) |
肿瘤数目/例(%) | 肿瘤直 径/cm |
ICGR15% /例(%) |
||
| 1个 | ≥2个 | ||||||||||
| 局部切除组 | |||||||||||
| 总数 | 140 | 90(64.3) | 60(28-73) | 69(49.3) | 14(10) | 52(37) | 132(94.3) | 8(5.7) | 4.0(1-8) | 28.0(0-56) | |
| 楔形 | 47 | 29(61.7) | 59(32-73) | 14(29.8) | 5(10.6) | 14(29.8) | 47(100) | 0 | 3.5(1-7.8) | 30.0(1-56) | |
| Ⅵ段 | 93 | 61(65.6) | 63(28-70) | 55(59.1)b | 9(9.7) | 38(40.9)a | 85(91.4) | 8(6.5) | 4.2(3-8.9) | 22.0(0-31) | |
| 扩大切除组 | |||||||||||
| 总数 | 70 | 42(60) | 59(23-68) | 43(64.1)c | 7(10) | 11(15.7)d | 19(27.1)d | 51(72.9)d | 8.0(4-14.5)c | 7.7(1-22.4)d | |
| 右后叶 | 41 | 26(63.4) | 60(25-68) | 25(61) | 4(9.8) | 6(14.6) | 10(24.4) | 31(75.6) | 6.7(4-10) | 8.6(1-22.4) | |
| 右半肝 | 29 | 16(55.2) | 62(23-66) | 18(62.1) | 3(10.3) | 5(17.2) | 9(21) | 20(69) | 8.3(5-14.5) | 7.5(0-18) | |
| a: P<0.05, b:P<0.01, 与楔形切除组比较;c:P<0.05, d:P<0.01, 与局部切除组比较。因排除了Child Pugh分级为B、C级的病例,故本组病例Child Pugh分级均为A级,故未在表中赘述 | |||||||||||
2.2 患者围手术期情况
局部切除组的手术时间(P=0.024),术中出血(P<0.001),平均住院日(P=0.015), 术后并发症(P<0.001)及手术切缘(P<0.001)均少于扩大切除组。楔形切除组和Ⅵ段切除组就术中出血量(P=0.138),平均住院日(P=0.681)及术后并发症(P=0.172)方面没有统计学差异,楔形切除组的手术时间明显少于Ⅵ段切除组(P=0.025)。术后并发症局部切除组发生9例(6.4%),其中楔形切除组发生2例(4.3%),Ⅵ段切除组发生7例(7.5%),扩大切除组发生16例(22.85%),其中右后叶切除组发生7例(17%),右半肝切除组发生9例(31%),局部切除组术后并发症发率低于扩大切除组,差异有统计学意义(P<0.001)。术后并发症主要包括胸腔积液,胆漏,伤口感染以及腹水,上述并发症均通过保守治疗治愈。尽管所有肝癌患者都合并有肝硬化,没有患者发生严重的肝功能衰竭,也没有患者在围术期死亡。所有患者手术切切缘均为阴性并通过术后病检证实,在平均手术切缘方面,局部切除组VS扩大切除组是15 mm vs 35 mm,差异有统计学意义(P<0.001)。楔形切除组和Ⅵ段切除组在手术切缘方面差异有统计学意义(13 mm vs 17 mm P=0.041), 见表 2。术后肝功能指标(AST、ALT、TBil、DBil)分析结果显示,楔形切除均低于Ⅵ段切除,局部切除均低于扩大切除,P<0.05, 见表 3。
| 分组 | 例数 | 手术时 间/min |
失血量 /mL |
住院时 间/d |
手术切 缘/mm |
腹水/例 (%) |
胆漏/例 (%) |
胸水/例 (%) |
伤口感染 /例(%) |
|
| 局部切除组 | 总数 | 140 | 236(95-570) | 800(100-1800) | 10(5-14) | 15(5-23) | 1(0.7) | 3(2.1) | 2(1.5) | 3(2.1) |
| 楔形 | 47 | 175(95-210) | 400(100-800) | 6(5-10) | 13(5-16) | 0 | 0 | 1(2.1) | 1(2.1) | |
| Ⅵ段 | 93 | 296(160-570)a | 700(300-1 100) | 8(6-12) | 17(9-23)a | 1(1.1) | 3(3.2) | 1(1.1) | 2(2.1) | |
| 扩大切除组 | ||||||||||
| 总数 | 70 | 357(78-627)b | 1 500(300-3 300)c | 16(7-33)b | 35(15-46)c | 6(8.6)b | 4(5.7)b | 3(4.3)b | 3(4.3)b | |
| 右后叶 | 41 | 338(185-672) | 1 300(300-2 700) | 12(7-18) | 33(15-38) | 3(7.3) | 2(4.9) | 1(2.45) | 1(2.45) | |
| 右半肝 | 29 | 385(178-583) | 1 800(350-3 300) | 17(7-33) | 37(17-46) | 3(10.3) | 2(6.9) | 2(1.69) | 2(1.69) | |
| a: P<0.05, 与楔形切除组比较;b: P<0.05, c:P<0.01, 与局部切除组比较 | ||||||||||
| 分组 | 例数 | ALT | AST | 总胆红素 | 直接胆红素 | |
| 局部切除组 | 总数 | 140 | 124(59-156) | 145(33-158) | 78(28-125) | 58(21-93) |
| 楔形 | 47 | 95(62-148) | 88(33-137) | 68(31-115) | 51(25-76) | |
| Ⅵ段 | 93 | 134(59-156)a | 96(42-158) a | 75(28-125)a | 62(21-93) a | |
| 扩大切除组 | 总数 | 70 | 159(44-212)b | 167(38-227)b | 104(21-189)b | 89(25-167)b |
| 右后叶 | 41 | 135(45-198) | 148(38-195) | 89(21-183) | 64(28-149) | |
| 右半肝 | 29 | 161(44-212) | 172(41-227) | 96(32-189) | 79(25-167) | |
| a: P<0.05, 与楔形切除组比较;b: P<0.05, 与局部切除组比较 | ||||||
2.3 患者术后生存情况随访结果
所有患者均进行了随访,中位随访时间51个月(5~109个月)。楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除组1年复发率分别是59.6%,26.9%,31.71%,31.04%,3年复发率分别是78.73%,56.99%,55.34%,55.18%,5年复发率分别是85.11%,78.5%,73.18%,75.87%,楔形切除组的1,3,5年复发率明显高于Ⅵ段切除组,右后叶切除组及右半肝切除组(P<0.05), Ⅵ段切除组,右后叶切除组及右半肝切除组1,3,5年复发率差异无统计学意义(P>0.05)。复发病例局部切除组有52例行再次肝切除术(楔形切除组12例,Ⅵ段切除组40例),61例行非手术治疗的局部治疗(楔形切除组28例,Ⅵ段切除组33例),扩大切除组有14例行再次肝切除(右后叶切除组10例,右半肝切除组4例),38例行非手术治疗的局部治疗(右后叶切除组20例,右半肝切除组18例).楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除组1年死亡率分别是14.9%,7.88%,4.88%,3.45%,3年死亡率分别是31.92%,25.81%,29.27%,24.14%,5年死亡率分别是55.32%,33.34%,35.72%,34.49%,楔形切除组的1,3,5年死亡率明显高于Ⅵ段切除组,右后叶切除组及右半肝切除组(P<0.05), Ⅵ段切除组,右后叶切除组及右半肝切除组1,3,5年死亡率差异无统计学意义(P>0.05)。局部切除组有23例死于局部复发,14例死于远处转移,20例死于肝内转移,扩大切除组有5例死于局部复发,13例死于远处转移,7例死于肝内转移(表 4)。
| 分组 | 例数 | 复发率/% | 死亡率/% | 死亡原因/例(%) | 复发后治疗/例(%) | |||||||||||
| 1年 | 3年 | 5年 | 1年 | 3年 | 5年 | 局部复发 | 远处转移 | 肝内转移 | 再次肝切 | 局部治疗 | ||||||
| 局部切除组 | 总数 | 140 | 37.86 | 64.29 | 80.71 | 10.00 | 27.86 | 40.72 | 23(16.43) | 14(10) | 20(14.29) | 52(37.14) | 61(43.57) | |||
| 楔形 | 47 | 59.6 | 78.73 | 85.11 | 14.9 | 31.92 | 55.32 | 13(27.66) | 2(4.26) | 11(23.4) | 12(25.53) | 28(59.57) | ||||
| Ⅵ段 | 93 | 26.9b | 56.99b | 78.5a | 7.88b | 25.81a | 33.34b | 8(8.6)b | 14(15.05)b | 9(9.68)b | 40(43.01)b | 33(35.48)b | ||||
| 扩大切除组 | 总数 | 70 | 31.43c | 55.71c | 74.29c | 4.29d | 27.14c | 35.72c | 5(7.14)d | 13(18.57)d | 7(10)c | 14(20)d | 38(54.29)d | |||
| 右后叶 | 41 | 31.71 | 55.34 | 73.18 | 4.88 | 29.27 | 36.59 | 3(7.32) | 8(19.51) | 4(9.76) | 10(24.39) | 20(48.78) | ||||
| 右半肝 | 29 | 31.04 | 55.18 | 75.87 | 3.45 | 24.14 | 34.49 | 2(6.9) | 5(17.24) | 3(10.34) | 4(17.79) | 18(62.07) | ||||
| a: P<0.05, b:P<0.01, 与楔形切除组比较;c: P<0.05, d:P<0.01, 与局部切除组比较 | ||||||||||||||||
楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除组1年DFS分别是40.4%、73.1%、68.29%、68.96%,3年DFS分别是21.27%、43.01%、46.34、44.82%,5年DFS分别是14.89%、21.5%、26.82%、24.13%。楔形切除组,Ⅵ段切除组,右后叶切除组和右半肝切除组1年OS分别是85.1%、92.47%、95.12%、96.55%,3年OS分别是68.08%, 74.19%, 70.73% and 75.86%,5年OS分别是44.68%, 66.66%, 63.41% and 65.51%。楔形切除组的1.3.5年OS和DFS均低于第Ⅵ段切除组,右后叶切除组和右半肝切除组(P<0.05)。Ⅵ段切除组,右后叶切除组和右半肝切除组1.3.5年OS和DFS无明显差异(P>0.05),见图 2、3。
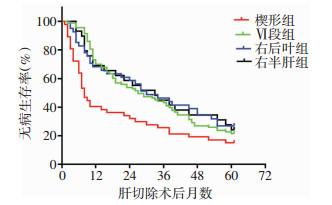
|
| 图 2 不同切除方式患者术后无病生存情况比较 |
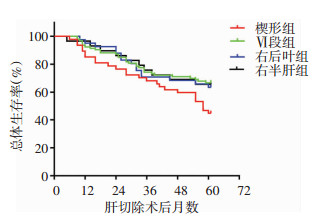
|
| 图 3 不同切除方式患者术后总生存情况比较 |
2.4 患者生存情况影响因素的回归分析结果
Cox多因素回归分析肝癌相关预后影响因素,结果发现Ⅵ段肝切除,右后叶肝切除,右半肝切除均是导致肝癌患者总体生存率和无病生存率增加的风险因素,死亡风险分别降低了0.44, 0.37, 0.39倍,复发风险分别降低了0.32, 0.52, 0.46倍,而楔形肝切除,肿瘤数目(≥2),肿瘤直径(≥5 cm)是降低总体生存率和无病生存率的危险因素,死亡风险分别增加了0.36, 0.73, 0.48倍,复发风险分别增加了0.69, 0.89, 0.61倍。其他指标与总体生存率及无病生存率无统计学关联,见表 5。
| 变量 | 总生存率 | 无病生存率 | |||||
| HR | 95%CI | P | HR | 95%CI | P | ||
| 楔形切除 | 1.36 | 1.06-1.85 | 0.032 | 1.69 | 1.13-2.03 | 0.014 | |
| Ⅵ段切除 | 0.56 | 0.21-0.83 | 0.028 | 0.68 | 0.25-0.87 | 0.018 | |
| 右后叶切除 | 0.63 | 0.14-0.79 | 0.015 | 0.48 | 0.08-0.69 | 0.029 | |
| 右半肝切除 | 0.61 | 0.34-0.85 | 0.018 | 0.54 | 0.19-0.76 | 0.031 | |
| 年龄(≥60岁) | 1.15 | 0.93-1.46 | 0.831 | 1.20 | 0.98-1.43 | 0.263 | |
| 性别 | 1.56 | 0.89-2.14 | 0.784 | 1.45 | 1.04-1.79 | 0.386 | |
| 肿瘤大小(≥5 cm) | 1.73 | 1.05-2.24 | 0.014 | 1.89 | 1.31-2.45 | 0.013 | |
| 肿瘤数目(≥2) | 1.48 | 1.02-1.83 | 0.026 | 1.61 | 1.14-2.05 | 0.022 | |
| ICG15(≥10%) | 0.98 | 0.74-1.28 | 0.358 | 0.95 | 0.66-1.36 | 0.583 | |
3 讨论
在我们的研究中,和右后叶切除及右半肝切除相比,行Ⅵ段肝切除的肝硬化肝细胞癌患者手术时间及平均住院日更短,术中出血量及术后并发症发生率更少。而在肿瘤预后方面,Ⅵ段切除组和右后叶切除组及右半肝切除组没有显著差异,差异无统计学意义。这就意味着,对于位于肝脏第Ⅵ段的肝硬化肝细胞癌患者来说,当肿瘤尚未侵犯临近肝叶或肝段的glissionean鞘时,行Ⅵ段肝切除是一线的肝切除方式。
楔形切除也叫非解剖性肝切除。虽然对于肝硬化肝癌患者来说,楔形切除能够保存更多的残肝体积,这样能减少患者术后肝功能衰竭的发生率,但是未检测到的肿瘤区域也保留了下来,包括门静脉微癌栓和微卫星灶。在我们的研究中,和解剖性肝切除相比,楔形切除的手术切缘更少,并且术后复发时间更短,复发率更高。有些研究也表明,和解剖性肝切除相比,楔形切除通常导致更高的术后复发率和更低的肿瘤生存率[9-10]。虽然在肝脏手术发展初期,解剖性肝切除通常导致患者出现术后并发症及围术期死亡,但随着手术技巧和患者围术期管理的进步,以及手术指针的把握,解剖性肝切除的安全性得到很大的提高,在大的肝脏外科中心,患者围术期死亡率发生率可以降低到5%以下[16-17]。而且有研究报道,对于符合手术指针的肝癌患者,行解剖性肝切除可以获得比较好的肿瘤预后,5年生存率可以达到50%-70%[18]。所以,对于肝癌患者来说,楔形切除不应该成为一线肝切除方式,但是有研究报道,对于结肠癌肝转移的患者,行解剖性肝切除和楔形肝切除在肿瘤预后方面没有明显差异[19],所以,对于结肠癌肝转移的患者,可以优先尝试行楔形肝切除。
Ⅵ段肝切除,右后叶切除和右半肝切除均属于解剖性肝切除的范畴,这种手术方式不仅能完全切除肿瘤可能侵犯的门静脉系统,而且能将尚未发现的微卫星灶一起切除[20]。但是,解剖性肝切除由于切除的肝组织更多,残余肝体积更少,术后患者更容易发生肝功能衰竭。据报道,行扩大肝切除的患者,术后肝功能衰竭的发生率大约是8%[11]。在我们的研究中,由于残肝体积更少,肝切除术后并发症主要发生在扩大切除组(右后叶切除组和右半肝切除组)。肝癌患者行肝切除时,手术切缘大于1 cm是符合肝癌根治性切除的标准[21]。然而,有研究表明,当肝癌患者行肝切除时手术切缘小于1 cm, 但是切缘阴性时并不影响患者术后DFS[22]。在我们的研究中,尽管Ⅵ段切除组的手术切缘比右后叶切除组和右半肝切除组更少,但是肿瘤预后方面,Ⅵ段切除组,右后叶切除组和右半肝切除组在1、3、5年OS和DFS方面无统计学差异(P>0.05)。和右后叶切除和右半肝切除相比,解剖性Ⅵ段切除不仅能做到肿瘤学的根治,同时也能保存更多的肝组织,减少患者术后并发症发生率,同时也使复发的患者能够进行第二次肝切除手术[23]。
综上,楔形切除,右后叶切除,右半肝切除相比,解剖性Ⅵ段肝切除应该成为位于肝脏第Ⅵ段的肝硬化肝细胞癌患者的一线肝切除方式。手术切除方式,肿瘤数目(≥2),肿瘤直径(≥5 cm)是肝癌患者预后影响因素。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [3] | EL-SERAG H B, MARRERO J A, RUDOLPH L, et al. Diagnosis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2008, 134(6): 1752–1763. DOI:10.1053/j.gastro.2008.02.090 |
| [4] | FORNER A, REIG M E, DE LOPE C R, et al. Current strategy for staging and treatment: the BCLC update and future prospects[J]. Semin Liver Dis, 2010, 30(1): 61–74. DOI:10.1055/s-0030-1247133 |
| [5] | LIAU K H, BLUMGART L H, DEMATTEO R P. Segment-oriented approach to liver resection[J]. Surg Clin North Am, 2004, 84(2): 543–561. DOI:10.1016/j.suc.2003.12.003 |
| [6] | BILLINGSLEY K G, JARNAGIN W R, FONG Y, et al. Segment-oriented hepatic resection in the management of malignant neoplasms of the liver[J]. J Am Coll Surg, 1998, 187(5): 471–481. DOI:10.1016/s1072-7515(98)00231-2 |
| [7] | MURATORE A, CONTI P, AMISANO M, et al. Bisegmentectomy 7-8 as alternative to more extensive liver resections[J]. J Am Coll Surg, 2005, 200(2): 224–228. DOI:10.1016/j.jamcollsurg.2004.10.003 |
| [8] | FAN S T, LO C M, LIU C L, et al. Hepatectomy for hepatocellular carcinoma: toward zero hospital deaths[J]. Ann Surg, 1999, 229(3): 322–330. DOI:10.1097/00000658-199903000-00004 |
| [9] | CUCCHETTI A, QIAO G L, CESCON M, et al. Anatomic versus nonanatomic resection in cirrhotic patients with early hepatocellular carcinoma[J]. Surgery, 2014, 155(3): 512–521. DOI:10.1016/j.surg.2013.10.009 |
| [10] | YE J Z, MIAO Z G, WU FX, et al. Recurrence after anatomic resection versus nonanatomic resection for hepatocellular carcinoma: a meta-analysis[J]. Asian Pac J Cancer Prev, 2012, 13(5): 1771–1777. DOI:10.7314/apjcp.2012.13.5.1771 |
| [11] | VIBERT E, PITTAU G, GELLI M, et al. Actual incidence and long-term consequences of posthepatectomy liver failure after hepatectomy for colorectal liver metastases[J]. Surgery, 2014, 155(1): 94–105. DOI:10.1016/j.surg.2013.05.039 |
| [12] | MINAGAWA M, MAKUUCHI M, TAKAYAMA T, et al. Selection criteria for repeat hepatectomy in patients with recurrent hepatocellular carcinoma[J]. Ann Surg, 2003, 238(5): 703–710. DOI:10.1097/01.sla.0000094549.11754.e6 |
| [13] | OKABE H, BEPPU T, CHIKAMOTO A, et al. Remnant liver volume-based predictors of postoperative liver dysfunction after hepatectomy: analysis of 625 consecutive patients from a single institution[J]. Int J Clin Oncol, 2014, 19(4): 614–621. DOI:10.1007/s10147-013-0591-0 |
| [14] | MAKUUCHI M, KOSUGE T, TAKAYAMA T, et al. Surgery for small liver cancers[J]. Semin Surg Oncol, 1993, 9(4): 298–304. DOI:10.1002/ssu.2980090404 |
| [15] | LIM C, ISHIZAWA T, MIYATA A, et al. Surgical indications and procedures for resection of hepatic malignancies confined to segment Ⅶ[J]. Ann Surg, 2016, 263(3): 529–537. DOI:10.1097/SLA.0000000000001118 |
| [16] | SIMILLIS C, CONSTANTINIDES VA, TEKKIS PP, et al. Laparoscopic versus open hepatic resections for benign and malignant neoplasms--a meta-analysis[J]. Surgery, 2007, 141(2): 203–211. DOI:10.1016/j.surg.2006.06.035 |
| [17] | SARPEL U, HEFTI M M, WISNIEVSKY J P, et al. Outcome for patients treated with laparoscopic versus open resection of hepatocellular carcinoma: case-matched analysis[J]. Ann of Surg Oncol, 2009, 16(6): 1572–1577. DOI:10.1245/s10434-009-0414-8 |
| [18] | SILVA M F, SAPISOCHIN G, STRASSER SI, et al. Liver resection and transplantation offer similar 5-year survival for Child-Pugh-Turcotte A HCC-patients with a single nodule up to 5 cm: a multicenter, exploratory analysis[J]. Eur J Surg Oncol, 2013, 39(4): 386–395. DOI:10.1016/j.ejso.2012.12.011 |
| [19] | KOKUDO N, TADA K, SEKI M, et al. Anatomical major resection versus nonanatomical limited resection for liver metastases from colorectal carcinoma[J]. Am J Surg, 2001, 181(2): 153–159. DOI:10.1016/S0002-9610(00)00560-2 |
| [20] | MORISE Z, KAWABE N, TOMISHIGE H, et al. Recent advances in the surgical treatment of hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(39): 14381–14392. DOI:10.3748/wjg.v20.i39.14381 |
| [21] | TORZILLI G, MONTORSI M, PALMISANO A, et al. Right inferior phrenic vein indicating the right hepatic vein confluence into the inferior vena cava[J]. Am J Surg, 2006, 192(5): 690–694. DOI:10.1016/j.amjsurg.2005.10.022 |
| [22] | SHI M, GUO R P, LIN X J, et al. Partial hepatectomy with wide versus narrow resection margin for solitary hepatocellular carcinoma: a prospective randomized trial[J]. Ann Surg, 2007, 245(1): 36–43. DOI:10.1097/01.sla.0000231758.07868.71 |
| [23] | MISE Y, ALOIA T A, BRUDVIK K W, et al. Parenchymal-sparing hepatectomy in colorectal liver metastasis improves salvageability and survival[J]. Ann Surg, 2016, 263(1): 146–152. DOI:10.1097/SLA.0000000000001194 |



