2. 610500 成都, 成都医学院:人体解剖与组织胚胎学教研室;
3. 610500 成都, 成都医学院:病理学与病理生理学教研室
2. Department of Anatomy and Histology & Embryology, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China;
3. Department of Pathology and Pathophysiology, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China
神经干细胞(neural stem cells, NSCs)修复和替代受损的神经元并重建神经环路的功能, 为神经损伤及神经退行性疾病等的治疗提供了新的途径和可能[1-2]。但该功能的实现依赖于神经干细胞的自我更新和多分化潜能[3]。因此, 揭示神经干细胞的自我更新和分化的分子机制是当代神经科学领域研究的热点之一, 其不仅有利于探索神经系统发育机制, 也为神经退行性疾病的治疗提供理论基础。
神经干细胞的自我更新和分化受到许多转录因子及信号通路的有序调控[4-5]。转录因子Foxp1作为Forkhead蛋白家族成员, 调节多个器官的发育, 如:心脏、肺、食管、骨等[6-7]。目前研究表明Foxp1突变可导致个体的语言学习能力障碍、智力迟钝, 并且个体患孤独症的风险较高[8]。最新的研究证实Foxp1参与了早期皮层的发育[9]。尽管如此, Foxp1在神经干细胞中的作用及机制仍未完全阐明。已有研究表明神经干细胞的分化受Jak/Stat信号通路调控, 该信号通路相关蛋白gp130、Jak1以及信号分子Stat1/3参与调节星形胶质细胞的生成[5]。因此, 本研究拟利用神经干细胞体外培养及分化模型, 探讨Foxp1在神经干细胞分化中的作用, 并初步探索相关的分子机制, 以期进一步揭示发育过程中神经干细胞自我更新和分化过程中转录调控机制。
1 材料与方法 1.1 实验动物及主要试剂实验动物: 8周龄SPF级C57/6J野生型雌性和雄性小鼠, 体质量20~24 g, 购自成都达硕实验动物有限公司[生产许可证号:SCXK(川)2015-030], 并饲养于成都医学院科研实验中心SPF级实验动物房。实验动物饲养及相关操作均按照成都医学院伦理委员会的规定实施。主要试剂:Accutase酶、胎牛血清、DMEM/F12(1 :1)基本培养基、青霉素-链霉素双抗溶液、GlutaMax、B27、Heparin购自Gibco公司; 表皮生长因子(epithelial growth factor, EGF)、碱性成纤维生长因子(basic fibroblast growth factor, bFGF)购自PeproTech公司; 多聚赖氨酸(Poly-D-lysine, PDL)、全反式维甲酸(all-trans-retinoic acid, RA)购自Sigma公司; 594标记的荧光二抗、488标记的荧光二抗、TRIzol、LipofectaminTM3000转染试剂购自Invitrogen公司; Nestin抗体、Map2抗体、GFAP抗体购自Abcam公司; 逆转录试剂盒和荧光定量PCR试剂盒购自Roche公司; BCA蛋白浓度测定试剂盒、RIPA裂解液等Western blot相关试剂购自上海碧云天生物工程公司; DAPI封片剂和GAPDH抗体、HRP标记的羊抗兔二抗购自中衫金桥生物技术公司; pcDNA3.0空质粒及pcDNA3.0- Foxp1过表达质粒由上海交通大学Bio-X研究院郭熙志教授赠送。
1.2 神经干细胞分离培养将性成熟小鼠于下午4:00~5:00期间按雌雄比2 :1合笼, 次日上午检栓, 栓阳性的雌鼠记为孕期0.5 d。收集E12.5d胎鼠, 分离前脑皮质, 结合Accutase酶消化和枪轻轻机械吹打使组织解离成单细胞[10]。将收集的细胞以2×105 /mL的密度接种到培养皿中, 于37 ℃、5%CO2培养箱中培养。培养基为含20 ng/mL bFGF和20 ng/mL EGF、1% GlutaMax、2% B27、2 μg/mL Heparin、1%双抗的DMEM/F12培养基。每隔2.5 d换液1次, 5~7 d收集增殖形成的神经球进行传代, 传代3次后可进行后期的分化或转染实验。
1.3 神经干细胞诱导分化将消化成单细胞的神经干细胞以2×105/mL的密度接种于PDL包被的6孔板中, 加入分化培养基, 于37 ℃、5%CO2培养箱中诱导分化3 d和7 d, 每隔2 d半换液1次。分化培养基为含1 μmol/L RA、2 μg/mL Heparin、2%B27、1%GlutaMax、1%双抗溶液的DMEM/F12培养基。
1.4 神经干细胞转染转染前1 d将神经干细胞以2×105/mL接种于PDL包被的6孔板中, 保证细胞数在转染时占孔板底面积的90%左右。按照LipofectaminTM3000转染试剂说明书中的6孔板加样体系, 每孔转染质粒2 μg, 分别转染空质粒pcDNA3.0和过表达质粒pcDNA3.0-Foxp1。转染18 h后将培养基更换为分化培养基, 诱导分化3 d。
1.5 免疫荧光检测将神经球接种到PDL包被的培养板中, 贴壁2~3 h, 吸出培养基, 用预冷的PBS轻轻换洗。4%多聚甲醛室温固定30 min, PBS洗3次, 含10%羊血清和0.3% Triton X-100的封闭液室温封闭1 h, 一抗(1 :200)4 ℃孵育过夜。PBS洗3次, 二抗(1 :400)室温孵育1 h, PBS洗3次, DAPI封片剂封片, 荧光显微镜观察并拍照。
对于贴壁分化的细胞, 只需吸出培养基后, 用预冷的PBS轻轻换洗。然后方法同前:4%多聚甲醛固定、PBS洗涤, 抗体孵育、DAPI封片、荧光显微镜观察并拍照。
使用Adobe Photoshop图像处理软件计数对照组和Foxp1过表达组中免疫荧光染色阳性的细胞数目及DAPI染色的总细胞数目, 分析MAP2或者GFAP免疫荧光染色阳性的细胞数目占DAPI染色的总细胞数目的百分比, 以及MAP2阳性的细胞与GFAP阳性的细胞的比值。每个诱导组含3个生物学重复, 每个重复在荧光显微镜下拍摄3个区域, 每个区域约200个细胞用于计数。
1.6 RT-PCR检测收集神经球或者贴壁分化的细胞, 用TRIzol法收集总RNA, 利用逆转录试剂盒合成cDNA。cDNA为模板进行荧光定量PCR。相关基因引物序列: Foxp1上游:5′-TCTCGTCCTCGGCACCTT-3′, 下游:5′-GTCAC-AAACCGCCTCACA-3′; Map2上游:5′-GTCACAGGGC-ACCTATTC-3′, 下游:5′-CACCTTTCAGGACTGCTAC-3′; GFAP上游:5′-ACCCTGGCTCGTGTGGAT-3′, 下游:5′-GCCACATCCATCTCCACG-3′; Jak1上游:5′-CACAA-CCTCTTCGCCCTGTA-3′, 下游:5′-TCGCCATACAGAC-TGTTCGT-3′; Stat1上游:5′-GGGCGTCTATCCTGTGGTAC-3′, 下游:5′-CTGCCAACTCAACACCTCTG-3′; Stat3上游:5′-AAGAGTCACATGCCACGTTG-3′, 下游:5′-GG-CTTCTCAAGATACCTGCTC-3′; gp130上游:5′-CAGCTCACCTGCAACATCCT-3′, 下游:5′-CCCTCATTCACAA-TGCAAGTC-3′; GAPDH上游:5′-GAAACCTGCCAAGTATGATGACA-3′, 下游:5′-GGTCCTCAGTGTAGCCC-AAGA-3′。各组实验重复3次, 扩增结果以2-ΔΔCt方法进行定量分析[11]。
1.7 Western blot检测RIPA裂解液提取蛋白, BCA法测定蛋白浓度。等量蛋白上样, SDS-PAGE凝胶电泳分离。电泳后转膜至PVDF膜, 5%脱脂奶粉室温封闭1 h, 一抗4 ℃孵育过夜, 二抗室温孵育1 h, 显影成像。
1.8 统计学分析使用GraphPad Prism软件进行统计学分析, 数据以x±s表示, 两组间比较采用t检验, 两组以上比较采用单因素方差分析。检验水准:α=0.05。
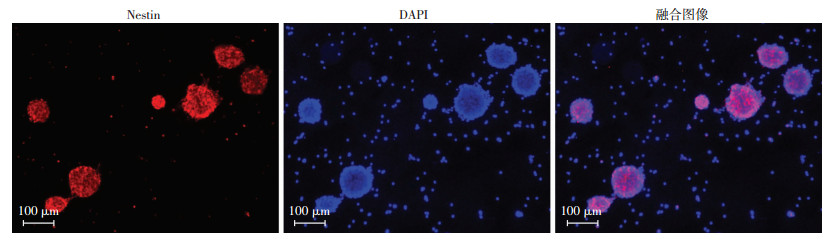
2 结果 2.1 神经干细胞体外培养原代分离的神经干细胞培养5~7 d后, 增殖形成80~100 μm的神经球。结合Accutase酶消化法和机械吹打法, 将神经球解离成单细胞, 进行传代培养, 神经干细胞可再次增殖形成神经球。用免疫荧光检测传代3次的神经球, 结果显示神经球中的细胞为Nestin阳性的神经干细胞(图 1)。将传代3次的神经球, 解离成单细胞, 分化培养基诱导3 d或7 d, 免疫荧光鉴定发现神经干细胞可进一步分化为神经元和星形胶质细胞(图 2)。结果显示分化3 d后Map2阳性的神经元数目明显增加(图 2), 而分化7 d后GFAP阳性的星形胶质细胞数目明显增加(图 2)。
|
| Nestin免疫荧光染色(红色); DAPI染色(蓝色) 图 1 免疫荧光鉴定神经球中Nestin阳性的神经干细胞 |

|
| Map2免疫荧光染色(红色); GFAP免疫荧光染色(绿色); DAPI染色(蓝色) 图 2 免疫荧光检测神经干细胞诱导不同时间的分化情况 |
2.2 Foxp1在神经干细胞分化过程中表达水平的变化
分别提取未诱导的神经干细胞、诱导分化3 d和7 d的神经干细胞的mRNA和蛋白。RT-PCR结果显示转录因子Foxp1的mRNA表达水平在神经干细胞分化3 d和7 d后都显著升高(P < 0.05), 并且在分化3d比分化7d升高更明显(P < 0.05, 图 3A)。Western blot检测进一步证实转录因子Foxp1蛋白表达水平也在神经干细胞分化后升高, 并且在分化3 d时最高(图 3B)。

|
| A:定量PCR检测Foxp1 mRNA在神经干细胞诱导分化过程中的相对表达水平; B:Western blot检测Foxp1在神经干细胞诱导分化过程中的表达情况1:未诱导组; 2:诱导3 d组; 3:诱导7 d组; a:P < 0.05, 与未诱导组比较; b: P < 0.05, 与诱导3 d组比较 图 3 Foxp1在神经干细胞诱导分化过程中的表达情况 |
2.3 Foxp1过表达促进神经干细胞分化向神经元的分化
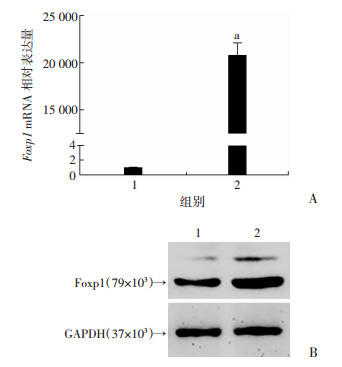
为进一步探究Foxp1对神经干细胞分化的影响, 我们利用脂质体法将pcDNA3.0-Foxp1质粒转入神经干细胞中过表达Foxp1, 其中pcDNA3.0空质粒作为对照组, 然后将转染的神经干细胞经分化培养基诱导3 d, 观察Foxp1对神经干细胞分化的影响。通过RT-PCR和Western blot检测结果显示Foxp1过表达组中Foxp1的mRNA和蛋白表达水平都显著升高(P < 0.01, 图 4)。
|
| A:定量PCR检测Foxp1 mRNA的相对表达水平; B:Westernblot检测Foxp1过表达情况1:对照组; 2:Foxp1过表达组; a:P < 0.01, 与对照组比较 图 4 转染后Foxp1在神经干细胞中的过表达水平检测 |
对照组和Foxp1过表达组经分化培养基诱导3 d后, 利用免疫荧光双标技术检测Map2阳性的神经元和GFAP阳性的星形胶质细胞(图 5), 并计数Map2阳性的神经元和GFAP阳性的星形胶质细胞、总细胞的数目(表 1)。统计分析结果显示Foxp1过表达组中Map2阳性的神经元占总细胞数目百分比显著高于对照组[(35.03±0.43)%vs (29.06±1.07)%; P < 0.01], 而GFAP阳性的星形胶质细胞占总细胞数目百分比明显低于对照组[(14.21±0.45)% vs (18.97±0.97)%; P < 0.05]。统计Map2阳性的神经元与GFAP阳性的星形胶质细胞数目比值发现, Foxp1过表达组中的比值显著高于对照组[(2.49±0.09) vs (1.55±0.04); P < 0.05]。RT-PCR结果也证实Foxp1过表达促进了Map2的表达(P < 0.01), 抑制了GFAP的表达(P < 0.05, 图 6)。

|
| Map2免疫荧光染色(红色); GFAP免疫荧光染色(绿色); DAPI染色(蓝色) 图 5 Foxp1过表达对神经干细胞分化的影响 |
| 组别 | Map2阳性的细胞数 | GFAP阳性的细胞数 | 总细胞数 |
| 对照组 | 66±5 | 44±6 | 229±16 |
| Foxp1过表达组 | 65±3 | 27±1 | 187±5 |
|
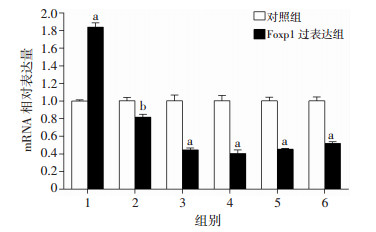
| 1:Map2;2:GFAP; 3:Jak1;4:Stat1;5:Stat3;6:gp130;a:P < 0.01, b:P < 0.05, 与对照组比较 图 6 Foxp1过表达对相关基因mRNA表达水平的影响 |
2.4 Foxp1过表达对Jak/Stat信号通路的影响
对照组和Foxp1过表达组分化3d后, 提取总RNA, 通过RT-PCR检测Jak/Stat信号通路中Jak1和Stat1、Stat3、gp130的表达。统计分析结果显示Foxp1过表达组中的Jak1和Stat1、Stat3、gp130表达水平明显降低, 且差异有统计学意义(P < 0.01, 图 6), 表明Foxp1过表达可抑制Jak/Stat信号通路活性。
3 讨论REYNOLDS等[12]于1992年从成年鼠的纹状体中分离出具有自我增殖和分化潜能的神经干细胞, 该研究不仅打破了成体中神经细胞不能再生的传统观念, 也为神经损伤、神经退行性疾病等的治疗提供了新的手段[2]。神经干细胞在体外诱导过程中, 可先后分化为神经元和胶质细胞, 模拟体内的神经发生, 为探究神经发生机制提供模型基础。文献[13]报道从E12.5d胎鼠中分离而来的神经干细胞具有较好的多向分化潜能。RA是维生素A的代谢产物, 在中枢神经系统早期发育过程中起着重要的调节作用, 而在体外培养中其也常作为诱导因子诱导神经干细胞分化[14-15]。因此, 本研究建立了神经干细胞在体外培养及诱导分化模型, 从胚胎E12.5d的前脑皮层中分离培养能自我增殖的神经干细胞, 利用RA诱导神经干细胞分化为神经元和胶质细胞。在该模型的基础上重点探讨转录因子Foxp1在神经干细胞分化中的表达及其过表达对神经干细胞分化的影响, 进一步揭示神经干细胞分化中的转录调节机制。
本研究发现在神经干细胞诱导分化3 d和7 d的过程中Foxp1的mRNA和蛋白表达水平都显著升高, 尤其是在神经元分化比例较高的3 d其表达水平最高。转录因子Foxp1作为Forkhead蛋白家族中的Foxp亚族成员之一, 在干细胞的多潜能维持和分化过程中具有重要作用。GABUT等[16]研究发现在人或鼠的胚胎干细胞中存在FOXP1/ Foxp1的一种特异剪切形式, 其能促进维持干细胞多潜能相关的转录因子的表达, 如OCT4、NANOG、NR5A2等。不仅如此, Foxp1敲除会导致小鼠毛发生长周期中的静息期变短, 毛囊中的干细胞活性提前成熟[17]。另外, 过表达Foxp1能诱导胚胎干细胞分化为多巴胺能神经元前体[18]。因此, Foxp1在神经干细胞向神经元分化中的高表达预示其可能参与了神经干细胞向神经元方向的分化。
已有研究表明Foxp1在皮层发育过程中调节着皮层神经元的迁移及形态发生, 该基因敲除可影响皮层发育, 并引起自闭症等相关症状[9, 19], 提示Foxp1在神经系统早期发育中的作用。已有研究表明神经干细胞中干扰Foxp1的表达可抑制神经干细胞的分化[20]。本实验在体外培养的神经干细胞中转染Foxp1过表达质粒发现, 过表Foxp1提高了神经元的分化比例, 并降低了星形胶质细胞的分化比例。反向证实了Foxp1在神经干细胞分化过程中可促进神经元的分化, 抑制星形胶质细胞的产生。
神经干细胞分化机制复杂, 许多信号通路参与调节着神经干细胞的自我更新和分化[4]。Notch信号通路在发育早期可抑制神经干细胞向神经元的分化, 维持神经干细胞的增殖和自我更新[21-22]。Jak/Stat信号通路控制着神经干细胞向星形胶质细胞方向的分化[5, 23]。最新研究表明Foxp1可抑制Notch信号通路, 从而促进神经干细胞的分化[20]。本研究发现, Foxp1过表达抑制了Jak/Stat信号通路相关分子的表达, 其中Jak1、Stat1、Stat3、gp130表达水平显著降低。因此, Foxp1不仅可通过Notch信号通路调节神经干细胞向神经元方向的分化, 也可调节Jak/Stat信号通路抑制神经干细胞向星形胶质细胞的分化。
综上所述, 本研究利用神经干细胞体外培养及分化模型揭示Foxp1在神经干细胞分化过程中表达水平显著升高, 并证实Foxp1过表达可促进神经干细胞向神经元方向分化, 且可调节Jak/Stat信号抑制星形胶质细胞产生, 对于揭示Foxp1在神经干细胞分化中的新功能具有重要意义。尽管如此, 本研究仅在体外细胞水平上探讨了Foxp1对神经干细胞分化的影响, 因此, 有待于在体内进一步验证其对胚胎发育早期的神经干细胞分化的影响。另外, Foxp1作为转录因子其调节的靶点也需通过CHIP等实验进一步研究, 从而深入阐明转录因子Foxp1如何通过其靶基因促进神经元的分化并抑制星形胶质细胞分化的分子机制。
| [1] | LINDVALL O, KOKAIA Z. Stem cells in human neuro-degenerative disorders—time for clinical translation[J]. J Clin Invest, 2010, 120(1): 29–40. DOI:10.1172/JCI40543 |
| [2] | HÉBERT J M, VIJG J. Cell replacement to reverse brain aging: challenges, pitfalls, and opportunities[J]. Trends Neurosci, 2018, 41(5): 267–279. DOI:10.1016/j.tins.2018.02.008 |
| [3] | LUNN J S, SAKOWSKI S A, HUR J, et al. Stem cell technology for neurodegenerative diseases[J]. Ann Neurol, 2011, 70(3): 353–361. DOI:10.1002/ana.22487 |
| [4] | MU Y, LEE S W, GAGE F H. Signaling in adult neurogenesis[J]. Curr Opin Neurobiol, 2010, 20(4): 416–423. DOI:10.1016/j.conb.2010.04.010 |
| [5] | HE F, GE W, MARTINOWICH K, et al. A positive auto-regulatory loop of Jak-STAT signaling controls the onset of astrogliogenesis[J]. Nat Neurosci, 2005, 8(5): 616–625. DOI:10.1038/nn1440 |
| [6] | BACON C, RAPPOLD G A. The distinct and overlapping phenotypic spectra of FOXP1 and FOXP2 in cognitive disorders[J]. Hum Genet, 2012, 131(11): 1687–1698. DOI:10.1007/s00439-012-1193-z |
| [7] | ZHAO H, ZHOU W, YAO Z, et al. Foxp1/2/4 regulate endochondral ossification as a suppresser complex[J]. Dev Biol, 2015, 398(2): 242–254. DOI:10.1016/j.ydbio.2014.12.007 |
| [8] | HAMDAN F F, DAOUD H, ROCHEFORT D, et al. De novo mutations in FOXP1 in cases with intellectual disability, autism, and language impairment[J]. Am J Hum Genet, 2010, 87(5): 671–678. DOI:10.1016/j.ajhg.2010.09.017 |
| [9] | LI X, XIAO J, FRÖHLICH H, et al. Foxp1 regulates cortical radial migration and neuronal morphogenesis in developing cerebral cortex[J]. PLoS ONE, 2015, 10(5): e0127671. DOI:10.1371/journal.pone.0127671 |
| [10] |
任丽伊, 赵海霞, 左璇, 等. 胚胎小鼠神经干细胞的培养和诱导分化[J].
成都医学院学报, 2017, 12(1): 1–6.
REN L Y, ZHAO H X, ZUO X, et al. The culture and induced differentiation of neural stem cells of embryonic mice[J]. J Chengdu Med Coll, 2017, 12(1): 1–6. DOI:10.3969/j.issn.1674-2257.2017.01.001 |
| [11] | SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6): 1101–1108. DOI:10.1038/nprot.2008.73 |
| [12] | REYNOLDS B A, WEISS S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J]. Science, 1992, 255(5052): 1707–1710. DOI:10.1126/science.1553558 |
| [13] | LOUIS S A, MAK C K, REYNOLDS B A. Methods to culture, differentiate, and characterize neural stem cells from the adult and embryonic mouse central nervous system[J]. Methods Mol Biol, 2013, 946: 479–506. DOI:10.1007/978-1-62703-128-8_30 |
| [14] | MADEN M. Retinoic acid in the development, regeneration and maintenance of the nervous system[J]. Nat Rev Neurosci, 2007, 8(10): 755–765. DOI:10.1038/nrn2212 |
| [15] | CHU T, ZHOU H, WANG T, et al. In vitro characteristics of valproic acid and all-trans-retinoic acid and their combined use in promoting neuronal differentiation while suppressing astrocytic differentiation in neural stem cells[J]. Brain Res, 2015, 1596: 31–47. DOI:10.1016/j.brainres.2014.11.029 |
| [16] | GABUT M, SAMAVARCHI-TEHRANI P, WANG X, et al. An alternative splicing switch regulates embryonic stem cell pluripotency and reprogramming[J]. Cell, 2011, 147(1): 132–146. DOI:10.1016/j.cell.2011.08.023 |
| [17] | LEISHMAN E, HOWARD J M, GARCIA G E, et al. Foxp1 maintains hair follicle stem cell quiescence through regulation of Fgf18[J]. Development, 2013, 140(18): 3809–3818. DOI:10.1242/dev.097477 |
| [18] | KONSTANTOULAS C J, PARMAR M, LI M. FoxP1 promotes midbrain identity in embryonic stem cell-derived dopamine neurons by regulating Pitx3[J]. J Neurochem, 2010, 113(4): 836–847. DOI:10.1111/j.1471-4159.2010.06650.x |
| [19] | BACON C, SCHNEIDER M, LE MAGUERESSE C, et al. Brain-specific Foxp1 deletion impairs neuronal development and causes autistic-like behaviour[J]. Mol Psychiatry, 2015, 20(5): 632–639. DOI:10.1038/mp.2014.116 |
| [20] | BRACCIOLI L, VERVOORT S J, ADOLFS Y, et al. FOXP1 promotes embryonic neural stem cell differentiation by repressing jagged1 expression[J]. Stem Cell Reports, 2017, 9(5): 1530–1545. DOI:10.1016/j.stemcr.2017.10.012 |
| [21] | LOUVI A, ARTAVANIS-TSAKONAS S. Notch signalling in vertebrate neural development[J]. Nature Reviews Neuroscience, 2006, 7(2): 93–102. DOI:10.1038/nrn1847 |
| [22] | UNGERER P, ERIKSSON B J, STOLLEWERK A. Unravelling the evolution of neural stem cells in arthropods: notch signalling in neural stem cell development in the crustacean Daphnia magna[J]. Dev Biol, 2012, 371(2): 302–311. DOI:10.1016/j.ydbio.2012.08.025 |
| [23] | WANG W, LI Y, ZHOU L, et al. Role of JAK/STAT signaling in neuroepithelial stem cell maintenance and proliferation in the Drosophila optic lobe[J]. Biochem Biophys Res Commun, 2011, 410(4): 714–720. DOI:10.1016/j.bbrc.2011.05.119 |



