2. 400010 重庆, 重庆医科大学超声影像学研究所 超声分子影像重庆市重点实验室;
3. 400016 重庆, 重庆医科大学附属第一医院超声科;
4. 400014 重庆, 重庆医科大学超声医学工程研究所 省部共建国家重点实验室培育基地
2. Institute of Ultrasound Imaging, Chongqing Key Laboratory of Ultrasound Molecular Imaging, Chongqing Medical University, Chongqing, 400010;
3. Department of Ultrasonography, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
4. Institute of Ultrasonic Medical Engineering, Training Base of Key Laboratory of Chongqing and Ministry of Education, Chongqing Medical University, Chongqing, 400016, China
超声分子影像学是分子影像学的一个分支, 具有无创、无辐射、简便、可反复应用等优点[1]。液-气相变型纳米粒兼具传统超声微泡的增强回声对比特性和纳泡的肿瘤组织血管外成像特点, 被认为是一种理想的新型超声分子探针[2]。光声成像利用光声对比剂改变局部组织的声学和光学特性, 兼具光学和声学成像的优势, 是目前比较有应用前景的一种成像模式。
相较于贵金属、无机物及荧光染料等传统光声显像材料, 广泛存在于人体的黑色素具有优良的生物安全性。我们团队近期报道了一种载黑色素纳米脂质体, 成功实现了光声/磁共振双模态引导下的肿瘤光热治疗[3-4]。聚多巴胺(polydopamine, PDA)是由多巴胺(dopamine, DA)自发氧化聚合合成的类黑色素, 其前体、氧化过程和理化特性均与天然黑色素类似, 且原料价格廉价, 合成方法简易, 制备工艺安全[4], 是一种具有广泛应用前景的成像介质。本研究拟将聚多巴胺修饰在包载全氟正戊烷(perfluoropentane, PFP)的聚乳酸-羟基乙酸纳米粒的表面, 合成聚多巴胺修饰的相变型超声造影剂(PFP@PLGA@PDAs), 探究该纳米粒作为对比剂实现体内外超声/光声双模态显像的能力, 为进一步开发安全、高灵敏、高特异的多功能分子探针提供新思路。
1 材料与方法 1.1 材料主要有:聚乳酸-乙醇酸(PLGA-COOH LA :GA=50 :50;济南岱罡), 盐酸多巴胺(dopamine hydrochloride, DA); 上海Sigma), PFP全氟正戊烷(perfluoropentane, PFP; 北京百灵威), 聚乙烯醇(polyving akokol, PVA; 上海Sigma), 三羟甲基氨基甲烷(Tris(hydroxymethyl)aminomethane, Tris; 上海Sigma)。
1.2 仪器主要有:倒置荧光显微镜(IX53, Olympus, 日本), 显微镜加热台(上海标本模型厂), 百盛超声诊断仪(ESAOTE Mylab90, 百盛, 意大利), 红外成像系统(Vevo® LASER, 美国), 声振仪(XL2020, Heat System, 美国), 激光粒径测量仪(Zetasizer Nano ZS90, Malvern, 美国), 紫外-可见分光光度计(UV-2600, Shimadzu, 日本), 激光仪(FC-808, 中川光电, 西安), 透射电镜(H-7500, Hitachi, 日本), 扫描电镜(NanoSEM450, FEI Nova, 美国)。
1.3 实验方法 1.3.1 包覆聚多巴胺相变纳米粒的制备及其一般特性的检测先采用单乳化法制备PFP@PLGA纳米粒, 分散在含有2 mg/mL盐酸多巴胺的Tris缓冲液(10 mmol/L, pH=8.5)中, 搅拌24 h, 离心(8 710×g, 10 min/次)、洗涤后获得聚多巴胺表面修饰的相变纳米粒(PFP@PLGA@PDA), 全程冰浴。通过光学显微镜、透射电镜、扫描电镜等观察纳米粒形态, 激光粒径测量仪测量其粒径分布及大小, 使用显微镜加热台观察热致相变, 紫外分光光度计检测吸收光谱并绘制标准曲线和计算聚多巴胺载药量。
1.3.2 细胞培养及细胞毒性实验采用CCK-8法检测细胞存活率, 选用小鼠乳腺癌4T1细胞(重庆医科大学超声分子影像研究所赠送), 接种于96孔板内, 细胞数10 000/孔, 与不同浓度(1、2、3、4、5 mg/mL)纳米粒孵育24 h后检测细胞存活率。
1.3.3 体外光声成像以PFP@PLGA@PDAs为实验组, 以PFP@PDAs为对照组, 将不同浓度(1、2、3、4 mg/mL, n=3)的两种纳米粒悬液分别加入凝胶孔洞模型(3%), 通过光声成像系统采集感兴趣区(region of interest, ROI)的光声图像, 测定光声信号强度并进行统计分析。
1.3.4 体外超声成像以PFP@PLGA@PDAs为实验组, 以PFP@PDAs为对照组, 分别稀释成2 mg/mL悬液, 置于凝胶孔洞模型(3%)中, 采用波长为808 nm、功率为1.5 W的脉冲激光辐照不同时长(0、3、5、10、15、20 min, n=5), 通过超声诊断仪采集超声图像。通过DFY组织灰度定征软件(超声分子影像学重庆市重点实验室自主研发的一种定量分析超声图像灰度值的软件)测量ROI回声强度值并进行统计分析。
1.3.5 动物模型的建立和实验分组4~6周龄雌性BALB/c裸鼠(体质量20 g)18只, 将小鼠乳腺癌4T1细胞的单细胞悬液(1×106 /mL)注射于裸鼠背部脊柱旁皮下(右侧, 0.1 mL)建立4T1肿瘤模型。观察、测量肿瘤生长情况, 肿瘤体积计算公式V=π/6×长×宽×高(单位:mm), 待肿瘤体积约达到200 mm3后, 分为3组:PFP@PLGA@PDAs组、PFP@PLGA@PDAs和PBS组(n=6)。
1.3.6 体内光声成像每组选取3只荷瘤鼠, 分别经尾静脉注射2 mg/mL PFP@PLGA@PDAs、2 mg/mL PFP@PLGA@PDAs或等量PBS, 使用光声成像系统分别采集注射前, 注射后1、4、24 h的光声图像, 定量分析光声信号强度变化。
1.3.7 体内超声成像每组选取3只荷瘤鼠, 尾静脉注射2 mg/mL PFP@PLGA@PDAs、2 mg/mL PFP@PLGA@PDAs或等量PBS, 4 h后以808 nm激光辐照(2 W/cm2, 10 min)肿瘤部位, 使用超声诊断仪采集辐照前后超声图像, 并通过DFY组织灰度定征软件定量分析信号强度变化。
1.4 统计学分析采用GraphPad cs5软件进行统计学分析, 计量资料以x±s表示, 多样本均数的比较采用单因素方差分析, 两组均数比较采用t检验, 检验水准:α=0.05, 两变量之间关系采用线性相关分析。
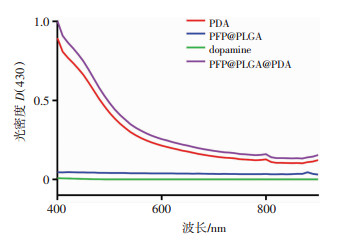
2 结果 2.1 聚多巴胺修饰的相变型纳米粒的一般性质将PFP@PLGAs纳米粒分散于2 mg/mL多巴胺的Tris缓冲液后, 乳白色悬液很快变为浅褐色, 之后悬液颜色逐渐加深最终呈深褐色, 这与多巴胺自发氧化生成聚多巴胺过程的颜色变化一致, 说明聚多巴胺的成功氧化合成。光学显微镜、扫描电镜均显示纳米粒呈规则球形, 大小均一, 分散性良好(图 1A、B), 透射电镜显示纳米粒呈黑色外壳包裹浅色核的壳-核结构, 说明聚多巴胺成功修饰在纳米粒表面(图 1C)。热致相变实验结果显示, 随着显微镜加热台的温度逐渐升高至43 ℃, 纳米粒开始发生液-气相变, 形成大量含气微泡(图 1D), 说明液态氟碳的成功包载, 温度超过50 ℃后相变生成的微泡数量明显减少。Malvern激光粒径仪测得其粒径为(209.40±36.15)nm, 分散指数小(PdI:0.0025), 说明纳米粒的粒径均一。紫外-可见光吸收光谱结果显示(图 2), 多巴胺在400~800 nm区域无吸收, PFP@PLGAs在此区域的光吸收强度极少, 而PFP@PLGA@PDAs与PDA有相似的吸收光谱, 说明多巴胺成功氧化生成了聚多巴胺, 与透射电镜结果一致。选择430 nm波长对应的各浓度悬液的光密度绘制标准曲线, 回归方程为Y=0.005 9X+0.140 2(r=0.998 4)。所制备的PFP@PLGA@PDAs纳米粒中聚多巴胺载药量为(30.57±2.89)%。

|
| A:光镜; B:纳米粒的扫描电镜; C:纳米粒的透射电镜; D:纳米粒发生相变后的光镜 图 1 PFP@PLGA@PDAs纳米粒的基本性质 |
|
| 图 2 4种物质的紫外-可见光吸收光谱结果 |
CCK-8法检测结果显示, 小鼠乳腺癌4T1细胞在加入含有不同浓度纳米粒(1、2、3、4、5 mg/mL)孵育24 h后, 细胞的存活率分别为(100.30±3.09)%、(99.16± 2.23)%、(97.45±2.69)%、(96.70±2.76)%和(96.33± 2.95)%, 各组间差异无统计学意义(P>0.05), 说明PFP@PLGA@PDA纳米粒没有明显的细胞毒性。
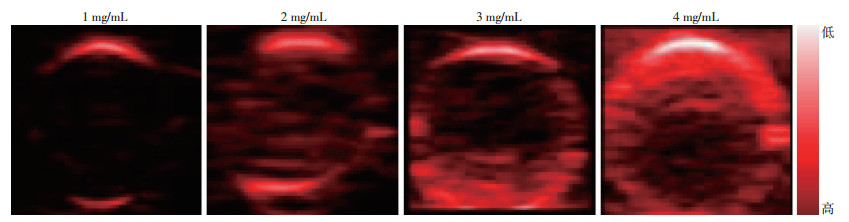
2.2 体外光声显像在700 nm激发波长下, 各浓度的PFP@PLGA@PDAs悬液(1、2、3、4 mg/mL)均表现了明显的光声信号, 并且随着对比剂浓度的增加, 其光声信号依次增强(图 3), 各组光声信号强度PA值分别为(0.12±0.02)、(0.23±0.02)、(0.37±0.03)、(0.56±0.05), 各浓度组间差异有统计学意义(P < 0.05)。PFP@PLGAs对照组未表现出明显光声显影。
|
| 图 3 不同浓度的PFP@PLGA@PDAs的体外光声成像表现 |
2.3 体外超声显像
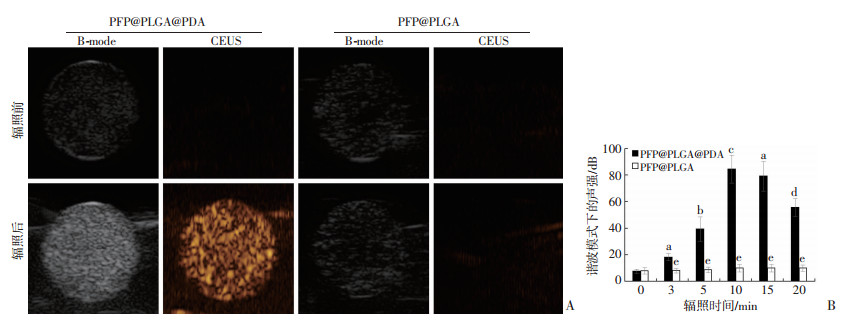
如图 4A, 辐照前PFP@PLGA@PDAs悬液和PFP@PLGAs悬液的二维超声图像均表现为均匀点状回声, 造影图像亦均未见点状高回声, 经激光辐照后, PFP@PLGA@PDAs的超声二维图像(B-mode)和造影图像(CEUS)均可见明显增多的点状高回声, 而PFP@PLGAs辐照前后两者均无明显改变。定量分析谐波模式ROI声强值的结果显示(图 4B), 未辐照(0 min)的PFP@PLGA@PDAs与未辐照(0 min)的PFP@PLGAs的ROI声强值相比差异无统计学意义(P>0.05), PFP@PLGA@PDAs组内各辐照时长(0、3、5、10、15、20 min)的ROI声强值之间差异具有统计学意义(P < 0.05), 其中激光辐照时长10 min时的回声强度值最高, PFP@PLGA@PDAs与PFP@PLGAs在相同辐照时长(0 min除外)的ROI声强值之间的差异有统计学意义(P < 0.05)。
|
| A:激光辐照前后PFP@PLGA@PDAs和PFP@PLGAs的超声二维和造影表现; B:激光辐照时长与两种纳米粒的谐波回声强度比较(n=5, x±s) a:P < 0.05, 与0 min比较; b:P < 0.05, 与3 min比较; c:P < 0.05, 与5 min比较; d:P < 0.05, 与15 min比较; e:P < 0.05, 与PFP@PLGA@PDAs比较 图 4 激光辐照前后两种纳米粒的体外超声成像表现和声强值比较 |
2.4 体内光声显像
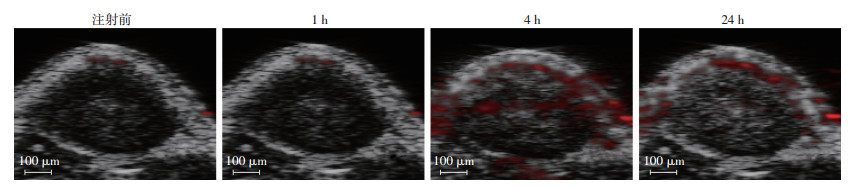
尾静脉注射对比剂之前, 各组裸鼠的肿瘤部位均未见明显光声信号。注射PFP@PLGA@PDAs组裸鼠的肿瘤部位可见随观察时间逐渐增强的光声信号(图 5), 注射前和注射后1、4、24 h光声信号值分别为(0.12±0.03)、(0.22±0.04)、(0.67±0.08)、(0.37± 0.06), 各时间点差异具有统计学意义(P < 0.05), PFP@PLGAs和PBS对照组的荷瘤鼠的肿瘤部位始终未见明显光声信号。
|
| 图 5 注射PFP@PLGA@PDAs前后裸鼠肿瘤的光声成像表现 |
2.5 体内超声增强显像
激光辐照之前, 基波模式(B-mode)下PFP@PLGA@PDAs组、PFP@PLGAs组与PBS组荷瘤鼠肿瘤部位表现为相似的均匀点状回声, 谐波模式(CEUS)下各组均无明显回声信号。激光辐照之后, PFP@PLGA@PDAs组肿瘤在基波和谐波模式下均显示了明显增多的点状高回声, 而PFP@PLGAs和PBS组均未见明显变化(图 6)。
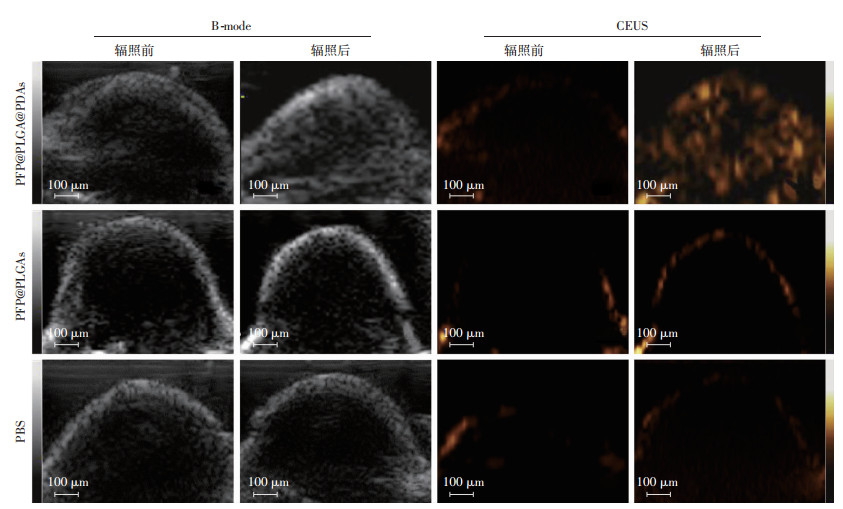
|
| 图 6 激光辐照前后裸鼠肿瘤的超声表现 |
3 讨论
现阶段, 分子影像学的发展依赖于多模态多功能分子探针的不断开发与升级优化[6]。目前, 实现多模态成像的分子探针大多以贵金属、无机物、染料等物质为原材料, 但固有的外源性特性导致其长期生物安全性有待深入研究, 因此国内外相关的研究大多停留在动物实验阶段[8], 其进一步的生物应用和临床转化明显受阻。黑色素是广泛存在于人体的天然色素, 生物安全性高, 具有光吸收性, 可产生光声信号, 已应用于开发多功能分子探针[3-5, 7]。聚多巴胺作为一种类黑色素聚合物, 且相较于天然黑色素, 不仅具有相似的内源性前体、氧化过程和理化性质, 而且成本低廉、工艺简单, 具有参与合成理想的多功能分子探针的潜力[5, 9]。此外, 聚多巴胺对固体表面的强力吸附作用和表面丰富的活性基团, 能改良材料的生物相容性, 减低生物毒性[9-11], 已作为表面修饰材料广泛应用于生物医学、环境、能源等许多领域。我们将PDA修饰在经典的相变型超声造影剂(PFP@PLGA)表面, 不仅合成过程简单易行, 而且由于未使用任何有机溶剂, 工艺过程安全无毒。细胞毒性实验显示, 对于选取的多个对比剂浓度组, 细胞存活率均大于96%, 说明PFP@PLGA@PDAs的细胞毒性极低, 具有进一步生物应用和临床转化的潜力。
相变型超声对比剂克服了传统超声微泡的尺寸与造影效果之间的矛盾, 是目前医学影像学领域的研究热点[12]。结合光学和声学特性的光声成像可实现高灵敏度、高特异度的功能成像, 超声成像可实时反应解剖结构, 光声/超声双模态对比剂可结合两者的长处, 克服单一成像的固有局限性, 是目前多功能分子探针开发的热点。我们制备的PFP@PLGA@PDAs纳米粒, 大小均一, 粒径为(209.40±36.15)nm, 分散性好, 生物安全性高, 理论上能作为分子探针通过肿瘤组织血管内皮间隙(一般为380~780 nm)到达肿瘤组织的血管外细胞间质实现血管外成像。体外光声成像结果显示, PFP@PLGA@PDAs悬液具有明显的光声信号, 且信号强度随浓度增加而增加, 而对照组中各浓度的PFP@PLGAs均未见明显光声信号, 提示光声信号来源于纳米粒表面修饰的聚多巴胺, 因此PFP@PLGA@PDAs具有成为光声对比剂用于生物成像的潜力。凝胶模块中的PFP@PLGA@PDAs经激光辐照后产生了明显增强的超声回声信号, 而PFP@PLGAs组始终未见明显回声增强, 结合光镜下观察到的PFP@PLGA@PDAs纳米粒因升温发生的液-气相变, 证实了纳米粒能利用聚多巴胺的光热转换作用产生微气泡, 实现增强超声造影。裸鼠4T1移植瘤动物模型的体内成像实验也进一步证实了PFP@PLGA@PDAs的增强光声/超声双模态成像的能力。PFP@PLGA@PDAs经尾静脉注射入裸鼠体内后, 肿瘤部位的光声信号随着观察时间逐渐增强, 激光辐照肿瘤部位后能采集到增强的超声回声信号, 分析是由于PFP@PLGA@PDAs能通过高通透性和滞留效应被动靶向聚集在荷瘤鼠的肿瘤组织。此外, PFP@PLGA@PDAs的PDA表面具有丰富的氨基、苯二酚基团等功能团, 可进一步修饰合成智能响应、主动靶向的对比剂[5, 11], 这将是我们课题组下一步的研究方向。
综上, 我们通过聚多巴胺表面修饰过程制备了一种新型的相变型光声/超声双模态对比剂, 检测了其基本性质和细胞生物毒性, 成功探究了其体内外光声/超声双模态显像的能力, 为进一步诊疗一体化平台的开发及应用打下了基础。
| [1] |
王志刚. 多功能超声分子探针显像与增效高强度聚焦超声治疗[J].
临床超声医学杂志, 2017, 19(9): 577–579.
WANG Z G. Multifunctional ultrasound molecular probes for imaging and synergistic high-intensity focused ultrasound therapy[J]. J Clin Ultrasound in Med, 2017, 19(9): 577–579. DOI:10.16245/j.cnki.issn1008-6978.2017.09.001 |
| [2] |
周頔, 孙阳, 王志刚. 包裹液态氟碳的多功能纳米粒研究进展[J].
中国医学影像技术, 2016, 32(1): 138–141.
ZHOU D, SUN Y, WANG Z G. Research progress of multi-functional liquid perfluorocarbons nanoparticles[J]. Chin J Med Imaging Technol, 2016, 32(1): 138–141. DOI:10.13929/j.1003-3289.2016.01.036 |
| [3] | ZHANG L, SHENG D L, WANG D, et al. Bioinspired multifunctional melanin-based nanoliposome for photoacoustic/magnetic resonance imaging-guided efficient photothermal ablation of cancer[J]. Theranostics, 2018, 8(6): 1591–1606. DOI:10.7150/thno.22430 |
| [4] |
张亮, 姚元志, 杨珂, 等. 载黑色素脂质纳泡的制备及体外多模态显像实验研究[J].
中国医学影像技术, 2017, 33(10): 1458–1462.
ZHANG L, YAO Y Z, YANG K, et al. Preparation of melanin-based lipid nanobubbles for enhangcing multimodal imaging in vitro[J]. Chin J Med Imaging Technol, 2017, 33(10): 1458–1462. DOI:10.13929/j.1003-3289.201704096 |
| [5] | D'ISCHIA M, NAPOLITANO A, BALL V, et al. Poly-dopamine and eumelanin: from structure-property relationships to a unified tailoring strategy[J]. Acc Chem Res, 2014, 47(12): 3541–3550. DOI:10.1021/ar500273y |
| [6] | WEISSLEDER R, ROSS B D, REHEMTULLA A, et al. Molecular imaging, principles and practices[J]. Mol Imaging Biol, 2011, 13(3): 594–598. DOI:10.1007/s11307-011-0492-4 |
| [7] |
姚元志, 王志刚, 张亮, 等. 制备叶酸受体靶向载阿霉素/黑色素多功能造影剂及体外超声/光声显像[J].
中国介入影像与治疗学, 2018, 15(5): 286–290.
YAO Y Z, WANG Z G, ZHANG L, et al. Preparation and in vitro ultrasound/photoacoustic imaging of folate receptor-targeted, doxorubicin and melanin-loaded multifunctional contrast media[J]. Chin J Interv Imaging Ther, 2018, 15(5): 286–290. DOI:10.13929/j.1672-8475.201710002 |
| [8] |
骆三, 查正宝, 李妍妍, 等. 光声成像造影剂的研究进展[J].
现代生物医学进展, 2014, 14(25): 4974–4977.
LUO S, ZHA Z B, Li Y Y, et al. The research progress of photoacoustic imaging contrast agents[J]. Prog Mod Biomedi, 2014, 14(25): 4974–4977. DOI:10.13241/j.cnki.pmb.2014.25.045 |
| [9] | HO C C, DING S J. The pH-controlled nanoparticles size of polydopamine for anti-cancer drug delivery[J]. J Mater Sci Mater Med, 2013, 24(10): 2381–2390. DOI:10.1007/s10856-013-4994-2 |
| [10] | JU K Y, KANG J, PYO J, et al. PH-induced aggregated melanin nanoparticles for photoacoustic signal amplification[J]. Nanoscale, 2016, 8(30): 14448–14456. DOI:10.1039/c6nr02294d |
| [11] | LIU J S, XU H, TANG X, et al. Simple and tunable surface coatings via polydopamine for modulating pharmacokinetics, cell uptake and biodistribution of polymeric nanoparticles[J]. Rsc Advances, 2017, 7(26): 15864–15876. DOI:10.1039/C7RA01354J |
| [12] | DENG L M, CAI X J, SHENG D L, et al. A laser-activated biocompatible theranostic nanoagent for targeted multimodal imaging and photothermal therapy[J]. Theranostics, 2017, 7(18): 4410–4423. DOI:10.7150/thno.21283 |
| [13] | KIM J, LEE D, JUNG U, et al. Photoacoustic imaging platforms for multimodal imaging[J]. Ultrasonography, 2015, 34(2): 88–97. DOI:10.14366/usg.14062 |



