2. 400042 重庆,陆军军医大学(第三军医大学)第三附属医院野战外科研究所重症医学科;
3. 735018 甘肃酒泉,95877部队医院内科
2. Intensive Care Unit, Institute of Surgery Research, Third Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042;
3. Department of Internal Medicine, Hospital of Troop 95877, Jiuquan, Gansu Province, 735018, China
我国2014-2017年高血压病流行病学调查显示:35~75岁人群中高血压病患病率为44.7%,且知晓率、治疗率、控制率皆低[1],高血压病及其并发症已经成为危害我国人民健康的第一位危险因素。肾脏是人体调节血压的重要器官,其中肾素-血管紧张素系统(Renin-angiotensin system,RAS)发挥着至关重要的作用。肾脏血管紧张素Ⅱ1型受体(Angiotensin Ⅱ type 1 receptor,AT1R)是RAS的重要组成部分,研究表明AT1R的表达和激活是导致尿钠排泄功能受损、引起血压增高的重要因素[2]。已有研究提示氧化应激水平增高是AT1R表达和功能增强的重要原因[3]。我们知道氧化应激与线粒体功能密切相关,线粒体功能障碍导致细胞内活性氧(Reactive oxygen species,ROS)增加[4],但线粒体本身功能与高血压发生之间的关系尚不完全清楚。我们前期研究发现原发性高血压大鼠(Spontaneously hypertensive rats,SHR)肾脏血管紧张素Ⅱ活性增高[5],而AngⅡ诱导的高血压大鼠模型的肾脏近曲小管(Renal proximal tubule,RPT)18ku转位蛋白(translocator protein,TSPO)表达明显上调[6],TSPO系线粒体外膜蛋白。既往研究提示,在应激介导的高血压大鼠模型中,肾脏TSPO与肾素血管紧张素系统(RAS)关系密切[7],但TSPO与AT1R之间的确切关系尚未见报道。本研究拟采用与SHR同源的正常血压大鼠(Wistar-Kyoto,WKY)和SHR,通过检测肾脏TSPO表达及定位,使用TSPO抑制剂(Ro5-4864)研究TSPO对血压、尿量、尿钠、肾脏AT1R表达和功能的影响,以期阐明TSPO在高血压发生发展中的重要作用,为高血压的防治提供新的靶点。
1 材料与方法 1.1 主要器材和试剂本实验采用的器材和试剂有:无创鼠尾测压仪(森西万通科技北京有限公司),大鼠代谢笼(玉研仪器公司),尿液分析仪(龙鑫科技有限公司),激光共聚焦显微镜(奥林巴斯公司),手术显微镜(公司),显微手术器械(上海伊沐医疗器械有限公司),血压监测仪(迈瑞公司)。抗TSPO抗体(Genetex公司、Santacruz公司),抗VDAC1抗体(Santacruz公司),抗COX4抗体(Abcam公司),抗AT1R抗体(Abcam公司),抗GAPDH抗体(ABclonal公司),Mito-tracker(Thermo Fisher公司),Ro5-4864(Sigma公司),坎地沙坦(Santa cruz公司),BSA (Sigma公司),BCA试剂盒(invitrogen公司),免疫组化试剂盒(博士德生物科技公司)。
1.2 模型分组及处理方法本实验所用雄性WKY和SHR均购自北京维通利华公司,在本单位动物实验中心适应饲养2周后开始实验。14周龄的WKY大鼠(体质量250~270 g)4只、14周龄的SHR大鼠(体质量250~270 g)大鼠16只。4只WKY大鼠、随机选择4只SHR大鼠,检测肾脏组织TSPO蛋白的表达及其定位。剩余12只SHR大鼠随机分成2组,TSPO抑制组和对照组(n=6),TSPO抑制组SHR大鼠每日腹腔注射Ro5-4864 (TSPO抑制剂)0.5 mg/kg,对照组腹腔注射等体积生理盐水。
1.3 无创鼠尾血压测定采用尾套法大鼠尾动脉血压测定方法。在进行有效的血压测量前,大鼠先进行3次适应性测量训练,同时,血压测量时间固定在每天15:00~18:00进行。静息时,保持室温25 ℃,固定笼37.5 ℃预热10 min,将清醒大鼠放入固定笼中,大鼠静息后,将无创测压仪的尾部气囊置于鼠尾根部,信号波形稳定后,重复测量血压并记录。每只大鼠间隔3 min测量血压1次,总共5次,取平均值进行数据分析。
1.4 肾脏组织固定、包埋及切片戊巴比妥钠(50 mg/kg)腹腔注射,大鼠麻醉成功后取出肾脏,剖成2半,生理盐水冲洗,将其中一半放入4%多聚甲醛固定24 h,脱水、石蜡包埋、切片、漂片、防脱载玻片固定肾脏组织,晾干备用;另一半置于液氮保存备用。
1.5 免疫组化检测肾脏TSPO表达将上述制备好的组织切片进行免疫组化染色,严格按照试剂说明书操作,PBS冲洗3次×5 min;滴加3%H2O2,室温静置10 min;再次PBS冲洗3次×5 min;血清封闭20 min;滴加Ⅰ抗,4 ℃孵育过夜。次日复温30 min;PBS冲洗3次×5 min;滴加Ⅱ抗,室温孵育15 min;PBS冲洗载玻片,3次×5 min;滴加辣根酶标记链霉卵白素工作液,室温孵育15 min;PBS冲洗3次× 5 min;DAB显色剂显色;自来水充分冲洗;苏木精复染细胞核1 min;自来水充分冲洗,中性树胶封片。待显微镜下观察。
1.6 免疫荧光检测TSPO的组织定位取上述制备好的大鼠肾脏组织石蜡切片,脱蜡,抗原修复。PBS冲洗3次×5 min;1% BSA封闭,室温静置1 h;滴加抗VDAC1抗体(1 :300),于湿盒内4 ℃过夜。次日复温30 min,PBS冲洗3次×5 min。滴加红色荧光二抗(1 :100)孵育1 h。PBS冲洗3次×5 min。再加抗TSPO抗体(1 :300),4 ℃孵育过夜。次日复温30 min,PBS冲洗3次×5 min。滴加绿色荧光二抗(1 :100)孵育1 h。PBS冲洗3次×5 min。滴加DAPI核染3 min,PBS冲洗4次×5 min。晾干,滴加荧光淬灭剂,避光保存。待激光共聚焦镜下观察。
1.7 代谢笼尿液分析收集尿液之前将大鼠置于代谢笼适应生存1 d,正常进食饮水。开始收集大鼠尿液时,撤去饲料,仅给予饮水,代谢笼下连接离心管以收集24 h尿液,收集尿液期间维持环境温度在25 ℃左右。收集尿液完毕,2 500×g低温离心尿液10 min,取其上清,测其体积,-20 ℃保存备用。
1.8 肾脏AT1R功能测定本实验采用实验室成熟的肾上腺动脉灌注AT1R阻滞剂坎地沙坦的方法,检测肾脏AT1R功能。具体实验方法参见我们之前的研究[8]。按照大鼠体重腹腔注射戊巴比妥钠(50 mg/kg)麻醉,成功后将其固定在恒温毯上,维持温度在37 ℃。切开气管,将PE-240管插入气管进行辅助呼吸;随后将PE-50管置入左侧颈静脉用于输液,将PE-10管置入左侧颈静脉用于麻醉维持;将PE-50管置入右侧颈动脉用于持续动态监测大鼠血压及心率。之后将PE-10管置入右侧肾上腺动脉以输注实验药物。最后,PE-10管分别置入双侧输尿管以收集尿液。手术结束后,2.5%戊巴比妥钠以0.1 mL/h持续泵入维持麻醉,生理盐水以1%体质量持续泵入,平衡1 h。平衡结束,通过导管向肾上腺动脉内输注溶剂或者药物,输注速度40 μL/h。实验分为3个阶段,系对照期(输注生理盐水)、实验期(输注坎地沙坦)、恢复期(输注生理盐水),每个阶段收集尿量40 min,注意维持大鼠动脉血压及心率稳定。实验完毕,计算并测量各阶段尿流速及尿钠排泄率。
1.9 RPT细胞的培养RPT细胞株培养采用10%胎牛血清DMEM/F-12培养基。细胞达到70%~80%融合度时换无血清培养基2 h后,采用TSPO抑制剂(Ro-4864)处理细胞,然后提取蛋白进行实验。
1.10 Western-blot检测AT1R表达用组织匀浆器于冰上研磨两组大鼠肾脏组织进行总蛋白的提取,蛋白质浓度测定使用BCA法。将100 μg蛋白进行SDS-PAGE电泳,加入抗AT1R抗体(1 :300)4 ℃孵育过夜。0.1%的TBS缓冲液洗膜3次×10 min。加入二抗IgG(1 :15 000)避光室温孵育1.5 h,0.1%的TBS缓冲液洗膜3次×15 min。使用荧光扫描仪对硝酸纤维素膜进行扫描,应用Quantity One软件测量、计算AT1R与GAPDH灰度比值。
1.11 统计学方法使用SPSS 17.0软件进行统计学分析,计量资料数据以x±s表示,两组间比较使用t检验,组内比较使用单因素方差分析。
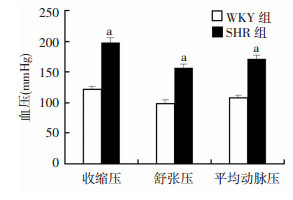
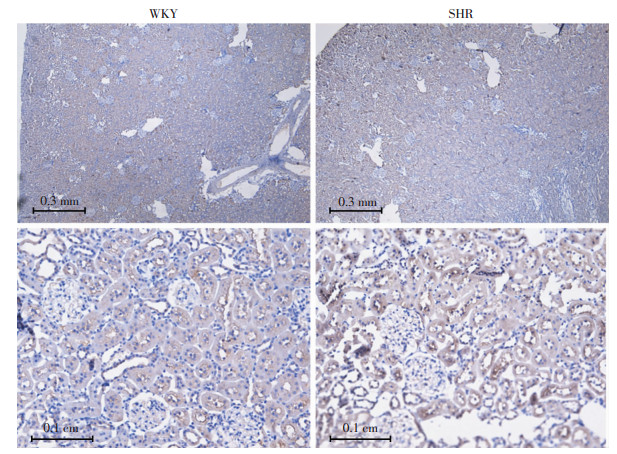
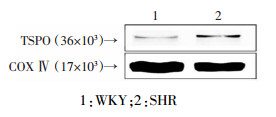
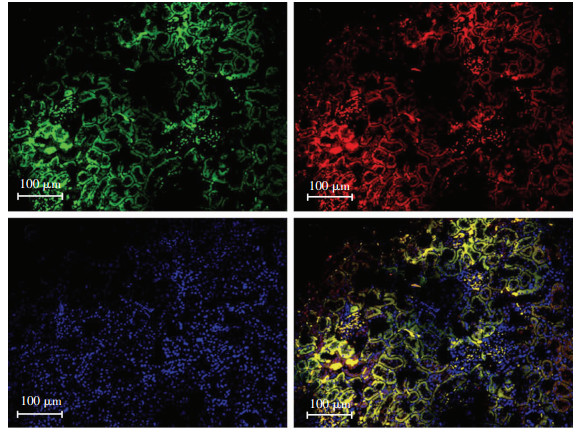
2 结果 2.1 WKY和SHR肾脏TSPO表达量及定位结果显示SHR大鼠收缩压、舒张压和平均动脉血压均高于WKY大鼠(P<0.05,图 1)。免疫组化结果显示TSPO在肾脏广泛分布,与WKY大鼠比较,TSPO在SHR大鼠肾脏皮质特别是近曲小管的表达显著增加(图 2)。近曲小管是调节水钠重吸收的重要部位,提示TSPO有可能通过水钠调节参与高血压的发生。免疫印迹结果表明,SHR大鼠肾脏组织TSPO表达较WKY大鼠明显上调[(1.9±0.7)vs.(0.5±0.3),P<0.05](图 3)。同时,激光共聚焦结果显示肾脏TSPO与线粒体蛋白VDAC1共定位(图 4),说明TSPO定位于线粒体。
|
| a:P<0.05,与WKY比较 图 1 14周龄WKY和SHR大鼠血压情况(x±s,n=4) |
|
| 图 2 免疫组化显示TSPO在WKY和SHR大鼠肾脏(A)及肾脏皮质(B)的分布 |
|
| 1:WKY;2:SHR 图 3 免疫印迹显示TSPO在WKY和SHR大鼠肾脏组织中的表达(x±s,n=4) |
|
| A:TSPO;B:VDAC1;C:DAPI;D:Merge 图 4 激光共聚焦显示TSPO在大鼠细胞中的定位 |
2.2 TSPO对原发性高血压大鼠血压的影响
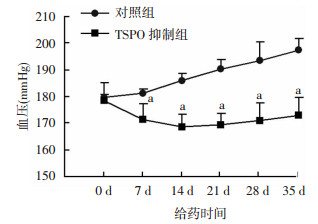
与对照组相比,7、14、21、28、35 d TSPO抑制组收缩压显著下降(P<0.05,图 5),说明TSPO可促进SHR大鼠血压升高。
|
| a:P<0.05,与对照组比较 图 5 抑制TSPO功能对SHR大鼠收缩压的影响(x±s,n=6) |
2.3 TSPO对SHR尿钠排泄的影响
TSPO抑制组24 h尿量及尿钠排泄量较对照组明显增加(P<0.05,表 1)。同时TSPO抑制组肾脏AT1R蛋白表达较对照组显著下调[(0.4±0.1)vs.(1.9±0.2),P<0.05](图 6)。
| 组别 | 尿量(ml/kg) | 24 h尿钠排泄(mmol/kg) | |||
| 给药前 | 给药后 | 给药前 | 给药后 | ||
| 对照组 | 15.3±5.4 | 13.5±3.5 | 1.0±0.2 | 1.0±0.2 | |
| TSPO抑制组 | 15.8±5.3 | 21.7±4.5a | 0.9±0.2 | 1.5±0.3a | |
| a:P<0.05,与对照组比较 | |||||

|
| 1:对照组;2:TSPO抑制组 图 6 TSPO抑制剂对SHR大鼠肾脏AT1R蛋白表达的影响 |
2.4 TSPO对SHR大鼠肾脏AT1R功能的影响
与对照组相比,肾上腺动脉给予坎地沙坦灌注后,TSPO抑制组尿流速及尿钠排泄率显著降低(P<0.05,表 2)。
| 组别 | 尿流速(μL /min) | 尿钠排泄率(mmol/min) | |||||
| 对照期 | 实验期 | 恢复期 | 对照期 | 实验期 | 恢复期 | ||
| 对照组 | 3.6±2.9 | 13.3±2.5 | 23.6±8.0 | 0.2±0.1 | 1.6±0.6 | 2.8±1.0 | |
| TSPO抑制组 | 2.2±0.5 | 5.9±2.0a | 8.6±3.3a | 0.2±0.1 | 0.6±0.2a | 1.2±0.2a | |
| a:P<0.05,与对照组比较 | |||||||
2.5 TSPO对RPT细胞AT1R表达的影响
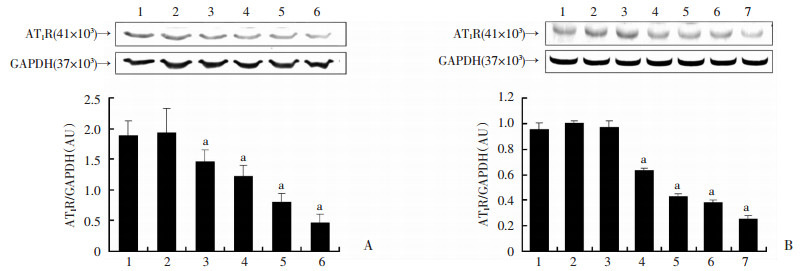
细胞实验研究发现TSPO抑制剂对AT1R蛋白表达呈浓度和时间依赖的抑制(P<0.05,图 7),进一步说明TSPO就是通过AT1R促进尿钠重吸收导致SHR大鼠血压升高。
|
| A:Ro5-486410-8 mmol/L处理RPT细胞不同时间对AT1R蛋白表达的影响1:对照;2:2 h;3:8 h;4:12 h;5:24 h;6:48 h;B:Ro5-4864不同浓度处理RPT细胞24 h对AT1R蛋白表达的影响1:对照;2:10-11 mmol/L;3:10-10 mmol/L;4:10-9 mmol/L;5:10-8 mmol/L;6:10-7 mmol/L;7:10-6 mmol/L。a:P<0.05,与对照比较 图 7 TSPO抑制剂降低SHR RPT细胞AT1R蛋白表达 |
3 讨论
肾脏对钠盐排泄和重吸收的调控是人体血压调节的重要机制。肾脏钠盐重吸收增多是导致血压升高的重要原因[9]。我们前期研究发现,增加钠盐排泄可以有效降低血压[10],说明钠盐代谢异常是高血压病的重要发病机制。而本研究发现SHR肾脏皮质特别是近曲小管的TSPO表达显著增加;腹腔注射TSPO抑制剂可通过增加尿量和尿钠排泄显著降低SHR的收缩压;肾上腺动脉灌注ATIR抑制剂可显著降低TSPO抑制组尿流速和尿钠排泄率,动物及细胞实验均显示TSPO促进肾脏ATIR的表达。这提示SHR肾脏TSPO的高表达在高血压的发生发展过程中发挥重要作用。
已有研究表明原发性高血压大鼠肾脏氧化应激水平增强[11],而后者是AT1R表达和功能增强的重要原因[12]。线粒体是氧化应激的主要参与者,线粒体功能障碍导致细胞内ROS增加[13]。近来研究发现原发性高血压大鼠肾脏AngⅡ水平增高,而AngⅡ介导的高血压大鼠肾脏近曲小管TSPO表达明显上调[6]。TSPO是一种包含169个氨基酸、富含色氨酸的疏水性线粒体外膜蛋白,相对分子质量约18×103,由5个异喹啉结合蛋白(Isoquinoline binding protein,IBP)组成,带有5个跨膜区,TSPO与氧化应激关系密切[14]。在多种高血压动物模型中,肾脏TSPO表达显著上调。在应激介导的高血压模型中,肾脏TSPO表达增加独立于垂体-下丘脑-肾上腺轴和交感神经系统,但给予ACEI卡托普利抑制RAS系统活性后,可阻断肾脏TSPO上调;AngⅡ介导的高血压大鼠,TSPO在肾脏皮质/近曲小管增加明显,与肾素合成部位类似,TSPO的变化可能是由肾素分泌后局部作用于近曲小管产生的AngⅡ造成;在排除性腺影响后,较雄性大鼠,应激环境中雌性大鼠肾脏TSPO表达下降,RAS活性降低,高血压的发生率明显低于雄性大鼠。上述研究提示在SHR肾脏组织中高表达的TSPO可能通过RAS影响尿钠排泄进而调控血压[7]。RAS是影响肾脏尿钠重吸收的重要系统,其主要生理学功能是AngⅡ通过其受体AT1R发挥水钠潴留效应。前期研究表明在原发性高血压、肥胖型高血压动物模型中,肾脏AT1R表达和功能增加是尿钠重吸收增多、血压升高的重要因素[15-16]。但目前SHR肾脏TSPO的高表达与AT1R之间的关系尚无报道。
本研究发现,与WKY比较,位于SHR肾脏皮质尤其是近曲小管区的TSPO表达显著上调。由于近曲小管是调节水钠重吸收的重要部位,提示TSPO有可能通过水钠调节参与高血压的发生。通过腹腔注射TSPO抑制剂Ro5-4864的方法来研究TSPO对SHR血压的影响,结果表明TSPO可通过影响尿量及尿钠排泄率调控SHR血压。为进一步研究TSPO对钠盐调控的分子机制,采用肾上腺动脉灌注AT1R抑制剂坎地沙坦,研究结果发现TSPO抑制组的SHR尿流速及尿钠排泄率较对照组大鼠显著下降,同时AT1R表达显著降低;细胞实验发现RPT细胞AT1R蛋白表达水平对TSPO抑制剂呈时间和浓度依赖,以上均提示TSPO通过影响AT1R的功能及表达调节肾脏尿钠排泄。既往研究表明在LPS介导的高血压大鼠模型中,AT1R功能增强与其表达量增加相关,本实验结论与其一致。
综上,在原发性高血压大鼠SHR肾脏中,TSPO通过促进肾脏AT1R高表达,增强尿钠重吸收,导致血压升高。同时我们的研究也为线粒体在高血压病发生中的作用提供了新依据,为高血压病的防治提供了新的思路。
| [1] | lu J, lu Y, wang X, et al. Prevalence, awareness, treatment, and control of hypertension in China: data from 1.7 million adults in a population-based screening study (China PEACE Million Persons Project)[J]. Lancet, 2017, 390(10112): 2549–2558. DOI:10.1016/S0140-6736(17)32478-9 |
| [2] | TAMURA K, WAKUI H, AZUSHIMA K, et al. Angiotensin Ⅱ type 1 receptor binding molecule ATRAP as a possible modulator of renal sodium handling and blood pressure in pathophysiology[J]. Curr Med Chem, 2015, 22(28): 3210–3216. DOI:10.2174/0929867322666150821095036 |
| [3] | SALEEM M, PiOKKUNURI I, ASGHAR M. Superoxide increases angiotensin Ⅱ AT1 receptor function in human kidney-2 cells[J]. FEBS Open Bio, 2016, 6(12): 1273–1284. DOI:10.1002/2211-5463 |
| [4] | TANG G, ZHANG C, JU Z, et al. The mitochondrial membrane protein FgLetm1 regulates mitochondrial integrity, production of endogenous reactive oxygen species and mycotoxin biosynthesis in Fusarium graminearum: function of Fg Letm 1 in Fusarium graminearum[J]. Mol Plant Pathol, 2018, 19(7): 1595–1611. DOI:10.1111/mpp.12633 |
| [5] | PAN J, ZhANG J, ZhANG X, et al. Role of microRNA-29b in angiotensin Ⅱ-induced epithelial-mesenchymal transition in renal tubular epithelial cells[J]. Int J Mol Med, 2014, 34(5): 1381–1387. DOI:10.3892/ijmm.2014.1935 |
| [6] | BRIBES E, CASELLAS P, VIDAL H, et al. Peripheral benzodiazepine receptor mapping in rat kidney. Effects of angiotensin Ⅱ-inducedhypertension[J]. J Am Soc Nephrol, 2002, 13(1): 1–9. |
| [7] | DRUGAN R C. Peripheralbenzodiazepine receptors: molecular pharmacology to possible physiological significance in stress-induced hypertension[J]. Clin Neuropharmacol, 1996, 19(6): 475–496. DOI:10.1097/00002826-199619060-00002 |
| [8] |
彭晓玉, 罗浩, 王新全, 等. 孕期炎症刺激对子代大鼠肾脏血管紧张素Ⅱ1型受体表达及功能的影响[J].
第三军医大学学报, 2016, 38(16): 1815–1819.
PENG X Y, LUO H, WANG X Q, et al. Effect of LPS exposure during pregnancy on expression and function of renal angiotensin Ⅱ type 1 receptor in adult rat offsprings[J]. J Third Mil Med Univ, 2016, 38(16): 1815–1819. DOI:10.16016/j.1000-5404.201512082 |
| [9] | AllISON S J. Hypertension: IL-1 receptor-induced sodium reabsorption in hypertension[J]. Nat Rev Nephrol, 2016, 12(3): 126. DOI:10.1038/nrneph.2016.1 |
| [10] | WANG X, LUO H, CHEN C, et al. Prenatal lipopolysaccharide exposure results in dysfunction of the renal dopamine D1 receptor in offspring[J]. Free Radic Biol Med, 2014, 76: 242–250. DOI:10.1016/j.freeradbiomed.2014.08.010 |
| [11] | CHIEN S J, LIN K M, KUO H C, et al. Two different approaches to restore renal nitric oxide and prevent hypertension in young spontaneously hypertensive rats: l-citrulline and nitrate[J]. Transl Res, 2014, 163(1): 43–52. DOI:10.1016/j.trsl.2013.09.008 |
| [12] | SARKAR O, LI Y, ANAND-SRIVASTAVA M B. Nitric oxide attenuates overexpression of Giα proteins in vascular smooth muscle cells from SHR: Role of ROS and ROS-mediated signaling[J]. PLoS One, 2017, 12(7): e0179301. DOI:10.1371/journal.pone.0179301.eCollection2017 |
| [13] | KORNFELD O S, HWANG S, DISATNIK M H, et al. Mitochondrial reactive oxygen species at the heart of the matter: new therapeutic approaches for cardiovascular diseases[J]. Circ Res, 2015, 116(11): 1783–1799. DOI:10.1161/CIRCRESAHA.116.305432 |
| [14] | GATLIFF J, EAST D, CROSBY J, et al. TSPO interacts with VDAC1 and triggers a ROS-mediated inhibition of mitochondrial quality control[J]. Autophgy, 2014, 10(12): 2279–2296. DOI:10.4161/15548627.2014.991665 |
| [15] | LUO H, WANG X, WANG J, et al. Chronic NF-κB blockade improves renal angiotensin Ⅱ type 1 receptor functions and reduces blood pressure in Zucker diabetic rats[J]. Cardiovasc Diabetol, 2015, 14: 76. DOI:10.1186/s12933-015-0239-7 |
| [16] | JAVKHEDKAR A A, BANDAY A A. Antioxidant resveratrol restores renal sodium transport regulation in SHR[J]. Physiol Rep, 2015, 3(11): pii: e12618. DOI:10.14814/phy2.12618 |



