2. 402160 重庆,重庆医科大学附属永川医院:中心实验室
2. Central Laboratory, Yongchuan Hospital Affiliated to Chongqing Medical University, Chongqing, 402160, China
乳腺癌是全球女性常见的恶性肿瘤之一,以40~60岁中老年妇女发病较多,其发病率自20世纪70年代末开始呈现上升趋势;乳腺癌也是我国女性发病率最高的癌种[1]。手术切除是如今治疗乳腺癌最主要手段,但乳腺癌极易复发与转移增加该病的死亡率,成为乳腺癌治疗的一大瓶颈。转化生长因子β1(transforming growth factor-β1,TGF-β1)不仅参与创伤愈合、组织修复和重塑等生理过程,也参与免疫抑制、组织纤维化和肿瘤发生与转移等病理过程[2]。丙泊酚,其化学名为2, 6-双异丙基苯酚,目前普遍用于临床手术患者、麻醉诱导、麻醉维持、ICU危重患者镇静。研究表示丙泊酚还具有多重非麻醉作用,包括抗氧化性抑制体内外炎症过程、止吐、神经保护以及抗肿瘤[3]等作用。近年来,全球对丙泊酚抗肿瘤作用及其潜在机制进行广泛研究,表明丙泊酚能诱导非小细胞肺癌[4-6]、原发性肝癌[7]、胰腺癌[8]、胃癌[9-10]等肿瘤细胞发生凋亡,并抑制其增殖和转移等。丙泊酚对乳腺癌转移的抑制作用也有报道[11],但是否通过TGF-β1抑制乳腺癌转移尚不清楚。
因此,本实验拟联合丙泊酚与TGF-β1对乳腺癌MCF-7细胞进行共同培养,探究丙泊酚是否是通过下调TGF-β1抑制乳腺癌MCF-7细胞转移。
1 材料与方法 1.1 材料乳腺癌细胞MCF-7购自美国模式培养物集存库(American Type Culture Collection,ATCC);胎牛血清购自美国PAA公司;RPMI1640培养基、胰酶购自美国Gibco公司;青霉素和链霉素购自中国碧云天公司;丙泊酚购自中国阿拉丁试剂公司;二甲亚砜(DMSO)购自中国生工生物工程(上海)股份有限公司;TGF-β1购自中国碧云天公司;RIPA细胞裂解液和BCA蛋白定量试剂盒购自中国博士德生物有限公司;Matrigel购自美国BD公司;Transwell小室购自美国Conring公司;CCK-8试剂盒购自日本株式会社同仁化学研究所;兔抗人TGF-β1、E-cadherin、MMP-9购自美国Cell signal technology公司;兔抗人GAPDH多克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司;PVDF膜和增强型化学发光试剂(enhanced chemiluminescence system, ECL)均购自美国Millipore公司。
1.2 细胞培养乳腺癌MCF-7细胞使用RPMI1640培养基(含10%胎牛血清和10%青-链霉素)于37℃,5% CO2的培养箱中培养,取稳定对数生长期的细胞进行后续研究。
1.3 蛋白质印迹法检测MCF-7细胞蛋白表达水平TGF-β1和丙泊酚作用MCF-7细胞48 h后,收集细胞,采用RIPA细胞裂解液提取各实验组的总蛋白,BCA蛋白定量试剂盒进行蛋白定量。取30 μg蛋白进行10% SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉封闭后分别与TGF-β1、E-cadherin、MMP-9和GAPDH(稀释比例均为1 :1 000)特异性一抗反应,于4 ℃摇床孵育过夜。TBST漂洗3次,每次10 min,后分别加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释比例均为1 :5 000)室温孵育1 h;TBST漂洗3次,每次10 min;按说明书配置ECL显影液(发光液),采用BIO-RAD图像分析系统(Bio-Rad公司,美国)进行分析。
1.4 血管拟态形成试验观察MCF-7细胞诱导新生血管形成能力实验前2 h,用基质胶(预先用RPMI1640培养基1 :1稀释,100 μL/孔)铺板于48孔板中,于4 ℃静置30 min,37 ℃孵箱静置1 h。将丙泊酚和TGF-β1作用48 h后的MCF-7细胞消化离心,重悬铺板于已包裹基质胶的48孔板上(约4×105个细胞/孔),每组设3个复孔。细胞培养箱中孵育6~8 h,显微镜观察每组的血管管腔形成数量。
1.5 Transwell迁移实验检测MCF-7细胞迁移能力收集TGF-β1和丙泊酚处理48 h后的细胞,制备悬液。取200 μL密度为2.5×105个/mL的细胞悬液接种于小室上室,下室加入600 μL含20%胎牛血清的RPMI1640培养基。恒温孵育箱孵育24 h后,取出小室,无菌PBS冲洗2次,棉签拭去小室上层细胞,甲醇固定,结晶紫染色,清水漂洗,室温风干,刀片揭膜,中性树胶封固。于倒置显微镜下观察,取5个不同视野进行拍照观察。
1.6 Matrigel侵袭实验检测MCF-7细胞侵袭能力Matrigel基质胶与无血清RPMI1640培养基按1 :7的比例混合后加入Transwell上室,每孔40 μL,37 ℃温育4~5 h使其凝成胶状。收集TGF-β1和丙泊酚处理48 h后的细胞,制备悬液。取200 μL密度为5×105个/mL的细胞悬液接种于侵袭小室上室,下室加入600 μL含20%胎牛血清的RPMI1640培养基。恒温孵育箱孵育24 h后,取出小室,无菌PBS冲洗2次,棉签拭去小室上层细胞,甲醇固定,结晶紫染色,清水漂洗,室温风干,刀片揭膜,中性树胶封固。于倒置显微镜下观察,取5个不同视野进行拍照观察。
1.7 统计学分析所有实验结果均保证重复3次,数据统计采用SPSS 22.0软件进行分析,计量资料采用x±s表示,多组间比较采用one-way ANOVA,组间比较采用LSD法,两两比较采用t检验。检验水准:α=0.05。
2 结果 2.1 丙泊酚下调乳腺癌MCF-7细胞中TGF-β1蛋白表达水平丙泊酚处理MCF-7细胞后,Western blot检测TGF-β1(45×103)蛋白表达水平如图 1所示:丙泊酚抑制TGF-β1蛋白表达,且随着丙泊酚浓度的增加,对TGF-β1蛋白的抑制能力逐渐增加(P<0.05)。
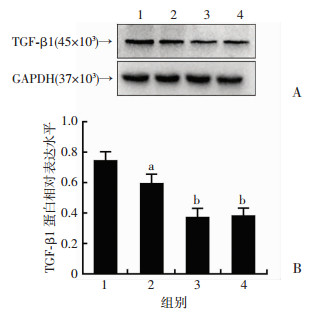
|
| 1:对照组;2:丙泊酚12.5 μg/mL组;3:丙泊酚25 μg/mL组;4:丙泊酚50 μg/mL组A:Western blot检测结果;B:半定量分析结果a:P<0.05, b:P<0.01, 与对照组比较 图 1 Western blot检测TGF-β1蛋白在丙泊酚不同浓度处理下的表达水平 |
2.2 丙泊酚对乳腺癌MCF-7细胞E-cadherin、MMP-9蛋白表达情况
丙泊酚处理MCF-7细胞后,Western blot检测结果显示:丙泊酚处理后的细胞与对照组细胞相比,上皮细胞相关蛋白E-cadherin(135×103)表达水平明显增加(P<0.05),基质金属蛋白酶MMP-9(92×103)蛋白表达水平明显降低(P<0.05,图 2)。

|
| 1:对照组;2:DMSO组;3:丙泊酚25 μg/mL组A,C:Western blot检测结果;B,D:半定量分析结果;a:P<0.05, b:P<0.01, 与对照组比较 图 2 丙泊酚对MCF-7细胞E-cadherin、MMP-9蛋白表达水平的影响 |
2.3 丙泊酚抑制乳腺癌MCF-7细胞迁移和侵袭
丙泊酚处理MCF-7细胞后,采用Transwell迁移实验和Transwell基质胶侵袭实验对乳腺癌细胞迁移和侵袭能力进行测定结果显示(图 3):丙泊酚处理的MCF-7迁移实验穿膜细胞数(84.7±4.5)与对照组穿膜细胞数(163.3±8.4)相比显著降低(P<0.01);丙泊酚处理MCF-7细胞基质胶侵袭实验穿膜细胞数(130.7±4.3)与对照组(190.7±8.4)相比也显著降低(P<0.01)。
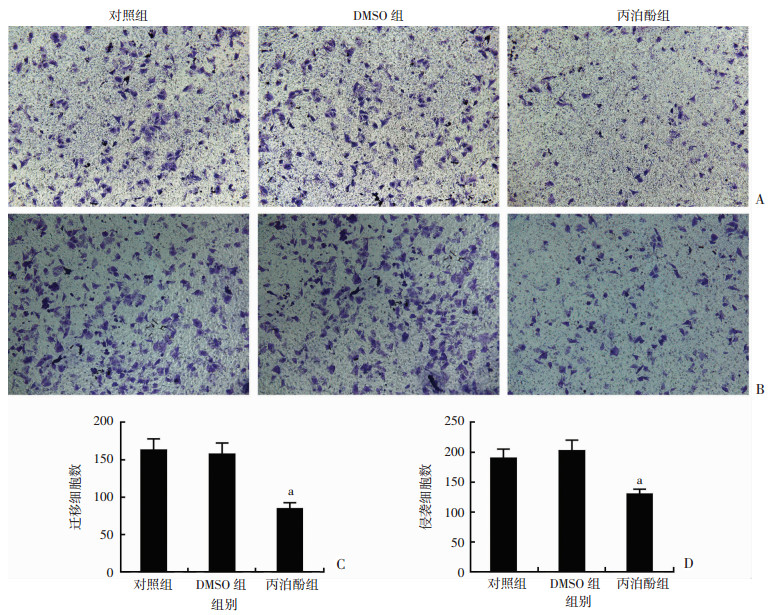
|
| A: Transwell迁移实验检测结果(结晶紫×100);B: Transwell侵袭实验检测结果(结晶紫×100); C:各组迁移细胞数变化; D:各组侵袭细胞数变化a: P<0.01,与对照组比较 图 3 丙泊酚对MCF-7细胞迁移、侵袭能力的影响 |
2.4 丙泊酚抑制肿瘤诱导新生血管生成
丙泊酚处理MCF-7细胞后,采用血管拟态形成实验对新生血管数量进行测定,结果显示:丙泊酚处理组新生血管管腔数量(53.7±5.6)与对照组(108.0±7.6)相比明显降低(P<0.01,图 5),说明丙泊酚能够抑制肿瘤诱导新生血管生成能力。
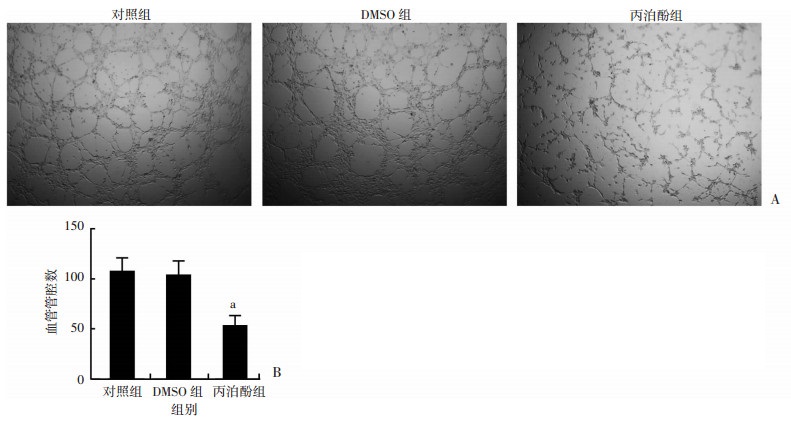
|
| A:血管拟态形成实验检测结果(×40);B:各组血管管腔形成数量变化; a:P<0.01, 与对照组比较 图 4 丙泊酚对MCF-7细胞促进新生血管形成能力的影响 |
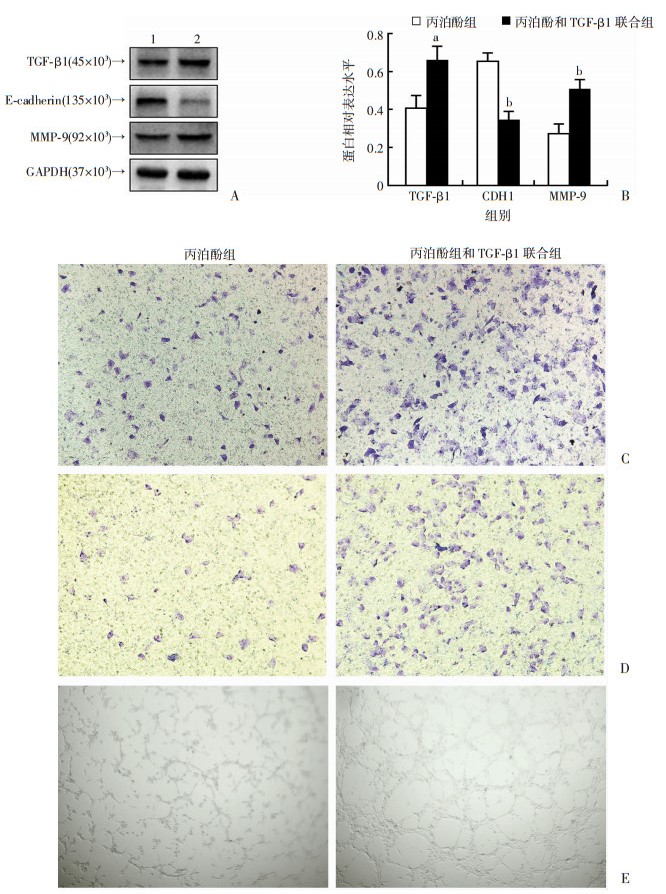
|
| A:Western blot检测结果1:丙泊酚组;2:丙泊酚和TGF-β1联合组;B:半定量分析结果;C: Transwell迁移实验检测结果(结晶紫×100); D: Transwell侵袭实验检测结果(结晶紫×100); E:血管拟态形成实验检测结果(×40); a:P<0.05, b:P<0.01,与丙泊酚组比较 图 5 TGF-β1对丙泊酚抑制MCF-7细胞转移作用的影响 |
2.5 TGF-β1能逆转丙泊酚对MCF-7细胞转移的抑制作用
TGF-β1和丙泊酚共同处理后,与丙泊酚处理相比,TGF-β1蛋白(P<0.05)和基质金属蛋白酶MMP-9(P<0.01)表达增加、上皮细胞标志蛋白E-cadherin (P<0.001)表达降低。迁移实验穿膜细胞数(180.3±9.6)、侵袭实验穿膜细胞数(172.0±10.3)和新生血管管腔形成数量(107.3±8.6)与丙泊酚处理组(100.7± 4.9)、(57.3±5.7)、(50.7±5.8)相比明显增多(P<0.01、P<0.05、P<0.05)。说明TGF-β1能逆转丙泊酚对MCF-7的抑制作用,图 5。
3 讨论乳腺癌是中国女性最常见的癌症,近年乳腺癌发病率占女性癌症发病率的30%,且死亡率也有明显的上升趋势。目前包括乳腺癌在内的多种实体肿瘤治疗首选是手术切除,但肿瘤的高侵袭性决定了术后肿瘤的复发与转移是难以避免的。肿瘤的远处转移升高了癌症患者的死亡率,如何抑制肿瘤转移,降低死亡率是目前研究的热点话题。
丙泊酚是目前临床常用的围手术期静脉麻醉药,主要用于全身麻醉的诱导和维持。研究表明丙泊酚除了多重麻醉作用外,还具有抗肿瘤作用。丙泊酚通过抑制基质金属蛋白酶抑制剂(MMP-2、MMP-9)表达及促进TIMP-1蛋白表达降低肝癌HepG2细胞的活性和侵袭能力[12],通过上调microRNA9在卵巢癌ES-2细胞的表达抑制NF-κB活化及其下游MMP-9表达,达到抑制ES-2细胞生长侵袭的目的[13],通过下调SOX4表达抑制子宫内膜癌的生长,迁移和侵袭,同时促进癌细胞凋亡[14]等。
肿瘤转移是肿瘤发展中的关键步骤,是导致乳腺癌患者死亡的主要原因。肿瘤转移是一个多因素,多阶段的复杂过程,依赖肿瘤细胞的生长,迁移,侵袭和微环境血管生成等多个过程的相互作用。研究发现在乳腺癌细胞中TGF-β1和TGF-β3高表达,且多以TGF-β1形式促进乳腺癌发生、发展[15],TGF-β1的过度表达与细胞癌变、肿瘤新生血管生成、上皮细胞-间充质转化、肿瘤远处转移密切相关[16],证明TGF-β1信号通路是目前公认的促进肿瘤转移的主要信号通路[17]。体外实验表明上皮细胞样标志蛋白E-cadherin、基质金属蛋白酶MMP-9等蛋白均为TGF-β1调控的下游蛋白,E-cadherin作为一种重要的细胞黏附分子,被人视作是肿瘤抑制因子,E-cadherin表达降低导致细胞极性和细胞间的紧密连接缺失,细胞获得了迁移能力,脱落上皮群体,是肿瘤迁移和侵袭的前提;而基质金属蛋白酶MMP-9能降解细胞外基质,促使肿瘤细胞突破基底膜融入周围细胞或经血液淋巴液发生威胁生命的远处转移。
本研究采用Western blot,transwell迁移、侵袭实验及血管拟态形成实验检测丙泊酚作用于MCF-7细胞后对MCF-7细胞转移能力的影响,结果显示丙泊酚能显著下调MMP-9蛋白及上调E-cadherin蛋白表达水平,阻止MCF-7乳腺癌细胞穿过transwell小室,降低了肿瘤细胞穿过基质胶的能力,抑制了肿瘤细胞诱导的新生血管形成的能力,这些结果表明丙泊酚能抑制乳腺癌的转移。同时发现丙泊酚能够以剂量依赖方式下调TGF-β1蛋白表达水平,与已研究证实的下调TGF-β1的表达,能抑制食管癌细胞迁移和侵袭能力[18]相一致。为进一步阐明丙泊酚抑制MCF-7细胞转移的机制,在丙泊酚处理时加入TGF-β1,上调TGF-β1蛋白表达,结果发现MMP-9蛋白表达显著回升,E-cadherin蛋白表达下降;且丙泊酚对MCF-7细胞穿过transwell小室、穿过基质胶以及诱导新生血管生成的抑制能力均减弱。以上结果证实丙泊酚通过TGF-β1发挥抑制乳腺癌细胞MCF-7转移的作用,表明丙泊酚是目前乳腺癌手术围手术期最适用的麻醉药。
综上所述,丙泊酚下调TGF-β1能降低乳腺癌MCF-7细胞迁移、侵袭与肿瘤新生血管形成能力,抑制乳腺癌细胞转移。但对下调TGF-β1表达机制尚不清楚,需要进行下一步研究验证。
| [1] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | DERYNCK R, ZHANG Y E. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958): 577–584. DOI:10.1038/nature02006 |
| [3] | WANG J, CHENG C S, LU Y, et al. Novel findings of anti-cancer property of propofol[J]. Anticancer Agents Med Chem, 2018, 18(2): 156–165. DOI:10.2174/1871520617666170912120327 |
| [4] | LIU W Z, LIU N. Propofol inhibits lung cancer A549 cells growth and epithelial-mesenchymal transition process by up-regulation of microRNA-1284[J]. Oncol Res, 2018, 5. DOI: 10.3727/096504018X15172738893959.[Epubaheadofprint] |
| [5] | 叶慧瑾, 白建杰, 郭培培, 等. 丙泊酚下调水通道蛋白3和基质金属蛋白酶-9表达抑制人肺癌A549细胞的侵袭力[J]. 南方医科大学学报, 2016, 36(9): 1286–1290. DOI:10.3969/j.issn.1673-4254.2016.09.22 |
| [6] | YANG N, LIANG Y, YANG P, et al. Propofol inhibits lung cancer cell viability and induces cell apoptosis by upregulating microRNA-486 expression[J]. Braz J Med Biol Res, 2017, 5, 50(1): e5794. DOI: 10.1590/1414-431X20165794. |
| [7] | OU W, LV J, ZOU X, et al. Propofol inhibits hepatocellular carcinoma growth and invasion through the HMGA2-mediated Wnt/β-catenin pathway[J]. Exp Ther Med, 2017, 13(5): 2501–2506. DOI:10.3892/etm.2017.4253 |
| [8] | DU Q H, XU Y B, ZHANG M Y, et al. Propofol induces apoptosis and increases gemcitabine sensitivity in pancreatic cancer cells in vitro by inhibition of nuclear factor-κB activity[J]. World J Gastroenterol, 2013, 19(33): 5485–5492. DOI:10.3748/wjg.v19.i33.5485 |
| [9] | YANG C, GAO J, YAN N, et al. Propofol inhibits the growth and survival of gastric cancer cells in vitro through the upregulation of ING3[J]. Oncol Rep, 2017, 37(1): 587–593. DOI:10.3892/or.2016.5218 |
| [10] | PENG Z, ZHANG Y. Propofol inhibits proliferation and accelerates apoptosis of human gastric cancer cells by regulation of microRNA-451 and MMP-2 expression[J]. Genet Mol Res, 2016, 15(2). DOI:10.4238/gmr.15027078 |
| [11] | YU B, GAO W, ZHOU H, et al. Propofol induces apoptosis of breast cancer cells by downregulation of miR-24 signal pathway[J]. Cancer Biomark, 2018, 21(3): 513–519. DOI:10.3233/CBM-170234 |
| [12] |
陈军, 赵文晖, 宋张骏, 等. 丙泊酚对HCC827肺癌细胞的增殖和凋亡的影响[J].
西安交通大学学报(医学版), 2014, 35(03): 361–363, 384.
CHEN J, ZHAO W H, SONG Z J, et al. Effects of propofol on proliferation and apoptosis of HCC827 lung cancer cells[J]. J Xi'an Jiaotong Univ(Med Sci), 2014, 35(03): 361–363, 384. DOI:10.7652/jdyxb201403017 |
| [13] | HUANG X, TENG Y, YANG H, et al. Propofol inhibits invasion and growth of ovarian cancer cells via regulating miR-9/NF-κB signal[J]. Braz J Med Biol Res, 2016, 49(12). DOI:10.1590/1414-431x20165717 |
| [14] | DU Q, LIU J, ZHANG X, et al. Propofol inhibits proliferation, migration, and invasion but promotes apoptosis by regulation of Sox4 in endometrial cancer cells[J]. Braz J Med Biol Res, 2018, 51(4): e6803. DOI:10.1590/1414-431x20176803 |
| [15] |
马艳, 刘虹, 张浩, 等. TGF-β信号通路调控乳腺癌上皮-间质转化的研究进展[J].
药学学报, 2015, 50(4): 385–392.
MA Y, LIU H, ZHANG H, et al. Progress in the regulation of breast cancer epithelial-mesenchymal transition by TGF-β signaling pathway[J]. Acta Pharm Sinica, 2015, 50(4): 385–392. DOI:10.16438/j.0513-4870.2015.04.013 |
| [16] | HACHIM M Y, HACHIM I Y, DAI M, et al. Differential expression of TGFβ isoforms in breast cancer highlights different roles during breast cancer progression[J]. Tumour Biol, 2018, 40(1): 1010428317748254. DOI:10.1177/1010428317748254 |
| [17] | WEI Q, LIU Q, REN C, et al. Effects of bradykinin on TGF-β1-induced epithelial-mesenchymal transition in ARPE-19 cells[J]. Mol Med Rep, 2018, 17(4): 5878–5886. DOI:10.3892/mmr.2018.8556 |
| [18] | YUE D, ZHANG Z, LI J, et al. Transforming growth factor-beta1 promotes the migration and invasion of sphere-forming stem-like cell subpopulations in esophageal cancer[J]. Exp Cell Res, 2015, 336(1): 141–149. DOI:10.1016/j.yexcr.2015.06.007 |



