2. 400010 重庆, 重庆医科大学附属第二医院超声科
2. Department of Ultrasonography, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
肝癌是一种常见的恶性肿瘤, 治疗方式以手术治疗为主, 但其早期症状无特异性, 80%的患者在确诊时已失去手术机会, 只能采用非手术治疗。化疗作为一种常用的非手术治疗方式, 其毒副作用明显, 患者生活质量及医从性均较低[1]。因此, 可通过联合化疗和其他非手术治疗方式, 减少单一治疗的毒副作用, 提高肝癌治疗效果[2-3]。
声动力治疗(sonodynamic therapy, SDT)是现今研究较为热门的一种治疗方式, 指在一定的环境下, 超声波与声敏剂相互作用产生活性氧, 从而对组织造成损伤。超声波具有高度聚焦、强穿透能力的性质, 使其在深部肿瘤治疗中拥有广阔的应用前景[4-6]。大量研究表明声动力治疗中产生的生物学效应与其频率和强度密切相关, 但相关机制仍不明确, 需进一步探究。另外, 低功率聚焦超声(low intensity focused ultrasound, LIFU)不同于高强度聚焦超声(HIFU)的高温热消融作用[7], 其对于人体几乎无毒副作用, 因此低功率聚焦超声与声敏剂结合, 可作为一种深部肿瘤治疗的新策略。
脂质体作为一种运用广泛的药物载体, 具有良好的生物相容性, 其双分子层之间可容纳疏水性物质, 内部可装载亲水性物质, 利用此特点可以构建出一载体多功能的药物转运系统[8]。不饱和磷脂是一种易与活性氧产生过氧化反应的磷脂, 该反应可使脂质体结构不稳定。利用这类磷脂制备的脂质体可转运声敏剂及化疗药物同时实现超声控制药物释放[9]。由于该系统依赖于体外因素控制药物释放, 因此将成像功能与之相结合能更好地实现控制释药。全氟溴辛烷(1-bromoheptadecafluorooctane, PFOB)是一类性质稳定的氟碳化合物, 由于其结构中的溴原子不易被射线穿过, 使得其可用于CT成像。由此可将PFOB包载在上述脂质体中, 监控脂质纳米粒在肿瘤位置的聚集情况[10-11]。
因此, 本研究制备一种载血卟啉单甲醚包裹PFOB及阿霉素的声敏型脂质纳米粒, 联合低功率聚焦超声检测其体外释药和产生活性氧的能力, 以及联合声动力治疗和化疗对HepG2细胞增殖的影响, 同时探究该脂质纳米粒体外CT成像的能力, 为后期的肝癌体内成像与治疗提供了基础。
1 材料与方法 1.1 材料DLPC(二月桂酰基卵磷脂, 上海阿拉丁生化科技股份有限公司), DPPC(二棕榈酸磷脂酰胆碱, Avanti Polar Lipids, Inc), DSPG(二硬脂酰基-sn-甘油-3-磷酸甘油, 钠盐, 瑞士卡登制药公司), DSPE-PEG2000(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000, 艾伟拓医药科技有限公司, 上海), 胆固醇(生物工程股份有限公司, 上海), HMME(血卟啉单甲醚, 源叶生物), DOX(盐酸阿霉素, 北京索莱宝科技有限公司), PFOB(全氟辛烷基溴化物, 上海麦克林生化科技股份有限公司), DPBF(1, 3-二苯基异苯并呋喃, 上海麦克林生化科技股份有限公司), HepG2细胞(上海中乔新舟生物科技有限公司), CCK8(东仁化学科技有限公司, 上海), DCFH-DA(2′, 7′-二氯荧光黄双乙酸盐, 美国英杰生命技术有限公司)。
1.2 仪器100 mL圆底烧瓶(苏州冠涵化工实验耗材厂), RE-52B旋转蒸发仪(上海亚荣生化仪器厂), 高速分散均质机(上海标本模型厂), 微量称样台(瑞士MettlerToleDo公司), 超声波清洗机(宁波新芝生物科技股份有限公司), 高速离心机(长沙平凡仪器仪表公司), Malvern粒度仪(美国Malvern公司), 紫外分光光度计(美国Thermo公司), 荧光分光光度计(美国Agilent公司), 恒温水浴锅(上海医疗器械厂), ELX800酶标定量测定仪(BIOTEK公司), 高效液相色谱仪(日本Shimadzu公司), 流式细胞计数仪(美国BD Biosciences公司), 激光共聚焦显微镜(LSCM)(德国Leica公司), CT(荷兰Philips公司), 低功率聚焦超声(LIFU, 重庆医科大学超声影像学研究所)。
1.3 实验方法 1.3.1 SNL的制备采用薄膜水化法制备SNL, 具体方法参照文献[12-13]。①精密称取1 mg DLPC, 4 mg DPPC, 2 mg DSPG, 1.5 mg DSPE-PEG2000, 1.5 mg胆固醇和1 mg HMME于圆底烧瓶中; ②避光条件下, 加入适量三氯甲烷与甲醇充分溶解磷脂和HMME; ③将圆底烧瓶置于旋转蒸发仪上减压蒸发1 h, 形成一均匀的暗红色薄膜; ④精密称取1 mg DOX溶解于4 mL PBS中, 待充分溶解后加入到上述烧瓶中; ⑤将烧瓶置于40 ℃水浴锅中缓慢摇晃, 直至暗红色薄膜完全洗脱成暗红色悬液; ⑥将悬液移至10 mL EP管中, 再加入200 μL PFOB后, 用高速均质机乳化5 min, 采用12 000 r/min的转速, 间隔5 s, 得暗红色乳液; ⑦离心乳液(5 000 r/min, 5 min), 弃上清液, 用PBS重悬沉淀, 清洗3次后得载PFOB包裹DOX的声敏型脂质纳米粒(SNL), 置于4 ℃储存备用。用相同的方法制备只包裹DOX或HMME以及两者均未包裹的载PFOB的脂质纳米粒(DNL、HNL、NL)和包裹DOX及HMME未载PFOB的脂质纳米粒。
1.3.2 SNL的一般性质采用普通光学显微镜和透射电子显微镜观察SNL的形貌, 透射电子显微镜观察LIFU处理后SNL的形貌, 马尔文激光粒径仪检测SNL的粒径和电位, 紫外分光光度计检测DOX、HMME、NL、SNL和snl(snl为SNL破裂离心后的上清液, 破裂SNL的具体方法参见参考文献[14])的吸光光谱。
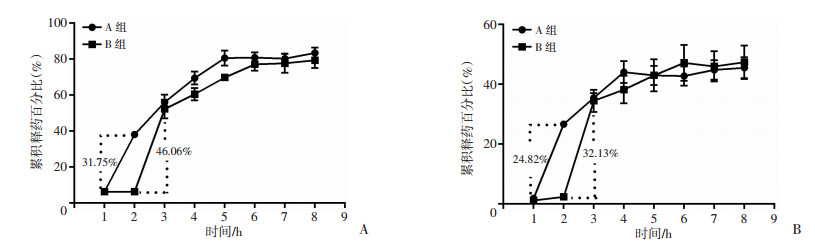
1.3.3 高效液相色谱法检测SNL的包封率直接测量法检测SNL中DOX和HMME的包封率, 具体方法参考文献[14]。用以下公式计算包封率。
HMME包封率=CHm/CHt×100%;DOX包封率=CDm/CDt×100%;CHm、CDm分别表示包载于脂质纳米粒中的HMME和DOX的含量, CHt、CDt分别表示HMME和DOX的总量。
1.3.4 SNL产生活性氧将SNL稀释为不同HMME浓度(1.25、2.5、5、10、20、40 μg/mL)的悬液, 各浓度分别取1 mL与10μL DPBF(100 μg/mL)混合均匀, 用LIFU(0.2 W/cm2, 650 kHz, 脉冲2 s, 1 min)处理该混合溶液。另取1 mL HMME浓度为10 μg/mL的SNL悬液与10 μL DPBF混合均匀, 用LIFU(0.4 W/cm2, 650 kHz, 脉冲2 s, 1 min)处理。以DNL与DPBF的混合溶液作对照组, 每组设3个平行组, 荧光分光光度计检测每组剩余DPBF的荧光强度。用以下公式计算产生活性氧的相对量。
产生活性氧的相对量=(FIc-FIi)/FIc×100%;FIc为对照组的荧光强度, FIi为各实验组的荧光强度。
1.3.5 SNL体外释药将刚制备好的SNL稀释到一定浓度后分为等体积的A、B两组, 再将两组置于37 ℃恒温摇床中, 于1 h后离心各取1 mL上清液用高效液相色谱法检测其中DOX和HMME的含量(D1, H1), 取出1 mL上清液后各组均补充1 mL PBS重新混合均匀, 再予以A组LIFU(0.2 W/cm2, 650 kHz, 脉冲2 s, 1 min)处理, 后将两组置于37 ℃恒温摇床中, 相同方法于2 h后取上清液检测其中DOX和HMME的含量(D2, H2), 2 h后给予B组LIFU(0.4 W/cm2, 脉冲2 s, 1 min)处理, 再置于37 ℃恒温摇床中。以相同的方法于3、4、5、6、7、8 h后取两组上清检测DOX和HMME的含量(D3、H3、D4、H4、D5、H5、D6、H6、D7、H7、D8、H8)。用以下公式计算DOX和HMME的累计释放量。
累积释放DOX百分比=(2×Dn+ 
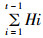
用含10%胎牛血清FBS和DMEM培养基, 5%CO2、37℃条件下培养, 每2天传代1次, 具体实验步骤参照文献[15]。
1.3.7 SNL细胞内活性氧检测将细胞接种在激光共聚焦皿中, 分为3组:①SNL组; ②SNL+LIFU(0.2 W/cm2, 650 kHz, 脉冲2 s, 1 min)组; ③SNL+LIFU(0.4 W/cm2, 650 kHz, 脉冲2 s, 1 min)组。以DCFH-DA为活性氧探针, 具体实验步骤参照文献[16], 将各组置于激光共聚焦显微镜下观察。再通过流式细胞计数仪检测不同组中绿色荧光的强度。用上述相似的方法观察不同HMME浓度的SNL产生活性氧的情况。
1.3.8 SNL对HepG2细胞生长的抑制作用采用CCK-8实验检测不同分组中HepG2细胞的存活率, 具体实验步骤参照文献[15]。设为:①LIFU组; ②DOX组; ③DNL组; ④HNL组; ⑤HNL+LIFU组; ⑥SNL组; ⑦SNL+LIFU组, 每组4个复孔。其中HMME浓度分别为20、10、5、2.5、1.25 μg/mL, DOX浓度分别为20、10、5、2.5、1.25 μg/mL, SNL中的HMME和DOX浓度相同, 孵育6 h后, LIFU(0.4 W/cm2, 650 kHz, 脉冲2 s, 1 min)处理, 再孵育18 h, PBS清洗3次, 每孔加入100 μL 10% CCK-8, 孵育一定时间后, 用酶标仪测450 nm处的光密度值D(450)。用以下公式计算细胞存活率, 同时采用SPSS软件计算各组的IC50。
细胞存活率=[D(450)加药-D(450)空白]/[D(450)对照组-D(450)空白]×100%
1.3.9 SNL体外CT成像将SNL配成不同PFOB浓度(386、193、96.5、48.25、24.125、12.0625)mg/mL的悬液, 以未包裹PFOB的SNL为对照组, 其中磷脂的浓度与包裹PFOB浓度中最高的SNL的磷脂浓度一致, 以PBS为空白组, 行CT扫描。CT参数设置:16排, 100 kV, 44 mA, 层厚0.29 mm[10]。
1.4 统计学分析采用SPSS 20.0统计软件进行分析, 计量资料采用x±s表示, 两样本均数的比较采用两独立样本t检验, 多样本均数的比较采用单因素方差分析, 两变量之间的关系采用线性相关分析。检验水准:α=0.05。
2 结果 2.1 SNL的一般特性光学显微镜下, SNL呈点状, 大小均匀, 分散无粘连(图 1A1)。透射电子显微镜显示SNL呈球形(图 1A2), LIFU处理后透射电子显微镜观察到SNL仍为球形, 但密度变浅(图 1A3), 可能与SNL中包载的物质释放出来有关。紫外吸光图谱中(图 1B), NL呈一平滑曲线, 未见明显吸收峰, DOX在480 nm处见一较小吸收峰, HMME和SNL均在390 nm处见明显的吸收峰, 可证明SNL中包裹了HMME。snl中在480 nm处及其附近出现光密度值轻微增高(图 1B箭头所指)。马尔文激光粒径仪测得SNL的粒径为(282.53± 6.95)nm(图 1C), 电位为(-45.46±1.22)mV(图 1D)。
|
| A:显微镜观察SNL 1:普通光镜; 2:透射电子显微镜; 3:透射电子显微镜(LIFU处理后); B:紫外吸光光谱分析; C:SNL粒径分布; D:SNL电位分布 图 1 声敏型脂质纳米粒(SNL)基本性质检测结果 |
2.2 SNL的包封率
SNL中DOX和HMME的包封率分别为(80.15±15.11)%、(46.47±4.82)%, 两者的包封率均较高。
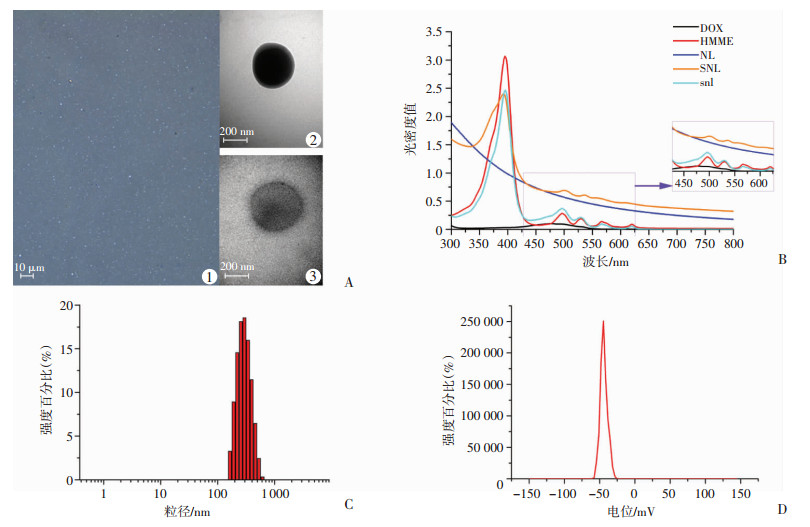
2.3 SNL产生活性氧SNL在LIFU(650 kHz, 0.2 W/cm2, 脉冲:2 s, 1 min)处理后, 产生活性氧的相对量随HMME浓度增加而增加, 且各浓度组间两两比较, 产生活性氧的相对量差异有统计学意义(F=172.558, P < 0.05, 图 2), 可见SNL产生活性氧呈HMME浓度依赖性。LIFU强度为0.4 W/cm2时, 产生活性氧的相对量为(63.93± 1.83)%, 较LIFU为0.2 W/cm2时的(55.56±2.32)%高, 差异有统计学意义(P < 0.05), 可见SNL产生活性氧也呈LIFU强度依赖性。
|
| a: P < 0.05, 各组间两两比较 图 2 不同HMME浓度的SNL体外活性氧荧光分光光度计检测结果(n=3) |
2.4 SNL体外释药
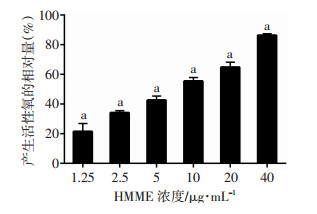
A组经LIFU处理2h时出现明显的释药, 1 h内释药量DOX达31.75%, HMME为24.82%;B组在未经过LIFU处理2 h后, DOX的释药量未超过10%, HMME的释药量均未超过5%;而B组在经过较高强度LIFU(0.4 W/cm2, 650 kHz, 脉冲2 s, 1 min)处理后, 3 h时可见B组DOX在1 h内释药量为46.06%, HMME为32.13%, B组第3小时的释药量较A组第2小时的释药量多, 说明较高强度的LIFU可加快释药。从之前SNL产生活性氧的实验中可知, 较高强度的LIFU可使SNL产生更多活性氧, 可能是因为更多的活性氧加快了磷脂过氧化, 使磷脂膜更不稳定, 加快了药物释放, 可间接证明该药物递送体系的释药过程与SNL的声敏性相关。8 h后A、B两组的DOX累积释药量分别达到(83.45±2.97)%、(79.42±4.36)%, HMME的释药量分别为(45.54±3.48)%、(47.37±5.60)%(图 3), 可见在LIFU作用下, SNL可加快药物释放, 但由于HMME的水溶性较差, 使其释药量较DOX慢。
|
| A:DOX的释放情况; B:HMME的释放情况A组给予LIFU(0.2 W/cm2, 650 kHz, 脉冲2 s, 1 min); B组给予LIFU(0.4 W/cm2, 650 kHz, 脉冲2 s, 1 min) 图 3 SNL体外释放药物生成曲线(n=3) |
2.5 SNL产生活性氧的细胞实验
活性氧探针DCFH-DA本身无荧光, 可以穿过细胞膜, 进入细胞内被酯酶水解产生水溶性DCFH, DCFH可被细胞内的活性氧氧化为DCF, 而DCF能产生绿色荧光。实验结果显示, SNL组几乎未见绿色荧光, SNL+LIFU(0.2 W/cm2)组绿色荧光较强, SNL+LIFU(0.4 W/cm2)组绿色荧光强于前两组(图 4)。可见在无LIFU作用时, 几乎无活性氧产生, 当LIFU强度增强, 产生的活性氧增多, 该结果与之前的实验结果一致。同样, 不同HMME浓度的SNL与HepG2细胞共孵育后, 经LIFU处理, 产生的绿色荧光随着HMME浓度增加而增加(图 5), 进一步证明SNL产生活性氧呈LIFU强度及HMME浓度依赖性。流式细胞计数结果与激光共聚焦显微镜观察结果一致。
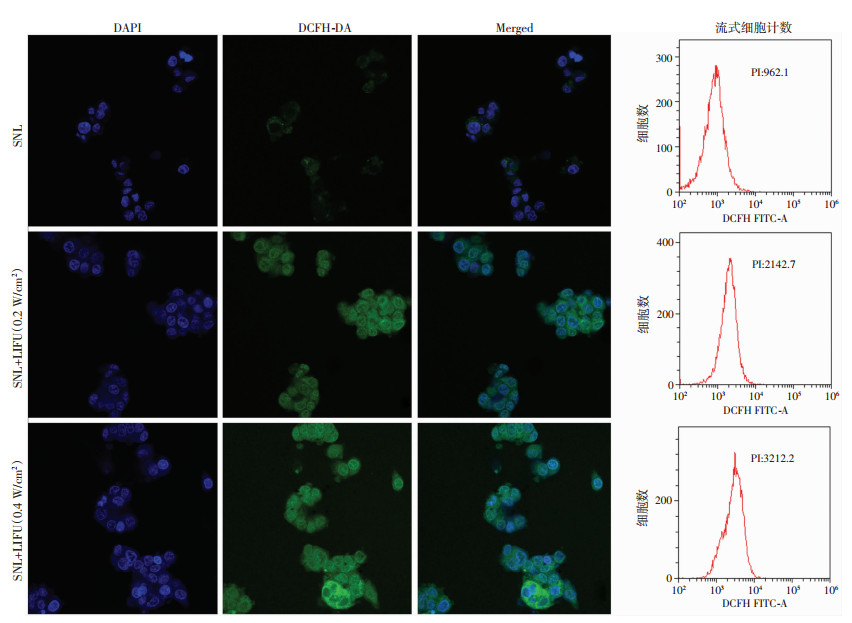
|
| DAPI标记细胞核(蓝色荧光); DCFH-DA标记活性氧(绿色荧光); Merged为融合图像 图 4 SNL细胞内活性氧激光共聚焦(×600)和流式细胞计数检测结果 |
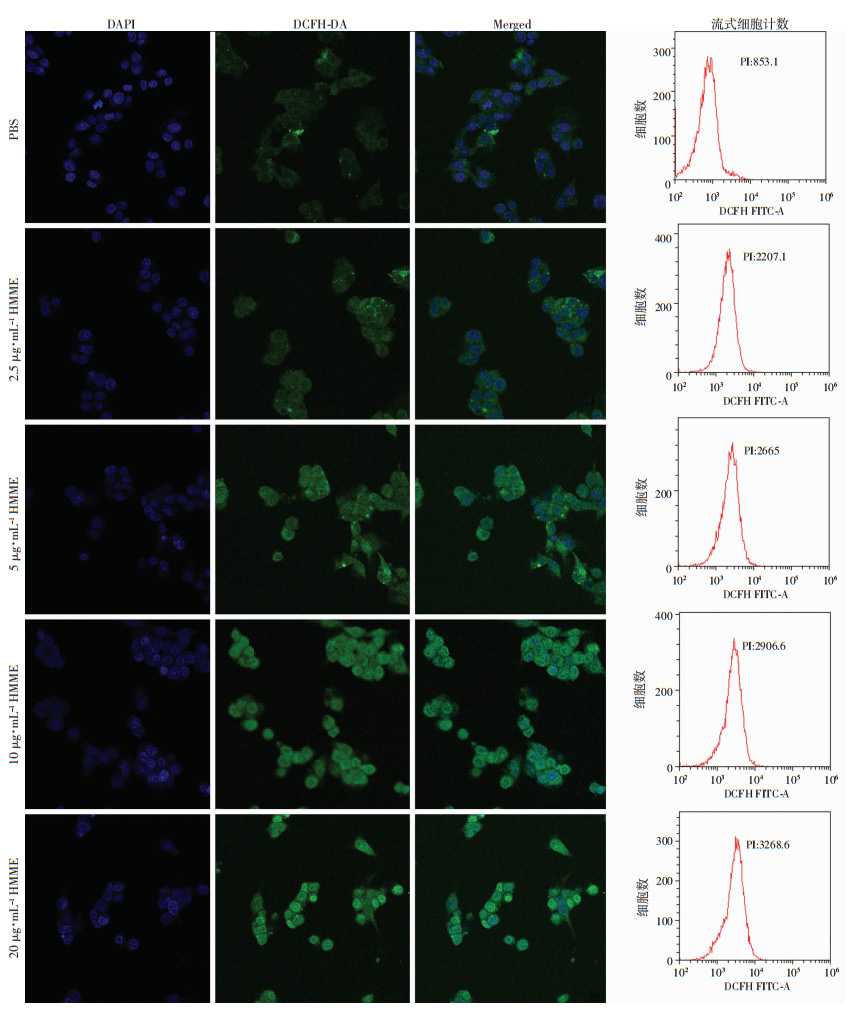
|
| DAPI标记细胞核(蓝色荧光); DCFH-DA标记活性氧(绿色荧光); Merged为融合图像 图 5 不同HMME浓度的SNL细胞内活性氧激光共聚焦(×600)和流式细胞计数检测结果 |
2.6 SNL对HepG2细胞生长的抑制作用
将NL与HepG2细胞共孵育24 h, 发现磷脂浓度在0.520 83~200 μg/mL之间HepG2细胞的存活率均高于85%, 差异无统计学意义(F=0.719, P>0.05, 图 6), 可见磷脂浓度从0.520 83~200 μg/mL的NL几乎无毒性。LIFU组HepG2细胞的存活率为(92.85± 2.36)%, 可认为LIFU对细胞生长几乎无影响; 在相同HMME或DOX浓度条件下, DNL组较DOX组的细胞存活率高, 差异有统计学意义(P < 0.05), 该结果可能与脂质纳米粒可以减缓药物释放有关; HNL+LIFU组的存活率较HNL组低, 差异有统计学意义(P < 0.05), 可见单独的HNL对细胞生长几乎无影响, 而在联合LIFU后, 明显抑制了细胞的生长; 同样, SNL+LIFU组较SNL组的细胞存活率低, 差异有统计学意义(P < 0.05);SNL+LIFU组的细胞存活率较HNL+LIFU组、DNL和DOX组均低, 差异有统计学意义(P < 0.05), 各组的IC50分别为, DOX:0.624 μg/mL, DNL:0.894 μg/mL, HNL+LIFU:5.357 μg/mL, SNL:2.32 μg/mL, SNL+LIFU:0.571 μg/mL, 其中SNL+LIFU组的IC50最低, 可见SNL+LIFU组联合声动力治疗和化疗明显增强了对HepG2细胞的生长抑制作用。而在不同浓度间, 相同处理组中细胞存活率存在明显的浓度依赖性, 差异有统计学意义(P < 0.05, 图 7)。

|
| 图 6 NL细胞毒性检测结果(n=5) |
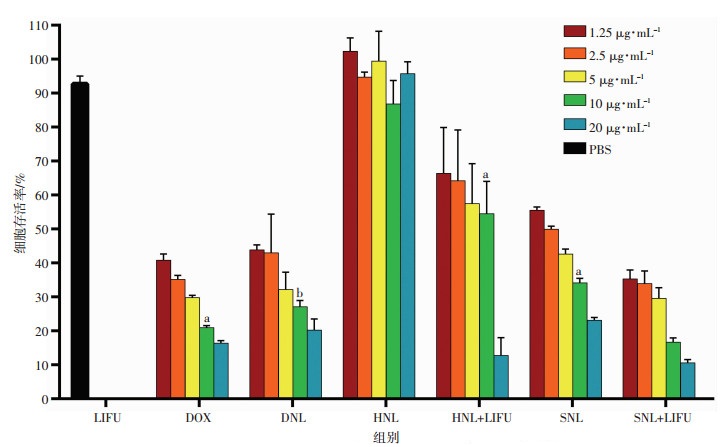
|
| a:P < 0.05, 与SNL+LIFU组比较; b:P < 0.05, 与DOX组比较 图 7 SNL细胞毒性检测结果(n=4) |
2.7 SNL体外CT成像
随着PFOB浓度的降低, CT成像密度逐渐降低, 对照组及空白组的密度明显低于其他组(图 8A), 同时, 通过PFOB浓度-CT值曲线可见SNL的CT值跟PFOB浓度具有良好的相关性(图 8B), 具体CT值见表 1。
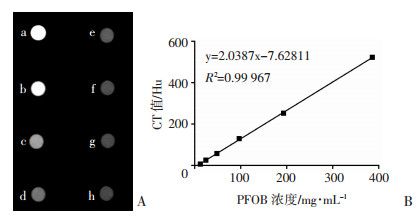
|
| A:不同PFOB浓度的SNL体外CT成像a:PFOB浓度为386 mg/mL; b:PFOB浓度为193 mg/mL; c:PFOB浓度为96.5 mg/mL; d:PFOB浓度为48.25 mg/mL; e:PFOB浓度为24.125 mg/mL; f:PFOB浓度为12.062 5 mg/mL; g:对照组; h:空白组; B:PFOB浓度-CT值曲线 图 8 SNL体外CT成像观察 |
| 组别 | CT值/Hu |
| PFOB浓度组/mg·mL-1 | |
| 386 | 523.10±26.45a |
| 193 | 252.65±24.68a |
| 96.5 | 129.80±5.66a |
| 48.25 | 58.40±3.82a |
| 24.125 | 26.10±3.68a |
| 12.062 5 | 6.95±6.86a |
| 对照组 | -5.60±1.27a |
| 空白组 | -10.10±2.67a |
| a: P < 0.05, 各组间两两比较 | |
3 讨论
声动力治疗, 是利用超声激发声敏剂, 基于声孔效应、声化学效应及声致光效应产生ROS杀死肿瘤细胞。其中超声具有高聚焦、强穿透力的特点, 因此, 其在深部肿瘤的治疗中具有一定的研究价值。本研究以HMME作为声敏剂, 并成功将HMME包裹进声敏型脂质纳米粒中。在探究SNL的声动力效果时, 发现SNL产生活性氧, 与HMME的浓度和LIFU的强度有密切关系, 呈现HMME浓度及LIFU强度依赖性, 且该结果与文献[17-18]报道一致。其中可能的机制为, LIFU产生的空化效应使微小的空化泡瞬间破裂时, 集中起来的声场能量瞬间释放, 进一步在局部微环境产生高温高压、声致光等效应, 其中的能量或使声敏剂HMME与周围环境中的水(H2O)、氧气(O2)之间发生电子的迁移, 从而产生羟基自由基(-OH)、单线态氧(1O2)、超氧根离子(O2﹣)[19-20]。
药物转运系统, 由于可减少化疗药物的毒副作用而得到了广泛的研究。其中有依赖于肿瘤内部微环境的pH响应型、酶响应型转运系统, 也有受外部条件控制的热响应型、光响应型、超声响应型转运系统[21]。本研究以声敏型脂质体为载体, 同时将DOX包载在声敏型脂质纳米粒的亲水层, 利用LIFU作用于声敏剂可产生活性氧, 以及活性氧易使不饱和磷脂发生过氧化反应这两个特点, 构建了一种活性氧响应型的药物转运系统, 成功实现了LIFU促进声敏型脂质纳米粒的药物释放。实验结果中可见随着LIFU强度的增强, 释药速度加快, 进一步说明了LIFU与声敏剂相互作用产生的活性氧可能加快了药物释放。
化疗作为肝癌常见的一种非手术治疗方式, 由于其毒副作用强, 常与其他治疗方式相结合。本实验制备的SNL成功地将声动力治疗与化疗结合, 增强了抑制HepG2细胞的生长。同时, 该转运系统包载了PFOB, 使SNL具有了CT成像的能力。因此, 该系统可用CT监测SNL在肝脏癌灶的聚集情况, 实现诊疗一体化。
综上所述, 本实验成功制备的载HMME包裹PFOB及DOX的声敏型脂质纳米粒, 实现了LIFU控制释药, 联合声动力及化疗增强抑制HepG2细胞生长以及体外CT成像。为后期体内成像与治疗提供了基础。
| [1] | DA MOTTA GIRARDI D, CORREA T S, CROSARA TEIXEIRA M, et al. Hepatocellular carcinoma:review of targeted and immune therapies[J]. J Gastrointest Cancer, 2018, 49(3): 227–236. DOI:10.1007/s12029-018-0121-4 |
| [2] |
广东省抗癌协会肝癌专业委员会. 肝癌多学科联合治疗策略与方法——广东专家共识(2)[J].
临床肝胆病杂志, 2014, 30(11): 1116–1119.
Society of Liver Cancer, Guangdong Provincial Anti-Cancer Association. Strategy and method of multi-disciplinary team for comprehensive treatment of liver cancer-consensus of experts in Guangdong, China (2)[J]. J Clin Hepatol, 2014, 30(11): 1116–1119. DOI:10.3969/j.issn.1001-5256.2014.11.005 |
| [3] | WAN G, LIU Y, SHI S, et al. Hematoporphyrin and doxorubicin co-loaded nanomicelles for the reversal of drug resistancein human breast cancer cells by combining sonodynamic therapyand chemotherapy[J]. RSC Advances, 2016, 6(102): 100361–100372. DOI:10.1039/C6RA22724D |
| [4] | PAN X, WANG H, WANG S, et al. Sonodynamic therapy (SDT): a novel strategy for cancer nanotheranostics[J]. Sci China Life Sci, 2018, 61(4): 415–426. DOI:10.1007/s11427-017-9262-x |
| [5] | NESBITT H, SHENG Y, KAMILA S, et al. Gemcitabine loaded microbubbles for targeted chemo-sonodynamic therapy of pancreatic cancer[J]. J Control Release, 2018, 279: 8–16. DOI:10.1016/j.jconrel.2018.04.018 |
| [6] |
刘韧耕, 李黎波. 声动力治疗的研究进展[J].
中国激光医学杂志, 2015, 24(3): 151–157.
LIU R G, LI L B. New progress of sonodynamic therapy research[J]. Chin J Laser Med Surg, 2015, 24(3): 151–157. DOI:10.13480/j.issn1003-9430.2015.0151 |
| [7] |
葛鹏磊, 李宁. 高强度聚焦超声治疗肝癌致皮肤烧伤的原因及预防[J].
临床超声医学杂志, 2007, 9(10): 635–636.
GE P L, LI N. Causes and prevention of skin burns caused by hepatocellular carcinoma treated by high intensity focused ultrasound[J]. J Ultrasound Clin Med, 2007, 9(10): 635–636. DOI:10.16245/j.cnki.issn1008-6978.2007.10.029 |
| [8] | OLUSANYA T O B, HAJ AHMAD R R, IBEGBU D M, et al. Liposomal drug delivery systems and anticancer drugs[J]. Molecules, 2018, 23(4): E907. DOI:10.3390/molecules23040907 |
| [9] |
黄苏苏, 谢波, 凌家俊, 等. 二氢卟吩e6磁性声敏纳米脂质体的制备及质量评价[J].
中国实验方剂学杂志, 2017, 23(8): 21–26.
HUANG S S, XIE B, LING J J, et al. Preparation and qualityevaluation of magnetic sound sensitive nano-liposomes with porphyrin e6[J]. Chin J Exp Tradit Med Formulae, 2017, 23(8): 21–26. DOI:10.13422/j.cnki.syfjx.2017080021 |
| [10] |
李奥, 王志刚, 余进洪, 等. 液态氟碳纳米粒增强CT成像在兔VX2肝癌模型中的应用[J].
中国医学影像技术, 2010, 26(5): 809–811.
LI A, WANG Z G, YU J H, et al. Lipid perfluorooctylbromidenanoparticles-enhanced CT imaging on rabbit VX2 liver carcinoma models[J]. Chin J Med Imaging Technol, 2010, 26(5): 809–811. DOI:10.13929/j.1003-3289.2010.05.047 |
| [11] | SHENG D, LIU T, DENG L, et al. Perfluorooctyl bromide & indocyanine green co-loaded nanoliposomes for enhanced multimodal imaging-guided phototherapy[J]. Biomaterials, 2018, 165: 1–13. DOI:10.1016/j.biomaterials.2018.02.041 |
| [12] |
周洋.相变纳米超声造影剂增效HIFU治疗作用的研究[D].重庆: 重庆医科大学, 2012.
ZHOU Y.Application of a phase-change type nano-size ultrasound contrast agent to enhance the efficacy of HIFU ablation[D]. Chongqing: Chongqing Medical University, 2012. |
| [13] | YAN F, DUAN W, LI Y, et al. NIR-laser-controlled drug release from DOX/IR-780-loaded temperature-sensitive-liposomes for chemo-photothermal synergistic tumor therapy[J]. Theranostics, 2016, 6(13): 2337–2351. DOI:10.7150/thno.14937 |
| [14] | SHI J, SU Y, LIU W, et al. A nanoliposome-based photoactivable drug delivery system for enhanced cancer therapy and overcoming treatment resistance[J]. Int J Nanomedicine, 2017, 12: 8257–8275. DOI:10.2147/IJN.S143776 |
| [15] |
陈佳丽.白藜芦醇苷对人肝癌细胞HepG2细胞株凋亡的促进作用的实验研究[D].广州: 南方医科大学, 2017.
CHEN J L.The study of effect of Polydatin on apoptosis of human hepatocellular carcinoma cell line[D]. Guangzhou: Southern Medical University, 2017. |
| [16] |
唐琴.携氧载吲哚菁绿纳米粒协同光-声动力对类风湿关节炎滑膜成纤维细胞的毒性作用研究[D].重庆: 重庆医科大学, 2017.
TANG Q.Oxygen and indocyanine green loaded phase-transition nanoparticle-mediated photo-sonodynamic cytotoxic effects on rheumatoid arthritis fibroblast-like synoviocytes[D]. Chongqing: Chongqing Medical University, 2017. |
| [17] | FENG Q, LI Y, YANG X, et al. Hypoxia-specific therapeuticagents delivery nanotheranostics: A sequential strategyfor ultrasound mediated on-demand tritherapies and imaging of cancer[J]. J Controlled Release, 2018, 275: 192–200. DOI:10.1016/j.jconrel.2018.02.011 |
| [18] | REN H, LIU J, SU F, et al. Relighting photosensitizers by synergistic integration of albumin and perfluorocarbon for enhanced photodynamic therapy[J]. ACS Appl Mater Interfaces, 2017, 9(4): 3463–3473. DOI:10.1021/acsami.6b14885 |
| [19] | MILLER D L, AVERKIOU M A, BRAYMAN A A, et al. Bioeffects considerations for diagnostic ultrasound contrast agents[J]. J Ultrasound Med, 2008, 27(4): 611–632. DOI:10.7863/jum.2008.27.4.611 |
| [20] | DEEPAGAN V G, YOU D G, UM W, et al. Long-circulating Au-TiO2 nanocomposite as a sonosensitizer for ROS-mediatederadication of cancer[J]. Nano Lett, 2016, 16(10): 6257–6264. DOI:10.1021/acs.nanolett.6b02547 |
| [21] | QIAO Y, WAN J, ZHOU L, et al. Stimuli-responsive nanotherapeutics for precision drug delivery and cancer therapy[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2018: e1527. DOI:10.1002/wnan.1527 |



