2. 400010 重庆,重庆医科大学附属第二医院肝胆外科;
3. 404000 重庆,重庆三峡中心医院百安分院外科
2. Department of Hepatobiliary Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010;
3. Department of General Surgery, Bai'an Branch of Chongqing Three Gorges Central Hospital, Chongqing, 404000, China
肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是一种主要通过调节活性氧和细胞炎症因子引起细胞损伤和器官衰竭的临床问题。由于手术过程中肝脏血流阻断,造成肝脏缺血缺氧。然而解除阻断,肝血供恢复后并没有因此恢复正常生理功能,反而加重损伤,这其中涉及大量信号分子和各细胞间的相互作用[1-3]。有目的的阻断或促进炎症通路中的某个物质,可降低细胞的损伤,从而减轻HIRI。新近发现,TIM(T-cell immunoglobulin and mucin-domain-containing molecule)基因家族成员TIM-4选择性表达于抗原提呈细胞群(antigen presenting cells, APCs),这种局限性表达提示了TIM-4参与了炎症反应以及免疫调节的过程[4-6]。Kupffer细胞(Kupffer cells,KCs)作为体内最大的抗原提呈细胞群,在调节肝脏氧化应激以及免疫环境中发挥着重要的作用。因此,本研究探讨阻断缺血再灌注(ischemia reperfusion,IR)小鼠模型KCs的TIM-4功能能否有效改善HIRI,并探讨其可能机制,从而阐明TIM-4对HIRI的影响。
1 材料与方法 1.1 实验动物和主要试剂实验动物:8~10周龄的BALB/c雄性小鼠40只,体质量为16~22 g,均购自重庆医科大学实验动物中心,饲养于重庆医科大学实验动物中心SPF实验室,予以正常昼夜光照以及饮食饮水。实验过程中所有操作遵守重庆医科大学伦理委员会发布的伦理及管理指南。主要试剂:Ⅳ型胶原酶购自美国Sigma公司;TIM-4 mAb(RMT4-53)购自美国GeneTex公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自上海博谷生物科技有限公司;Toll-like receptor 4(TLR4)、IκB kinase α(IKKα)、p-IKKα、inhibitor of kappa B(IκBα)、p-IκBα、p65、p-p65抗体购自美国Abcam公司;ELISA试剂盒购自美国Active motif公司;总蛋白提取试剂和TUNEL荧光试剂盒购自上海碧云天生物技术有限公司。
1.2 小鼠缺血再灌注损伤模型的建立和分组术前禁食12 h,采用乙醚持续性吸入麻醉方式,小鼠(n=18)仰卧位于操作台上,四肢固定,上腹部手术区去毛消毒,然后切开一小口充分暴露肝门区,用无损伤小血管夹阻断肝蒂,造成全肝热缺血30 min后,松开血管夹,缝合腹部刀口,行原位再灌注3、12、24 h后,取下中叶肝组织备检,Sham小鼠(n=4)仅行开腹手术暴露肝蒂。另外,需行TIM-4抗体处理的IR动物模型按随机数字表法分为3组:Sham组(n=6),经门静脉注入1 mL PBS;Ctr Ig组(n=6),于夹闭肝蒂前经门静脉注入含TIM-4同型对照抗体(0.35 mg/只)的1 mL PBS;TIM-4 mAb组(n=6),于夹闭肝蒂前经门静脉注入含抗TIM-4抗体(0.35 mg/只)的1 mL PBS。手术过程中所有小鼠均未发生意外死亡,并于IR后12、24 h麻醉状态下,腹主动脉穿刺取血0.5 mL,离心5 min,上清液-80 ℃保存,处死小鼠,并取下中叶肝组织备检、液氮保存。余部分固定包埋。
1.3 细胞分离和纯化参照LI等[7]介绍的胶原酶肝脏原位灌注法分离肝脏非实质细胞,并将所得细胞培养7 d后,通过轻轻抽吸收集漂浮或松散贴壁的细胞,即为树突状细胞(DCs),而贴壁较紧的即为KCs,重悬上述细胞,并将浓度调整至1×106/mL备用。
1.4 免疫组织化学检测肝脏TIM-4表达肝组织固定包埋并切片(3 μm)。将切片常规脱蜡、脱水,抗原修复15 min。滴加正常山羊血清室温孵育20 min。滴加TIM-4抗体(1 :100),湿盒中4 ℃过夜孵育。滴加辣根过氧化酶(HRP)标记的二抗(1 :200),室温孵育1 h。二氨基联苯胺(DAB)显色直至切片变黄。苏木精复染2 min后,流水冲洗返蓝。将切片脱水,中性树脂封片,镜下观察,细胞核呈紫蓝色,阳性产物呈棕黄色或黄色颗粒。
1.5 肝功能、炎症因子以及氧化应激检测使用全自动生化分析仪检测小鼠血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆红素值(TBIL)水平;根据ELISA检测试剂盒说明书检测小鼠肝组织匀浆白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、白介素10(IL-10)、丙二醛(MDA)、过氧化氢酶(CAT)和超氧歧化酶(SOD)的表达水平。每组实验重复3次。
1.6 肝组织病理检测肝组织切片脱蜡脱水,苏木精染色5~15 min。并用流水冲洗洗去苏木精。将切片放入1%盐酸乙醇液1~3 s。用自来水冲洗数秒。将切片放入0.5%曙红液中染色1~3 min,流水冲洗数秒。然后依次放入不同浓度的乙醇和二甲苯进行脱水,中性树胶封片,并在光学显微镜观察肝组织病变情况。
1.7 TUNEL检测肝细胞凋亡TUNEL染色切片脱蜡至水,滴加蛋白酶K室温消化15 min,PBS洗涤3次。滴加3% H2O2,室温封闭10 min,PBS洗涤3次。每片加50 μL TUNEL混合液,37 ℃避光孵育1 h,PBS洗3次。然后封片,封片剂为含有4′, 6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭的封片剂,并在荧光显微镜下观察。
1.8 流式细胞仪检测向细胞悬液中加入荧光素标价的抗体(Annexin-FITC),室温避光孵育30 min;加PI,室温结合30 min;再加入2 mL含0.09%叠氮化钠的PBS,震荡混匀后1 000 r/min,离心5 min,弃上清,PBS重悬细胞上流式细胞仪检测凋亡情况。
1.9 Western blot分析按照总蛋白提取试剂盒说明提取蛋白,用BCA法测定蛋白浓度。蛋白变性后40 μg加入上样孔进行电泳分离,至溴酚蓝燃料到达分离胶的底部。然后将凝胶内的蛋白恒流250 mA转至PVDF膜。用5%的脱脂奶粉室温摇床封闭1 h,然后加入稀释好的目的蛋白抗体(1 :1 000),4 ℃孵育过夜。PBST清洗3次,每次5 min,加入稀释好的HRP标记二抗(1 :8 000),室温摇床孵育1 h,PBST清洗3次,每次5 min。化学发光法显色,使用凝胶成像分析系统对显色条带进行光密度分析。
1.10 统计学分析应用SPSS 18.0统计软件分析,数据以x±s表示,组间比较用单因素方差分析和LSD-t检验,不满足方差齐性时,组间比较用秩和检验,检验水准α=0.05。
2 结果 2.1 肝脏早期IRI后KCs表达TIM-4增多TIM-4选择性表达于APCs中,而在肝脏主要集中表达于KCs和DCs。通过建立IRI小鼠模型,分别在不同时间点(IR 3、12、24 h)提取肝组织中KCs和DCs,Western blot结果提示,随着再灌注时间的变化,KCs表达TIM-4蛋白逐渐增加,且明显高于对照Sham组(P < 0.05),然而DCs表达TIM-4不随时间变化而表达增高,且与对照Sham组比无统计学差异。见图 1。
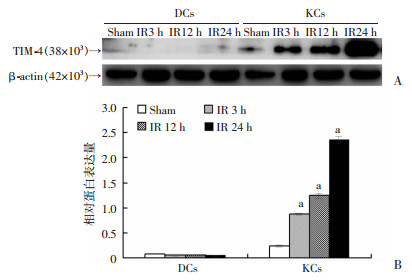
|
| A:Western blot检测DCs和KCs TIM-4蛋白表达;B:相对蛋白表达量比较a:P < 0.05, 与Sham组比较 图 1 肝缺血再灌注后细胞TIM-4表达情况 |
组化分析结果也显示,TIM-4主要表达于肝血窦巨噬细胞,且随着再灌注时间的变化,阳性表达量逐渐增加,见图 2,这也提示了KCs TIM-4的表达在早期缺血再灌注的损伤中有一定的作用。
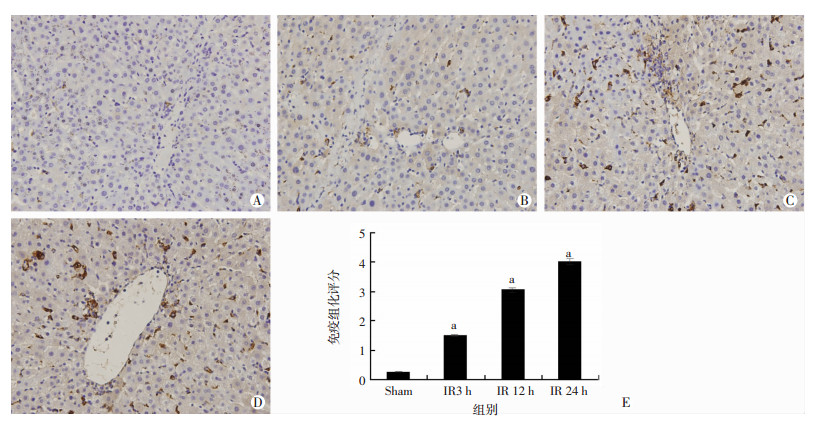
|
| A:Sham组;B:再灌注后3 h;C:再灌注后12 h;D:再灌注后24 h;E:免疫组化评分a:P < 0.05,与Shan组比较 图 2 免疫组化检测肝缺血再灌注后肝组织内TIM-4表达情况(S-P ×400) |
2.2 阻断TIM-4减轻炎症反应程度以及改善肝组织IRI
通过门静脉灌注TIM-4 mAb,阻断肝脏TIM-4的功能,检测各组肝脏IR后12、24 h肝功能以及炎症反应情况,发现随着时间变化,Ctr Ig组血清肝功AST、ALT、TBIL以及肝组织匀浆促炎症因子IL-1β、TNF-α和氧化应激产物MDA水平逐渐增高,且明显高于Sham组;然而与Ctr Ig组比较,TIM-4 mAb组血清肝功、肝组织匀浆促炎症因子以及氧化应激产物水平明显减低,而抗炎因子IL-10以及抗氧化应激产物CAT、SOD逐渐增高,且差异具有统计学意义(P < 0.05),见图 3及表 1。肝组织病理学检查结果示Ctr Ig组部分炎症细胞浸润,肝血窦轻度充血,TIM-4 mAb组无明显变化,见图 4。
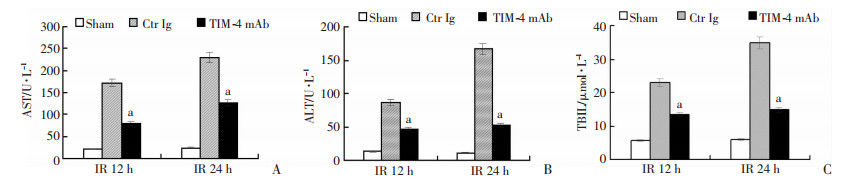
|
| A:AST;B:ALT;C:TBIL;a:P < 0.05,与Ctr Ig组比较 图 3 肝缺血再灌注后各组肝功能比较 |
| 组别 | IR 12 h | IR 24 h | |||||||||||
| MDA | CAT | SOD | IL-1β | TNF-α | IL-10 | MDA | CAT | SOD | IL-1β | TNF-α | IL-10 | ||
| Sham | 6.5±0.6 | 8.3±0.8 | 8.2±0.7 | 9.8±0.9 | 15.7±1.7 | 12.3±1.0 | 7.6±0.4 | 10.2±0.6 | 14.8±1.1 | 8.6±0.7 | 12.4±1.0 | 14.6±1.0 | |
| Ctr Ig | 128.4±6.6 | 17.5±1.9 | 20.8±1.8 | 185.7±6.9 | 88.9±4.9 | 20.6±2.0 | 168.4±5.8 | 23.7±2.0 | 18.4±1.2 | 245.9±8.7 | 180.8±5.6 | 15.7±1.8 | |
| TIM-4 mAb | 88.3±4.5a | 30.6±2.4a | 36.4±3.9a | 100.6±5.3a | 77.6±6.5 | 125.6±8.5a | 33.1±2.7a | 52.4±3.6a | 57.6±4.3a | 65.4±3.7a | 60.4±4.1a | 163.3±8.3a | |
| a:P < 0.05,与Ctr Ig组比较 | |||||||||||||
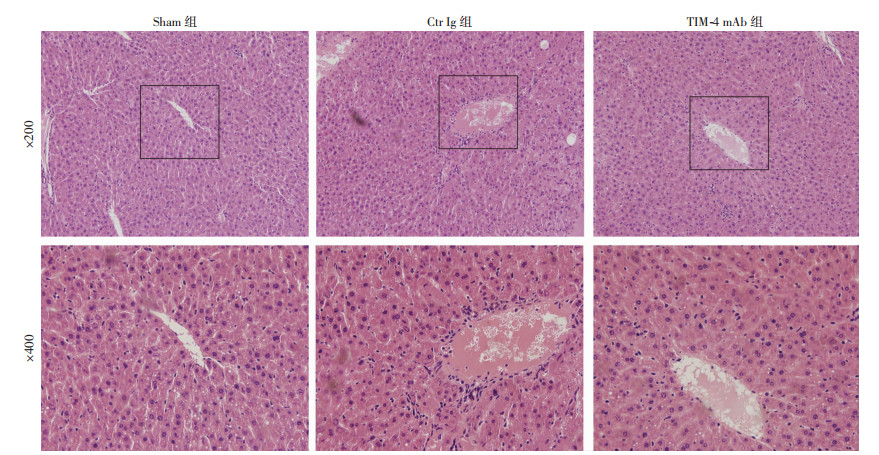
|
| 图 4 肝缺血再灌注24 h后HE染色观察肝组织病理变化 |
2.3 阻断TIM-4降低肝细胞凋亡程度
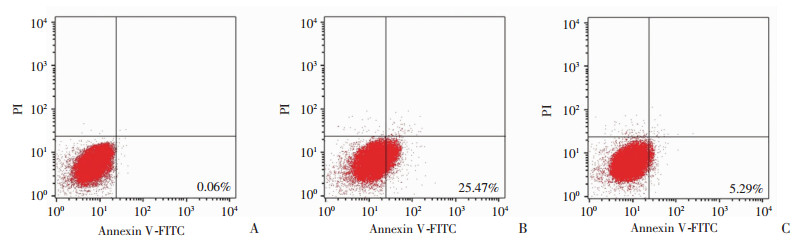
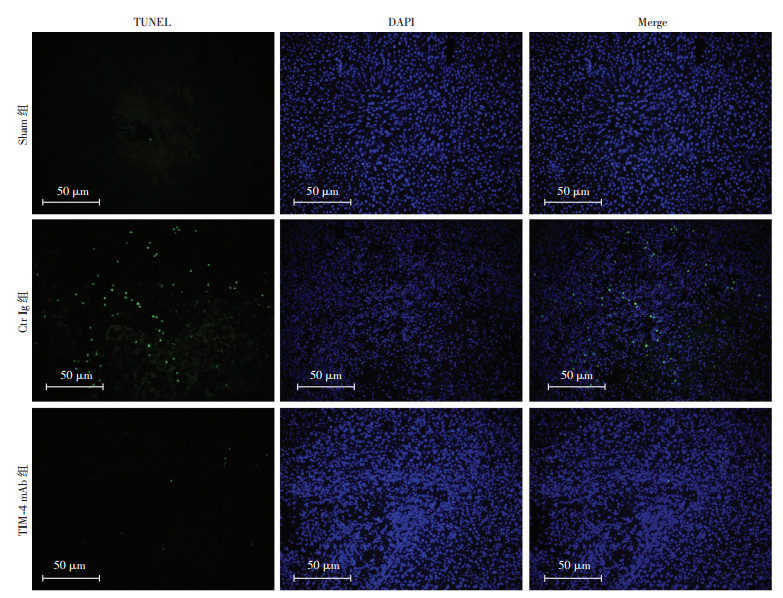
严重的细胞凋亡会引起炎症反应的级联放大,再灌注24 h后从TUNEL荧光结果上看,TIM-4 mAb组凋亡程度明显低于Ctr Ig组,并且通过流式检测肝细胞的凋亡数量发现,Ctr Ig组和TIM-4 mAb组细胞早期凋亡程度分别为(25.56±1.26)%、(5.35±0.33)%,且差异具有统计学意义(P < 0.05),结果提示阻断KCs TIM-4的功能对肝细胞具有一定程度的保护作用,见图 5、6。
|
| A: Sham组;B:Ctr Ig组;C:TIM-4 mAb组 图 5 肝缺血再灌注24 h后流式检测各组肝细胞凋亡 |
|
| 图 6 TUNEL检测肝缺血再灌注24 h后肝细胞凋亡 |
2.4 阻断KCs TIM-4可通过抑制NF-κB信号通路减轻炎症反应
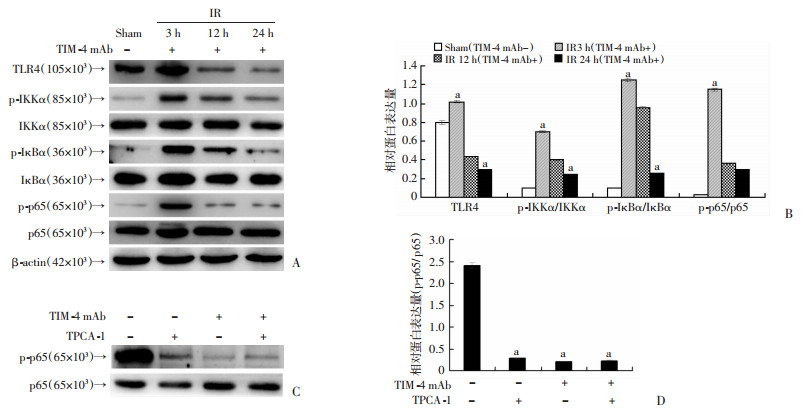
Western blot检测各组IR后3、12、24 h KCs炎症通路NF-κB相关蛋白发现,阻断KCs TIM-4功能后,KCs TLR4以及下游p-IKKα、p-IκBα、p-p65蛋白表达水平逐渐减低,12 h和24 h比较差异有统计学意义(P < 0.05);另外,采用TPCA-1(IKK-2阻断剂)进行预处理小鼠,IR 24 h后检测各组NF-κB通路关键因子p-p65蛋白表达情况,进一步验证了阻断KCs TIM-4可通过抑制NF-κB信号通路减轻IRI程度。见图 7。
|
| A:阻断KCs TIM-4功能后各蛋白表达水平的Western blot;B:阻断KCs TIM-4功能后各蛋白的相对表达量;a: P < 0.05, 与IR12 h组比较;C:TPCA-1预处理后p-p65蛋白表达的Western blot;D:TPCA-1预处理后,p-p65蛋白的相对表达量;a:P < 0.05,与TIM-4 mAb-TPCA-1-组比较 图 7 肝缺血再灌注后KCs NF-κB通路相关蛋白表达比较 |
3 讨论
HIRI主要由氧化应激、白细胞聚集介导的炎症紊乱等引起,是肝手术、肝移植中常见的病理生理现象,其后果往往取决于肝储备功能的强弱、缺血时间的长短等,肝功能的失衡可能会导致较高的死亡率[2, 8-9]。肝IR期间肝组织会发生明显的病理改变,长时间的缺血缺氧会引起细胞发生厌氧代谢,导致血清转氨酶以及乳酸脱氢酶升高,同时生成大量炎症因子和有毒代谢物,吸引游离水进入缺血细胞和细胞器,造成细胞水肿甚至细胞坏死凋亡[10]。KCs是定居于肝血窦内的巨噬细胞,占全身单核-巨噬细胞的80%以上,是机体最大的抗原递呈细胞群,在调节肝脏炎症状态以及免疫微环境中发挥着重要作用。因此,KCs的功能状态会直接影响HIRI的预后。
目前,TIM基因家族在免疫调节的作用越来越受到研究者的关注。小鼠TIM基因家族有8个成员,包括编码蛋白的TIM-1~4和4个假想蛋白TIM-5~8[5]。TIM-1表达于初始T细胞,为T细胞的激活提供协同刺激信号[11];TIM-2表达于Th2细胞上,但同时也表达于B细胞和肝细胞上[12];TIM-3选择性表达于Th1细胞上,作为半乳糖凝集素-9的配体,它们的相互作用可阻碍Th1细胞效应,缓解炎症反应[13];不同于其他TIM成员,TIM-4胞内区缺乏络氨酸活化基序,TIM-4仅表达于成熟的巨噬细胞和淋巴结DC细胞表面。TIM-4是TIM-1的天然配体,它们的相互作用可调节Th细胞的平衡。有研究发现,TIM-4/TIM-1信号通路参与了初始T细胞的激活分化,TIM-4浓度较低时,阻碍T细胞的活化,当浓度较高时,则刺激T细胞的活化增殖,而抑制TIM-4/TIM-1信号通路具有保护肾脏缺血再灌注损伤的作用[14-15]。TIM-4还能够与作为主要“eat me”信号分子磷脂酰丝氨酸(phosphatidy- lserine, PS)结合,介导凋亡细胞的吞噬清除,参与调节体内免疫微环境的稳态[16-17]。近来有研究报道,TIM-4在骨关节炎的患者中表达会增高,因此TIM-4的功能与炎症反应有一定的联系。研究人员通过阻断小鼠模型TIM-4发现,体内的炎症反应明显改善,并且还能够抑制破骨细胞的分化以及骨吸收,从而改善骨关节炎[18]。因此,本实验通过阻断小鼠KCs TIM-4的功能,能够明显减轻肝脏IR后炎症因子以及氧化产物等介导的炎症反应,从而改善小鼠HIRI。
本实验通过建立不同时间点小鼠HIRI模型,发现TIM-4的表达会随着时间变化逐渐升高,并且在早期肝IR,TIM-4的表达主要集中在KCs。阻断小鼠KCs TIM-4的功能能够明显改善肝功能指标AST、ALT、TBIL,降低促炎因子IL-1β、TNF-α和氧化应激产物MDA的分泌,提高抗炎因子IL-10以及抗氧化应激产物CAT、SOD的分泌,改善肝组织病理学的改变,减少肝细胞的凋亡,从而对肝组织起到保护性作用。NF-κB是一类转录因子,与炎症反应、免疫应答及细胞的增生、转化和凋亡等重要的病理生理过程密切相关[19]。细胞处于静息状态时,NF-κB通常与抑制性蛋白IκBs结合,以无活性的形式存在于胞质中。当细胞受到刺激时,NF-κB的诱导剂通过细胞膜激活胞浆中的IKK,导致IκB的磷酸化和降解,胞浆中游离的NF-κB被转运至细胞核内,与特定靶点结合,发挥相应的生物学功能。NF-κB可诱导细胞因子(如TNF-α、IL-1β和IL-6)、趋化因子(如IL-8)以及一些与炎症级联放大相关的酶等不同炎症靶基因的过度表达,进而趋化大量中性粒细胞等炎症细胞聚集,诱导产生炎性效应分子,同时这些细胞因子又是NF-κB的刺激剂,可进一步活化NF-κB,造成持续放大的炎症反应[20]。我们通过检测KCs NF-κB通路相关蛋白发现,阻断TIM-4能够明显抑制KCs TLR4以及下游p-IKKα、p-IκBα、p-p65蛋白表达,这也说明了阻断KCs TIM-4可通过抑制NF-κB信号通路减轻IRI程度。
因此,TIM-4有望在HIRI的治疗中发挥潜在作用,但对于其对其他相关炎症通路以及HIRI后期的影响机制尚需进一步实验证明。
| [1] | FENG J, YAO W, ZHANG Y, et al. Intravenous anesthetics enhance the ability of human bone marrow-derived mesenchymal stem cells to alleviate hepatic ischemia-reperfusion injury in a receptor-dependent manner[J]. Cell Physiol Biochem, 2018, 47(2): 556–566. DOI:10.1159/000489989 |
| [2] | DENG W S, XU Q, LIU Y E, et al. Effects of melatonin on liver function and lipid peroxidation in a rat model of hepaticischemia/reperfusion injury[J]. Exp Ther Med, 2016, 11(5): 1955–1960. DOI:10.3892/etm.2016.3160 |
| [3] | SHIMADA S, WAKAYAMA K, FUKAI M, et al. Hydrogen gas ameliorates hepatic reperfusion injury after prolonged cold preservation in isolated perfused rat liver[J]. Artif Organs, 2016, 40(12): 1128–1136. DOI:10.1111/aor.12710 |
| [4] | LI Z, JU Z, FRIERI M. The T-cell immunoglobulin and mucin domain(Tim) gene family in asthma[J]. Allergy Asthma Proc, 2013, 34(1): e21–e26. DOI:10.2500/aap.2013.34.3646 |
| [5] | MEYERS J H, SABATOS C A, CHAKRAVARTI S, et al. The TIM gene family regulates innate and adaptive immunity[J]. Trends Mol Med, 2005, 11(8): 362–269. DOI:10.1016/j.molmed.2005.06.008 |
| [6] | CHEN G S, QI H Z. Effect of Kupffer cells on immune tolerance in liver transplantation[J]. Asian Pac J Trop Med, 2012, 5(12): 970–972. DOI:10.1016/S1995-7645(12)60184-9 |
| [7] | LI P Z, LI J Z, LI M, et al. An efficient method to isolate and culture mouse Kupffer cells[J]. Immunol Lett, 2014, 158(1/2): 52–56. DOI:10.1016/j.imlet.2013.12.002 |
| [8] | YANG W, CHEN J, MENG Y, et al. Novel targets for treating ischemia-reperfusion injury in the liver[J]. Int J Mol Sci, 2018, 19(5): e1302. DOI:10.3390/ijms19051302 |
| [9] | ZHANG J, XU P, SONG P, et al. CCL2-CCR2 signaling promotes hepatic ischemia/reperfusion injury[J]. J Surg Res, 2016, 202(2): 352–362. DOI:10.1016/j.jss.2016.02.029 |
| [10] | XIE F, LI Z P, WANG H W, et al. Evaluation of liver ischemia-reperfusion injury in rabbits using a nanoscale ultrasound contrast agent targeting ICAM-1[J]. PLoS ONE, 2016, 11(4): e0153805. DOI:10.1371/journal.pone.0153805 |
| [11] | ZHANG Y, LIU Y, CHEN H, et al. TIM-1 attenuates the protection of ischemic preconditioning for ischemia reperfusion injury in liver transplantation[J]. Am J Transl Res, 2017, 9(8): 3665–3675. |
| [12] | DEWITZ C, MÖLLER-HACKBARTH K, SCHWEIGERT O, et al. T-cell immunoglobulin and mucin domain 2(TIM-2) is a target of ADAM10-mediated ectodomain shedding[J]. FEBS J, 2014, 281(1): 157–174. DOI:10.1111/febs.12583 |
| [13] | KIKUSHIGE Y, MIYAMOTO T, YUDA J, et al. A TIM-3/Gal-9 autocrine stimulatory loop drives self-renewal of human myeloid leukemia stem cells and leukemic progression[J]. Cell Stem Cell, 2015, 17(3): 341–352. DOI:10.1016/j.stem.2015.07.011 |
| [14] | RONG S, PARK J K, KIRSCH T, et al. The TIM-1: TIM-4 pathway enhances renal ischemia-reperfusion injury[J]. J Am Soc Nephrol, 2011, 22(3): 484–495. DOI:10.1681/ASN.2010030321 |
| [15] | FOKS A C, ENGELBERTSEN D, KUPERWASER F, et al. Blockade of Tim-1 and Tim-4 enhances atherosclerosis in low-density lipoprotein receptor-deficient mice[J]. Arterioscler Thromb Vasc Biol, 2016, 36(3): 456–465. DOI:10.1161/ATVBAHA.115.306860 |
| [16] | TIETJEN G T, GONG Z, CHEN C H, et al. Molecular mechanism for differential recognition of membrane phosphatidylserine by the immune regulatory receptor Tim4[J]. Proc Natl Acad Sci USA, 2014, 111(15): e1463–e1472. DOI:10.1073/pnas.1320174111 |
| [17] | SAVILL J, GREGORY C. Apoptotic PS to phagocyte TIM-4: eat me[J]. Immunity, 2007, 27(6): 830–832. DOI:10.1016/j.immuni.2007.12.002 |
| [18] | ABE Y, KAMACHI F, KAWAMOTO T, et al. TIM-4 has dual function in the induction and effector phases of murine arthritis[J]. J Immunol, 2013, 191(9): 4562–4572. DOI:10.4049/jimmunol.1203035 |
| [19] | TANIGUCHI K, KARIN M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nat Rev Immunol, 2018, 18(5): 309–324. DOI:10.1038/nri.2017.142 |
| [20] | ROTHSCHILD D E, MCDANIEL D K, RINGEL-SCAIA V M, et al. Modulating inflammation through the negative regulation of NF-κB signaling[J]. J Leukoc Biol, 2018.[Epub ahead of print]. DOI: 10.1002/JLB.3MIR0817-346RRR. |



