2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:干细胞与再生医学科
2. Department of Stem Cell and Regenerative Medicine, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
结直肠癌是最常见的恶性肿瘤之一,全球每年初诊患者超过120万[1]。根据美国癌症协会(American Cancer Society,ACS)资料,2018年新发病例约14万,占所有癌症病例的8.1%,死亡人数约5万,占癌症死亡人数的8.3%[2-3]。目前,结直肠癌患者5年总体生存率为64.5%[4],约25.0%的患者在就诊时已出现转移,而发生转移的患者5年总体生存率仅为14.0%[5]。传统的外科手术治疗以及辅助化疗依然是结直肠癌患者的主要治疗方式[6]。因此,寻找新的治疗靶点和策略,具有重要的临床意义。
肿瘤细胞通过改变自身代谢状态以适应细胞外微环境[7]。同时,代谢异常又可调控众多基因表达,从而改变肿瘤细胞表型[8]。其中,乙醛脱氢酶家族18成员A1(aldehyde dehydrogenase family 18 member A1,ALDH18A1),又称为吡咯啉-5-羧酸合成酶(pyrroline-5-carboxylate synthetase,P5CS),在脯氨酸、鸟氨酸及谷氨酸代谢中发挥重要作用[9]。研究表明ALDH18A1通过调控蛋白质合成代谢,进而促进黑色素瘤细胞增殖[10],提示ALDH18A1可能发挥促癌作用。然而,ALDH18A1在结直肠癌患者中的临床病理学意义目前尚不清楚。本研究利用肿瘤基因组图谱(the cancer genome atlas, TCGA)和基因表达综合数据库(gene expression omnibus, GEO)的基因表达信息以及结直肠癌组织芯片的免疫组化分析,探讨ALDH18A1与结直肠癌临床病理参数和生存预后的关系,观察敲低ALDH18A1对结直肠癌细胞增殖活性的影响以及与骨髓细胞瘤原癌基因(myelocytomatosis oncogene,MYC)表达的关系,并进一步通过基因集富集分析(gene set enrichment analysis,GSEA)评价ALDH18A1与MYC靶基因活化的关系,旨在为探索新的结直肠癌治疗靶点和策略提供实验依据。
1 资料与方法 1.1 TCGA和GEO数据挖掘登录Xena Public Data Hubs(http://xena.ucsc.edu/public-hubs/)下载结直肠癌RNA测序数据(TCGA colon and rectal cancer,COADREAD),芯片平台为Illumina HiSeq 2000 RNA Sequencing Platform;通过R数据包(affy 1.42.3)[11]下载GEO数据库的GSE41258数据集,芯片平台为Affymetrix Human Genome U133A Array。表达谱差异分析利用R语言包(limma 3.20.9)[12]。
1.2 GSEA整理GSE41258数据集的表达数据,取ALDH18A1中位表达量为临界值,分为ALDH18A1高/低表达组,制作表型数据文件。在GSEA官方网站(http://software.broadinstitute.org/gsea)下载功能基因集文件:HALLMARK_MYC_TARGETS_V1、HALLMARK_MYC_TARGETS_V2、DANG_REGULATED_BY_MYC_UP和DANG_MYC_TARGETS_UP。完善参数设置,进行GSEA分析,提取标准化富集积分(normalized enrichment score,NES)、错误发现率(false discovery rate,FDR)和名义P值。
1.3 受试者工作特征曲线(receiver operating characteristic curve,ROC Curve)确定临界值将TCGA结直肠癌数据库、GSE41258数据集的病例按照是否发生终点事件分为生存组和死亡组,以真阳性率(灵敏度)为纵坐标,假阳性率(1-特异度)为横坐标绘制ROC曲线,得到约登指数(灵敏度+特异度-1)。以约登指数最大所对应的分界值或决定阈为最佳分类界值,即ALDH18A1或MYC分组的临界值。
1.4 免疫组化检测结直肠癌组织芯片的ALDH18A1和c-MYC蛋白水平组织芯片来源于上海芯超生物科技有限公司。将样本烘烤30 min后标准脱蜡处理,37 ℃过氧化氢阻断液内浸泡30 min以阻断内源性过氧化氢酶,随后用PBS液洗涤3次,每次5 min,放入枸橼酸抗原修复工作液中进行修复,血清封闭30 min。之后加入ALDH18A1兔抗人多克隆抗体(1 :20)(Abgent公司,美国)和c-MYC兔抗人单克隆抗体(1 :50)(Cell Signaling Technology公司,美国),4 ℃孵育过夜;第2天用PBS液洗涤3次,每次5 min,滴加鼠兔通用二抗,37 ℃孵育30 min;DAB显色3~5 min,苏木精复染细胞核30 s,酒精梯度脱水后置于二甲苯中透明,待晾干后用中性树胶封片。在光学显微镜下观察并拍照,采用Image-pro-plus 6.0软件定量分析ALDH18A1和c-MYC累积光密度值。
1.5 细胞培养人结直肠癌细胞系HT29、HCT116购自中科院上海细胞库,人正常结肠上皮细胞NCM460购自美国ATCC,采用含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2、95%湿度的恒温培养箱中培养,隔日换液,3~5 d传代。
1.6 ALDH18A1 shRNA慢病毒包装及感染采用分子克隆技术将ALDH18A1 shRNA(5′-CCGGCCATTATTTGACC AGATCATTCTCGAGAATGATCTGG- TCAAATAATGGTTTTTG-3′,5′-AATTCAAAAACCATT-ATTTGACCAG ATCATTCTCGAGAATGATCTGGTCAAAT- AATGG-3′)(Sigma-Aldrich公司,美国)构建到pLVshRNA-eGFP慢病毒载体(英茂盛业生物科技有限公司,北京)中,命名为ALDH18A1 shRNA。利用Lipofectamine 3000转染试剂(Invitrogen公司,美国)将5 μg ALDH18A1 shRNA,3.75 μg PSPAX2和1.25 μg PMD2.G包装质粒转入5×10-6个生长状态良好的HEK293T细胞,48 h后收取病毒上清加入HT29、HCT116细胞中,置于37 ℃恒温培养箱中培养,6 h后换成新鲜培养基,流式细胞分选仪筛选eGFP阳性细胞。
1.7 siRNA敲低ALDH18A1基因的表达根据广州锐博生物设计合成的siRNA干扰系列(siALDH18A1 #1:GTTCGTTCTTGGAGCAACA;siALDH18A1 #2:GAACCTCAATGGAACACTT;siALDH18A1 #3:GA- AGGGATCTGTCACATGT)以及产品使用说明书,分别将5 μL siALDH18A1-1、siALDH18A1-2和siALDH18A1-3及阴性对照,与5 μL的Lipofectamine RNAiMAX(Invitrogen公司,美国)转染试剂在200 μL的Opti-MEM(Gibco公司,美国)中混匀,室温孵育15 min。同时,将HT29、HCT116细胞消化后按(3~5)×105/孔的密度接种于6孔板中,并加入上述混合液,置于37 ℃、5% CO2、95%湿度的恒温培养箱中培养,转染48 h后收集细胞用于ALDH18A1的mRNA和蛋白表达的检测[13]。
1.8 Real-time PCR检测ALDH18A1和MYC的mRNA水平按照RNAiso Plus说明书提取转染siALDH18A1和阴性对照的HT29细胞RNA,利用NanoDrop2000超微量分光光度计测量RNA浓度。根据Prime Script RT Reagent Kit(TaKaRa公司,日本)说明书,将上述提取的RNA反转录为cDNA,并按照SYBR Premix Ex TaqTMⅡ说明书,取7.5 μL SYBR Premix Ex TaqTM Ⅱ、1 μL cDNA、1 μL上游引物、1 μL下游引物、4.5 μL dH2O,配制成15 μL Real-time PCR反应体系。GAPDH引物,上游:5′-ACAACTTTGGTATCGTGGAAGG-3′,下游:5′-GCCATCACGCCACAGTTTC-3′,101 bp;ALDH18A1引物,上游:5′-GCCCTTCAACCAACATCTTCT-3′,下游:5′-AGGGGTACAGTGATAAACGGG-3′,126 bp;MYC引物,上游:5′-GGCTCCTGGCAAAAGGTCA-3′,下游:5′-CTGCGTAGTTGTGCTGATGT-3′,119 bp。反应条件为:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;溶解曲线65.0~95.0 ℃,温度间隔0.5 ℃,每15秒读板1次。
1.9 Western blot检测ALDH18A1和c-MYC的蛋白表达收集转染siALDH18A1和阴性对照的HT29、HCT116细胞,加入适量M-PERTM Mammalian Protein Extraction Reagent(Thermo Scientific公司,美国),并按100 :1加入蛋白酶抑制剂,吹打混匀后置于冰上裂解30 min,之后4 ℃、14 000 r/min离心10 min,提取上清,BCA试剂盒测定蛋白浓度。随后加入适量蛋白上样缓冲液(5×),混匀后金属浴加热至100 ℃,10 min变性。配置电泳凝胶,蛋白上样量为50 μg/孔。恒压电泳80 V, 40 min,之后120 V, 45 min,PVDF转膜100 V, 100 min。将膜放入含5%脱脂奶粉的PBST中封闭1 h后孵育一抗,GAPDH兔抗人多克隆抗体(1 :1 000)(Cell Signaling Technology公司,美国)、ALDH18A1兔抗人多克隆抗体(1 :1 000)以及c-MYC兔抗人单克隆抗体(1 :1 000),4 ℃孵育过夜。PBST洗膜10 min×3次,然后将膜放入1 :3 000的羊抗兔二抗(中杉金桥公司,北京)中,室温孵育1 h;PBST洗膜10 min×3次,加入SuperSignalingTM West Femto Substrate(Thermo Scientific,34095),Bio-Rad凝胶成像仪显影。
1.10 四唑化合物(methyl-thiazolyldiphenyl-sulfophenyl-tetrazolium bromide,MTS)检测下调ALDH18A1对结直肠癌细胞增殖活性的影响将HT29、HCT116细胞消化后,用含10%胎牛血清的DMEM高糖培养基配成单细胞悬液,按1 000/孔的密度接种于96孔板中,每孔体积100 μL,置于37 ℃、5%CO2、95%湿度的恒温培养箱中培养24 h;第2天,每孔加入MTS溶液20 μL,继续孵育2 h;选择490 nm波长,在分光光度计上测定各孔光密度值D(490),记录结果,以时间为横坐标、光密度值为纵坐标,绘制细胞生长曲线。
1.11 统计学分析采用SPSS 22.0统计软件和GraphPad Prism 5对实验数据进行处理,数据用x ±s表示,进行独立样本t检验;Kaplan-Meier生存分析应用Log-Rank检验;列联表分析采用χ2检验;预后预测因子的单因素/多因素方差分析采用Cox比例风险回归模型:模型检验采用似然比检验,参数估计采用最大似然法,参数检验采用Wald检验。检验水准:α= 0.05。
2 结果 2.1 ALDH18A1在结直肠癌中高表达并具有预后判断价值 2.1.1 ALDH18A1在结直肠癌组织中高表达GSE41258数据集结果显示:与正常结肠组织(8.237 0± 0.037 4,n=103)比较,结直肠癌患者(8.365 0±0.029 6,n=186)的ALDH18A1 mRNA表达显著升高(独立样本t检验,P=0.008 8)。
2.1.2 ALDH18A1与结直肠癌临床病理参数密切相关对结直肠癌患者的组织芯片(共90例)进行免疫组化染色,并采用Image-Pro Plus软件对ALDH18A1表达进行量化分析,结果显示ALDH18A1与原发肿瘤大小蔓延范围(pT)、区域淋巴结转移(pN)以及美国癌症联合委员会(American Joint Committee on Cancer,AJCC)临床分期等结直肠癌病理参数密切相关(表 1,图 1~3)。
| 临床病理参数 | 例数 | ALDH18A1表达 | P值 | |
| ALDH18A1low | ALDH18A1high | |||
| 性别 | 0.53 | |||
| 女性 | 45 | 20 | 25 | |
| 男性 | 45 | 23 | 22 | |
| 发病年龄 | 0.71 | |||
| ≤65岁 | 40 | 20 | 20 | |
| >65岁 | 50 | 23 | 27 | |
| 肿瘤部位 | 0.64 | |||
| 右半结肠 | 40 | 18 | 22 | |
| 左半结肠 | 50 | 25 | 25 | |
| 病理分级 | 0.12a | |||
| Ⅰ+Ⅱ | 76 | 39 | 37 | |
| Ⅲ | 14 | 4 | 10 | |
| pT | 0.03a | |||
| T1+T2 | 6 | 6 | 0 | |
| T3+T4 | 84 | 37 | 47 | |
| pN | 0.00 | |||
| N0 | 55 | 33 | 22 | |
| N1+N2 | 35 | 10 | 25 | |
| AJCC临床分期 | 0.00 | |||
| Ⅰ+Ⅱ | 55 | 33 | 22 | |
| Ⅲ+Ⅳ | 35 | 10 | 25 | |
| ALDH18A1low:ALDH18A1低表达患者;ALDH18A1high:ALDH18A1高表达患者;取ALDH18A1中位表达量为临界值;a:P值采用Continuity连续性校正公式所得 | ||||
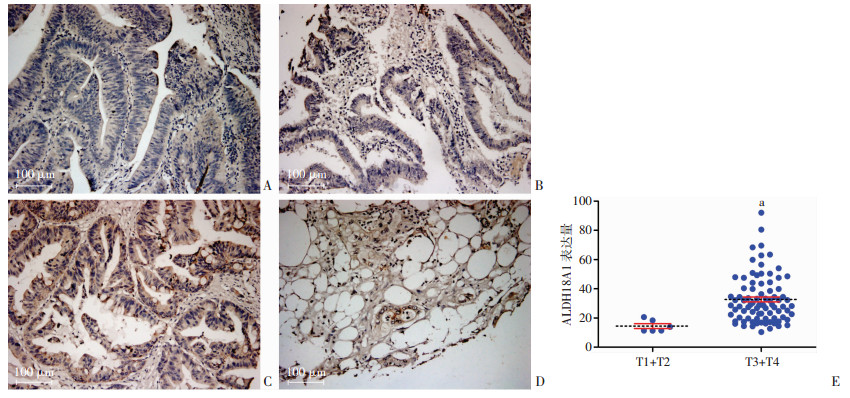
|
| A~D:分别为免疫组化检测ALDH18A1在不同原发肿瘤大小/蔓延范围(T1、T2、T3、T4)结直肠癌组织的表达(二步法);E:结直肠癌组织芯片ALDH18A1定量分析(n=90)a:独立样本t检验,P=0.007 6,与T1+T2比较 图 1 免疫组化检测ALDH18A1在不同原发肿瘤大小/蔓延范围结直肠癌组织的表达 |
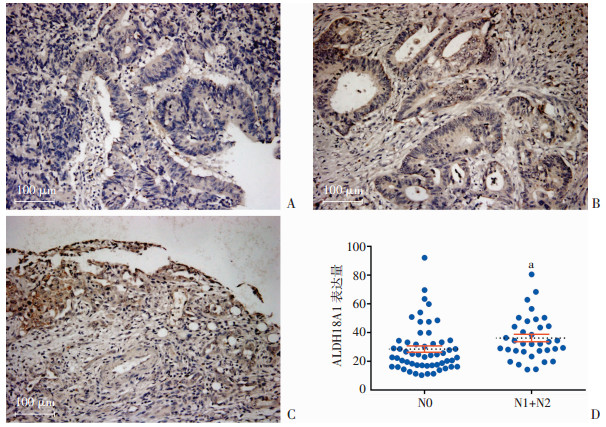
|
| A~C:分别为免疫组化检测ALDH18A1在不同淋巴结转移状态(N0、N1、N2)结直肠组织的表达(二步法);D:结直肠癌组织芯片ALDH18A1定量分析(n=90) a:独立样本t检验,P=0.029 7,与N0比较 图 2 免疫组化检测ALDH18A1在不同淋巴结转移状态结直肠癌组织的表达 |
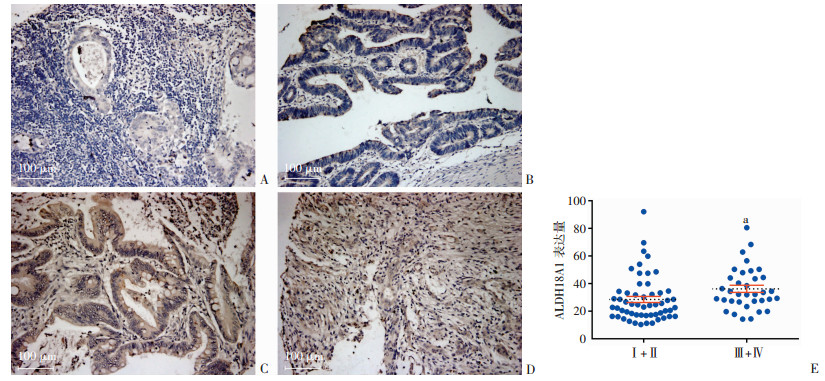
|
| A~D:分别为免疫组化检测ALDH18A1在不同AJCC临床分期(Ⅰ、Ⅱ、Ⅲ、Ⅳ)结直肠癌组织的表达(二步法);E:结直肠癌组织芯片ALDH18A1定量分析(n=90) a:独立样本t检验,P=0.029 7,与Ⅰ+Ⅱ比较 图 3 免疫组化检测ALDH18A1在不同AJCC临床分期结直肠癌组织的表达 |
2.1.3 ALDH18A1高表达的结直肠癌患者预后不良
对TCGA数据库的结直肠癌患者进行基于ALDH18A1表达差异的Kaplan-Meier生存分析(利用ROC曲线确定临界值),结果显示:ALDH18A1低表达患者的生存时间(中位生存时间2 821 d,n=325)较ALDH18A1高表达患者(中位生存时间1 566 d,n=93)显著延长(Log-rank检验,P=0.033 3,图 4A)。
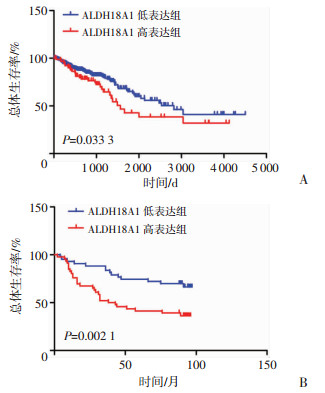
|
| A:基于TCGA结直肠癌数据库ALDH18A1表达差异的Kaplan-Meier生存曲线分析(n=418);B:基于结直肠癌组织芯片ALDH18A1表达差异的Kaplan-Meier生存曲线分析(n=89) 图 4 ALDH18A1高/低表达患者之间的预后差异分析 |
同时,基于结直肠癌患者组织芯片的免疫组化数据分析结果显示:ALDH18A1低表达患者的预后(中位生存时间77.65个月,n=43)较高表达患者(中位生存时间52.39个月,n=46)显著延长(Log-rank检验,P=0.002 1),与TCGA结直肠癌数据库分析结果一致(图 4B)。
进一步对上述90例结直肠癌患者的预后预测因子进行单因素和多因素回归分析,结果提示ALDH18A1在结直肠癌中具有显著的预后判断价值(风险比为1.996,95%置信区间为1.012~3.939,P=0.046,表 2)。
| 变量 | 例数 | 单因素分析 | 多因素分析 | |||
| 平均生存/月 | P值 | 风险比 (95%可信区间) |
P值 | |||
| 性别 | 0.20 | 0.217 | ||||
| 女性 | 44 | 60.08 | 1.0 | |||
| 男性 | 45 | 69.36 | 0.678(0.366~1.256) | |||
| 发病年龄 | 0.36 | 0.223 | ||||
| ≤65岁 | 40 | 67.35 | 1.0 | |||
| >65岁 | 49 | 62.69 | 1.483(0.787~2.795) | |||
| 肿瘤部位 | 0.73 | 0.736 | ||||
| 右半结肠 | 40 | 62.48 | 1.0 | |||
| 左半结肠 | 49 | 66.68 | 0.896(0.473~1.696) | |||
| 病理分级 | 0.00 | 0.056 | ||||
| Ⅰ+Ⅱ | 76 | 68.68 | 1.0 | |||
| Ⅲ | 13 | 41.82 | 2.054(0.982~4.296) | |||
| pT | 0.17 | 0.512 | ||||
| T1+T2 | 6 | 90.83 | 1.0 | |||
| T3+T4 | 83 | 62.73 | 1.999(0.253~15.830) | |||
| pNb | <0.01 | |||||
| N0 | 54 | 74.51 | ||||
| N1+N2 | 35 | 49.76 | ||||
| AJCC临床分期 | <0.01 | 0.043 | ||||
| Ⅰ+Ⅱ | 54 | 74.51 | 1.0 | |||
| Ⅲ+Ⅳ | 35 | 49.76 | 1.926(1.020~3.635) | |||
| ALDH18A1表达量 | <0.01 | 0.046 | ||||
| ALDH18A1low | 43 | 77.65 | 1.0 | |||
| ALDH18A1high | 46 | 52.39 | 1.996(1.012-3.939) | |||
| ALDH18A1low:ALDH18A1低表达患者;ALDH18A1high:ALDH18A1高表达患者;取ALDH18A1中位表达量为临界值;a:pN的自由度已因线性相关协变量AJCC临床分期而降低;b:线性相关协变量AJCC临床分期=pN | ||||||
2.2 下调ALDH18A1表达可显著抑制结直肠癌细胞增殖活性
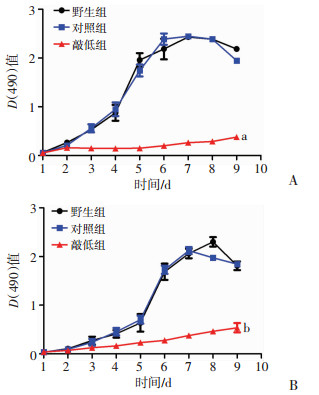
MTS检测结果显示:利用ALDH18A1 shRNA下调其表达后,结直肠癌细胞的增殖能力显著抑制(HT29:对照组和ALDH18A1敲低组,独立样本t检验,n=6,P=1.485 0×10-19;HCT116:对照组和ALDH18A1敲低组,独立样本t检验,n=6,P=2.869 8×10-11,图 5)。
|
| a:P<0.01,与HT29对照组比较;b:P<0.01,与HCT116对照组比较 图 5 下调ALDH18A1表达后结直肠癌细胞HT29(A)、HCT116(B)增殖活性的变化 |
2.3 ALDH18A1表达与癌基因MYC密切相关 2.3.1 ALDH18A1和MYC在mRNA水平呈正相关
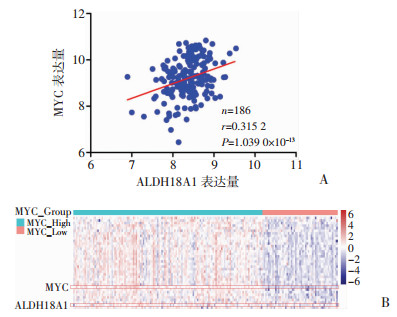
有研究结果显示:几乎所有结直肠癌患者都有不同程度的MYC基因表达失控,其在结直肠癌的恶性增殖、干性维持、癌性转化等方面扮演重要的角色[14]。本研究围绕ALDH18A1对结直肠癌细胞增殖能力的调控是否与MYC基因有关进行了探讨。提取结肠癌患者GSE41258数据集中ALDH18A1和MYC的mRNA表达量信息,相关性分析结果提示:ALDH18A1与MYC的表达呈显著正相关(相关系数r=0.315 2,P=1.039 0×10-13,图 6A)。
|
| A:GSE41258数据集中结直肠癌患者ALDH18A1与MYC表达的相关分析;B:MYC高/低表达组的表达谱差异分析 图 6 ALDH18A1和MYC在mRNA水平的相关性 |
提取GSE41258数据集中的MYC基因表达值,根据患者生存结局,利用ROC曲线确定临界值,将结直肠癌患者分为MYC高表达组和低表达组。表达谱差异分析结果显示:与MYC低表达组相比,ALDH18A1在MYC高表达组的表达水平较高,差异有统计学意义(Log2Fold Change=0.194 7,P=0.014 9,图 6B),提示两者在mRNA水平存在高度相关性。
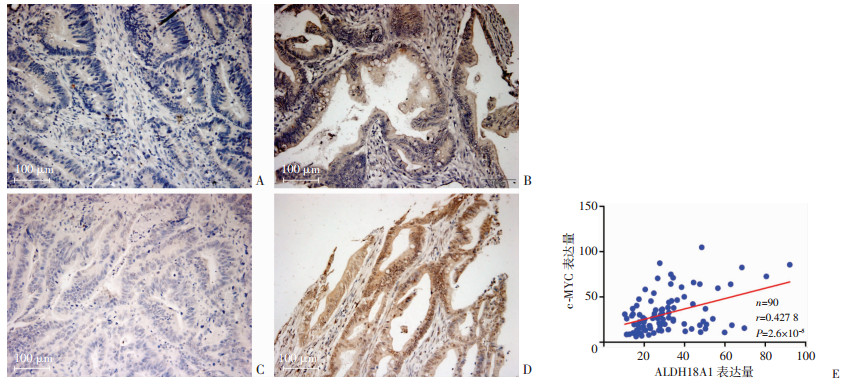
2.3.2 ALDH18A1和MYC在蛋白水平呈正相关对结直肠癌组织芯片免疫组化结果进行ALDH18A1和c-MYC蛋白水平的量化分析,发现结直肠癌患者的ALDH18A1和c-MYC蛋白水平呈显著的正相关(相关系数r=0.427 8,P=2.600 0×10-5,图 7)。
|
| A、C:分别为免疫组化检测编号D15A0640-B30-C1的结直肠癌组织芯片中ALDH18A1和c-MYC的表达(二步法);B、D:分别为免疫组化检测编号D15A0980-B30-C1的结直肠癌组织芯片中ALDH18A1和c-MYC的表达(二步法);E:结直肠癌组织芯片中ALDH18A1与c-MYC表达的相关分析 图 7 免疫组化分析ALDH18A1和c-MYC蛋白之间的相关性 |
2.4 下调ALDH18A1可抑制MYC基因表达 2.4.1 ALDH18A1、c-MYC在结直肠癌细胞系中高表达
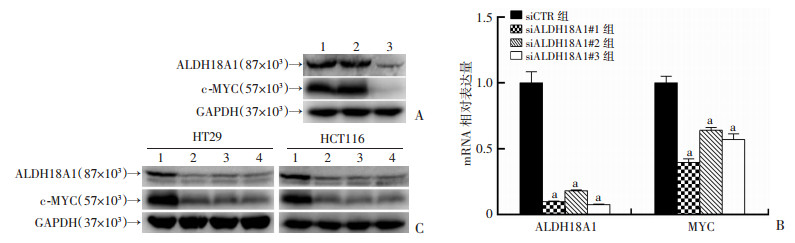
Western blot检测结果显示:与正常结肠上皮细胞NCM460相比,ALDH18A1在结直肠癌细胞中表达明显较高。同时,c-MYC的表达趋势与ALDH18A1基本一致(图 8A)。
|
| A:Western blot检测ALDH18A1和c-MYC的表达1:HT29细胞系;2:HCT116细胞系;3:NCM460细胞系;B:Real-time PCR检测下调ALDH18A1表达后c-MYC mRNA的表达a:P<0.01,与siCTR组比较;C:Western blot检测下调ALDH18A1表达后c-MYC蛋白的表达1:siCTR组;2:siALDH18A1 #1组;3:siALDH18A1 #2组;4:siALDH18A1 #3组 图 8 下调ALDH18A1抑制MYC基因表达 |
2.4.2 下调ALDH18A1基因表达显著抑制MYC mRNA水平
Real-time PCR结果显示:siALDH18A1组与siCTR组比较,其ALDH18A1 mRNA水平显著下调(n=4,P<0.01);而下调ALDH18A1之后,MYC mRNA水平呈现同向变化(n=4,P<0.01,图 8B)。
2.4.3 下调ALDH18A1表达显著降低c-MYC蛋白水平Western blot检测结果同样提示:siALDH18A1可显著降低ALDH18A1蛋白水平,而c-MYC与ALDH18A1在蛋白水平上呈现同向变化:即下调ALDH18A1,c-MYC在蛋白水平同样出现显著性下降(图 8C)。
2.4.4 ALDH18A1高表达患者存在c-MYC靶基因的活化GSEA分析结果显示:高表达ALDH18A1的结直肠癌患者存在多个c-MYC靶基因集的富集,包括:HALLMARK_MYC_TARGETS_V1(共含200个基因,其中152个基因显著富集,FDR=0.006 0,P=0.004 1)、HALLMARK_MYC_TARGETS_V2(共含58个基因,其中44个基因显著富集,FDR=0.035 9,P=0.042 5)、c-MYC正向调控基因DANG_REGULATED_BY_MYC_UP(含72个基因,其中39个基因显著富集,FDR=0.046 7,P=0.041 8)和DANG_MYC_TARGETS_UP(含143个基因,其中75个基因显著富集,FDR=0.004 0,P=0.004 1,图 9)。
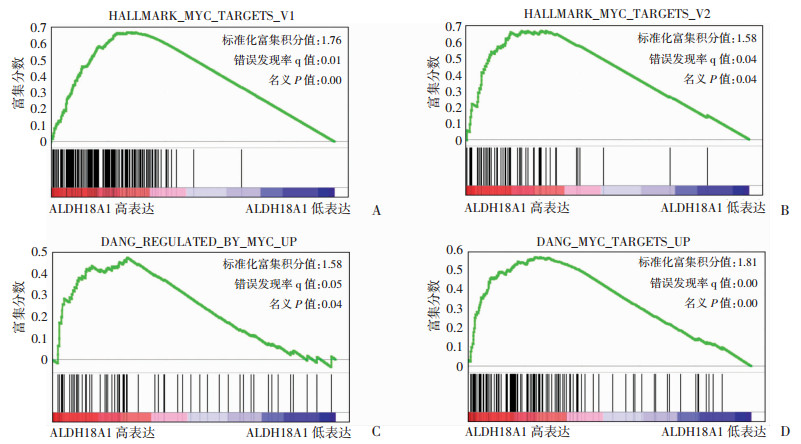
|
| A:c-MYC靶基因集HALLMARK_MYC_TARGETS_V1的富集分析;B:c-MYC靶基因集HALLMARK_MYC_TARGETS_V2的富集分析;C:c-MYC正向调控基因集DANG_REGULATED_BY_MYC_UP的富集分析;D:c-MYC正向调控基因集DANG_MYC_TARGETS_UP的富集分析 图 9 基于ALDH18A1表达差异的GSEA分析 |
3 讨论
ALDHs家族作为机体重要的代谢相关酶类,可利用NADP+或NAD+将各种醛氧化生成相应的羧酸,并参与糖类、脂类和氨基酸三大物质代谢,与胚胎发育和肿瘤发生、进展密切相关[15]。其中,ALDH18A1所编码的P5CS是催化脯氨酸、鸟氨酸和精氨酸合成的关键酶,其催化产物吡咯啉羧酸(P5C)及其异构体谷氨酸半醛(GSA)则是脯氨酸、鸟氨酸及谷氨酸的互变转换中所必需的中间产物[9]。脯氨酸作为唯一的亚氨基酸,可转变为多种氨基酸及代谢中间产物,间接参与了三羧酸循环和尿素循环。研究表明脯氨酸代谢可调控组蛋白H3K9和H3K36甲基化修饰,在肿瘤代谢重编程(metabolic reprogramming)与表观遗传学调控之间发挥重要的连接作用[16];谷氨酸则为嘌呤和嘧啶的生物合成提供亚氨基,从而在核苷酸代谢中扮演重要的角色;另外,谷氨酸还可转变为α-酮戊二酸,研究表明α-酮戊二酸可作为一种辅因子,参与组蛋白去甲基化酶(histone demethylases,HDMs)和10-11易位酶(ten eleven translocation,TET)家族所介导的组蛋白和DNA去甲基化修饰;同时,谷氨酸代谢经三羧酸循环产生柠檬酸盐,可引起乙酰-CoA增加,后者也被证实是组蛋白乙酰转移酶(histone acetyltransferases,HATs)的辅因子,广泛参与组蛋白乙酰化修饰作用,以上均表明基因组的去甲基化、乙酰化等表观遗传学修饰与谷氨酸代谢等肿瘤的代谢异常密切相关[17]。
结直肠癌是最常见的消化道恶性肿瘤,尽管有效筛查、药物防护和积极改善生活方式已使得结直肠癌的病死率有所下降,但20%~25%的患者在诊断时已有肿瘤转移,约20%的患者在治疗过程中出现转移,导致结直肠癌的治疗结果仍不理想[18]。同时,年龄小于55岁的患者,其发病率和病死率依然处于上升趋势[3]。因此,需要进一步解析结直肠癌发生、进展的分子机制,探索全新的治疗靶点和策略。本研究通过生物信息学分析发现:ALDH18A1在结直肠癌中存在异常表达,与结直肠癌的临床病理参数密切相关,对患者的生存预后具有显著影响。同时,利用siRNA下调ALDH18A1可明显抑制结直肠癌细胞的增殖活性,提示ALDH18A1可能通过代谢-表观遗传学修饰的机制对结直肠癌的恶性增殖、细胞周期进程以及肿瘤发生、进展等过程发挥调控作用,其具体机制还需进一步研究加以明确。
有研究表明ALDH18A1在Luminal B型乳腺癌中处于异常高表达状态,与其预后不良有关,并且与MYC表达呈显著正相关关系[19]。转录因子c-MYC作为DNA结合蛋白复合体的一部分,含有碱性螺旋-环-螺旋(basic-helix-loop-helix,bHLH)亮氨酸拉链结构,与同为bHLH转录因子的Max二聚体化后[20],广泛结合至多个靶基因的启动子或增强子上的E-box[CAC(G/A)TG][21]区域,形成复杂的调控网络[22],涉及多种促细胞生长信号转导通路,包括细胞分裂周期、细胞代谢与生物合成、细胞结构、细胞生存以及与增殖细胞微环境相关的血管生成、组织重构以及酶和生长因子募集等[23]。MYC基因近端启动子区域存在许多转录调节模体,可通过多种机制对MYC表达水平进行精密调控[24]。大量研究表明癌基因MYC在结直肠癌中通常处于高表达状态,并参与多种信号转导通路和靶基因调控网络[14],在结直肠癌的发生、进展以及侵袭转移中发挥驱动作用[25]。研究表明在基因水平干扰MYC表达能够显著抑制结直肠癌细胞的恶性增殖,显示出良好的治疗效应[25]。然而,由于c-MYC与Max二聚体之间存在很大的蛋白质交界面(3206A)[26],目前对该转录因子的直接药物干预仍较困难[23],亟须找寻新的干预手段和策略。其中,寻找MYC的上游调控因子,尤其从代谢-表观遗传学调控的角度,探寻抑制MYC转录、促进其mRNA降解的机制,或是一个重要的探索方向[27]。
值得一提的是:MYC可在Burkitt淋巴瘤和前列腺癌中调控ALDH18A1的表达[28]。进一步研究表明:ALDH18A1基因的启动子区域含有两个c-MYC结合位点[29],以上均提示ALDH18A1可能是c-MYC的靶基因。同时,既往研究证据显示:MYC调控肿瘤细胞的有氧糖酵解、线粒体生物合成以及谷氨酰胺-谷氨酸代谢等过程[30],可导致NAD+/NADH、乙酰葡糖胺、α乙酮戊二酸、ATP/AMP、乙酰CoA和SAM等细胞代谢产物水平异常,而这些代谢物质又是多种表观遗传学修饰酶类的底物或辅因子[17]。目前尚无研究表明ALDH18A1可通过代谢-表观遗传学机制对癌基因MYC的表达发挥调控作用。尽管本研究发现下调ALDH18A1可显著抑制MYC基因表达,但位于线粒体内膜的代谢酶ALDH18A1影响MYC基因表达的具体机制,以及二者是否存在直接相互作用,还需要后续研究进一步探索。
综上所述,本研究发现下调ALDH18A1可明显抑制MYC基因表达,表明ALDH18A1对MYC基因表达可能存在调控作用,进一步提示:在结直肠癌中MYC和ALDH18A1之间可能存在正反馈调节环路,在结直肠癌中干预ALDH18A1或许能够抑制MYC基因表达,并具有潜在的治疗学意义。本研究结果为找寻新的结直肠癌治疗靶点和干预措施提供了实验依据。
| [1] | BERTOTTI A, PAPP E, JONES S, et al. The genomic landscape of response to EGFR blockade in colorectal cancer[J]. Nature, 2015, 526(7572): 263–267. DOI:10.1038/nature14969 |
| [2] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [3] | WOLF A M D, FONTHAM E T H, CHURCH T R, et al. Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society[J]. CA: A Cancer J Clin, 2018, 68(4): 250–281. DOI:10.3322/caac.21457 |
| [4] | VAN CUTSEM E, CERVANTES A, NORDLINGER B, et al. Metastatic colorectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(Suppl 3): iii1–9. DOI:10.1093/annonc/mdu260 |
| [5] | OVERMAN M J, LONARDI S, WONG K Y M, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair-deficient/microsatellite instability-high metastatic colorectal cancer[J]. J Clin Oncol, 2018, 36(8): 773–779. DOI:10.1200/jco.2017.76.9901 |
| [6] | TAN S H, BARKER N. Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate[J]. Cancer Cell, 2015, 28(6): 683–685. DOI:10.1016/j.ccell.2015.11.004 |
| [7] | PAVLOVA N N, THOMPSON C B. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23(1): 27–47. DOI:10.1016/j.cmet.2015.12.006 |
| [8] | HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [9] | HU C A, KHALIL S, ZHAORIGETU S, et al. Human delta1-pyrroline-5-carboxylate synthase: function and regulation[J]. Amino Acids, 2008, 35(4): 665–672. DOI:10.1007/s00726-008-0075-0 |
| [10] | KARDOS G R, WASTYK H C, ROBERTSON G P. Disruption of proline synthesis in melanoma inhibits protein production mediated by the GCN2 pathway[J]. Mol Cancer Res, 2015, 13(10): 1408–1420. DOI:10.1158/1541-7786.MCR-15-0048 |
| [11] | GAUTIER L, COPE L, BOLSTAD B M, et al. Affy—analysis of Affymetrix Genechip data at the probe level[J]. Bioinformatics, 2004, 20(3): 307–315. DOI:10.1093/bioinformatics/btg405 |
| [12] | RITCHIE M E, PHIPSON B, WU D, et al. limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Res, 2015, 43(7): e47. DOI:10.1093/nar/gkv007 |
| [13] |
彭动斌, 唐雪峰, 高自然, 等. 下调Notch3表达对骨肉瘤细胞生物学特性的影响[J].
第三军医大学学报, 2018, 40(7): 551–556.
PENG D B, TANG X F, GAO Z R, et al. Effect of down-regulating Notch3 expression on biological characteristics of osteosarcoma cells[J]. J Third Mil Med Univ, 2018, 40(7): 551–556. DOI:10.16016/j.1000-5404.201711019 |
| [14] | Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487(7407): 330–337. DOI:10.1038/nature11252 |
| [15] | DUAN J J, CAI J, GUO Y F, et al. ALDH1A3, a metabolic target for cancer diagnosis and therapy[J]. Int J Cancer, 2016, 139(5): 965–975. DOI:10.1002/ijc.30091 |
| [16] | COMES S, GAGLIARDI M, LAPRANO N, et al. L-proline induces a mesenchymal-like invasive program in embryonic stem cells by remodeling H3K9 and H3K36 methylation[J]. Stem Cell Reports, 2013, 1(4): 307–321. DOI:10.1016/j.stemcr.2013.09.001 |
| [17] | LU C, THOMPSON C B. Metabolic regulation of epigenetics[J]. Cell Metab, 2012, 16(1): 9–17. DOI:10.1016/j.cmet.2012.06.001 |
| [18] | HAMILTON S R. Characterizing the killer colorectal carcinomas[J]. Cancer Cell, 2018, 33(1): 7–9. DOI:10.1016/j.ccell.2017.12.010 |
| [19] | CRAZE M L, CHEUNG H, JEWA N, et al. MYC regulation of glutamine-proline regulatory axis is key in luminal B breast cancer[J]. Br J Cancer, 2018, 118(2): 258–265. DOI:10.1038/bjc.2017.387 |
| [20] | BLACKWOOD E M, EISENMAN R N. Max: a helix-loop-helix zipper protein that forms a sequence-specific DNA-binding complex with Myc[J]. Science, 1991, 251(4998): 1211–1217. DOI:10.1126/science.2006410 |
| [21] | BLACKWELL T K, KRETZNER L, BLACKWOOD E M, et al. Sequence-specific DNA binding by the c-Myc protein[J]. Science, 1990, 250(4984): 1149–1151. DOI:10.1126/science.2251503 |
| [22] | CONACCI-SORRELL M, MCFERRIN L, EISENMAN R N. An overview of MYC and its interactome[J]. Cold Spring Harb Perspect Med, 2014, 4(1): a014357. DOI:10.1101/cshperspect.a014357 |
| [23] | EVAN G. Cancer. Taking a back door to target Myc[J]. Science, 2012, 335(6066): 293–294. DOI:10.1126/science.1217819 |
| [24] | BROOKS T A, HURLEY L H. Targeting MYC expression through G-Quadruplexes[J]. Genes Cancer, 2010, 1(6): 641–649. DOI:10.1177/1947601910377493 |
| [25] | WIEGERING A, UTHE F W, JAMIESON T, et al. Targeting translation initiation bypasses signaling crosstalk mechanisms that maintain high MYC levels in colorectal cancer[J]. Cancer Discov, 2015, 5(7): 768–781. DOI:10.1158/2159-8290.CD-14-1040 |
| [26] | BOGAN A A, THORN K S. Anatomy of hot spots in protein interfaces[J]. J Mol Biol, 1998, 280(1): 1–9. DOI:10.1006/jmbi.1998.1843 |
| [27] | GUSTAFSON W C, WEISS W A. Myc proteins as therapeutic targets[J]. Oncogene, 2010, 29(9): 1249–1259. DOI:10.1038/onc.2009.512 |
| [28] | LIU W, LE A, HANCOCK C, et al. Reprogramming of proline and glutamine metabolism contributes to the proliferative and metabolic responses regulated by oncogenic transcription factor c-MYC[J]. Proc Natl Acad Sci USA, 2012, 109(23): 8983–8988. DOI:10.1073/pnas.1203244109 |
| [29] | HU C A A, BART WILLIAMS D, ZHAORIGETU S, et al. Functional genomics and SNP analysis of human genes encoding proline metabolic enzymes[J]. Amino Acids, 2008, 35(4): 655–664. DOI:10.1007/s00726-008-0107-9 |
| [30] | ALTMAN B J, STINE Z E, DANG C V. From krebs to clinic: glutamine metabolism to cancer therapy[J]. Nat Rev Cancer, 2016, 16(11): 749. DOI:10.1038/nrc.2016.114 |



