2. 400038 重庆, 陆军军医大学(第三军医大学)第一附属医院:神经内科
2. Department of Neurology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肝豆状核变性(hepaticolenticular degeneration,HLD)又称Wilson’s disease(WD),是一种常染色体隐性遗传的铜代谢障碍疾病,其全球临床患病率约3/10万,人群携带率1/90[1],2018年5月被收入我国《国家首批罕见病目录》。其致病基因ATP7B定位于13号染色体长臂(13q14.3),编码一种铜转运P型ATP酶,参与铜的跨膜转运[2-3]。ATP7B变异导致铜不能正常转运,在肝、脑、肾、角膜、关节以及肠道等部位的过量沉积[3],从而引起相应的临床表现。肝豆状核变性是至今少数几种可治的神经遗传病之一,关键是早诊断和早治疗,晚期治疗基本无效,但本病起病隐匿、受累器官多、首发症状不一,因此早期诊断较为困难,容易误诊[4-5]。由于病例少见,国内对肝豆状核变性的报道多为小样本病例报道,系统深入研究的文献较少;而欧美人群与中国人群存在很大的人群异质性,其ATP7B基因变异与中国人群存在很大的差异,临床特征也不尽相同[6]。因此探索中国人群肝豆状核变性患者的ATP7B基因变异谱及其临床特征,对本病的早期识别有重要意义。本研究就近年我院收治的119例肝豆状核变性患者进行分析,旨在分析国人肝豆状核变性及其亚型的临床特点、转归以及基因变异谱特征,为肝豆状核变性的早期识别和临床诊治提供依据。
1 资料与方法 1.1 研究对象119例确诊的肝豆状核变性患者,为2011年1月至2017年10月间我院就诊的门诊和住院患者,10.1%来自重庆主城区,34.5%来自重庆各区县,55.4%来自周边的贵州、四川及云南等省市。119例患者中男性64例(53.8%),女性55例(46.2%),年龄(23.1±11.9)岁。其中12例患者有明确的肝豆状核变性家族史、7例患者家族史可疑。患者签署《Wilson疾病基因检测知情同意书》后留取血细胞提取DNA作ATP7B基因检测。详细收集患者人口学和临床资料,对发病年龄、症状和体征、实验室指标、ATP7B基因变异以及生存预后进行分析,并对各临床亚型进行比较。本研究已通过陆军军医大学(第三军医大学)第一附属医院伦理委员会审批[批准号:2014年科研第(35)号]。
1.2 纳入和排除标准参照2012年2月欧洲肝脏病学会发布的《Wilson病临床诊疗指南》[7],以及该指南推荐使用的2001年第8届莱比锡国际会议Wilson病大会制定的诊断评分系统[8],主要包括:临床症状(包括肝病症状和锥体外系症状)、神经系统评估、角膜K-F环、肝功能检查、Coombs阴性的溶血性贫血、铜沉积(肝活检/肝铜/头颅MR)、血清铜蓝蛋白浓度、24 h尿铜水平以及ATP7B基因变异等方面评估,评分≥4分即确诊肝豆状核变性。排除自身免疫性肝炎、病毒性肝炎等引起的肝功能异常者,排除外伤及其他原因的引起的神经精神异常者。
1.3 临床分型根据中华医学会神经病学分会帕金森病及运动障碍学组和神经遗传病学组2008年发布的《肝豆状核变性的诊断与治疗指南》[4],进行临床分型:①肝型:持续性血清转氨酶增高;急性或慢性肝炎;肝硬化(代偿或失代偿);暴发性肝功能衰竭(伴或不伴溶血性贫血)。②脑型:帕金森综合征;运动障碍:扭转痉挛、手足徐动、舞蹈症状、步态异常、共济失调等;口-下颌肌张力障碍:流涎、讲话困难、声音低沉、吞咽障碍等;精神症状。③其他类型:以肾损害、骨关节肌肉损害或溶血性贫血为主。④混合型:以上各型的组合。
1.4 观察指标包括发病年龄、诊断时效、临床症状、角膜K-F环、影像学指标、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBil)、白蛋白(Alb)、凝血酶原时间(PT)、白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)、血清铜蓝蛋白(CER)、24 h尿铜以及ATP7B基因变异情况等。所有患者随访至2018年4月,观察患者生存情况。
1.5 分组分析119例患者中,根据起病年龄,18岁前起病患者53例(未成年人组)、18岁及以后起病66例(成年人组);根据临床表现,肝型患者68例、脑型患者33例、混合型患者18例。分别对各临床亚型之间的性别、年龄及上述观察指标进行统计学分析;按不同性别组、年龄组、临床亚型组进行分层分析。
1.6 统计学分析采用SPSS 13.0统计软件,计量资料正态分布以x±s表示,均值比较用t检验或者Mann-Whitney U检验,率的比较采用χ2检验或Fisher’s精确检验,生存分析采用Kaplan-Meier法分析。检验水准:α=0.05。
2 结果 2.1 临床分型及发病年龄119例肝豆状核变性患者来自115个家庭,其中4个家庭各有2位同胞患者来院诊治。单纯表现为肝病症状的患者68例(肝型,占57.1%),单纯表现为神经精神系统症状的患者33例(脑型,占27.7%);同时表现为多个器官受累的患者18例(混合型,占15.1%),其中肝脑混合型13例,脑骨关节混合型2例,肝脑骨关节混合型2例以及肝骨关节混合型1例。各组基本特征见表 1。
| 基本参数 | 总体 | 肝型 | 脑型 | 混合型 | P值a |
| 例数n | 119 | 68 | 33 | 18 | - |
| 入院年龄(岁) | 23.1±11.9 | 24.0±13.4 | 20.3±6.6 | 25.3±12.7 | 0.067 |
| 男性n(%) | 64 (53.8) | 31 (45.6) | 22 (66.7) | 11 (61.1) | 0.057 |
| 首次起病时间b[ n(%)] | 0.003 6 | ||||
| 婴幼儿期 | 4 (3.4%) | 4 (5.9%) | 0 | 0 | |
| 儿童期 | 22 (18.5%) | 13 (19.1%) | 5 (15.2%) | 4 (22.2%) | |
| 少年期 | 27 (22.7%) | 8 (11.8%) | 14 (42.4%) | 5 (27.8%) | |
| 青年期 | 58 (48.7%) | 36 (52.9%) | 14 (42.4%) | 8 (44.4%) | |
| 中年期 | 8 (6.7%) | 7 (10.3%) | 0 | 1 (5.6%) | |
| BMI(x±s) | 21.3±3.8 | 21.4±3.7 | 21.2±3.8 | 21.2±4.5 | 0.791 |
| 成人组吸烟比例c[ n(%)] | 14/66 (21.2%) | 8/43 (18.6%) | 4/14 (28.6%) | 2/9 (22.2%) | 0.463 |
| 成人组饮酒比例c[ n(%)] | 6/66 (9.1%) | 4/43 (9.3%) | 1/14 (7.1%) | 1/9 (11.1%) | 1 |
| a:P值为肝型组与脑型组统计值,混合型因例数较少,未进行统计比较;b:年龄分组:婴幼儿组0~5岁,儿童期6~13岁,少年期14~17岁,青年期18~40岁,中年期41~64岁;c:未成年患者中饮酒及吸烟比例均为0 | |||||
本组患者多以青少年起病,首次发病年龄1~58(21.8±11.8)岁,30岁以前发病的患者95例(占79.8%),其中未成年人53例(占44.5%);30~60岁各年龄段也偶有发病,占20.2%。肝型患者和脑型患者首次起病的年龄分布差异有统计学意义(P=0.003 6);脑型患者发病全部集中在儿童青少年期,婴幼儿期均未出现神经精神系统症状、中老年期也未见发病;肝型患者在各年龄段均有分布,首次出现肝病症状的患者最小1岁,最大58岁。患者首次发病年龄如图 1所示。
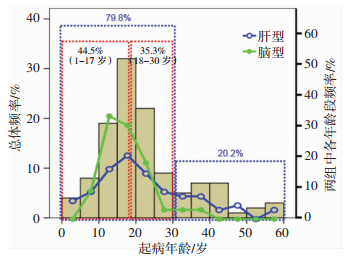
|
| 柱状图示119例肝豆状核变性患者年龄分布总体频率(多以青少年起病,30岁以前发病的患者占79.8%);折线图示肝型与脑型患者各年龄段所占百分比(脑型患者发病全部集中在儿童青少年期;肝型患者在各年龄段均有分布,首次出现肝病症状的患者最小1岁,最大58岁)。 图 1 119例肝豆状核变性患者首次起病年龄分布 |
2.2 临床特征 2.2.1 肝损害表现
主要表现依次为肝功能异常64例,肝硬化60例,肝脾肿大57例,皮肤巩膜黄染48例,腹胀腹痛43例,乏力、纳差42例,腹水42例,双下肢浮肿36例,肝掌16例以及静脉曲张10例。比较未成年人和成人患者间肝损害症状,结果显示,肝型组成年人患者的肝硬化和腹水等终末期症状显著高于未成年患者(分别为:P=0.005,P=0.008),可能与肝脏铜沉积时间长短以及基础肝脏状态有关。见表 2。同时,进行性别分层分析,在不同性别间肝损害症状差异无统计学意义(P>0.05)。值得注意的是,有3例患者临床上仅表现转氨酶升高而无其他肝损害症状(分别为2、5岁和12岁),这类患者容易漏诊。
| 临床特征 | 总体(n=119) | 肝型(n=68) | 脑型(n=33) | 混合型(n=18) | ||||||||
| 未成年人(n=24) | 成人(n=44) | P值 | 未成年人(n=15) | 成人(n=18) | P值 | 未成年人(n=7) | 成人(n=11) | P值 | ||||
| 肝脏受累 | ||||||||||||
| 乏力、纳差 | 42 | 11 (45.8) | 25 (56.8) | > 0.05 | 0 | 0 | - | 2 (28.6) | 4 (36.4) | > 0.05 | ||
| 皮肤巩膜黄染 | 48 | 15 (62.5) | 32 (72.7) | > 0.05 | 0 | 0 | - | 0 | 1 (9.1) | > 0.05 | ||
| 腹胀、腹痛 | 43 | 11 (45.8) | 30 (68.2) | > 0.05 | 0 | 0 | - | 0 | 2 (18.2) | > 0.05 | ||
| 肝脾肿大 | 57 | 18 (75.0) | 28 (63.6) | > 0.05 | 0 | 0 | - | 4 (57.1) | 7 (63.6) | > 0.05 | ||
| 腹水 | 42 | 9 (37.5) | 31 (70.5) | 0.008 | 0 | 0 | - | 0 | 2 (18.2) | > 0.05 | ||
| 肝硬化 | 60 | 11 (45.8) | 36 (81.8) | 0.005 | 0 | 0 | - | 4 (57.1) | 9 (81.8) | > 0.05 | ||
| 肝掌 | 16 | 5 (20.8) | 10 (22.7) | > 0.05 | 0 | 0 | - | 0 | 1 (9.1) | > 0.05 | ||
| 双下肢浮肿 | 36 | 11 (45.8) | 22 (50.0) | > 0.05 | 0 | 0 | - | 0 | 3 (27.3) | > 0.05 | ||
| 静脉曲张 | 10 | 1 (4.2) | 7 (15.9) | > 0.05 | 0 | 0 | - | 0 | 2 (18.2) | > 0.05 | ||
| 肝功异常 | 64 | 21 (87.5) | 37 (84.1) | > 0.05 | 0 | 0 | - | 2 (28.6) | 4 (36.4) | > 0.05 | ||
| 仅转氨酶异常 | 4 | 3 (12.5) | 0 | 0.04 | 0 | 0 | - | 1 (14.3) | 0 | > 0.05 | ||
| 神经精神系统受累 | ||||||||||||
| 不自主运动 | 28 | 0 | 0 | - | 7 (46.7) | 15 (83.3) | 0.026 | 4 (57.1) | 2 (18.2) | > 0.05 | ||
| 共济失调 | 24 | 0 | 0 | - | 9 (60.0) | 9 (50.0) | > 0.05 | 3 (42.9) | 3 (27.3) | > 0.05 | ||
| 口下颌肌张力障碍 | 38 | 0 | 0 | - | 13 (86.7) | 12 (66.7) | > 0.05 | 5 (71.4) | 8 (72.7) | > 0.05 | ||
| 精神症状 | 29 | 0 | 0 | - | 8 (53.3) | 13 (72.2) | > 0.05 | 4 (57.1) | 4 (36.4) | > 0.05 | ||
| 四肢肌力降低 | 8 | 0 | 0 | - | 4 (26.7) | 1 (5.6) | > 0.05 | 1 (14.3) | 2 (18.2) | > 0.05 | ||
| 四肢肌张力增高 | 18 | 0 | 0 | - | 4 (26.7) | 9 (50.0) | > 0.05 | 3 (42.9) | 2 (18.2) | > 0.05 | ||
| 其他 | ||||||||||||
| 骨关节痛 | 5 | 0 | 0 | - | 0 | 0 | - | 2 (28.6) | 3 (27.3) | > 0.05 | ||
| 治疗药物 | ||||||||||||
| 青霉胺PCA | 78 | 18(75.0) | 28(63.6) | > 0.05 | 9 (60.0) | 12 (66.7) | > 0.05 | 3 (42.9) | 8 (72.7) | > 0.05 | ||
| 锌剂Zn | 2 | 0 | 0 | 1 (6.7) | 0 | 0 | 1 (9.1) | |||||
| PCA+Zn | 25 | 4(16.7) | 6(13.6) | 4 (26.7) | 5 (27.8) | 4 (57.1) | 2 (18.2) | |||||
2.2.2 神经系统损害表现
主要表现为口下颌肌张力障碍38例,具体表现出流涎、讲话困难、声音低沉、吞咽障碍等症状,精神症状29例、不自主运动28例、共济失调24例、肌张力增高18例、肌力减弱8例。见表 2。对脑型组患者进行性别和年龄分层分析,结果显示,成人患者的不自主运动症状显著高于未成年人(P=0.026),其余症状无性别和年龄差异(P>0.05)。
2.2.3 其他本研究中有5例患者出现了骨关节疼痛,占4.2%。
2.3 实验室及影像学检查 2.3.1 血清学检查对患者的血常规、肝功能以及铜生化等进行比较(表 3),结果显示,各亚型患者的红细胞、血红蛋白、肝功能、血清铜及铜蓝蛋白水平差异有统计学意义(P < 0.05)。肝型患者的红细胞数量和血红蛋白浓度显著低于脑型患者,可能与肝损伤患者尤其是终末期肝病患者合并肝硬化、消化道出血等导致贫血有关。肝型患者的ALT、AST、TBil和PT显著高于脑型患者,这与各临床亚型的定义本身有关。脑型患者铜蓝蛋白下降程度显著高于肝型患者(P=0.025),进一步分级分析,分别有60.9%的肝型、81.8%的脑型以及94.4%的混合型患者铜蓝蛋白下降到低于100 mg/L,呈加重趋势。所有指标均未观察到性别和年龄差异(P>0.05)。
| 指标 | 总体(n=119) | 肝型(n=68) | 脑型(n=33) | 混合型(n=18) | P |
| WBC (×109/L, x±s) | 5.52±2.68 | 5.98±3 | 4.89±1.65 | 4.91±2.84 | 0.121 |
| RBC (×1012/L, x±s) | 3.79±0.88 | 3.38±0.82 | 4.48±0.58 | 4.08±0.61 | 1.81×10-9 |
| Hb (g/L, x±s) | 114±28 | 108±23 | 127±26 | 108±42 | 0.005 |
| PLT (×109/L, x±s) | 117±71 | 114±79 | 134±59 | 90±49 | 0.135 |
| ALT (U/L, x±s) | 68±107 | 93±125 | 19±9 | 62±107 | 0.005 |
| AST (U/L, x±s) | 103±171 | 135±143 | 27±8 | 127±331 | 0.011 |
| Alb (g/L, x±s) | 40.6±52.2 | 40.4±69.5 | 41.9±4.7 | 38.6±8.3 | 0.976 |
| TBil (μmol/L, x±s) | 66.2±112.9 | 103.7±138.3 | 14.5±4.7 | 20±14.7 | 1.38×10-4 |
| PT (s, x±s) | 16.8±9.4 | 20.5±10.4 | 11±3.7 | 13.1±4.3 | 4.46×10-6 |
| 血清铜(μmol/L, x±s) | 8.4±8.9 | 10.6±11.7 | 6±2.9 | 6.7±5.1 | 0.048 |
| 铜蓝蛋白(mg/L, x±s) | 85±80 | 105±91 | 65±60 | 53±48 | 0.011 |
| 铜蓝蛋白浓度分级[ n(%)] | 0.024 | ||||
| < 100 mg/L | 83 (72.2%) | 39 (60.9%) | 27 (81.8%) | 17 (94.4%) | |
| 100~200 mg/L | 24 (20.9%) | 20 (31.3%) | 4 (12.1%) | 0 (0) | |
| > 200 mg/L | 8 (6.9%) | 5 (7.8%) | 2 (6.1%) | 1 (5.6%) | |
| K-F环阳性率a[ n(%)] | 88/106 (83.0%) | 49/62(79.0%) | 25/29 (86.2%) | 14/15 (93.3%) | 0.361 |
| 24 h尿铜(μmol/L,x±s)a | 7.33±10.83 | 7.3±11.04 | 14.9 | 0.57 | - |
| a: 119例患者中有106例患者进行了眼底检查,统计在106例患者中进行;32例患者进行了24 h尿铜检查,由于例数较少,未进行统计比较 | |||||
2.3.2 眼底检查
106例患者进行了眼底检查,共检出角膜K-F环阳性88例(83.0%),其中肝型组检出49例(79.0%)、脑型检出25例(86.2%)、混合型检出14例(93.3%)。组间及年龄分布差异无统计学意义(P>0.05)。
2.3.3 影像学检查110例患者行肝脏超声或者CT检查,检出肝硬化60例,占54.5%(60/110)。88例患者行头颅MRI检查,检出阳性征44例(50.0%),病灶多呈对称性改变,包括豆状核、丘脑、桥脑、尾状核、中脑以及壳核等部位病变。
2.3.4 ATP7B基因检查31例患者进行了ATP7B基因的外显子变异分析,其中21例患者检测到复合杂合或纯合的致病变异位点(占67.7%),5例患者仅检测到单等位变异(16.1%),另外5例患者检测到的所有ATP7B变异位点在Clinvar数据库(美国NCBI临床疾病相关变异数据库,https://www.ncbi.nlm.nih.gov/clinvar/)中明确注释为良性(Benign),占16.1%,5例单等位变异和5例良性变异的患者临床诊断均成立。所有致病变异中,c.2333G>T(Arg778Leu)在本研究人群中等位频率最高,占17.4%(11/62),其次为c.2975C>T(Pro992Leu)、c.2304dupC(Met769HisfsX26)、c.2621C>T(Ala874Val)以及c.3443T>C(Ile1148Thr),在本研究人群中等位频率分别为6.5%、4.8%、4.8%和4.8%。其余变异位点均为散在的突变位点,见表 4。
| 核苷酸变异 | 外显子 | 氨基酸改变 | 变异类型 | 检出人数 | 等位数量 | MAFa | Clinvar Classa | dbSNPa |
| 频率前5的致病变异 | ||||||||
| 1 c.2333G > T | 8 | p.Arg778Leu | missense | 10 | 11 | 16.1% | Pathogenic | rs28942074 |
| 2 c.2975C > T | 13 | p.Pro992Leu | missense | 4 | 4 | 6.5% | Pathogenic | rs201038679 |
| 3 c.2304dupC | 8 | p.Met769HisfsX26 | frameshift | 3 | 3 | 4.8% | Pathogenic | rs137853287 |
| 4 c.2621C > T | 11 | p.Ala874Val | missense | 3 | 3 | 4.8% | Pathogenic | rs121907994 |
| 5 c.3443T > C | 16 | p.Ile1148Thr | missense | 2 | 3 | 4.8% | Pathogenic | rs60431989 |
| 频率前5的非致病变异 | ||||||||
| 1 c.2495A > G | 10 | p.Lys832Arg | missense | 20 | 22 | 32.3% | Benign | rs1061472 |
| 2 c.2855G > A | 12 | p.Arg952Lys | missense | 20 | 22 | 32.3% | Benign | rs732774 |
| 3 c.1216T > G | 2 | p.Ser406Ala | missense | 19 | 21 | 30.6% | Benign | rs1801243 |
| 4 c.3419T > C | 16 | p.Val1140Ala | missense | 19 | 21 | 30.6% | Benign | rs1801249 |
| 5 c.1366G > C | 3 | p.Val456Leu | missense | 19 | 19 | 30.6% | Benign | rs1801244 |
| a: MAF,等位频率;Clinvar,美国NCBI临床疾病相关变异数据库;dbSNP,美国NCBI单核苷酸多态性数据库 | ||||||||
2.4 诊断时效
文献[9]报道,遗传代谢性疾病作为罕见疾病,误诊率极高,明确诊断时间漫长。本研究中我们对119例肝豆状核变性患者的诊断时效进行了分析,结果显示,从首次发病至明确诊断,所用时间中位数为5个月(四分位区间1.3~13.0),其中62例患者在起病5个月之后才得以明确诊断,占52.1%。有2例患者因同胞患病进行筛查,通过铜生化、K-F环以及ATP7B基因变异检测,在出现明显临床症状前得以确诊。比较肝型、脑型、混合型患者,从首次发病到确诊病程中位数分别为3.0(1.0~9.8)、6.0(2.0~27.2)、6.5(4.5~ 27.0)个月,肝型患者确诊所用时间显著少于脑型和混合型患者(分别为:Z=-2.233,P=0.026;Z=-2.424,P=0.015),提示脑型患者和混合型患者临床诊治更为困难和复杂。见图 2。
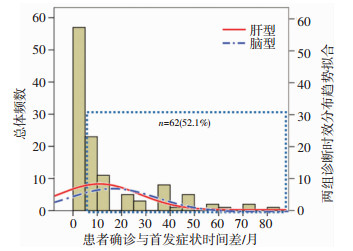
|
| 柱状图示患者从首次发病至确诊所用时间(52.1%的患者在起病5个月之后才得以明确诊断);曲线图为肝型和脑型患者确诊时效趋势拟合(肝型患者确诊所用时间显著少于脑型患者) 图 2 119例肝豆状核变性患者首次发病至确诊所用时间 |
2.5 生存预后
本研究中105例患者进行了积极治疗,其中78例(65.5%)患者进行了青霉胺驱铜治疗,25例(21.0%)患者青霉胺驱铜的同时,还采用了锌剂阻止铜吸收,2例患者(1.7%)仅进行了锌剂治疗,见表 2。
本研究中,共有11例患者发生死亡事件,其中肝型8例、混合型2例、脑型1例。从受累器官、起病早晚、是否有肝硬化以及性别等层次,采用Kaplan-Meier进行生存分析,结果显示,有肝硬化的肝豆状核变性患者的生存率显著低于非肝硬化患者(χ2=4.202,P=0.04),这类患者多死于终末期肝硬化失代偿或者慢加急性肝衰竭。另外,肝型患者的远期生存率稍低于脑型患者,女性患者略低于男性患者,成年起病患者略低于未成年时期起病的患者,但差异均无统计学意义(分别为:χ2=2.221,P=0.136;χ2=2.673,P=0.102;χ2=1.246,P=0.264,图 3)。
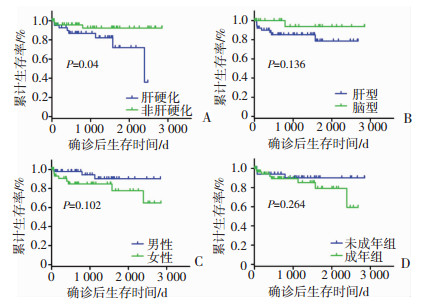
|
| A:肝硬化组与非肝硬化组比较;B:肝型患者与脑型患者的比较;C:男性患者与女性患者比较;D:未成年组与成年组比较 图 3 119例肝豆状核变性患者的生存分析 |
3 讨论
肝豆状核变性是一种古老的疾病,自1912年WILSON等第一次进行临床描述至今已逾百年[10]。目前,国内外学者一致认为肝豆状核变性是一种常染色体隐性遗传的铜代谢障碍疾病,研究表明,ATP7B基因突变导致ATP酶功能减弱或丧失,引起血清铜蓝蛋白合成减少以及胆道排铜障碍,蓄积于体内的铜离子在肝、脑、肾、角膜、肠道等处沉积,引起进行性加重的肝硬化、锥体外系症状、精神症状、肾损害及角膜色素(Kayser-Fleischerring,K-F)环等[1-4, 6]。沉积部位的不同,导致临床亚型表现各异。由于ATP7B基因变异存在人群异质性,因此肝豆状核变性的临床特征和基因变异谱也呈现出人群差异[6]。
本研究回顾性分析2011年1月至2017年10月我院收治的119例肝豆状核变性患者,其临床亚型以肝型患者更多见,占57.1%,其次是脑型(27.7%)。既往认为,本病好发于5~35岁的青少年[4]。本组患者多以青少年起病,30岁以前发病的患者占79.8%。肝型患者和脑型患者首次起病的年龄分布差异有统计学意义,其中脑型患者发病全部集中在儿童青少年期,而肝型患者在各年龄段均有分布,首次出现肝病症状时患者最小1岁,最大58岁。表明随着基因检测技术的进步,5岁以下的婴幼儿以及45岁以上的中老年人病例不断增多,国外亦有在9个月大婴儿中检出本病的报道[11],而迟发患者可能与疾病修饰基因导致迟发性轻度临床表现有关[1],因此,临床上婴幼儿早发的和老年人迟发的不明原因肝损害应考虑本病的可能性。
肝豆状核变性的临床表现复杂多样。本组患者中肝脏受累主要表现为肝功能异常(53.8%)、肝硬化(50.4%)、肝脾肿大(47.9%)和皮肤巩模黄染(40.3%),其次为腹胀腹痛、乏力、纳差、腹水等。与文献[12]报道基本一致。其中成年患者的肝硬化和腹水等终末期症状显著高于未成年患者,可能与肝铜沉积时间长短以及基础肝脏状态有关。值得注意的是,有3例患者临床上仅表现转氨酶升高而无其他症状,经基因检测确诊。这类患者容易漏诊。本组患者神经系统受累主要表现口下颌肌张力障碍(31.9%)、精神症状(24.4%)和不自主运动(23.5%)。铜蓝蛋白是诊断肝豆状核变性的常用指标,本研究中脑型患者铜蓝蛋白下降程度显著高于肝型患者,分别有60.9%的肝型、81.8%的脑型以及94.4%的混合型患者铜蓝蛋白下降到低于100 mg/L,呈加重趋势。另外,肝型患者的红细胞数量和血红蛋白浓度显著低于脑型患者,可能与肝损伤患者尤其是终末期肝病患者合并肝硬化、消化道出血等导致贫血有关,提示对于肝型患者应注意预防贫血等并发症的发生。
遗传代谢性疾病作为罕见疾病,误诊率极高,明确诊断所需时间漫长,文献[9]指出30%以上的遗传代谢性疾病要经过5~10位医师的诊治才得以确诊;48.3%的患者被误诊,误诊时间长达5年或更长。本研究中,从首次发病至明确诊断,所用时间中位数为5个月(四分位区间1.3~13.0),52.1%的患者在起病5个月之后才得以明确诊断,最长的1例患者所用时间长达82个月。与多数患者来我院之前已辗转多个基层医院有关。本研究中肝型患者确诊所用时间显著少于脑型和混合型患者,提示脑型患者和混合型患者临床诊治更为困难和复杂,与文献[13]报道一致。
作为肝豆状核变性的病因,ATP7B基因变异检测有助于疾病的早期诊断[1, 2, 4, 6-7]。本研究中31例患者ATP7B基因致病变异检出率83.9%,最常见的致病变异位点是Arg778Leu,其次是Pro992Leu、Met769HisfsX26、Ala874Val及Ile1148Thr,变异类型与国内报道有相似,但等位频率存在差异[12],其中Met769HisfsX26位点国内少见报道,而本研究中其等位频率为4.8%,占第3位。与国外变异谱分布明显不同,欧洲以His1069Gln为主(35%~45%)、而印度和中东分别以Cys271Stop(20%)和Gln1399Arg(30%)为主[6]。另外,本研究中有5例诊断明确的患者检测到的所有ATP7B变异位点为良性位点。国内外文献报道也均未100%检出致病变异[1, 12],可能与ATP7B基因的不完全外显以及存在其他疾病修饰基因(包括COMMD1、ATOX1、XIAP、HFE、朊病毒蛋白、亚甲基四氢叶酸、MTHF还原酶以及载脂蛋白E等)有关[1]。ATP7B基因变异检测还有助于家系成员的筛查[7],本研究中有2例患者因同胞患病,通过测序检出相同致病变异,进一步进行铜生化、K-F环检测,在出现明显临床症状前得以及早确诊和治疗。
在长期随访中,本研究共有11例患者发生死亡事件,分析发现有肝硬化的肝豆状核变性患者的生存率显著低于非肝硬化患者。这类患者多死于终末期肝硬化失代偿或者慢加急性肝衰竭。肝豆状核变性作为罕见疾病,难以建立前瞻性随机双盲大样本队列,给该疾病的研究带来一定困难,罕见疾病观察性登记研究作为一种替代方法,我们在西南医院重大领域技术创新计划(SWH2016ZDCX1007)的资助下,已于2017年开始建立青少年及成人遗传代谢性肝病病例登记系统,对肝豆状核变性等6种遗传代谢性肝病进行登记、观察及长期随访,以期建立基于中国人群自己的疾病变异数据库和遗传代谢性肝病病例登记数据库,为进一步深入研究肝豆状核变性等疾病的临床特征和远期生存特点提供支撑。
综上所述,本研究结果提示肝豆状核变性各年龄段均有发病,婴幼儿及中老年人检出率并不低,进展为肝硬化的患者因铜沉积久、肝损伤重,其生存率显著低于非肝硬化患者,而基因检测有助于提高诊断。因此,对不明原因肝损伤患者,尤其是年幼和年老患者,临床上应及早借助基因变异、铜生化等检测手段,提高肝豆状核变性患者的早期诊断率,以便及早开展治疗、防止肝硬化的发生,提高生存率。
| [1] | POUJOIS A, WOIMANT F. Wilson's disease: A 2017 update[J]. Clin Res Hepatol Gastroenterol, 2018, 3, pii: S2210- 7401(18)30046-9. DOI: 10.1016/j.clinre.2018.03.007. |
| [2] | PARISI S, POLISHCHUK E V, ALLOCCA S, et al. Characterization of the most frequent ATP7B mutation causing Wilson disease in hepatocytes from patient induced pluripotent stem cells[J]. Sci Rep, 2018, 8(1): 6247. DOI:10.1038/s41598-018-24717-0 |
| [3] | PIERSON H, MUCHENDITSI A, KIM B E, et al. The fun-ction of ATPase copper transporter ATP7B in intestine[J]. Gastroenterology, 2018, 154(1): 168–180. DOI:10.1053/j.gastro.2017.09.019 |
| [4] |
中华医学会神经病学分会帕金森病及运动障碍学组, 中华医学会神经病学分会神经遗传病学组. 肝豆状核变性的诊断与治疗指南[J].
中华神经科杂志, 2008, 41(8): 566–569.
Parkinson's Disease and Movement Disorders Group, Neurogenetics Group, Chinese Medical Association Neurology Branch. Guidelines for the diagnosis and treatment of Wilson's disease[J]. Chin J Neurol, 2008, 41(8): 566–569. DOI:10.3321/j.issn:1006-7876.2008.08.022 |
| [5] |
马仕坤, 汪荣泉. 肝豆状核变性误诊为药物性肝损害1例[J].
第三军医大学学报, 2009, 31(17): 1675.
MA S K, WANG R Q. Misdiagnosed of Wilson's disease as drug induced liver damage in one case[J]. J Third Mil Med Univ, 2009, 31(17): 1675. DOI:10.3321/j.issn:1000-5404.2009.17.033 |
| [6] | BANDMANN O, WEISS K H, KALER S G. Wilson's disease and other neurological copper disorders[J]. Lancet Neurol, 2015, 14(1): 103–113. DOI:10.1016/S1474-4422(14)70190-5 |
| [7] | European Association for Study of Liver. EASL clinical practice guidelines: Wilson's disease[J]. J Hepatol, 2012, 56(3): 671–685. DOI:10.1016/j.jhep.2011.11.007 |
| [8] | FERENCI P, CACA K, LOUDIANOS G, et al. Diagnosis and phenotypic classification of Wilson disease[J]. Liver Int, 2003, 23(3): 139–142. DOI:10.1034/j.1600-0676.2003.00824.x |
| [9] |
罗小平, 王天有. 从戈谢病的诊疗现状看我国罕见病的未来之路[J].
中华儿科杂志, 2015, 53(4): 254–255.
LUO X P, WANG T Y. The future of rare diseases in China: from the status of diagnosis and treatment of gaucher disease[J]. Chin J Pediatr, 2015, 53(4): 254–255. DOI:10.3760/cma.j.issn.0578-1310.2015.04.005 |
| [10] | TROCELLO J M, BROUSSOLLE E, GIRARDOT-TINANT N, et al. Wilson's disease, 100 years later[J]. Rev Neurol (Paris), 2013, 169(12): 936–943. DOI:10.1016/j.neurol.2013.05.002 |
| [11] | KIM J W, KIM J H, SEO J K, et al. Genetically confirmed Wilson disease in a 9-month old boy with elevations of aminotransferases[J]. World J Hepatol, 2013, 5(3): 156–159. DOI:10.4254/wjh.v5.i3.156 |
| [12] | LI X H, LU Y, LING Y, et al. Clinical and molecular charac- terization of Wilson's disease in China: identification of 14 novel mutations[J]. BMC Med Genet, 2011, 12: 6. DOI:10.1186/1471-2350-12-6 |
| [13] | MERLE U, SCHAEFER M, FERENCI P, et al. Clinical presentation, diagnosis and long-term outcome of Wilson's disease: a cohort study[J]. Gut, 2007, 56(1): 115–120. DOI:10.1136/gut.2005.087262 |



