类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫疾病,病理特征包括慢性滑膜炎、细胞浸润、形成滑膜翳、骨和软骨侵蚀以及关节结构破坏[1]。RA风险因子包括易感基因突变、表观遗传修饰、吸烟、微生物感染、女性性别、西方饮食和种族[2]。传统抗风湿药只能减轻症状延缓病程,且容易引起严重的副作用,而生物抗风湿药花费昂贵[3]。
雷公藤多苷(tripterygium glycoside,TG)片通过免疫抑制和抗增殖作用抑制RA的进展:影响CD4+ T细胞,调节T细胞生成和树突细胞生成与活化;降低肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、核因子κB(NF-κB)等炎症介导因子;降低血管生成因子;调节NF-κB受体活化子配体(RANKL)-RANK-护骨素信号通路,抑制c-Jun激酶活化,调节免疫相关的骨质平衡;抑制丝裂原活化蛋白激酶(MAPK)/JNK途径激酶磷酸化,防止滑膜成纤维细胞侵袭。但TG片也会诱导肝损伤、肾损伤和生殖毒性[4-5]。
发展预后标记,有助于合理用药。RA患者分泌大量TNF-α驱动RA发生发展[6-7]。LPS通过刺激NF-κB瓜氨酸化修饰和入核,促进TNF-α表达[5, 8]。雷公藤甲素通过抑制NF-κB磷酸化抑制TNF-α表达,促进成骨细胞分化[9]。
MAPKs促进了RA炎性环境生成、骨损伤、滑膜组织重塑、滑膜内膜基质降解[10]。而雷公藤提取物显著抑制了MAPK信号激酶磷酸化[11]。双特异性磷酸酶(dual specificity protein phosphatase,DUSP)家族蛋白通过去磷酸化活化的MAPK家族蛋白抑制其活性[12]。
本研究表明,RA患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中DUSP3和TNF-α表达显著改变,但被TG片治疗缓解。DUSP3和TNF-α可作为TG片治疗RA独立的预后标记。TG通过抑制NF-κB磷酸化下调了TNF-α表达,并通过抑制HDAC1促进DUSP3的生成。本研究有助于促进TG片在RA治疗中的应用。
1 资料与方法 1.1 一般资料选取2016年3月至2018年1月就诊于六安市人民医院风湿门诊的RA患者67例。患者的诊断均符合美国风湿病学院对于类风湿关节炎的诊断标准(2010年)。排除标准:①急性、慢性感染,结核感染,肿瘤及其他慢性疾病,自身免疫疾病患者;②3个月内接受生物试剂和传统抗RA药物治疗的患者;③孕妇和哺乳期妇女。本研究2016年5月经本院伦理委员会审批。RA患者包括男性18例,女性49例,年龄33~74(54.3±13.2)岁,给予TG片治疗,按体质量给药每日l~1.5 mg/kg,分3次饭后服用;选取在本院参加体检的年龄性别相匹配(P>0.05)的67名健康志愿者作为对照,包括22名男性,45名女性,年龄28~75(56.1±10.8)岁。分别抽取清晨空腹状态下健康志愿者外周血以及治疗前和治疗1个月的RA患者静脉血5 mL, 放入EDTA抗凝管中, 送化验科进行相关指标检测。TG片治疗前RA患者与健康志愿者的特征见表 1。
| 组别 | n | 年龄(x±s) | 女性/ n(%) | 病程(月) | ESR/mm·h-1 | CRP/mg·L-1 | DAS28(x±s) | |||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |||||||
| RA患者 | 67 | 54.3±13.2 | 49(73) | 102(60~150) | 39.5(31.3~48.1)a | 26.8(22.4~34.6)b | 23.1(18.2~35.4)a | 18.7(14.5~27.8)b | 5.9±2.1 | 3.6±1.2b | ||
| 健康志愿者 | 67 | 56.1±10.8 | 45(67) | - | 11.3(8.5~14.2) | - | 5.8(3.9~6.7) | - | - | - | ||
| a:P < 0.05,与健康志愿者比较;b:P < 0.05,与治疗前比较;CRP:C反应蛋白;DAS28:28处关节疾病活动度评分;ESR:红细胞沉降率 | ||||||||||||
1.2 疾病评估
由住院病历获得临床数据,包括关节肿胀数(swollen joint count,SJC)和压痛关节数(tender joint count,TJC)。通过标准方法检测血液指标,包括红细胞沉降率(erythrocyte sedimentation rate,ESR)和C反应蛋白(C-reactive protein,CRP)。拍摄双手X线片计算28处关节疾病活动度评分(disease activity score using 28 joint counts,DAS28)评分获取RA患者疾病活动度,公式: DAS28=0.56×sqrt(TJC)+0.28×sqrt(SJC)+0.70× ln(ESR/CRP)×1.08+0.16,计算肩、肘、膝、腕、掌、指关节1~5,近端指间关节1~5,共28个关节;sqrt:开平方;ln:取自然对数[13]。采用改良的sharp评分法,计算关节破坏的侵蚀积分和狭窄积分。由两位放射科专业医师单独、盲法阅片,评分值取平均数。
1.3 药物与试剂药物:雷公藤多苷片(10 mg/片,国药准字:Z33020422;浙江得恩德制药有限公司),用于RA患者;雷公藤多苷(TG,浙江新昌第二制药厂),用于细胞实验。试剂:胎牛血清(FBS)、RPMI1640培养基、0.25%胰酶(GIBCO),IgG Beads(Sigma),HDAC1抗体、pNF-κB抗体、TNF-α抗体、DUSP3抗体、ERK1/2抗体、JNK抗体(cell sinaling, Abcam),lip2000(invitrogen)。
1.4 PBMC及总RNA分离采用标准Ficoll密度梯度离心法分离外周血PBMC,用洗液(含2%FBS的PBS)洗涤2次。用TRIzol试剂提取PBMC的总RNA,并反转录为互补DNA。
1.5 细胞培养和药物处理人源组织细胞淋巴瘤细胞U937在含有10%胎牛血清(FBS)的RPMI1640培养基中培养,放置于37 ℃ 5%CO2的培养箱中培养。新鲜消化清洗的细胞以100 ng/mL的脂多糖(LPS)预处理2 h,然后加入不同浓度(1、10、30 μg/mL)的TG培养48 h。
1.6 稳定转染制备了HDAC1稳转细胞株。培养HEK293T细胞,转染包装质粒及含有靶序列的质粒,第2天更换培养基,并将靶细胞铺板,48 h后用HEK293T细胞培养基(过滤后)培养靶细胞48 h,更换培养基,筛选靶细胞。
1.7 RT-PCR与Western blot检测用SYBR Green RT-PCR试剂检测PBMC中DUSP3和TNF-α表达。Western blot检测过程如下,于冰上裂解细胞,收集蛋白并测定浓度,加入上样缓冲液并煮沸,冷却后上样到SDS-PAGE胶进行电泳,电泳后依次进行PVDF半干转膜,封闭液封闭,一抗孵育,洗涤,二抗孵育,洗涤及显影。
1.8 染色质免疫共沉淀细胞经多聚甲醛固定后裂解超声,用抗HDAC1抗体免疫沉淀与HDAC1结合的染色质复合物,然后用耦连G蛋白的免疫磁珠回收。超声断裂DNA。将蛋白与DNA热解离后,纯化DNA,并通过PCR和RT-PCR检测。
1.9 统计学方法采用SPSS 17.0统计软件进行分析,数据采用x±s和中位数(第一四分位数~第三四分位数)表示。采用K-S检验判断连续变量是否正态分布。Wilcoxon符号秩检验比较响应组与不响应组患者(28例骨侵蚀RA患者)间蛋白表达的数据差异。RA患者DUSP3和TNF-α表达与DAS28评分、sharp评分、CRP、RF相关性采用Pearson’s相关分析。利用受试者工作曲线(ROC)下的面积(AUC)评估DUSP3和TNF-α作为TG片用药临床响应评估的能力。以P < 0.05为差异有统计学意义。
2 结果 2.1 RA患者PBMC中TNF-α表达升高而DUSP3表达水平降低RT-PCR检测结果显示:与健康志愿者相比,RA患者TNF-α表达水平显著升高而DUSP3表达水平显著降低(图 1A、B)。为检测DUSP3和TNF-α能否用作RA诊断的生物标记,我们进行了ROC分析(图 1C、D),得到DUSP3的AUC为0.908(95%CI: 0.854~0.963),TNF-α的AUC为0.948(95%CI: 0.915~0.981),说明DUSP3和TNF-α是很好的RA诊断指标。此外,DUSP3表达与DAS28(r=-0.472, P=0.007)和CRP(r=-0.371, P=0.016)相关,TNF-α表达与DAS28(r=0.524, P=0.002)和CRP(r=0.404, P=0.008)相关。

|
| A:RA患者与健康志愿者PBMC中DUSP3表达;B:RA患者与健康志愿者PBMC中TNF-α表达;a: P < 0.001,与健康对照比较;C:DUSP3用于RA诊断的ROC曲线;D:TNF-α用于RA诊断的ROC曲线 图 1 RA患者PBMC中DUSP3和TNF-α的表达及其用于RA诊断的ROC曲线 |
2.2 TG片治疗后TNF-α表达降低,DUSP3表达水平升高
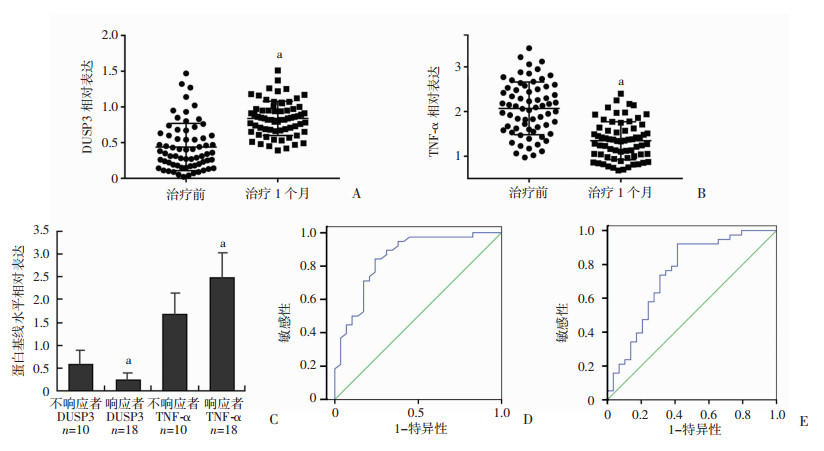
RA患者服用TG片后病情明显缓解,DAS28评分、CRP、ESR的值均显著降低(P < 0.05)。RT-PCR结果显示,与治疗前相比,RA患者接受1个月的TG片治疗后,DUSP3表达水平显著升高而TNF-α表达显著降低(图 2A、B)。
|
| A:TG片治疗前后RA患者DUSP3表达;B:TG片治疗前后RA患者TNF-α表达;a: P < 0.001,与基线比较;C:响应与不响应TG片治疗的骨侵蚀RA患者DUSP3和TNF-α的表达差异;a: P < 0.01,与不响应者比较;D:DUSP3用于RA患者TG片治疗预后的ROC曲线;E:TNF-α用于RA患者TG片治疗预后的ROC曲线 图 2 TG片用药后RA患者DUSP3和TNF-α的表达改变及其用于RATG片治疗预后的ROC曲线 |
女性和男性用药后DUSP3和TNF-α的表达水平相当,差异无统计学意义(P>0.05)。因此。性别因素不影响用药后DUSP3和TNF-α的表达。以平均年龄为界,将患者分为高龄和低龄组,两组患者用药后DUSP3和TNF-α的表达水平差异无统计学意义(P>0.05),年龄因素也不影响用药后DUSP3和TNF-α的表达。见表 2。
| 项目 | n | DUSP3 | TNF-α |
| 性别 | |||
| 女性 | 49 | 0.841±0.035 | 1.344±0.064 |
| 男性 | 18 | 0.836±0.055 | 1.351±0.089 |
| 年龄 | |||
| 高龄 | 33 | 0.848±0.042 | 1.355±0.074 |
| 低龄 | 34 | 0.831±0.041 | 1.337±0.074 |
在67例RA患者的X线片中,28例患者表现有骨侵蚀征象,根据治疗后骨侵蚀缓解状态,将这28例患者分为TG片治疗响应组(n=18)和非响应组(n=10)。响应组DUSP3的表达显著低于非响应组(0.225 vs 0.579,P < 0.01),而响应组TNF-α的表达高于非响应组(2.487 vs 1.683,P < 0.01,图 2C)。
根据TG片治疗后DAS28的减少程度,将RA患者分为TG片治疗响应组(n=38)和不响应组(n=38),分析响应组和不响应组治疗前DUSP3和TNF-α表达水平,检测将DUSP3和TNF-α作为TG片用药预后响应生物标记的能力。绘制ROC曲线对DUSP3和TNF-α表达水平与临床TG片用药响应的关系分析发现(图 2D,E):以DUSP3水平作图(95% CI: 0.753~0.945)的AUC为0.849。以TNF-α水平作图(95% CI: 0.622~0.871)的AUC为0.747。表明治疗前DUSP3和TNF-α表达水平能够很好地预示TG片治疗效果。
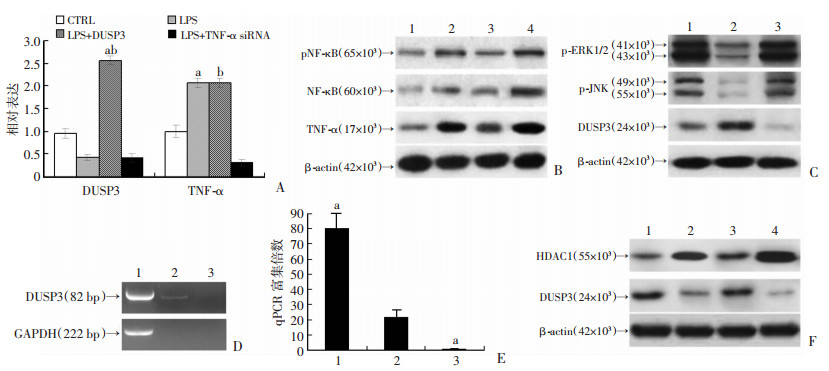
2.3 DUSP3和TNF-α表达的调节为检测TG片调节DUSP3和TNF-α的机制,采用受LPS刺激的U937人组织细胞性淋巴瘤细胞株模拟RA患者体内的PBMC。首先检测了DUSP3和TNF-α之间是否存在调控关系,LPS刺激U937细胞导致DUSP3表达下调而TNF-α表达上调(P < 0.05),而过表达DUSP3或敲低TNF-α并不能影响对方的表达(图 3A),说明DUSP3和TNF-α之间不存在显著的调节关系。
|
| A:DUSP3和TNF-α相对表达a:P < 0.001,与CTRL比较;b:P < 0.001,与LPS+TNF-α siRNA比较;B:Western blot结果示TG通过NF-κB影响TNF-α的表达1:CTRL,2:LPS,3:LPS+TG,4:LPS+TG+NF-κB;C:Western blot检测DUSP3对ERK1/2和JNK磷酸化的影响1:LPS,2:LPS+TG,3:LPS+TG+DUSP3 shRNA;D:PCR和qPCR分析HDAC1与DUSP3 DNA的相互作用1:Input, 2: anti-HDAC1, 3:IgG;E:qPCR分析TG对HDAC1与DUSP3启动子区结合的影响1: anti-HDAC1, 2: anti-HDAC1, 3: anti-IgG;a:P < 0.001,与anti-HDAC1比较;F:Western blot结果示TG通过抑制HDAC1促进DUSP3表达1: CTRL, 2: LPS, 3: LPS+TG, 4: LPS+TG+HDAC1 图 3 DUSP3和TNF-α之间的关系及其上下游信号通路 |
TG给药抑制了LPS诱导的TNF-α表达和NF-κB磷酸化,而NF-κB过表达促进NF-κB磷酸化,防止了TG对TNF-α的表达抑制(P < 0.05,图 3B)。表明TG对TNF-α的抑制是通过NF-κB介导的。
RT-PCR结果证实TG片给药促进了DUSP3表达并抑制了ERK1/2和JNK磷酸化,而敲低DUSP3表达抑制了这一现象(P < 0.05,图 3C),说明TG通过上调DUSP3促进ERK1/2和JNK去磷酸化。检索Genecards和UCSC数据库发现DUSP3启动子区(转录起始位点下游300 bp)有Sp1结合位点,且有较强的H3K27ac修饰,而RA患病组织中HDAC1是过表达的。我们推测RA组织中,高表达的HDAC1抑制了DUSP3转录,而TG通过抑制HDAC1与DUSP3的相互调节,解除其对DUSP3的抑制。ChIP实验证明,HDAC1与DUSP3启动子区相结合(图 3D),而TG给药使HDAC1与DUSP3的结合减弱(P < 0.05,图 3E)。免疫印迹证明TG给药抑制了LPS诱导的HDAC1表达上调,而HDAC1介导了TG对DUSP3的调节(P < 0.05,图 3F)。
3 讨论RA是一种多发的非特异性自身免疫性疾病,伴有生成抗免疫球蛋白、类风湿因子,瓜氨酸化蛋白的自身抗体[2]。TG片能够调节免疫相关细胞的生成,抑制炎症介导因子表达,抑制免疫相关的血管生成,调节免疫相关的骨质平衡,以及抑制滑膜成纤维细胞增殖。但TG片治疗效果因人而异,且有一定生理毒性,不能长期使用[14]。因此,需要开发灵敏稳定的预后标记。研究显示雷公藤甲素通过调节NF-κB磷酸化调节TNF-α表达,并显著抑制MAPK途径激酶磷酸化。本研究证实DUSP3和TNF-α的表达与RA的疾病活性相关,且能够预测TG片治疗RA的临床响应。此外,TNF-α和DUSP3没有明显的相互调节作用。离体实验结果表明,TG通过抑制NF-κB磷酸化下调TNF-α表达,并可以抑制HDAC1与DUSP3启动子结合,以及HDAC1表达,以此促进DUSP3的生成及其下游的ERK1/2与JNK去磷酸化。
TNF-α信号途径与RA发病紧密相关。RA发病过程中,过度分泌的TNF-α刺激白细胞浸润,活化内皮细胞生成血管,并诱导滑膜纤维细胞增生[8];免疫细胞产生的TNF-α通过调节FOXP3磷酸化介导调节性T细胞的免疫抑制功能;激活RANKL-RANK-OPG信号通路刺激破骨细胞成熟和骨吸收等[15]。另一方面,MAPKs活化失调导致了RA发病。RA组织中,MAPKs家族蛋白MAPK高表达促进促炎因子的生成,诱导血管内皮细胞增殖,募集炎性细胞[16];ERK1/2可调节细胞的增殖与分化,介导巨噬细胞中促炎因子产生,调节关节处缺氧微环境转变和前列腺素含量[17];JNK促进了基质金属蛋白酶的产生和IL-6与IL-8的合成[17]。而DUSPs家族蛋白是MAPKs的阴性调节因子,对DUSPs的研究可促进RA治疗方法的提高。在我们的研究中,RA患者PBMC中TNF-α表达显著升高,DUSP3显著降低,ROC曲线表明TNF-α和DUSP3水平是RA诊断非常灵敏的生物标记。通过对临床指标的检测表明TG片对于RA患者有较好的治疗效果。TG片治疗后,TNF-α表达显著降低,而DUSP3显著升高,且这一改变不受RA患者年龄与性别的影响。以sharp评分和DAS28评分改善程度作为标准显示,DUSP3和TNF-α表达是TG片治疗的优秀的预后指标。
实验显示DUSP3和TNF-α间没有显著的调节关系,二者可作为独立的生物标记。可能说明TG用药后PBMC中TNF-α和DUSP3的表达变化没有明显的因果关系,而二者也没有共同的、作用显著的上游。因此,NF-κB并不能显著地调节DUSP3表达。调节DUSPs家族蛋白表达的机制有三种:外界刺激造成的转录调节,磷酸化状态调节,催化结构域活化[17]。本研究证明TG给药抑制了HDAC1的表达及其与DUSP3启动子的结合,从而促进DUSP3转录。可能TG给药既抑制了Sp1的活性,也抑制了HDAC1的表达。HDAC家族蛋白通过参与基因表观调节影响RA发病,而HDAC蛋白抑制剂对RA有较好的治疗效果[18-19]。据报道在多种HDAC家族蛋白中,RA患者体内的HDAC1是显著过表达的[19-20]。HDAC3调节RA患者PBMC中IL-6的分泌和滑膜成纤维细胞中炎症基因的表达[21]。此外,HDAC抑制剂促进了RA滑膜成纤维细胞E11中DUSP1表达,从而抑制了MAPK活性,这与本文TG调节DUSP3以及ERK1/2和JNK的机制类似[22]。但在PBMC中,致病因子和TG如何调节HDAC1与DUSP3启动子的相互调节,及如何调节HDAC1表达并不清楚,需要进一步的实验研究。
本研究发现的TG给药导致NF-κB磷酸化抑制和TNF-α表达下调与先前的研究是一致的,且ROC分析结果表明TNF-α的表达与TG给药的预后显著相关,说明NF-κB是TG的一个比较直接的调节靶点。DUSP3作用底物包括ERK1/2、JNK、p38(较弱)以及STAT5、EGFR、ErbB2等[23]。在多种体系中的研究表明DUSP3参与的细胞过程:调节正常细胞的周期进程,如通过ERK1/2调节纺锤体双极化结构[24];影响炎症作用,如防止肺癌组织中单核和巨噬细胞浸润[25],调节腹膜巨噬细胞中LPS刺激导致的雌激素介导的ERK1/2与AKT活化[26],参与血小板活化和血栓形成;调节血管生成以及在肿瘤细胞中抑制凋亡,降低粘附[27]等。但DUSP3在RA发病中的作用尚未有研究。此外,本研究发现TG给药促进DUSP3表达,从而抑制了ERK1/2和JNK磷酸化,这与DUSP1和DUSP2的作用是不同的,可能也与他们分处不同的组织有关[28]。RA组织中,MAPK在滑膜微脉管系统和滑膜衬里层细胞高表达,ERK1/2在炎症性滑膜组织的微脉管周围细胞,而JNK是在单核浸润细胞中显著表达[10]。RA患者PBMC中DUSP3表达下调可能会促进PBMC的分化、浸润和炎症作用以及促进滑膜组织基质降解和血管生成,这需要进一步的实验检测。
综上所述,DUSP3和TNF-α是TG片治疗RA的灵敏的预后标记。TG片通过抑制HDAC与DUSP3的相互调节及HDAC1的表达促进了DUSP3的转录,抑制了MAPK信号途径,并通过抑制NF-κB磷酸化抑制TNF-α表达。然而对于DUSP3和TNF-α作为预后指标如何指导用药,还需进一步研究。
| [1] | SCOTT D L, WOLFE F, HUIZINGA T W. Rheumatoid arthritis[J]. Lancet, 2010, 376(9746): 1094–1108. DOI:10.1016/S0140-6736(10)60826-4 |
| [2] | SMOLEN J S, ALETAHA D, BARTON A, et al. Rheumatoid arthritis[J]. Nat Rev Dis Primers, 2018, 4: 18001. DOI:10.1038/nrdp.2018.1 |
| [3] | ALAM J, JANTAN I, BUKHARI S N A. Rheumatoid arthritis: Recent advances on its etiology, role of cytokines and pharmacotherapy[J]. Biomed Pharmacother, 2017, 92: 615–633. DOI:10.1016/j.biopha.2017.05.055 |
| [4] | FAN D, GUO Q, SHEN J, et al. The effect of triptolide in rheumatoid arthritis: from basic research towards clinical translation[J]. Int J Molecular Sci, 2018, 19(376): 1–17. DOI:10.3390/ijms19020376 |
| [5] | LIU S P, WANG G D, DU X J, et al. Triptolide inhibits the function of TNF-α in osteoblast differentiation by inhibiting the NF-κB signaling pathway[J]. Exp Ther Med, 2017, 14: 2235–2240. DOI:10.3892/etm.2017.4749 |
| [6] | VAN HAMBURG J P, TASS W. Molecular mechanisms underpinning T helper 17 cell heterogeneity and functions in rheumatoid arthritis[J]. J Autoimmun, 2018, 87: 69–81. DOI:10.1016/j.jaut.2017.12.006 |
| [7] | PALA O, DIAZ A, BLOMBERG B B, et al. B lymphocytes in rheumatoid arthritis and the effects of anti-TNF-alpha agents on B lymphocytes: a review of the literature[J]. Clin Ther, 2018, 40(6): 1034–1045. DOI:10.1016/j.clinthera.2018.04.016 |
| [8] | ROSSOL M, SCHUBERT K, MEUSCH U, et al. Tumor necrosis factor receptor type I expression of CD4+ T cells in rheumatoid arthritis enables them to follow tumor necrosis factor gradients into the rheumatoid synovium[J]. Arthritis Rheum, 2013, 65(6): 1468–1476. DOI:10.1002/art.37927 |
| [9] |
王贵, 郭明慧, 徐慧慧, 等. 雷公藤甲素对高迁移率族蛋白1诱导的破骨细胞分化的影响[J].
中日友好医院学报, 2017, 31(2): 102–106.
WANG G, GUO M H, XU H H, et al. The effect of triptolide on differentiation of osteoclasts induced by HMGB1[J]. J China-Japan Friendship Hosp, 2017, 31(2): 102–106. DOI:10.3969/j.issn.1001-0025.2017.02.010 |
| [10] | PAUNOVIC V, HARNETT M M. Mitogen-activated protein kinases as therapeutic targets for rheumatoid arthritis[J]. Drugs, 2013, 73(2): 101–115. DOI:10.1007/s40265-013-0014-6 |
| [11] |
王建竹, 连金饶, 孔祥英, 等. 雷公藤甲素对TNF-α诱导的滑膜细胞增殖的影响及对Ras-MAPKs信号转导通路的调控作用[J].
中国中药杂志, 2010, 35(7): 888–891.
WANG J Z, LIAN J R, KONG X Y, et al. Effects of triptolide on cell proliferation and regulation of Ras-MAPKs pathway in synoviocytes induced by tumor necrosis factor[J]. China J Chin Materia Med, 2010, 35(7): 888–891. DOI:10.4268/cjcmm20100719 |
| [12] | CERIGNOLI F, RAHMOUNI S, RONAI Z, et al. Regulation of MAP kinases by the VHR dual-specific phosphatase: implications for cell growth and differentiation[J]. Cell Cycle, 2006, 5(19): 2210–2215. DOI:10.4161/cc.5.19.3267 |
| [13] | SHARP J T, YOUNG D Y, BLUHM G B, et al. How many joints in the hands and wrists should be included in a score of radiologic abnormalities used to assess rheumatoid arthritis?[J]. Arthritis Rheum, 1985, 28(12): 1326–1335. DOI:10.1002/(ISSN)1529-0131 |
| [14] | FAN D, GUO Q, SHEN J, et al. The effect of triptolide in rheumatoid arthritis: from basic research towards clinical translation[J]. Int J Molecular Sci, 2018, 19(376): 1–17. DOI:10.3390/ijms19020376 |
| [15] | REDLICH K, HAYER S, MAIER A, et al. Tumor necrosis factor alpha-mediated joint destruction is inhibited by targeting osteoclasts with osteoprotegerin[J]. Arthritis Rheum, 2002, 46(3): 785–792. DOI:10.1002/art.10097 |
| [16] | TANAKA K, ODA N, IWASAKA C, et al. Induction of Ets-1 in endothelial cells during reendothelialization after denuding injury[J]. J Cell Physiol, 1998, 176(2): 235–244. DOI:10.1002/(SICI)1097-4652(199808)176:2<235::AID-JCP2>3.0.CO;2-P |
| [17] | GUMPENA R, LOUNTOS G, RARAN-KURUSSI S, et al. Crystal structure of the human dual specificity phosphatase 1 catalytic domain[J]. Protein Sci, 2018, 27(2): 561–567. DOI:10.1002/pro.3328 |
| [18] | HAWTREE S, MUTHAN A M, WILSON A G. The role of histone deacetylases in rheumatoid arthritis fibroblast-like synoviocytes[J]. Biochem Soc Trans, 2013, 41(3): 783–788. DOI:10.1042/BST20130053 |
| [19] | GRABIEC A M, REEDQUIST K A. Histone deacetylases in RA: epigenetics and epiphenomena[J]. Arthritis Res Ther, 2010, 12(5): 142. DOI:10.1186/ar3137 |
| [20] | HAWTREE S, MUTHANA M, WILKINSONJ M, et al. Histone deacetylase 1 regulates tissue destruction in rheumatoid arthritis[J]. Hum Mol Genet, 2015, 24(19): 5367–5377. DOI:10.1093/hmg/ddv258 |
| [21] | BUCKLAND J. Rheumatoid arthritis: HDAC and HDACi: pathogenetic and mechanistic insights[J]. Nat Rev Rheumatol, 2011, 7(12): 682. DOI:10.1038/nrrheum.2011.162 |
| [22] | CHOO Q Y, HO P C, TANAKA Y, et al. The histone deacetylase inhibitors MS-275 and SAHA suppress the p38 mitogen-activated protein kinase signaling pathway and chemotaxis in rheumatoid arthritic synovial fibroblastic E11 cells[J]. Molecules, 2013, 18(11): 14085–14095. DOI:10.3390/molecules181114085 |
| [23] | HOYT R, ZHU W, CERIGNOLI F, et al. Cutting edge: selective tyrosine dephosphorylation of interferon-activated nuclear STAT5 by the VHR phosphatase[J]. J Immunol, 2007, 179(6): 3402–3406. DOI:10.4049/jimmunol.179.6.3402 |
| [24] | TAMBE M B, NARVI EKALLIO M. Reduced levels of Dusp3/Vhr phosphatase impair normal spindle bipolarity in an Erk1/2 activity-dependent manner[J]. FEBS Letters, 2016, 590(16): 2757–2767. DOI:10.1002/1873-3468.12310 |
| [25] | VANDEREYKEN M, JACQUES S, VAN OVERMEIRE E, et al. Dusp3 deletion in mice promotes experimental lung tumour metastasis in a macrophage dependent manner[J]. PLoS ONE, 2017, 12(10): e0185786. DOI:10.1371/journal.pone.0185786 |
| [26] | AMAND M, ERPICUM C, BAJOU K, et al. DUSP3/VHR is a pro-angiogenic atypical dual-specificity phosphatase[J]. Mol Cancer, 2014, 13(108): 1–18. DOI:10.1186/1476-4598-13-108 |
| [27] | CHEN Y, CHOU H, YANG C, et al. Deficiency in VHR/DUSP3, a suppressor of focal adhesion kinase, reveals its role in regulating cell adhesion and migration[J]. Oncogene, 2017, 36(47): 6509–6517. DOI:10.1038/onc.2017.255 |
| [28] | TOH M L, YANG Y, LEECH M, et al. Expression of mitogen- activated protein kinase phosphatase 1, a negative regulator of the mitogen-activated protein kinases, in rheumatoid arthritis: up-regulation by interleukin-1beta and glucocorticoids[J]. Arthritis Rheum, 2004, 50(10): 3118–3128. DOI:10.1002/art.20580 |



