宫颈癌是全球常见恶性肿瘤之一,而发展中国家宫颈癌的发病率明显高于其他国家,约占85%[1]。虽然目前认为宫颈癌大部分是由于HPV病毒感染导致,但是宫颈癌的发病机制尚未完全清楚。泛素E3连接酶膜相关锌指蛋白(membrane-associated RING-CH,MARCH)家族包含11个成员,具有多种细胞功能,包括:免疫调节、蛋白质质量控制、膜运输、线粒体的融合和分裂以及精子发生[2-4]。MARCH5属于MARCH家族中的一员,是一种完整的线粒体外膜蛋白,具有4个膜跨越区段[5]。MARCH5参与线粒体形态的控制,其过表达引起线粒体延伸。MARCH5与MFN2(mitofusin 2)和DNM1L/Drp1结合后分别参与线粒体的融合和分裂[6-7]。MARCH5可以通过泛素化调节缺氧诱导的线粒体自噬[8]。目前关于MARCH5的研究主要是其对线粒体功能的影响,在肿瘤方面的研究尚少。我们前期研究发现,MARCH5能促进卵巢癌的自噬、迁移和侵袭[9],但是MARCH5对宫颈癌的影响尚不清楚。因此,本研究检测MARCH5在宫颈癌中的表达,并初步探讨其对宫颈癌细胞功能的影响及其可能的作用机制。
1 材料与方法 1.1 材料人类宫颈癌HeLa细胞来自于重庆医科大学附属第二医院妇产科实验室。RPMI1640培养基购自Gibco公司,胎牛血清购自德国PAN公司,青链霉素溶液和细胞胰酶消化液购自碧云天公司。MARCH5慢病毒购自上海吉玛公司。MARCH5、Drp1、Bax、PGAM5d等抗体购自CST公司,GAPDH抗体购自博奥森公司。宫颈癌组织芯片、组织微阵列(CR1501)购自西安艾丽娜生物科技有限公司,共75例,其中宫颈癌组织70例(有分期70例,有分级59例),非典型增生1例,边缘正常组织4例,同时收集我院正常宫颈组织10例。患者均已签署知情同意书,本研究获重庆医科大学附属第二医院伦理委员会批准[(2018)243号]。
1.2 方法 1.2.1 细胞培养采用完全培养基RPMI1640加入10%胎牛血清以及1%青链霉素。置于37 ℃和5% CO2的孵育箱中,用NEST的培养瓶培养,待细胞长满80%~90%后,PBS冲洗后使用含0.25%胰酶和0.02% EDTA的胰酶消化液在37 ℃消化约2 min后传代。
1.2.2 细胞转染以约3×106个细胞种于含有5 mL完全培养基的T25培养瓶中,待细胞融合至60%~70%时,弃掉培养基。加入完全培养基后并以10 pfu number/cell的慢病毒转染细胞,同时加入病毒转染增强剂polybrene增强病毒转染效率。放回细胞培养箱继续培养48 h后,加入2.5 μg/mL嘌呤霉素去除未转染成功的细胞,并持续用嘌呤霉素筛选。分别用LV3-1和LV3-2表示敲减组,用NC表示对照组。
1.2.3 免疫组织化学检测二甲苯浸泡后阶梯酒精进行脱蜡脱水,接着行抗原修复,加入内源性过氧化物酶阻断剂室温孵育10 min后PBS冲洗,血清封闭,然后一抗4 ℃过夜。次日PBS冲洗后滴加二抗,室温孵育15 min,PBS冲洗后滴加辣根酶标记链霉卵白素,然后经DAB显色,苏木精复染,盐酸酒精分化,饱和碳酸锂返蓝后脱水、透明、封片,最后阅片。
1.2.4 免疫荧光检测将细胞接种在无菌玻璃盖玻片上放培养箱中48 h,然后加入无血清培养基(含150 nmol/L MitoTracker Green FM)在黑暗中孵育30 min,用冷PBS冲洗后加入甲醇固定,接着用血清封闭后加入MARCH5抗体放入4 ℃冰箱孵育过夜。次日加入二抗37 ℃孵育30 min,然后用PBS冲洗后用DAPI染色细胞核,最后在倒置荧光显微镜下观察。
1.2.5 划痕实验将稳转细胞种于6孔板中,长满后用200 μL移液枪头在的细胞上垂直划一条直线划痕,PBS清洗掉脱落细胞,然后加入无血清培养基。在0 h和48 h拍摄图像并和记录。实验重复3次。
1.2.6 EdU增殖实验在24孔板中每孔种入约1×105个稳转细胞,孵育24 h后倒掉培养基并加入EdU培养基(细胞培养基按1 000 :1的比例稀释EdU试剂A)孵育,然后多聚甲醛固定,甘氨酸清洗后用0.5% Triton X-100的PBS摇床孵育、清洗。随后加入1×Apollo(阿波罗)染色反应液染色,依次用0.5% Triton X-100的PBS、甲醇及PBS清洗。DAPI染色后PBS清洗。最后荧光显微镜计数并分析,实验重复3次。
1.2.7 Transwell小室侵袭实验将细胞提前用无血清培养基培养饥饿24 h。每孔加入500 μL完全培养基,将5×104个细胞加入已经加入基质胶的Transwell小室,培养48 h后取出Transwell小室,擦除小室中的细胞。然后小室外侧面的细胞用多聚甲醛固定后用苏木精染色,自来水冲净,然后放入烘箱烘干后在倒置显微镜下观察并计数。
1.2.8 Western blot检测加入PMSF :RIPA=1 :100的细胞裂解液,刮集细胞后在超声波仪器打碎,在低温离心机上13 000 r/min离心15 min,吸取上清液,BCA测定蛋白浓度,加入上样缓冲液(体积比1 :4),加热失活后电泳,每孔加20 μg样品蛋白,PVDF膜转膜,用脱脂奶粉封闭后,加入一抗后4 ℃过夜处理,TBST洗膜后孵育二抗,最后显影。
1.3 统计学分析使用SPSS 20.0统计软件分析,数据以x±s表示,非正态分布数据由中位数表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,使用非参数检验中的秩和检验分析。检验水准:α=0.05。
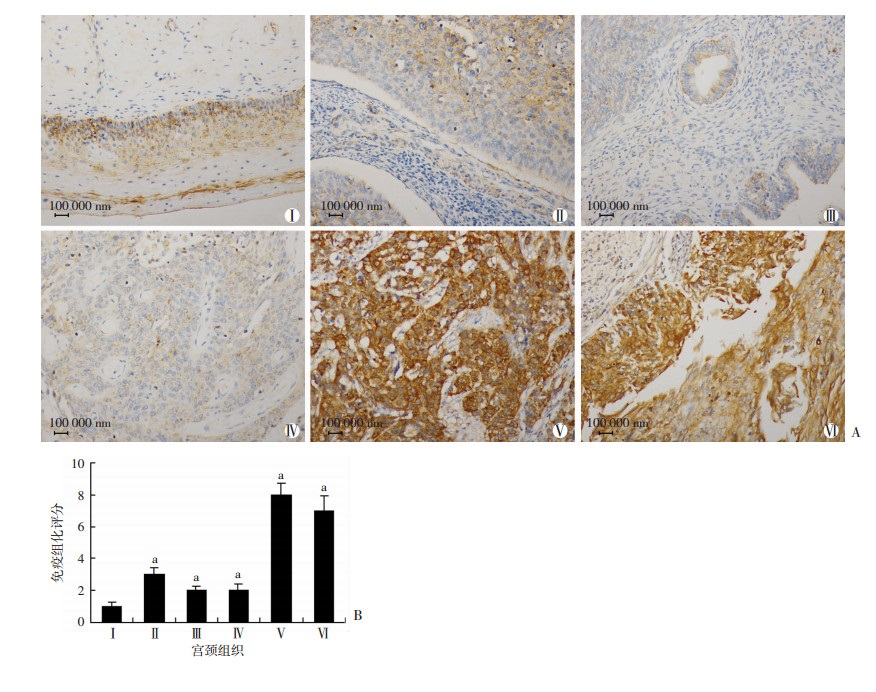
2 结果 2.1 MARCH5在宫颈癌组织中的表达运用免疫组织化学(IHC)检测组织芯片正常宫颈和宫颈癌的组织样本中MARCH5的表达(图 1),宫颈癌的组织样本中MARCH5免疫染色高于正常宫颈组织(P < 0.05),且MARCH5的表达与宫颈癌的分级有关(P < 0.01,表 1),但MARCH5表达与年龄和宫颈癌的分期无关(P > 0.05,表 1)。
|
| Ⅰ :正常宫颈组织;Ⅱ : Ⅰ期鳞癌组织;Ⅲ :Ⅰb期腺癌组织;Ⅳ:Ⅱb期鳞癌组织;Ⅴ :Ⅲb期腺癌组织;Ⅵ: Ⅲb鳞癌组织;a:P < 0.05, 与正常宫颈组织比较 图 1 免疫组化检测MARCH5在不同类型宫颈癌与正常宫颈组织中的表达(A,S-P)及评分(В) |
| 临床病理特征 | 例数 | MARCH5 低表达 |
MARCH5 高表达 |
χ2值 | P值 |
| 年龄/岁 | 0.872 | 0.350 | |||
| ≤50 | 47 | 34 | 13 | ||
| >50 | 37 | 30 | 7 | ||
| 组织类型 | 28.393 | < 0.001 | |||
| 正常宫颈组织 | 14 | 1 | 13 | ||
| 宫颈癌组织 | 70 | 56 | 14 | ||
| 分期 | 1.556 | 0.459 | |||
| Ⅰ | 55 | 45 | 10 | ||
| Ⅱ | 13 | 9 | 4 | ||
| Ⅲ | 2 | 2 | 0 | ||
| 分级 | 12.848 | 0.002 | |||
| 1 | 16 | 7 | 9 | ||
| 2 | 33 | 29 | 4 | ||
| 3 | 10 | 9 | 1 |
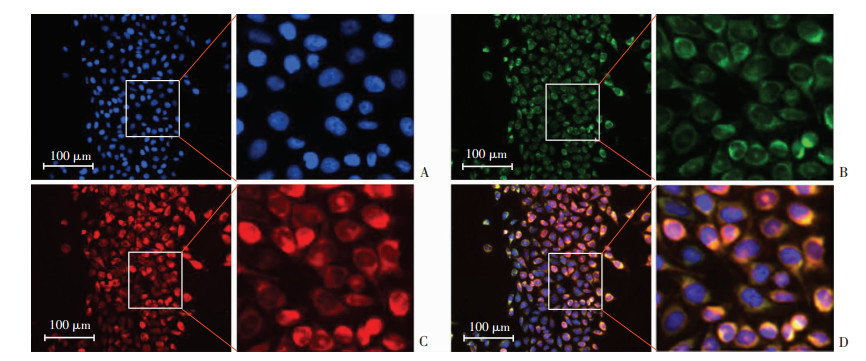
2.2 MARCH5在线粒体的表达
为研究MARCH5的亚细胞定位,使用MitoTracker Green标记线粒体,然后用免疫荧光染色检测MARCH5。结果显示,MARCH5的位置与MitoTracker Green重叠(图 2)。表明MARCH5主要位于线粒体中。
|
| A:Hoechst;B:线粒体;C:MARCH5;D:Merged;右图为左图方框部分放大 图 2 免疫荧光染色检测MARCH5与线粒体的共定位(倒置荧光显微镜) |
2.3 下调MARCH5后HeLa细胞的迁移能力受到抑制
沉默MARCH5后(LV3-1和LV3-2组),HeLa细胞的迁移能力显著低于对照组(P < 0.05,图 3)。

|
| A:划痕实验检测细胞的迁移能力(倒置荧光显微镜); B:下调MARCH5后各组迁移率对比 1:NC组; 2:LV3-1组;3:LV3-2组;a:P < 0.05, 与NC组比较 图 3 划痕实验验证下调MARCH5表达后HeLa细胞迁移能力显著降低 |
2.4 下调MARCH5后HeLa细胞的增殖能力受到抑制
EdU细胞增殖实验结果(图 4)显示:沉默组LV3-1和LV3-2的EdU细胞阳性率分别为(17±3)%和(15±2)%,较对照组(38±6)%显著降低(P < 0.05)。提示敲低MARCH5能削弱HeLa细胞的增殖能力。

|
| 图 4 EDU实验检测各组细胞增殖能力(倒置荧光显微镜) |
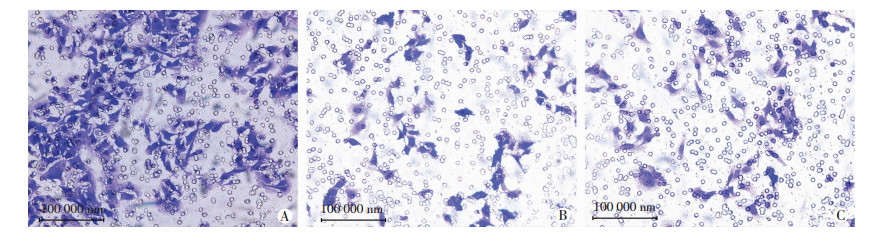
2.5 下调MARCH5后HeLa细胞的侵袭能力受到抑制
Transwell结果(图 5)显示:沉默组LV3-1和LV3-2的穿膜细胞数量分别为(60±6)和(67±8),较对照组(170±12)显著减少(P < 0.05)。提示宫颈癌HeLa细胞株转染携带MARCH5基因的慢病毒后侵袭能力变低。
|
| A: NC组;B:LV3-1组;C:LV3-2组 图 5 Transwell实验检测各组细胞株迁移能力(倒置荧光显微镜) |
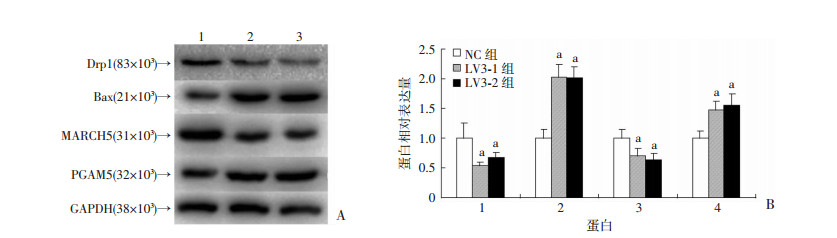
2.6 下调MARCH5对HeLa细胞中Drp1、PGAM5和Bax蛋白表达的影响
Western blot检测HeLa细胞中Drp1、PGAM5和Bax的蛋白表达,发现下调MARCH5后会导致PGAM5和Bax的表达上调,而Drp1的表达下调(P < 0.05, 图 6)。
|
| A:Western blot检测结果 1:NC组;2:LV3-1组;3:LV3-2组;B:半定量分析 1:Drp1;2:Bax;3:MARCH5;4:PGAM5;a:P < 0.05, 与NC组比较 图 6 Western blot检测下调MARCH5后对Drp1、Bax、PGAM5蛋白的影响 |
3 讨论
目前宫颈癌在我国每年的新发病例约有10万例[10]。近年来其发病有年轻化的趋势[11]。随着对肿瘤的研究不断深入,肿瘤的诊治已逐渐向细胞学、分子生物学乃至基因组学发展[12]。近几年,分子靶向药物已经取得了明显的临床疗效,但是宫颈癌的确切靶向治疗药物研究仍然有限[13]。因此,明确宫颈癌发生及发展的分子机制,不仅有利于对宫颈癌的恶性生物学行为的了解,而且对于分子靶向药物的研发以及改善宫颈癌的治疗和预后具有重要意义[14]。癌症的发生常以多方面的细胞功能失调为特征,包括细胞增殖以及细胞生物能量的异常,而细胞生物能量的异常往往涉及特定的线粒体[15]。线粒体是ATP产生的部位,对细胞的正常功能的运转起这至关重要的作用[16]。线粒体含有多种蛋白质,这些蛋白质对于诱导、促进以及防止细胞死亡都是必需的,可以说线粒体是决定细胞命运的关键[17]。
MARCH5是一种完整的线粒体外膜蛋白,参与线粒体形态的控制。MARCH5过表达可引起线粒体延伸。MARCH5与MFN2(mitofusin 2)和DNM1L/Drp1结合后分别参与线粒体的融合和分裂[6-7]。MARCH5的缺失会抑制Drp1介导的线粒体分裂活性,在细胞中敲低MARCH5会导致Drp1活性缺陷[18]。前期研究表明MARCH5可以通过线粒体促进卵巢癌的自噬、迁移和侵袭[9]。本实验通过免疫荧光MARCH5与线粒体的共定位分析,发现在细胞内MARCH5与线粒体高度重合,证实MARCH5位于线粒体内。免疫组织化学结果显示MARCH5在宫颈癌组织中的表达高于正常宫颈组织,且MARCH5在宫颈癌中的表达与肿瘤组织学分级有关,而下调MARCH5表达后宫颈癌细胞的迁移、侵袭和增殖能力均受到了抑制,说明MARCH5水平升高有助于子宫颈癌的进展,并促进侵略行为的发生。Drp1是参与线粒体凋亡分裂的线粒体活化蛋白[19],在调控线粒体动力学方面起着关键的作用。Drp1在线粒体周围的异位诱导以GTP依赖的方式诱导[20]。Drp1的下调可导致线粒体延伸并抑制线粒体的分裂[21]。敲除Drp1基因后可以抑制皮肤鳞状细胞癌的增殖和乳腺癌细胞的转移能力[22]。PGAM5是磷酸甘油酸变位酶,是一种糖酵解酶,在多种原因造成的细胞坏死通路中占据枢纽的作用[23]。PGAM5作为线粒体上的重要能量酶,已被证明主要定位于内部线粒体膜(IMM)的C末端PGAM结构域面向膜间隙[24]。PGAM5异常激活可导致成串排列的线粒体发生线性断裂并诱导活性氧簇ROS增多,导致细胞坏死[25]。在执行坏死期间PGAM5和Drp-1会形成“线粒体攻击复合物”[26]。Bax基因为bcl-2基因家族一员, 为促进细胞凋亡基因。在凋亡刺激时,Bax、Bak和可能的其他未识别的蛋白质被重新定位到线粒体外膜并寡聚化以形成线粒体凋亡诱导的通道并释放细胞C[27]。Bax可通过直接影响线粒体功能诱导细胞凋亡。Bax与Drp1在线粒体收缩位点共定位[28]。文献[29]报道Bax、PGAM5L、Drp1在内在凋亡执行时会形成必需的复合物。
本研究采用Western blot检测结果显示,下调MARCH5后,Drp1的蛋白表达也下调,而PGAM5和Bax的蛋白表达上调。说明下调MARCH5后可能通过抑制Drp1、激活PGAM5和Bax来抑制子宫颈癌细胞的增殖和侵袭。表明MARCH5可以作为一种新型肿瘤标志物以及潜在的卵巢癌治疗靶点。
| [1] |
周晖, 刘昀昀, 林仲秋. 《2017 NCCN宫颈癌临床实践指南》解读[J].
中国实用妇科与产科杂志, 2017, 33(1): 100–107.
ZHOU H, LIU J J, LING Z Q. 2017 NCCN cervical cancer clinical practice guide interpretation[J]. Chin J Prac Gynecol Obstetr, 2017, 33(1): 100–107. DOI:10.19538/j.fk2017010125.fk2017010125 |
| [2] | NATHAN J A, LEHNER P J. The trafficking and regulation of membrane receptors by the RING-CH ubiquitin E3 ligases[J]. Exp Cell Res, 2009, 315(9): 1593–1600. DOI:10.1016/j.yexcr.2008.10.026 |
| [3] | HU J, ZHANG L, MEI Z, et al. Interaction of E3 ubiquitin ligase MARCH7 with long noncoding RNA MALAT1 and autophagy-related protein ATG7 promotes autophagy and invasion in ovarian cancer[J]. Cell Physiol Biochem, 2018, 47(2): 654–666. DOI:10.1159/000490020 |
| [4] |
王美姣, 于廷和. MARCH家族蛋白在免疫、生殖等方面的研究进展[J].
重庆医学, 2016, 45(29): 4144–4147.
WANG M J, YU T H. Advances in research on MARCH family proteins in immunity and reproduction[J]. Chongqing Med, 2016, 45(29): 4144–4147. DOI:10.3969/j.issn.1671-8348.2016.29.039 |
| [5] | YONASHIRO R, ISHIDO S, KYO S, et al. A novel mitochondrial ubiquitin ligase plays a critical role in mitochondrial dynamics[J]. EMBO J, 2006, 25(15): 3618–3626. DOI:10.1038/sj.emboj.7601249 |
| [6] | NAKAMURA N, KIMURA Y, TOKUDA M, et al. MARCH-V is a novel mitofusin 2- and Drp1-binding protein able to change mitochondrial morphology[J]. EMBO Rep, 2006, 7(10): 1019–1022. DOI:10.1038/sj.embor.7400790 |
| [7] | KARBOWSKI M, NEUTZNER A, YOULE R J. The mitochondrial E3 ubiquitin ligase MARCH5 is required for Drp1 dependent mitochondrial division[J]. J Cell Biol, 2007, 178(1): 71–84. DOI:10.1083/jcb.200611064 |
| [8] | SUGIURA A, NAGASHIMA S, TOKUYAMA T, et al. MITOL regulates endoplasmic reticulum-mitochondria contacts via Mitofusin2[J]. Mol Cell, 2013, 51(1): 20–34. DOI:10.1016/j.molcel.2013.04.023 |
| [9] | HU J, MENG Y, ZHANG Z, et al. MARCH5 RNA promotes autophagy, migration, and invasion of ovarian cancer cells[J]. Autophagy, 2017, 13(2): 333–344. DOI:10.1080/15548627.2016.1256520 |
| [10] |
顾秀瑛, 郑荣寿, 孙可欣, 等. 2014年中国女性子宫颈癌发病与死亡分析[J].
中华肿瘤杂志, 2018, 40(4): 241–246.
GU X Y, ZHENG R S, SUN K X, et al. Incidence and mortality of cervical cancer in China, 2014[J]. Chin J Oncol, 2018, 40(4): 241–246. DOI:10.3760/cma.j.issn.0253-3766.2018.04.001.cma.j.issn.0253-3766.2018.04.001 |
| [11] | SNIJDERS P J, STEENBERGEN R D, HEIDEMAN D A, et al. HPV-mediated cervical carcinogenesis: concepts and clinical implications[J]. J Pathol, 2006, 208(2): 152–164. DOI:10.1002/path.1866 |
| [12] |
王静, 刘晓军, 金志军. 宫颈癌靶向治疗的研究进展[J].
国际妇产科学杂志, 2017, 44(3): 292–295.
WANG J, LIU X J, JIN Z J. Progress in the treatment of cervical cancer targeted therapy[J]. J Int Obstet Gynecol, 2017, 44(3): 292–295. DOI:10.3969/j.issn.1674-1870.2017.03.014 |
| [13] |
施珊珍, 刘媛, 赵蕾. 宫颈癌治疗的临床研究进展[J].
中外医学研究, 2016, 14(34): 156–159.
SHI S Z, LIU Y, ZHAO L. Progress in clinical research of cervical cancer treatment[J]. Chin Foreign Med Res, 2016, 14(34): 156–159. DOI:10.14033/j.cnki.cfmr.2016.34.088 |
| [14] | LIU S, HAO X, OUYANG X, et al. Tyrosine kinase LYN is an oncotarget in human cervical cancer: A quantitative proteomic based study[J]. Oncotarget, 2016, 7(46): 75468–75481. DOI:10.18632/oncotarget.12258 |
| [15] | WALLACE D C. Mitochondria and cancer[J]. Nat Rev Cancer, 2012, 12(10): 685–698. DOI:10.1038/nrc3365 |
| [16] | NEUPERT W, HERRMANN J M. Translocation of proteins into mitochondria[J]. Annu Rev Biochem, 2007, 76: 723–749. DOI:10.1146/annurev.biochem.76.052705.163409 |
| [17] | DONG L F, NEUZIL J. Mitochondria in cancer: why mitochondria are a good target for cancer therapy[J]. Prog Mol Biol Transl Sci, 2014, 127: 211–227. DOI:10.1016/B978-0-12-394625-6.00008-8 |
| [18] | PARK Y Y, LEE S, KARBOWSKI M, et al. Loss of MARCH5 mitochondrial E3 ubiquitin ligase induces cellular senescence through dynamin-related protein 1 and mitofusin 1[J]. J Cell Sci, 2010, 123(4): 619–626. DOI:10.1242/jcs.061481 |
| [19] | XU W, JING L, WANG Q, et al. Bax-PGAM5L-Drp1 complex is required for intrinsic apoptosis execution[J]. Oncotarget, 2015, 6(30): 30017–30034. DOI:10.18632/oncotarget.5013 |
| [20] | SMIRNOVA E, GRIPARIC L, SHURLAND D L, et al. Dynamin-related protein Drp1 is required for mitochondrial division in mammalian cells[J]. Mol Biol Cell, 2001, 12(8): 2245–2256. DOI:10.1091/mbc.12.8.2245 |
| [21] | YU Y, XU L, QI L, et al. ABT737 induces mitochondrial pathway apoptosis and mitophagy by regulating DRP1-dependent mitochondrial fission in human ovarian cancer cells[J]. Biomed Pharmacother, 2017, 96: 22–29. DOI:10.1016/j.biopha.2017.09.111 |
| [22] | KITAMURA S, YANAGI T, IMAFUKU K, et al. Drp1 regulates mitochondrial morphology and cell proliferation in cutaneous squamous cell carcinoma[J]. J Dermatol Sci, 2017, 88(3): 298–307. DOI:10.1016/j.jdermsci.2017.08.004 |
| [23] | WANG Z, JIANG H, CHEN S, et al. The mitochondrial phosphatase PGAM5 functions at the convergence point of multiple necrotic death pathways[J]. Cell, 2012, 148(1/2): 228–243. DOI:10.1016/j.cell.2011.11.030 |
| [24] | SEKINE S, KANAMARU Y, KOIKE M, et al. Rhomboid protease PARL mediates the mitochondrial membrane potential loss-induced cleavage of PGAM5[J]. J Biol Chem, 2012, 287(41): 34635–34645. DOI:10.1074/jbc.M112.357509 |
| [25] |
佘浪, 彭军. 磷酸甘油酸变位酶5与坏死样凋亡[J].
中国病理生理杂志, 2016, 32(2): 377–380.
SHE L, PENG J. Phosphoglycerate mutase 5 and necroptosis[J]. Chin J Pathophysiol, 2016, 32(2): 377–380. DOI:10.3969/j.issn.1000-4718.2016.02.031.j.issn.1000-4718.2016.02.031 |
| [26] | CHAN F K, BAEHRECKE E H. RIP3 finds partners in crime[J]. Cell, 2012, 148(1/2): 17–18. DOI:10.1016/j.cell.2011.12.020 |
| [27] | WOLFF S, ERSTER S, PALACIOS G, et al. p53's mitochondrial translocation and MOMP action is independent of Puma and Bax and severely disrupts mitochondrial membrane integrity[J]. Cell Res, 2008, 18(7): 733–744. DOI:10.1038/cr.2008.62 |
| [28] | KARBOWSKI M, LEE Y J, GAUME B, et al. Spatial and temporal association of Bax with mitochondrial fission sites, Drp1, and Mfn2 during apoptosis[J]. J Cell Biol, 2002, 159(6): 931–938. DOI:10.1083/jcb.200209124 |
| [29] | MONTESSUIT S, SOMASEKHARAN S P, TERRONES O, et al. Membrane remodeling induced by the dynamin-related protein Drp1 stimulates Bax oligomerization[J]. Cell, 2010, 142(6): 889–901. DOI:10.1016/j.cell.2010.08.017 |



